一种促代谢、抗氧化的燕麦蛋白肽及其制备方法和应用与流程
1.本发明涉及蛋白肽技术领域,具体涉及一种促代谢、抗氧化的燕麦蛋白肽及其制备方法和应用。
背景技术:
2.肽由2个或2个以上氨基酸脱水缩合而成,是蛋白质机构和功能的片段,并使蛋白质具有各种生理功能,其本身也具有很强的特殊的生理功能。由2个或3个氨基酸脱水缩合而成的,分别成为二肽和三肽,以此类推为四肽、五肽等。一般而言,肽链上氨基酸数目在10以下为寡肽,达到10-50个为多肽,50个以上为蛋白质。多肽是人体自身存在而且必需的活性物质、营养物质,几乎广泛分布于动物及人类全身,特别是大脑,几乎对所用的细胞都有调节作用,如缺失,免疫系统、各功能系统就会发生紊乱。
3.传统的蛋白提取方式是采用“碱溶酸沉法”,获得分离蛋白后再经过酶制剂的水解制得水解蛋白肽,生产周期长;环境不友好:工业生产过程中使用大量的酸和碱,会造成一定程度的环境污染;废水量大:传统工业化生产方法的废水排放量大,盐含量高,废水处理难度大,运行成本高。同时,市场上的植物多肽产品,平均分子量较大,特定区间分子量占比不可控,而不同分子量多肽的作用机理、作用效果不同,所以其发挥作用的可控性较差。
4.中国发明专利cn103243144b公开了一种富含胶原三肽的胶原蛋白粉及其制备工艺。该发明的目的是提供一种富含胶原三肽的胶原蛋白粉及其该胶原蛋白粉的制备工艺,该发明以鱼皮为原料,先采用复合蛋白酶对鱼皮胶原蛋白进行提取并降解成小分子肽,再利用自主筛选的胶原蛋白酶对小分子肽进一步定向降解成胶原三肽,然后经离心、脱腥脱色、浓缩、喷雾干燥获得富含胶原三肽的胶原蛋白粉。该发明选用脂肪含量低的鱼皮为原料,在制备工艺中省去稀碱溶液浸泡脱除脂肪,减少因酸碱处理而产生的有害物质;另外,采用市售的蛋白酶、风味酶对鱼皮进行酶解后,再采用自制的胶原蛋白酶进一步将部分蛋白肽降解成胶原三肽,不仅可以提高原料中胶原蛋白的抽提率而且还显著提高胶原蛋白粉的功能性日本特开2005-80668号公报中公开了:提供一种大豆蛋白水解方法,其使用了一种兼具内和外肽酶活性的酶来水解大豆蛋白,从而能增加可溶性部分,避免苦味部分,并且增强或提高抗氧化能力。然而,该专利中记载的可溶性大豆蛋白部分含有约3kda-30kda的肽,基本上不含低分子量的大豆蛋白。如非如该专利中介绍的那样,大豆蛋白中,二肽和三肽在肠道中的吸收最佳,更大的肽通常难以被直接吸收。因此,可以认为,该专利中记载的肽过大,因而不适于吸收,在生物体内无法发挥明显作用,因此不实用。此外,日本特开平10-203994号公报中记载的肽的大小也为500-5000,与二肽和三肽相比过大,因此同样被认为不实用。
技术实现要素:
5.本发明的目的在于提出一种促代谢、抗氧化的燕麦蛋白肽及其制备方法和应用,
5000d。
10.作为本发明的进一步改进,步骤s2中所述燕麦蛋白提取液、胃蛋白酶和酸性蛋白酶的质量比为100:1-5:3-7;所述酶解时间为1-3h;步骤s3中所述燕麦蛋白一级酶解液、中性蛋白酶和木瓜蛋白酶的质量比为100:2-5:3-6,所述酶解时间为2-4h;步骤s4中所述燕麦蛋白二级酶解液、中性蛋白酶和木瓜蛋白酶的质量比为100:3-5:1-3,所述酶解时间为0.5-1.5h。
11.作为本发明的进一步改进,所述微缺氧条件为氧气含量为5-12%,二氧化碳含量为3-5%,余量为氮气,其中,%为体积百分比;所述灭酶的方法为1000-1500w超声处理15-20min。
12.作为本发明的进一步改进,步骤s5中所述培养温度为35-40℃,时间为18-24h,所述菌种种子液的含菌量为10
7-109cfu/ml;步骤s6中所述植物乳杆菌、凝结芽孢杆菌的接种量分别为2-5%,1-3%;所述发酵培养的条件为温度在36-38℃,时间为24-36h。
13.作为本发明的进一步改进,步骤s7中所述富硒酵母菌的接种量为3-5%,所述燕麦蛋白一级发酵产物、含有钙离子的溶液、维生素溶液的体积比为10:1-2:0.5-1;所述含有钙离子的溶液中钙离子浓度为5-12wt%,所述维生素溶液为含有2-5wt%的维生素b1和1-3wt%的维生素b12的水溶液;所述发酵培养的条件为36-38℃,所述第三时间段为12-18h;所述第四时间段为18-24h;所述微滤膜孔径范围为0.1-0.5
µ
m,所述纳滤膜的孔径范围为不大于2nm。
14.作为本发明的进一步改进,具体包括以下步骤:s1.燕麦蛋白的提取:将燕麦洗净,干燥,粉碎,过筛,得到燕麦粉,加入三氯乙酸-丙酮-乙腈溶液中,所述燕麦粉和三氯乙酸-丙酮-乙腈溶液的固液比为1:3-5g/ml,所述三氯乙酸-丙酮-乙腈溶液中三氯乙酸:丙酮:乙腈的体积比为0.5-1:7-12:3-5,混合均匀,沉淀0.5-1.5h,离心,将不溶物加入丙酮-乙腈溶液中,所述不溶物与丙酮-乙腈溶液的固液比为1:2-4g/ml,所述丙酮-乙腈溶液中丙酮:乙腈的体积比为3-5:4-7,混合均匀,沉淀1-2h,离心,洗涤不溶物,干燥,加入裂解液中裂解2-4h,所述不溶物和裂解液的固液比为1:2-5g/ml,所述裂解液为含有3-5mol/l的尿素、1-2mol/l的硫脲和0.5-1wt%的二硫苏糖醇的水溶液,取上清液,经过孔径为3000-5000d的超滤膜浓缩,得到燕麦蛋白提取液;s2.一级酶解:调节100重量份步骤s1制得的燕麦蛋白提取液的ph值为2.5-3.5,加热至温度为35-40℃,加入1-5重量份胃蛋白酶和3-7重量份酸性蛋白酶,酶解1-3h,灭酶,过滤,滤液为燕麦蛋白一级酶解液;s3.二级酶解:调节100重量份步骤s2制得的燕麦蛋白一级酶解液的ph值为6.5-7,加热至温度为50-55℃,加入2-5重量份中性蛋白酶和3-6重量份木瓜蛋白酶,酶解2-4h,灭酶,过滤,滤液为燕麦蛋白二级酶解液;s4.三级酶解:调节100重量份步骤s3制得的滤液为燕麦蛋白二级酶解液的ph值为8-9,加热至温度为45-55℃,加入3-5重量份碱性蛋白酶和1-3重量份风味蛋白酶,酶解0.5-1.5h,灭酶,过滤,滤液为燕麦蛋白三级酶解液;s5.菌种活化:分别将植物乳杆菌、凝结芽孢杆菌和富硒酵母菌接种至高氏培养基,微缺氧条件培养,培养温度为35-40℃,时间为18-24h,分别培养成菌种种子液,含菌量为10
7-109cfu/ml;
s6.一级发酵:将植物乳杆菌、凝结芽孢杆菌的菌种种子液接种至步骤s4制得的燕麦蛋白三级酶解液中,所述植物乳杆菌、凝结芽孢杆菌的接种量分别为2-5%,1-3%,微缺氧条件下,在36-38℃温度下发酵培养24-36h,得到燕麦蛋白一级发酵产物;s7.二级发酵:将富硒酵母菌的菌种种子液接种至10体积份的步骤s6制得的燕麦蛋白一级发酵产物中,所述富硒酵母菌的接种量为3-5%,加入1-2体积份含有5-12wt%钙离子的溶液,微缺氧条件下,在36-38℃温度下发酵培养12-18h,然后加入0.5-1体积份的维生素溶液,所述维生素溶液为含有2-5wt%的维生素b1和1-3wt%的维生素b12的水溶液,继续在36-38℃温度下发酵培养18-24h,经过孔径范围为0.1-0.5
µ
m的微滤膜过滤,分离除去未能透过膜的未水解的不可溶成分,然后经过孔径范围为不大于2nm的纳滤膜浓缩,冷冻干燥,制得促代谢、抗氧化的燕麦蛋白肽;所述微缺氧条件为氧气含量为5-12%,二氧化碳含量为3-5%,余量为氮气,其中,%为体积百分比;所述灭酶的方法为1000-1500w超声处理15-20min。
15.本发明进一步保护一种上述的制备方法制得的促代谢、抗氧化的燕麦蛋白肽。
16.本发明进一步保护一种上述的促代谢、抗氧化的燕麦蛋白肽在制备减肥、体重控制类产品中的应用。
17.本发明具有如下有益效果:本发明将燕麦粉直接用三氯乙酸-丙酮-乙腈溶液/丙酮-乙腈溶液二次提取,采用三氯乙酸-丙酮-乙腈溶液替代传统的三氯乙酸-丙酮溶液,蛋白提取率更高,采用的乙腈中含有的氰基上的氮元素易于与蛋白氨基酸的羧酸结构形成氢键键连,从而促进燕麦粉中的蛋白提取并在丙酮的存在下沉淀下来,提取时间短,重复率高,可以减少样品中代谢物质的影响和减少蛋白质损耗,研究发现,同时,该提取方法没有使用大量的酸和碱,不会造成环境污染,废水易于处理,运行成本低,简单容易实施;进一步地,本发明将制得的燕麦蛋白提取液分别在酸性、中性和碱性条件下分别进行酶解,在酸性条件下,由适合于酸性的胃蛋白酶和酸性蛋白酶来酶解,水解产物中小分子肽占比非常高,产出的多肽几乎都为小分子肽;在中性条件下,由适合于中性的中性蛋白酶和木瓜蛋白酶来酶解,中性蛋白酶是一种金属蛋白酶,优先切割亮氨酸和苯丙氨酸之间的肽键,木瓜蛋白酶能够分解疏水区域的肽键,包括苏氨酸、色氨酸、苯丙氨酸等,酶解产物的水解度高,抗氧化活性高,在碱性条件下,由适合于碱性的碱性蛋白酶和风味蛋白酶来酶解,碱性蛋白酶能切割肽键,包括苯丙氨酸、酪氨酸、色氨酸和赖氨酸羧基,风味蛋白酶优先裂解亮氨酸与脯氨酸或脯氨酸与脯氨酸之间的肽键;酶解速度快,酶解效果好,水解产物小肽的得率高,酶解后的多肽乳化稳定性更高,经过三级酶解后,燕麦蛋白提取液中的燕麦蛋白已经大部分被酶解成小分子短肽、寡肽类物质,具有极好的抗氧化活性;将制得的燕麦蛋白三级酶解液中还包含有一些长链蛋白质分子以及未水解的蛋白,进一步加入植物乳杆菌、凝结芽孢杆菌进行发酵,益生菌将蛋白分子进一步发酵水解,将大部分未水解的长链蛋白质水解成了氨基酸、短肽、寡肽或者多肽类物质,从而制得燕麦蛋白一级发酵产物;随后,向燕麦蛋白一级发酵产物中加入富硒酵母菌,进一步酶解的同时,使得产物多肽与有机硒物质中的硒矿物元素发生螯合,形成燕麦蛋白肽-硒螯合物,燕麦蛋白肽与硒元素的螯合物是硒元素与燕麦蛋白肽中的n-端氨基、氨基酸侧链、c-端羧基以及肽链中的
羰基和亚氨基之间的相互配位构成的。与单纯的氨基酸和硒元素相互作用所构成的螯合物相比较能发现燕麦蛋白肽与硒元素的螯合物具有更好的稳定性和配合率,同时还具备生物效益高、极佳的吸收效果、极好的营养性等优点,还有能够结合燕麦蛋白肽与硒元素的互补功能活性如促进代谢、抗氧化、消炎、抗菌、增强免疫、降压、降脂、降糖、减肥减脂肪、体重控制等。
18.本发明方法制得的促代谢、抗氧化的燕麦蛋白肽包括一种燕麦蛋白肽-硒螯合物,经过检测,起到极好的抗氧化效果,其大部分为低分子量的短肽、寡肽类物质,低分子质量的短肽、寡肽类物质比其庞大的亲本蛋白质更容易接近自由基,并能抑制自由基介导的过氧化。短肽、寡肽类物质通过其肽键和羟基提供氢原子或电子,清除缺少氢离子或电子的自由基,以消除其对生物分子的破坏作用;同时,能通过抑制某些促氧化酶和螯合参与催化自由基生成的过渡金属离子来抑制ros和自由基的形成。短肽、寡肽类物质还可以通过抑制自由基转化为过氧化氢,通过内源性抗氧化剂(包括超氧化物歧化酶、过氧化氢酶、谷胱甘肽)能够将其分解为无害的代谢产物,如水和氧,从而起到高效的抗氧化作用。
19.本发明制得的促代谢、抗氧化的燕麦蛋白肽含有丰富的短肽、寡肽、多肽以及燕麦蛋白肽-硒螯合物,具有极好的促进代谢、抗氧化、消炎、抗菌、增强免疫、降压、降脂、降糖、减肥减脂肪、体重控制的效果,制备方法简单,制得的产品效果好,可以应用于制备减肥、体重控制类产品中。
附图说明
20.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
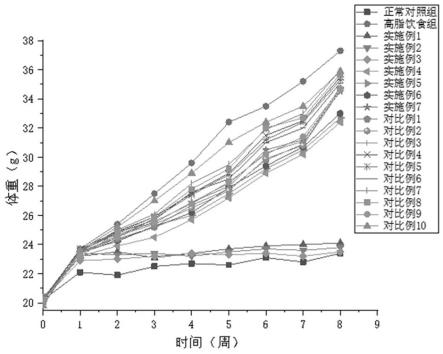
21.图1为本发明测试例4中各组小鼠体重随时间变化图。
具体实施方式
22.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
23.胃蛋白酶由沧州夏盛酶生物技术有限公司提供,10万u/g,最适ph值为2.0-3.0,最适温度为30-50℃。酸性蛋白酶由南宁东恒华道生物科技有限责任公司提供,3万u/g,最适ph值为2.5-3.5,最适温度为30-40℃。中性蛋白酶由南宁东恒华道生物科技有限责任公司提供,20万u/g,最适ph值为6.5-7.5,最适温度为40-50℃。木瓜蛋白酶由南宁东恒华道生物科技有限责任公司提供,10万u/g,酶活力保存率99.5%,最适ph值为7.0-8.0,最适温度50-55℃。碱性蛋白酶由南宁东恒华道生物科技有限责任公司提供,20万u/g,最适ph值为9-12,最适温度40-55℃。风味蛋白酶由南宁东恒华道生物科技有限责任公司提供,5万u/g,最适ph值为5-9,最适温度为50-55℃。
24.植物乳杆菌由潍坊瑞辰生物科技有限公司提供,50亿cfu/g;凝结芽孢杆菌由西安
展迅生物科技有限公司提供,100亿cfu/g,富硒酵母菌由山东骄阳生物科技有限公司提供,含硒大于300mg/kg,其中有机硒含量在95%以上。
25.实施例中每个步骤互相独立,进行下一个步骤前可以重复多次进行上个步骤以得到合适量的产物。
26.单位d为道尔顿的简写。
27.实施例1本实施例提供一种促代谢、抗氧化的燕麦蛋白肽,具体包括以下步骤:s1.燕麦蛋白的提取:将100g燕麦洗净,干燥,粉碎,过100目筛,得到燕麦粉,加入300ml三氯乙酸-丙酮-乙腈溶液中,混合均匀,沉淀0.5h,10000r/min离心10min,将70g不溶物加入140ml丙酮-乙腈溶液中;混合均匀,沉淀1h,10000r/min离心10min,洗涤50g不溶物,60℃干燥2h,加入100ml裂解液中裂解2h,取上清液,经过孔径为3000d的超滤膜浓缩,得到燕麦蛋白提取液;裂解液为含有3mol/l的尿素、1mol/l的硫脲和0.5wt%的二硫苏糖醇的水溶液;所述三氯乙酸-丙酮-乙腈溶液中三氯乙酸:丙酮:乙腈的体积比为0.5:7:3;所述丙酮-乙腈溶液中丙酮:乙腈的体积比为3:4;s2.一级酶解:调节100g步骤s1制得的燕麦蛋白提取液的ph值为2.5,加热至温度为35℃,加入1g胃蛋白酶和3g酸性蛋白酶,酶解1h,灭酶,过滤,滤液为燕麦蛋白一级酶解液;s3.二级酶解:调节100g步骤s2制得的燕麦蛋白一级酶解液的ph值为6.5,加热至温度为50℃,加入2g中性蛋白酶和3g木瓜蛋白酶,酶解2h,灭酶,过滤,滤液为燕麦蛋白二级酶解液;s4.三级酶解:调节100g步骤s3制得的滤液为燕麦蛋白二级酶解液的ph值为8,加热至温度为45℃,加入3g碱性蛋白酶和1g风味蛋白酶,酶解0.5h,灭酶,过滤,滤液为燕麦蛋白三级酶解液;s5.菌种活化:分别将植物乳杆菌、凝结芽孢杆菌和富硒酵母菌接种至高氏培养基,微缺氧条件培养,培养温度为35℃,时间为18h,分别培养成菌种种子液,含菌量为107cfu/ml;s6.一级发酵:将植物乳杆菌、凝结芽孢杆菌的菌种种子液接种至100ml步骤s4制得的燕麦蛋白三级酶解液中,所述植物乳杆菌、凝结芽孢杆菌的接种量分别为2%,1%,微缺氧条件下,在36℃温度下发酵培养24h,得到燕麦蛋白一级发酵产物;s7.二级发酵:将富硒酵母菌的菌种种子液接种至100ml的步骤s6制得的燕麦蛋白一级发酵产物中,所述富硒酵母菌的接种量为3%,加入10ml含有5wt%钙离子的氯化钙溶液,微缺氧条件下,在36℃温度下发酵培养12h,然后加入5ml的维生素溶液,继续在36℃温度下发酵培养18h,经过孔径范围为0.1
µ
m的微滤膜过滤,分离除去未能透过膜的未水解的不可溶成分,然后经过孔径范围为不大于2nm的纳滤膜浓缩,冷冻干燥,制得促代谢、抗氧化的燕麦蛋白肽;所述维生素溶液为含有2wt%的维生素b1和1wt%的维生素b12的水溶液;所述微缺氧条件为氧气含量为5%,二氧化碳含量为3%,余量为氮气,其中,%为体积百分比;
所述灭酶的方法为1000w超声处理15min。
28.实施例2本实施例提供一种促代谢、抗氧化的燕麦蛋白肽,具体包括以下步骤:s1.燕麦蛋白的提取:将100g燕麦洗净,干燥,粉碎,过100目筛,得到燕麦粉,加入500ml三氯乙酸-丙酮-乙腈溶液中,混合均匀,沉淀1.5h,10000r/min离心10min,将75g不溶物加入300ml丙酮-乙腈溶液中;混合均匀,沉淀2h,10000r/min离心10min,洗涤60g不溶物,60℃干燥2h,加入300ml裂解液中裂解4h,取上清液,经过孔径为5000d的超滤膜浓缩,得到燕麦蛋白提取液;裂解液为含有5mol/l的尿素、2mol/l的硫脲和1wt%的二硫苏糖醇的水溶液;所述三氯乙酸-丙酮-乙腈溶液中三氯乙酸:丙酮:乙腈的体积比为1:12:5;所述丙酮-乙腈溶液中丙酮:乙腈的体积比为5:7;s2.一级酶解:调节100g步骤s1制得的燕麦蛋白提取液的ph值为3.5,加热至温度为40℃,加入5g胃蛋白酶和7g酸性蛋白酶,酶解3h,灭酶,过滤,滤液为燕麦蛋白一级酶解液;s3.二级酶解:调节100g步骤s2制得的燕麦蛋白一级酶解液的ph值为7,加热至温度为55℃,加入5g中性蛋白酶和6g木瓜蛋白酶,酶解4h,灭酶,过滤,滤液为燕麦蛋白二级酶解液;s4.三级酶解:调节100g步骤s3制得的滤液为燕麦蛋白二级酶解液的ph值为9,加热至温度为55℃,加入5g碱性蛋白酶和3g风味蛋白酶,酶解1.5h,灭酶,过滤,滤液为燕麦蛋白三级酶解液;s5.菌种活化:分别将植物乳杆菌、凝结芽孢杆菌和富硒酵母菌接种至高氏培养基,微缺氧条件培养,培养温度为40℃,时间为24h,分别培养成菌种种子液,含菌量为109cfu/ml;s6.一级发酵:将植物乳杆菌、凝结芽孢杆菌的菌种种子液接种至100ml步骤s4制得的燕麦蛋白三级酶解液中,所述植物乳杆菌、凝结芽孢杆菌的接种量分别为5%,3%,微缺氧条件下,在38℃温度下发酵培养36h,得到燕麦蛋白一级发酵产物;s7.二级发酵:将富硒酵母菌的菌种种子液接种至100ml的步骤s6制得的燕麦蛋白一级发酵产物中,所述富硒酵母菌的接种量为5%,加入20ml含有12wt%钙离子的氯化钙溶液,微缺氧条件下,在38℃温度下发酵培养18h,然后加入10ml的维生素溶液,继续在38℃温度下发酵培养24h,经过孔径范围为0.5
µ
m的微滤膜过滤,分离除去未能透过膜的未水解的不可溶成分,然后经过孔径范围为不大于2nm的纳滤膜浓缩,冷冻干燥,制得促代谢、抗氧化的燕麦蛋白肽;所述维生素溶液为含有5wt%的维生素b1和3wt%的维生素b12的水溶液;所述微缺氧条件为氧气含量为12%,二氧化碳含量为5%,余量为氮气,其中,%为体积百分比;所述灭酶的方法为1500w超声处理20min。
29.实施例3本实施例提供一种促代谢、抗氧化的燕麦蛋白肽,具体包括以下步骤:s1.燕麦蛋白的提取:将100g燕麦洗净,干燥,粉碎,过100目筛,得到燕麦粉,加入
400ml三氯乙酸-丙酮-乙腈溶液中,混合均匀,沉淀1h,10000r/min离心10min,将72g不溶物加入220ml丙酮-乙腈溶液中;混合均匀,沉淀1.5h,10000r/min离心10min,洗涤53g不溶物,60℃干燥2h,加入190ml裂解液中裂解3h,取上清液,经过孔径为4000d的超滤膜浓缩,得到燕麦蛋白提取液;裂解液为含有4mol/l的尿素、1.5mol/l的硫脲和0.7wt%的二硫苏糖醇的水溶液;所述三氯乙酸-丙酮-乙腈溶液中三氯乙酸:丙酮:乙腈的体积比为0.7:10:4;所述丙酮-乙腈溶液中丙酮:乙腈的体积比为4:5;s2.一级酶解:调节100g步骤s1制得的燕麦蛋白提取液的ph值为3,加热至温度为37℃,加入3g胃蛋白酶和5g酸性蛋白酶,酶解2h,灭酶,过滤,滤液为燕麦蛋白一级酶解液;s3.二级酶解:调节100g步骤s2制得的燕麦蛋白一级酶解液的ph值为6.7,加热至温度为52℃,加入3.5g中性蛋白酶和5g木瓜蛋白酶,酶解3h,灭酶,过滤,滤液为燕麦蛋白二级酶解液;s4.三级酶解:调节100g步骤s3制得的滤液为燕麦蛋白二级酶解液的ph值为8.5,加热至温度为50℃,加入4g碱性蛋白酶和2g风味蛋白酶,酶解1h,灭酶,过滤,滤液为燕麦蛋白三级酶解液;s5.菌种活化:分别将植物乳杆菌、凝结芽孢杆菌和富硒酵母菌接种至高氏培养基,微缺氧条件培养,培养温度为37℃,时间为21h,分别培养成菌种种子液,含菌量为108cfu/ml;s6.一级发酵:将植物乳杆菌、凝结芽孢杆菌的菌种种子液接种至100ml步骤s4制得的燕麦蛋白三级酶解液中,所述植物乳杆菌、凝结芽孢杆菌的接种量分别为3.5%,2%,微缺氧条件下,在37℃温度下发酵培养30h,得到燕麦蛋白一级发酵产物;s7.二级发酵:将富硒酵母菌的菌种种子液接种至100ml的步骤s6制得的燕麦蛋白一级发酵产物中,所述富硒酵母菌的接种量为4%,加入15ml含有10wt%钙离子的氯化钙溶液,微缺氧条件下,在37℃温度下发酵培养16h,然后加入7ml的维生素溶液,继续在37℃温度下发酵培养22h,经过孔径范围为0.3
µ
m的微滤膜过滤,分离除去未能透过膜的未水解的不可溶成分,然后经过孔径范围为不大于2nm的纳滤膜浓缩,冷冻干燥,制得促代谢、抗氧化的燕麦蛋白肽;所述维生素溶液为含有3.5wt%的维生素b1和2wt%的维生素b12的水溶液;所述微缺氧条件为氧气含量为9%,二氧化碳含量为4%,余量为氮气,其中,%为体积百分比;所述灭酶的方法为1250w超声处理17min。
30.实施例4与实施例3相比,步骤s1中的三氯乙酸-丙酮-乙腈溶液由三氯乙酸-丙酮溶液替代,三氯乙酸:丙酮的体积比为0.7:14,其他条件均不改变。
31.实施例5与实施例3相比,步骤s7中未添加15ml含有10wt%钙离子的氯化钙溶液,其他条件均不改变。
32.具体步骤如下:s7.二级发酵:将富硒酵母菌的菌种种子液接种至100ml的步骤s6制得的燕麦蛋白
一级发酵产物中,所述富硒酵母菌的接种量为4%,微缺氧条件下,在37℃温度下发酵培养16h,然后加入7ml的维生素溶液,继续在37℃温度下发酵培养22h,经过孔径范围为0.3
µ
m的微滤膜过滤,分离除去未能透过膜的未水解的不可溶成分,然后经过孔径范围为不大于2nm的纳滤膜浓缩,冷冻干燥,制得促代谢、抗氧化的燕麦蛋白肽。
33.实施例6与实施例3相比,步骤s7中未添加7ml的维生素溶液,其他条件均不改变。
34.具体步骤如下:s7.二级发酵:将富硒酵母菌的菌种种子液接种至100ml的步骤s6制得的燕麦蛋白一级发酵产物中,所述富硒酵母菌的接种量为4%,加入15ml含有10wt%钙离子的氯化钙溶液,微缺氧条件下,在37℃温度下发酵培养38h,经过孔径范围为0.3
µ
m的微滤膜过滤,分离除去未能透过膜的未水解的不可溶成分,然后经过孔径范围为不大于2nm的纳滤膜浓缩,冷冻干燥,制得促代谢、抗氧化的燕麦蛋白肽。
35.实施例7与实施例3相比,步骤s7中未添加15ml含有10wt%钙离子的氯化钙溶液和7ml的维生素溶液,其他条件均不改变。
36.具体步骤如下:s7.二级发酵:将富硒酵母菌的菌种种子液接种至100ml的步骤s6制得的燕麦蛋白一级发酵产物中,所述富硒酵母菌的接种量为4%,微缺氧条件下,在37℃温度下发酵培养38h,经过孔径范围为0.3
µ
m的微滤膜过滤,分离除去未能透过膜的未水解的不可溶成分,然后经过孔径范围为不大于2nm的纳滤膜浓缩,冷冻干燥,制得促代谢、抗氧化的燕麦蛋白肽。
37.对比例1与实施例3相比,未进行步骤s1一级酶解,其他条件均不改变。
38.对比例2与实施例3相比,未进行步骤s2二级酶解,其他条件均不改变。
39.对比例3与实施例3相比,未进行步骤s3三级酶解,其他条件均不改变。
40.对比例4与实施例3相比,未进行步骤s1-s3酶解步骤,其他条件均不改变。
41.对比例5与实施例3相比,步骤s6中未接种植物乳杆菌,其他条件均不改变。
42.对比例6与实施例3相比,步骤s6中未接种凝结芽孢杆菌,其他条件均不改变。
43.对比例7与实施例3相比,未进行步骤s6,其他条件均不改变。
44.对比例8与实施例3相比,未进行步骤s7,其他条件均不改变。
45.对比例9与实施例3相比,步骤s7中采用普通面包酵母菌(购于安琪酵母股份有限公司)替代富硒酵母菌,其他条件均不改变。
46.对比例10与实施例3相比,未进行步骤s6-s7发酵步骤,其他条件均不改变。
47.测试例1按照gb5009.5-2016《食品安全国家标准食品中蛋白质的测定》测定实施例1-4步骤s1中得到的燕麦蛋白提取液的蛋白质含量。
48.燕麦蛋白提取率r按以下公式计算:r=m/m
×
100%式中:r为蛋白提取率,%;m为提取液中蛋白的总质量,g;m为燕麦中蛋白质量,g。
49.结果见表1。
50.表1由上表可知,本发明实施例1-3中步骤s1所述的方法对燕麦蛋白的提取率更高。
51.测试例2分子量分布的测定参照文献:liyh,etal.antioxidantandfreeradical-scavengingactivitiesofchickpeaproteinhydrolysate(cph)[j].foodchemistry,2008,106(2):444-450.将实施例1-7和对比例1-10制得的促代谢、抗氧化的燕麦蛋白肽配制成2mg/ml的样品溶液的待分析液,用微孔滤膜过滤。用手动进样器取10μl样品待分析液注入tskgelg2000swxl柱,用含0.15%三氟乙酸的42%乙腈溶液进行洗脱,流速为0.2ml/min,检测波长214nm。用标品aprotinin(6512d)、bactutracin(1423d)、wpww(四肽,674d)、ncs(三肽,322d)、gly-ser(二肽,146d),洗脱时间对log分子量作图获得标准曲线:y=-0.1892x+6.5172(y:logmw,x:洗脱时间),结果见表2。
[0052]
表2
由上表可知,本发明实施例1-3制得的促代谢、抗氧化的燕麦蛋白肽的分子量主要集中在1000d以下,有研究表明小分子肽更容易被吸收,说明制得的促代谢、抗氧化的燕麦蛋白肽所得的多肽分子量更小,主要存在形式为小于五肽的形式。
[0053]
测试例3抗氧化性能测试1、dpph自由基清除能力的测定将实施例1-7和对比例1-10制得的促代谢、抗氧化的燕麦蛋白肽配制成10mg/ml的样品溶液,取1ml样品溶液和4ml0.12mmol/l的dpph溶液混匀,室温下密闭静置30min后在波长517nm处检测其吸光度,对照组为10mg/ml的维生素c溶液,清除率计算公式如下:清除率(%)=(1-a
1-a2)/a3×
100%式中:a1为加入样品后溶液的吸光度;a2为样品的吸光度;a3为未加样品溶液的吸光度。
[0054]
结果见表3。
[0055]
表3
由上表可知,本发明实施例1-3制得的促代谢、抗氧化的燕麦蛋白肽具有很好的dpph自由基清除效果。
[0056]
2、
·
oh自由基清除能力测定于离心管中依次加入0.1ml 10mmol/lfeso4·
7h2o、0.1ml 10mmol/l edta、0.1ml 10mmol/l 2-脱氧核糖、0.1ml 10mg/ml 实施例1-7和对比例1-10制得的促代谢、抗氧化的燕麦蛋白肽溶液、0.5ml 0.1mol/l pbs(ph=7.4)和0.1ml 10mmol/l h2o2,混合均匀后于37℃恒温水浴锅中反应60min,然后加入0.5ml 2.8%三氯乙酸和0.5ml1%硫代巴比妥酸,沸水煮沸15min,冷水冷却,于532nm的条件下测定吸光度。用等量蒸馏水作空白组,10mg/ml的维生素c溶液为对照组。
[0057]
清除率计算公式如下:清除率(%)=(a
0-as)/a0×
100%式中:a0为空白组的吸光度,as为待测样品组的吸光度。
[0058]
结果见表4。
[0059]
表4
由上表可知,本发明实施例1-3制得的促代谢、抗氧化的燕麦蛋白肽具有很好的
·
oh自由基清除效果。
[0060]
3、超氧阴离子自由基清除能力测定将实施例1-7和对比例1-10制得的促代谢、抗氧化的燕麦蛋白肽配制成10mg/ml的样品溶液,取1ml样品溶液和1.85ml 50mmol/l tris-hcl(ph=8.2)置于25℃水浴条件下反应10min,然后加入0.15ml 3mmol/l邻苯三酚(10mmol/l hcl 配制),于325nm下测定溶液的吸光值,每30s 读一次吸光值,直到反应 4min。根据吸光值的变化率来确定邻苯三酚的氧化率(a
样品
),以等体积的蒸馏水代替样品测定邻苯三酚的氧化率(a
空白
)作为空白组,10mg/ml的维生素c溶液为对照组。清除率计算公式如下:清除率(%)=(1-a
样品
/a
空白
)
×
100%式中:a
空白
为空白组的吸光度;a
样品
为待测样品的吸光度。
[0061]
结果见表5。
[0062]
表5
由上表可知,本发明实施例1-3制得的促代谢、抗氧化的燕麦蛋白肽具有很好的超氧阴离子自由基清除效果。
[0063]
综上可知,本发明实施例1-3制得的促代谢、抗氧化的燕麦蛋白肽具有极好的抗氧化效果。
[0064]
测试例4减肥小鼠试验将c57小鼠经过1周适应性的饲养后,将小鼠随机分为19组:正常对照组,高脂饮食组,实施例1-7组,对比例1-10组,每组10只小鼠。正常对照组给予正常小鼠饲料(购于临清市多米农业科技有限公司),其他组给予高脂饲料(购于江苏省协同医药生物工程有限公司,60%脂肪含量,自由采食)。实施例1-5组和对比例1-10组另外每日给予制得的促代谢、抗氧化的燕麦蛋白肽10g/kg体重,正常对照组,高脂饮食组,给予等量的水。所有小鼠连续喂养8周,期间每周固定时间测定动物体重1次并记录,第8周末,所有动物禁食过夜,10%水合氯醛腹腔注射(100
µ
l/10g体重)麻醉,心脏采血,室温放置30min后,离心,收集血清,采用酶法测定血清tg、tc、hdl、ldl。
[0065]
结果见图1和表6。
[0066]
由图1可知,实施例1-3组小鼠在食用制得的促代谢、抗氧化的燕麦蛋白肽后,其体重明显得到了控制,体重明显低于高脂饮食组。
[0067]
表6
由上表可知,喂养高脂饲料的小鼠的tg含量明显低于正常对照组小鼠,tc、hdl、ldl含量明显高于正常对照组小鼠,经过使用本发明实施例1-3制得的促代谢、抗氧化的燕麦蛋白肽,其tg含量明显提高,tc、hdl、ldl含量明显下降,可见,本发明实施例1-3制得的促代谢、抗氧化的燕麦蛋白肽具有较好的控制血脂的效果,促进体内代谢,控制体重。
[0068]
实施例4与实施例3相比,步骤s1中的三氯乙酸-丙酮-乙腈溶液由三氯乙酸-丙酮溶液替代,三氯乙酸:丙酮的体积比为0.7:14。其提取的蛋白质含量明显下降,抗氧化效果下降、减重效果、降低血脂的效果下降。本发明将燕麦粉直接用三氯乙酸-丙酮-乙腈溶液/丙酮-乙腈溶液二次提取,采用三氯乙酸-丙酮-乙腈溶液替代传统的三氯乙酸-丙酮溶液,蛋白提取率更高,采用的乙腈中含有的氰基上的氮元素易于与蛋白氨基酸的羧酸结构形成氢键键连,从而促进燕麦粉中的蛋白提取并在丙酮的存在下沉淀下来,提取时间短,重复率高,可以减少样品中代谢物质的影响和减少蛋白质损耗。
[0069]
实施例5与实施例3相比,步骤s7中未添加15ml含有10wt%钙离子的氯化钙溶液。实施例6与实施例3相比,步骤s7中未添加7ml的维生素溶液。实施例7与实施例3相比,步骤s7中未添加15ml含有10wt%钙离子的氯化钙溶液和7ml的维生素溶液。制得的蛋白肽小于1000d的含量下降,且抗氧化效果、减重效果、降低血脂的效果下降。对比例8与实施例3相比,未进行步骤s7,制得的蛋白肽小于500d的含量明显下降,且抗氧化效果、减重效果、降低血脂的效果明显下降。对比例9与实施例3相比,步骤s7中采用普通面包酵母菌(购于安琪酵母股份有限公司)替代富硒酵母菌,制得的蛋白肽的抗氧化效果、减重效果下降。向燕麦蛋白一级发酵产物中加入富硒酵母菌,进一步酶解的同时,使得产物多肽与有机硒物质中的硒矿物元素发生螯合,形成燕麦蛋白肽-硒螯合物,燕麦蛋白肽与硒元素的螯合物是硒元素与燕麦蛋白肽中的n-端氨基、氨基酸侧链、c-端羧基以及肽链中的羰基和亚氨基之间的相
互配位构成的。与单纯的氨基酸和硒元素相互作用所构成的螯合物相比较能发现燕麦蛋白肽与硒元素的螯合物具有更好的稳定性和配合率,同时还具备生物效益高、极佳的吸收效果、极好的营养性等优点,还有能够结合燕麦蛋白肽与硒元素的互补功能活性如促进代谢、抗氧化、消炎、抗菌、增强免疫、降压、降脂、降糖、减肥减脂肪、体重控制等。
[0070]
对比例1、2、3与实施例3相比,分别未进行步骤s1一级酶解、步骤s2二级酶解、步骤s3三级酶解,其制得的蛋白肽小分子量的相对含量下降,抗氧化效果明显下降。对比例4与实施例3相比,未进行步骤s1-s3酶解步骤,其制得的蛋白肽小分子量的相对含量明显下降,抗氧化效果明显下降,减肥效果、降低血脂的效果明显下降。本发明将制得的燕麦蛋白提取液分别在酸性、中性和碱性条件下分别进行酶解,在酸性条件下,由适合于酸性的胃蛋白酶和酸性蛋白酶来酶解,水解产物中小分子肽占比非常高,产出的多肽几乎都为小分子肽;在中性条件下,由适合于中性的中性蛋白酶和木瓜蛋白酶来酶解,中性蛋白酶是一种金属蛋白酶,优先切割亮氨酸和苯丙氨酸之间的肽键,木瓜蛋白酶能够分解疏水区域的肽键,包括苏氨酸、色氨酸、苯丙氨酸等,酶解产物的水解度高,抗氧化活性高,在碱性条件下,由适合于碱性的碱性蛋白酶和风味蛋白酶来酶解,碱性蛋白酶能切割肽键,包括苯丙氨酸、酪氨酸、色氨酸和赖氨酸羧基,风味蛋白酶优先裂解亮氨酸与脯氨酸或脯氨酸与脯氨酸之间的肽键;酶解速度快,酶解效果好,水解产物小肽的得率高,酶解后的多肽乳化稳定性更高,经过三级酶解后,燕麦蛋白提取液中的燕麦蛋白已经大部分被酶解成小分子短肽、寡肽类物质,具有极好的抗氧化活性。
[0071]
对比例5、6与实施例3相比,步骤s6中未接种植物乳杆菌或凝结芽孢杆菌。对比例7与实施例3相比,未进行步骤s6,制得的蛋白肽小于1000d的相对含量明显下降,减肥效果、降低血脂的效果下降。将制得的燕麦蛋白三级酶解液中还包含有一些长链蛋白质分子以及未水解的蛋白,进一步加入植物乳杆菌、凝结芽孢杆菌进行发酵,益生菌将蛋白分子进一步发酵水解,将大部分未水解的长链蛋白质水解成了氨基酸、短肽、寡肽或者多肽类物质,从而制得燕麦蛋白一级发酵产物。
[0072]
对比例10与实施例3相比,未进行步骤s6-s7发酵步骤。制得的蛋白肽小于1000d的相对含量明显下降,抗氧化效果、减肥效果、降低血脂的效果明显下降。本发明方法制得的促代谢、抗氧化的燕麦蛋白肽包括一种燕麦蛋白肽-硒螯合物,经过检测,起到极好的抗氧化效果,其大部分为低分子量的短肽、寡肽类物质,低分子质量的短肽、寡肽类物质比其庞大的亲本蛋白质更容易接近自由基,并能抑制自由基介导的过氧化。短肽、寡肽类物质通过其肽键和羟基提供氢原子或电子,清除缺少氢离子或电子的自由基,以消除其对生物分子的破坏作用;同时,能通过抑制某些促氧化酶和螯合参与催化自由基生成的过渡金属离子来抑制ros和自由基的形成。短肽、寡肽类物质还可以通过抑制自由基转化为过氧化氢,通过内源性抗氧化剂(包括超氧化物歧化酶、过氧化氢酶、谷胱甘肽)能够将其分解为无害的代谢产物,如水和氧,从而起到高效的抗氧化作用。
[0073]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1