一种基于水凝胶的三维细胞培养支架及其制备方法
1.本发明属组织工程支架技术领域,具体涉及一种基于水凝胶的三维细胞培养支架及其制备方法。
背景技术:
2.细胞移植生物疗法用于治疗多种疾病是临床未来重要的治疗方式。在使用细胞进行治疗时,需要一定的细胞数量,由于细胞来源的数量有限,通常需要经过体外的大规模培养增殖,才能达到临床治疗需要的细胞数量,现有的培养方法,通常是对提取的细胞在体外的扩增与培养。
3.二维细胞培养是利用培养板、培养瓶或培养皿等培养细胞,二维细胞培养操作简单,显著降低了实验的复杂性和成本,所有细胞都处于同一平面上,确保了所有细胞在相同的培养条件下生长,包括气体交换、营养供应和废物清除,此外,细胞还易于控制、筛选和收集。但二维培养常发生细胞组织架构、机械和生物化学信号以及细胞与细胞之间信息交流的丢失,无法反映真实组织生理上的复杂性,影响细胞功能。
4.三维细胞培养通过细胞聚集建立细胞球或将细胞嵌入支架上或支架内来模拟真实组织的细胞外基质,从而在一定程度上模拟体内环境,在细胞增殖、分化、形态和功能方面有不同的表现。如在二维环境中细胞生长的初始速率很高,但当细胞开始融合,增殖便会停止。与二维环境相比,三维支架中的细胞生长持续时间更长。三维培养系统,根据产品是否为细胞提供支撑材料大体可分为两种类型:基于支架的培养体系和无支架的培养体系。
5.无支架三维细胞培养是指细胞自发聚集形成巨大细胞球体,无需外源性支架或基质。心脏来源的祖细胞进行无支架三维细胞培养,与二维培养相比,干细胞相关基因表达有所上调,氧化应激条件下细胞存活率更高。然而,球体培养仍具有一些明显的缺点。细胞球的功能性活动与其直径密切相关,球体中心的细胞仅依赖球体由外向内扩散的营养和氧气生存,可能由于缺乏氧气和营养供应而死亡。目前人们还无法精准控制球体的大小,对球体结构控制的缺乏、与天然组织的差异等难题,限制着细胞球作为三维组织模型的应用。
6.有支架的三维细胞培养是将细胞复合在三维支架上进行培养。支架分为三种:天然细胞外基质支架、天然材料支架和合成材料支架。天然细胞外基质支架的可用性相对较小,组织质量难以控制,天然组织结构本身的复杂性及细胞或组织对刺激的独立应答,使得技术依赖性较高。天然支架包括海藻酸盐、壳聚糖等,天然材料本身复杂的生化反应、质量不一致、不明确来源等属性限制了其应用。合成生物材料具有良好的可控性和降解性,精良的组成成分和物理特性,可操作性高,灵活度大,没有免疫方面的问题,但缺点是器官特异性结构和细胞类型特异性的相对缺乏。支架采用的类型通常为水凝胶或者多孔材料,多孔支架虽然是三维结构,但细胞仍然是以二维粘附的方式在支架内部的表面生长,水凝胶具有与三维培养的特性更接近的模式。
7.水凝胶支架仍然存在营养物质向支架内部扩散的问题,当水凝胶厚度支架超过一定尺度后,通常约为2mm,支架内部的细胞难以获得足够的养分;此外,水凝胶由于强度较
差,通常只能静置在培养装置内,或悬挂在无强制对流的培养装置内,这两种方式均限制了大规模培养的实施。同时这两种方式也不便进行相应的力学加载刺激,影响了体外细胞行为的研究效率。
8.因此,在传统三维培养支架的基础上,开发一种适于大规模培养,耐受培养基强制对流,且能进行力学加载刺激的三维细胞培养支架,对细胞的快速扩增、细胞活性及特性的维持具有重要的意义。
技术实现要素:
9.针对以上现有技术的缺点和不足之处,本发明的首要目的是提供一种基于水凝胶的三维细胞培养支架。
10.本发明的另一目的是提供上述基于水凝胶的三维细胞培养支架的制备方法。
11.本发明的另一目的是提供上述基于水凝胶的三维细胞培养支架的应用。
12.用于三维细胞培养的载体材料,材料具有层状结构,层状结构的中间是用于支持细胞载体再生的多孔水凝胶结构,水凝胶上下两端是具有一定孔径孔隙率的多孔高分子材料膜结构,水凝胶与高分子膜间通过化学键合结合在一起。
13.针对细胞三维培养,解决培养基强制对流用的细胞规模化三维培养的三维培养支架。
14.为实现上述目的,本发明提供以下技术实现方案:
15.一种基于水凝胶的三维细胞培养支架,所述三维细胞培养支架中间层为水凝胶,上下两层为高分子多孔膜,所述中间层与上下层通过化学键合连接。
16.优选地,所述三维细胞培养支架厚度为0.1~0.5mm,所述高分子多孔膜厚度为0.01~0.05mm,所述水凝胶厚度为0.05~0.2mm,更优选为0.08-0.14mm;
17.所述高分子多孔膜的孔径为0.01μm-500μm;
18.优选地,所述化学键合连接为双键连接、和/或氨基与醛基键合连接,通过叠加制备五层以上的三维细胞培养支架。
19.优选地,所述高分子多孔膜的组成为聚氨酯,聚己内酯,聚乳酸,聚乙醇酸的一种或两种以上,或者为双键修饰的聚氨酯,聚己内酯,聚乳酸,聚乙醇酸的一种或两种以上;所述上下两层多孔高分子膜相同或不同。
20.优选地,所述水凝胶为明胶、透明质酸、壳聚糖、海藻酸、聚乙二醇、聚乙烯醇的一种或两种以上的组合;
21.或者所述水凝胶为氨基、巯基、不饱和基团改性后的明胶、透明质酸、壳聚糖、海藻酸、聚乙二醇、聚乙烯醇的一种或两种以上的组合。
22.所述不饱和基团包括碳碳双键,碳碳三建,羰基,羧基,醛基。
23.优选地,所述高分子多孔膜组成为表面修饰有双键的多孔聚氨酯,所述水凝胶为侧基带有双键的聚乙烯醇。
24.优选地,在所述高分子多孔膜表面涂敷抗菌涂层,或在水凝胶中包埋抗菌成分;
25.优选地,所述抗菌涂层为季铵盐;
26.所述水凝胶中还添加短肽、生长因子或药物,所述短肽为rgd肽,所述生长因子是vegf或bfgf,所述药物为dmog和/或去铁胺dfo。
27.一种制备上述基于水凝胶的三维细胞培养支架的方法,包括如下步骤:
28.(1)制备表面修饰有双键的多孔材料:制备10~15wt%的高分子多孔材料溶液,加入40~50%乙二胺,70-90℃搅拌反应,造孔,得到修饰有氨基的多孔材料,浸入到体积分数为2~3%的gma的乙醇溶液中,加入催化剂,搅拌反应12-24h,超声清洗,干燥,得到表面修饰有双键的高分子多孔材料;
29.(2)制备侧基带有双键的水凝胶:将水凝胶层原料溶解于dmso中得到3-10%w/v溶液,加入羟基含量2%的gma,催化剂,60-70℃搅拌反应12-24h,洗去未反应的gma,得到侧基带有双键的水凝胶;
30.(3)化学键合:将步骤(1)表面修饰有双键的高分子多孔材料平铺在两片载玻片上,将步骤(2)得到的侧基带有双键的水凝胶添加光引发剂,加入到两片载玻片之间,365nm紫外光照1-5min,通过双键自由基聚合反应化学键合,形成水凝胶整体与多孔膜的化学键合,得到三层结构的复合材料,再通过用dmf或thf溶剂将上下两层边缘的多孔材料溶在一起得到三维细胞培养支架。
31.优选地,步骤(3)所述的光引发剂为1-2%i-2959或tpo-l,步骤(1)和(2)所述催化剂为1-2%dmap,步骤(1)所述搅拌反应温度为室温。
32.优选地,还在步骤(1)的表面修饰有双键的高分子多孔材料表面修饰有季铵盐抗菌涂层,所述季铵盐涂层材料通过以下方法得到:
33.称取甲基丙烯酸二甲氨乙酯和2,2'-偶氮(2-甲基-n-(2-羟基乙基)丙酰胺),加入无水n,n
′‑
二甲基甲酰胺溶解,向体系中通氮气30min,于86~90℃下反应12h;称取聚丁二醇搅拌下抽真空除水2~3h,称量除水后的聚丁二醇,于110~120℃机械搅拌下抽真空二次除水30min,于65~75℃氮气氛围下加入六亚甲基二异氰酸酯和0.3g/ml异辛酸锡的n,n
′‑
二甲基甲酰胺溶液,聚合6~8h;将反应结束的聚甲基丙烯酸二甲氨乙酯溶液加入到聚合完成的聚氨酯预聚物溶液中,添加0.3g/ml异辛酸锡的n,n
′‑
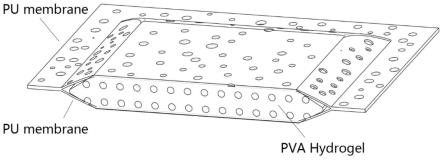
二甲基甲酰胺溶液,65~75℃反应12~24h,继续升温至80℃反应5~6h;将反应混合物滴加到去离子水中,收集产物,置于45℃烘箱烘干。
34.更优选地,称取4.7160g甲基丙烯酸二甲氨乙酯和0.1440g 2,2'-偶氮(2-甲基-n-(2-羟基乙基)丙酰胺)于50ml单口烧瓶中,加入15ml无水n,n
′‑
二甲基甲酰胺溶解,向体系中通氮气30min,于86℃下反应12h;称取6g聚丁二醇(mn=1000)于50ml单口烧瓶中,于110℃磁力搅拌下抽真空除水2h,称量除水后的聚丁二醇(mn=1000)4.5g于250ml三口烧瓶中,于110℃机械搅拌下抽真空二次除水30min;于65℃氮气氛围下加入0.8450g六亚甲基二异氰酸酯和55μl 0.3g/ml异辛酸锡的n,n
′‑
二甲基甲酰胺溶液,聚合6h;将反应结束的聚甲基丙烯酸二甲氨乙酯溶液加入到聚合完成的聚氨酯预聚物溶液中,添加50ul 0.3g/ml异辛酸锡的n,n
′‑
二甲基甲酰胺溶液,65℃反应12h,继续升温至80℃反应5h;将反应混合物滴加到去离子水中,收集产物,置于45℃烘箱烘干。
35.上述基于水凝胶的三维细胞培养支架在三维细胞培养中的应用。
36.与现有技术相比,本发明具有以下优点及有益效果:
37.(1)本发明提供的一种多层结构的三维支架,多孔膜适宜的厚度与孔径不影响夹层内细胞与培养基的物质交换,同时,多孔高分子膜的力学增强结构,在与传统的水凝胶支架相比较时,多孔膜与水凝胶的多层复合结构可在强制对流的培养基环境中使用,操作适
应性能更佳,便于用于大规模细胞培养;
38.(2)化学键合的多孔膜复合水凝胶材料能够增强其力学特性,弹性模量较水凝胶提高了14.86倍,较物理结合的pu-pva提高了29%;
39.(3)与传统的多孔支架相比时,多孔聚氨酯材料键合水凝胶层材料pu@d-pvama具有更接近真实状态的三维培养模式,能够更好维持细胞的特性,具有良好的生物相容性,有利于细胞增殖。
附图说明
40.图1是实施例1中多孔聚氨酯材料的示意图;
41.图2是实施例3中水凝胶材料的示意图;
42.图3是实施例4中上下为多孔聚氨酯材料,中间为水凝胶层的多层结构的三维支架示意图;
43.图4是实施例4中上下为多孔聚氨酯材料,中间为水凝胶层的多层结构的三维支架截面示意图;
44.图5是实施例1中多孔聚氨酯材料的电镜图;
45.图6是实施例3中碳碳双键改性的聚乙烯醇的核磁图;
46.图7是实施例2中多孔聚氨酯材料修饰双键的核磁图;
47.图8是实施例2中多孔聚氨酯材料修饰双键的电镜图;
48.图9是实施例4中多孔聚氨酯材料键合水凝胶层的电镜图;
49.图10是实施例6中多孔聚氨酯材料键合水凝胶层的应力应变曲线图;
50.图11是实施例7中多孔聚氨酯材料键合水凝胶层的细胞增殖图;
51.图12是实施例7中多孔聚氨酯材料键合水凝胶层的活死染色图,12a、12b、12c分别为control组,多孔pu材料组和pu@d-pvama组。
具体实施方式
52.为更好的说明本发明的目的、技术方案和优点,下面结合实施例对本发明做进一步地详细描述,但本发明的实施方式不限于此。本发明涉及的原料除非特别声明均为普通市售产品,对于未特别注明的工艺参数,可参照常规技术进行。
53.聚氨酯:购自广州敬信高聚物科技有限公司,分子量为110000-120000。
54.pva:购自麦克林,分子量为84000-89000。
55.l929细胞来源华南理工大学国家人体组织功能重建技术研究中心。
56.l929细胞培养基:高糖dmem(含有10%fbs和1%双抗)。
57.实施例1制备多孔聚氨酯材料
58.将聚氨酯溶于dmf中得到10%质量分数溶液,加入nacl搅拌均匀,理论孔隙率为60%,采用改良液体位移法测定孔隙率(孙凯,年争好,徐成,李瑞欣,李晖.丝素蛋白复合胶原蛋白支架的制备及性能研究.中国修复重建外科杂志,2014,28(7):903-908.),实际孔隙率为57.9%,通过涂膜器在玻璃板上铺膜,成膜后将其浸入去离子水中使nacl溶出,得到厚度为0.01mm的聚氨酯膜。
59.图5为多孔聚氨酯膜材料的电镜图,从图中可以看出聚氨酯膜的多孔结构,在膜的
内部也存在着连通孔,孔直径大概在100um左右。
60.实施例2多孔聚氨酯材料表面修饰
61.将聚氨酯溶于dmf得到10%质量分数溶液,加入40%己二胺并在85℃下搅拌反应,反应结束后在乙醇中沉淀洗去未反应的己二胺,重新溶解在dmf中并在乙醇中反复沉淀3次,干燥得到修饰有氨基的聚氨酯;将修饰有氨基的聚氨酯溶解在四氢呋喃(thf)中,加入nacl后,通过涂膜器在玻璃板上铺膜,干燥后将其浸入去离子水中使nacl溶出得到修饰有氨基的多孔聚氨酯材料;将修饰有氨基的多孔聚氨酯材料浸入到含有2%体积分数的甲基丙烯酸缩水甘油酯(gma)的乙醇溶液中,加入质量分数为1%4-二甲氨基吡啶(dmap)作为催化剂,在室温下搅拌反应12h后,用乙醇超声清洗三遍,干燥后得到表面修饰有双键的多孔聚氨酯材料(pu@d)。
62.图7为多孔聚氨酯材料修饰双键的核磁图,从图中可以看到pu@d在6.04ppm和5.63ppm的位置出峰,表明成功将双键修饰到聚氨酯分子链上;图8为多孔聚氨酯材料修饰双键后的电镜图,对比图5可以看到两者差异不大,说明对于聚氨酯材料的改性不会影响到制备多孔膜的物理结构。
63.实施例3制备中间水凝胶层
64.将聚乙烯醇溶解于dmso中得到10%w/v pva溶液,加入羟基含量2%的甲基丙烯酸缩水甘油酯(gma),并且加入1%dmap作为催化剂,在60℃下搅拌反应12h,将其在丙酮中洗去未反应的gma,最后收集得到侧基带有双键的聚乙烯醇pvama。
65.图6为碳碳双键改性的聚乙烯醇的核磁图,从图中可以看到改性后的碳碳双键的氢原子出峰在6.04ppm和5.63ppm,表面成功将双键修饰到聚乙烯醇分子链上。
66.实施例4水凝胶与多孔聚氨酯进行化学键合
67.将实施例2得到的表面修饰有双键的多孔聚氨酯材料平铺在载玻片上,将实施例3得到的侧基带有双键的聚乙烯醇溶液,添加1%i2959作为光引发剂,将聚乙烯醇溶液添加到两片载玻片之间,之后在365nm紫外光下照射1min之后,通过自由基聚合反应进行化学键合,得到厚度约为0.1mm的三层结构的复合材料,其中,多孔聚氨酯材料厚度为0.01mm,水凝胶层厚度为0.08mm,最后通过用dmf或thf溶剂将上下两层边缘的多孔聚氨酯材料溶在一起,形成图3、4样的复合材料。
68.图9为多孔聚氨酯材料键合水凝胶层的电镜图,可以看到位于上层的水凝胶多孔结构以及位于下层的聚氨酯的多孔结构。
69.实施例5多孔聚氨酯涂层表面修饰有季铵盐抗菌涂层
70.本实例中季铵盐涂层材料通过以下方法得到:称取4.7160g甲基丙烯酸二甲氨乙酯和0.1440g 2,2'-偶氮(2-甲基-n-(2-羟基乙基)丙酰胺)于50ml单口烧瓶中,加入15ml无水n,n
′‑
二甲基甲酰胺溶解,向体系中通氮气30min,于86℃下反应12h;称取6g聚丁二醇(mn=1000)于50ml单口烧瓶中,于110℃磁力搅拌下抽真空除水2h,称量除水后的聚丁二醇(mn=1000)4.5g于250ml三口烧瓶中,于110℃机械搅拌下抽真空二次除水30min;于65℃氮气氛围下加入0.8450g六亚甲基二异氰酸酯和55μl 0.3g/ml异辛酸锡的n,n
′‑
二甲基甲酰胺溶液,聚合6h;将反应结束的聚甲基丙烯酸二甲氨乙酯溶液加入到聚合完成的聚氨酯预聚物溶液中,添加50ul 0.3g/ml异辛酸锡的n,n
′‑
二甲基甲酰胺溶液,65℃反应12h,继续升温至80℃反应5h;将反应混合物滴加到去离子水中,收集产物,置于45℃烘箱烘干。
71.实施例6
72.力学测试:采用万能拉力试验机(jhy-5000、金河源)对实施例4的复合材料进行力学测试。所有的样品裁剪为长4cm、宽2.1cm的长条,测试环境温度为25℃,拉伸速度为10mm/min。
73.图10为多孔聚氨酯材料键合水凝胶层的应力应变曲线图,其中水凝胶的弹性模量为0.29mpa,物理结合pu-pva弹性模量为3.56mpa,化学键合pu@d-pvama弹性模量为4.6mpa,化学键合的多孔膜复合水凝胶材料能够增强其力学特性,弹性模量较水凝胶提高了14.86倍,较物理结合的pu-pva提高了29%。
74.实施例7
75.细胞增殖测试:将pu、pu@d-pvama材料置于48孔板中,将细胞接种到材料上,每个孔接种1
×
104个l929细胞,空白组做对照。在培养1,3,5,7天后,将含有10%cck-8溶液的培养基加入孔板,孵育两小时,然后取100ul培养基加入96孔板,用酶标仪测试培养基在450nm处的吸光度(见图11)。
76.活死染色测试:在培养3d后,用pbs冲洗数遍,参考试剂盒(calcein-am/pi double staining kit,型号:c542,厂商:同仁化学)的操作步骤,进行细胞活死染色,15min后,吸走染色试剂,用pbs冲洗三遍后,用倒置荧光显微镜拍照。
77.图11为多孔聚氨酯材料键合水凝胶层的细胞增殖图,由图可知,l929细胞在不同材料上的增殖情况,表明多孔聚氨酯材料键合水凝胶层材料pu@d-pvama具有良好的生物相容性,有利于细胞增殖。
78.图12为多孔聚氨酯材料键合水凝胶层的活死染色图。可以看到在多孔聚氨酯材料键合水凝胶层材料上的细胞存活良好。
79.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1