一种海洋杂色曲霉胞外多糖、制备方法及其应用
versicolor scau141。其分离和鉴定方法为常规方法。
7.对该菌株进行发酵,筛选其发酵条件,得到胞外粗多糖avp141。
8.通过阴离子交换柱和凝胶柱层析的方法对该胞外粗多糖avp141进行分离纯化,得到多个相对均一、平均分子量为4082da的胞外多糖 avp141-a,通过紫外光谱、傅里叶红外光谱、液相色谱、气相-质谱联用色谱、甲基化和核磁共振谱对avp141-a进行结构解析,得到结构如式1的新颖多糖。
9.体外免疫活性评估,其对raw264.7巨噬细胞具有免疫调节作用,探究相关信号通路上免疫蛋白的表达情况,并推测avp141-a是通过影响raw264.7巨噬细胞的氨基酸代谢,尤其是精氨酸合成和代谢发挥免疫调节作用。
10.本发明解决上述技术问题的方案如下:
11.本发明的一个目的在于提供一种海洋杂色曲霉胞外多糖,所述的海洋杂色曲霉胞外多糖avp141-a为具有式1所示的结构的多糖:
[0012][0013]
进一步的,所述海洋杂色曲霉胞外多糖是将海洋杂色曲霉aspergillus versicolor scau141接种至发酵液培养基中发酵,得发酵液,对发酵液过滤、浓缩、醇沉、除蛋白、透析、冻干后得粗多糖,粗多糖再经deae 离子交换柱、g-100凝胶柱层析分离纯化,得平均分子量为4082da的胞外多糖avp141-a;
[0014]
所述海洋杂色曲霉胞外多糖avp141-a的单糖组成为100%葡萄糖;
[0015]
所述海洋杂色曲霉胞外多糖avp141-a的糖苷键类型为: [glcp-(1
→
],[
→
4)-glcp-(1
→
],[
→
6)-glcp-(1
→
],和[
→
4,6)
–
glcp-(1
→
],且摩尔比为16.93:58.80:7.38:16.89。
[0016]
所述海洋杂色曲霉胞外多糖avp141-a不含有核酸和蛋白质;
[0017]
所述海洋杂色曲霉胞外多糖avp141-a不含有糠醛酸;
[0018]
所述海洋杂色曲霉胞外多糖avp141-a的硫酸根含量为3.62%;
[0019]
所述胞外多糖avp141-a为表面粗糙,有大量孔洞的片状结构。
[0020]
本发明的另一目的,提供了所述的海洋杂色曲霉胞外多糖的制备方法,包括如下步骤:
[0021]
(1)制备发酵液培养基:发酵培养基组成为:麦芽糖20g/l、葡萄糖10g/l、甘露糖20g/l、谷氨酸钠10g/l、七水硫酸镁0.3g/l、磷酸二氢钾0.5g/l、玉米浆1g/l、酵母膏3g/l以及海盐30g/l,调整发酵培养基ph值为6.8-7.5,灭菌,得发酵液培养基;
[0022]
(2)接种培养:将海洋杂色曲霉aspergillus versicolor scau141孢子接种至步骤(1)所述的发酵液培养基中培养,得发酵液;
[0023]
(3)除菌体、浓缩:将所述步骤(2)中的发酵液过滤,滤液60℃减压浓缩,得浓缩液;
[0024]
(4)醇沉:向步骤(3)所述的浓缩液中加入无水乙醇,4℃静置,离心收集沉淀,沉淀溶于水,得粗多糖液;
[0025]
(5)除蛋白:向步骤(4)所述的粗多糖液中加入savage试剂,摇床震荡,离心,保留
水相,透析,冻干后得粗多糖avp141,avp141产率为0.4g/l;
[0026]
(6)deae离子交换柱分离:用水将步骤(5)所述的粗多糖avp141 配置成10mg/ml溶液,离心,取上清液上样,以0~2mol/l的nacl溶液洗脱,收集洗脱液,透析,冻干得到粗多糖avp141-i,经称重,avp141-i 占avp141粗多糖重量的62.5%;
[0027]
(7)g-100凝胶柱层析纯化:将步骤(6)所述的粗多糖avp141-i 用超纯水洗脱,透析,冻干得到粗多糖avp141-1,使用g-100葡聚糖凝胶分离avp141-1,收集洗脱液,透析,冻干得到均一组分多糖avp141-a。
[0028]
进一步的,所述步骤(2)中接种培养的温度为26
±
3℃,培养时间为6-8天。
[0029]
进一步的,所述步骤(3)中浓缩液为原体积1/4-1/5。
[0030]
进一步的,所述步骤(4)中浓缩液:无水乙醇=1:(4-5),v/v。
[0031]
本发明的再一目的,公开了所述的海洋杂色曲霉胞外多糖avp141-a 在制备免疫活性调节试剂中的应用。
[0032]
进一步的,所述免疫活性调节试剂为调节raw264.7巨噬细胞的免疫活性的试剂。
[0033]
本发明相对于现有技术具有如下的优点:
[0034]
(1)本发明中的海洋杂色曲霉胞外多糖avp141-a是首次从杂色曲霉(aspergillus versicolor scau141)菌株发酵液中提取的,具有新的结构,组分均一,其分子量为5135da。单糖组成为100%葡萄糖,不含有核酸和蛋白质,不含有糠醛酸。
[0035]
(2)采用红外、甲基化结果和nmr结果分析,avp141-a的主链由残基[α-d-glcp-(1
→
],[
→
4)-α-d-glcp-(1
→
],[
→
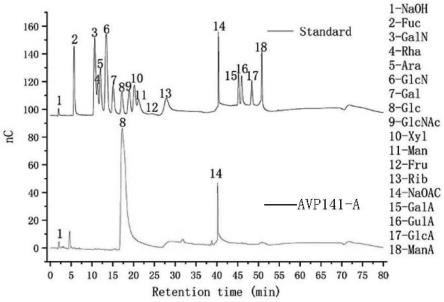
6)-α-d-glcp-(1
→
], [
→
4,6)-α-d-glcp-(1
→
]组成,在[
→
4,6)-α-d-glcp-(1
→
]的c-4位置可能有末端基团和硫酸基的取代。
[0036]
(3)采用扫描电镜发现胞外多糖avp141为表面光滑的片状结构; avp141-a为表面粗糙、有大量的孔洞的片状结构。
[0037]
(4)海洋杂色曲霉胞外多糖avp141-a纯度高达99.13%。
[0038]
(5)经海洋杂色曲霉胞外多糖avp141-a作用于raw264.7巨噬细胞,cck-8法测定结果表明在25-200μg/ml浓度范围内,avp141-a可促进巨噬细胞raw264.7的增殖,证明其对细胞无毒性。不同浓度(50、100和200μg/ml)的avp141-a能剂量依赖性地促进no、tnf-α和il-6 分泌。免疫荧光表明avp141-a能剂量依赖性地促进raw264.7细胞表达cox2,流式细胞术及细胞荧光探针表明avp141-a能升高细胞的脂质氧化水平,蛋白质免疫印迹实验中cox2、acsl4的表达上调。
[0039]
(6)海洋杂色曲霉胞外多糖avp141-a的网络药理学-代谢组学联合分析,海洋杂色曲霉胞外多糖avp141-a是通过影响raw264.7巨噬细胞的氨基酸代谢,尤其是精氨酸合成和代谢发挥免疫调节作用。
[0040]
菌种:本发明的杂色曲霉scau141菌株分离自中国南海海域(9
°
39' 29.75"n,112
°
59'09.84"e)的石珊瑚样品,该菌株已于2020年7月27 日保藏于广东省微生物菌种保藏中心,保藏地址为广州市先烈中路100号大院59号楼5楼,其保藏编号为gdmcc no:61106,其分类命名为aspergullus versicolor scau141。
附图说明
[0041]
构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实
施例及其说明用来解释本发明,并不构成对本发明的不当限定。
[0042]
图1海洋杂色曲霉胞外多糖avp141的deae-sepharose fast flow洗脱曲线;
[0043]
图2海洋杂色曲霉胞外多糖avp141-i的g-100凝胶层析洗脱曲线;
[0044]
图3海洋杂色曲霉胞外多糖avp141-a的hpgpc出峰图,其峰型为单一对称,与g-100凝胶层析图所得的结果相符合,证明avp141-a 为均一多糖。
[0045]
图4海洋杂色曲霉胞外多糖avp141-a的离子色谱;
[0046]
图5海洋杂色曲霉胞外多糖avp141-a的总糖含量测定的标准曲线;
[0047]
图6海洋杂色曲霉胞外多糖avp141-a的蛋白质含量测定的标准曲线;
[0048]
图7海洋杂色曲霉胞外多糖avp141-a的硫酸根含量测定的标准曲线;
[0049]
图8海洋杂色曲霉胞外多糖avp141-a的紫外扫描光谱;
[0050]
图9海洋杂色曲霉胞外多糖avp141-a的红外扫描光谱;
[0051]
图10海洋杂色曲霉胞外多糖avp141-a的电镜扫描图谱(a:500
×
; b:2000
×
;c:4000
×
);
[0052]
图11海洋杂色曲霉胞外多糖avp141-a的乙酰化产物的gcms色谱图;
[0053]
图12海洋杂色曲霉胞外多糖avp141-a的甲基化衍生物的质谱图 (a,残基a;b,残基b;c,残基c;d,残基d);
[0054]
图13海洋杂色曲霉胞外多糖avp141-a的一维核磁共振1h-nmr 谱图;
[0055]
图14海洋杂色曲霉胞外多糖avp141-a的一维核磁共振
13
c-nmr 谱图;
[0056]
图15海洋杂色曲霉胞外多糖avp141-a的二维1h-1
h-cosy谱图;
[0057]
图16海洋杂色曲霉胞外多糖avp141-a的二维hmbc谱图;
[0058]
图17海洋杂色曲霉胞外多糖avp141-a的二维hsqc谱图;
[0059]
图18海洋杂色曲霉胞外多糖avp141-a对raw264.7巨噬细胞增殖的影响;
[0060]
图19海洋杂色曲霉胞外多糖avp141-a对raw264.7巨噬细胞分泌 no的影响;
[0061]
图20海洋杂色曲霉胞外多糖avp141-a对raw264.7分泌细胞因子 tnf-α和il-6的影响(a,tnf-α;b,il-6)与空白对照组相比,*:p《0.05, **:p《0.01,****:p《0.0001;
[0062]
图21海洋杂色曲霉胞外多糖avp141-a对raw264.7细胞产生ros 的影响(a,细胞荧光强度;b,细胞的平均荧光强度);
[0063]
图22海洋杂色曲霉胞外多糖avp141-a对raw264.7细胞表达 cox2的免疫荧光结果(a,荧光显微镜拍摄图片;b,细胞的平均荧光强度;c,荧光所占面积);
[0064]
图23海洋杂色曲霉胞外多糖avp141-a对raw264.7细胞各蛋白质表达量的影响(a,目标蛋白条带图片;b,cox2相对表达量;c,acsl4 相对表达量),注:与空白对照组相比,*:p《0.05,***:p《0.001。
具体实施方式
[0065]
下面结合附图和实施例对本发明作进一步说明。
[0066]
实施例1:海洋杂色曲霉胞外多糖avp141-a的提取与分离纯化
[0067]
发酵液培养基的组成为:麦芽糖20g/l、葡萄糖10g/l、甘露糖20g/l、谷氨酸钠10g/l、七水硫酸镁0.3g/l、磷酸二氢钾0.5g/l、玉米浆1g/l、酵母膏3g/l以及海盐30g/l,ph值调整为7.5。发酵培养基配制完成后于高压灭菌锅中121℃灭菌20min;
[0068]
(1)接种培养:待液体培养基恢复至室温后接种aspergullusversicolorscau141孢子,于26℃培养7d;
[0069]
(2)醇沉:获得的发酵液经布氏漏斗过滤去除不溶性杂质,在60℃下减压浓缩至原体积的五分之一,无水乙醇(发酵液:无水乙醇=1:3,v/v),密封,于4℃冰箱中沉淀20h后,12000r/min离心20min,收集沉淀。
[0070]
(3)除蛋白:向步骤(2)中所得粗多糖液中加入sevage试剂(粗多糖液:sevage试剂=4:1,v/v),室温下置于摇床震荡(1h)混匀,使蛋白充分吸附在有机相中,然后离心(12000r/min,20min),保留水相,重复操作直至蛋白完全除去,收集的水相,将上清液多糖水溶液加入截留分子量为3500da的透析袋中封口,置于蒸馏水中,放入4℃冰箱内透析,每4h更换一次蒸馏水,直至外界透析液的导电率不再变化、透析袋中小分子物质被透析到外界透析液中。取出袋内溶液,样品在-80℃超低温冰箱中预冻48h后冷冻干燥,得到海洋来源杂色曲霉胞外粗多糖avp141。本发明提取的海洋杂色曲霉胞外多糖avp141产率约为0.4g/l。
[0071]
(4)deae离子交换柱分离:
[0072]
deaefastflow弱阴离子交换柱是利用吸附与解吸附原理来分离多糖的一种办法,将已预处理的deae-sepharosefastflow填料装入玻璃层析柱(2.6
×
70cm)中,用蒸馏水平衡4个柱体积,将上述步骤(3)后的粗胞外粗多糖avp141称取100mg溶解在10ml蒸馏水中配置成10mg/ml溶液,充分溶解后离心,取上清液样品上样,加样于deae离子交换柱中,依次用0、0.1、0.3、0.6、0.9、1.0和2mol/l的nacl溶液进行洗脱,洗脱液流度为1ml/min,每管收集10ml,收集avp141洗脱液进行并隔管检测,绘制洗脱曲线如图1所示,得到四个对称的洗脱峰,收集每个对称洗脱峰、透析、冻干,得到四个组分多糖分别为白色絮状物avp141-i、淡黄色絮状物avp141
‑ⅱ
、深黄色絮状物avp141-iii和深褐色絮状物avp141-iv。经称重,avp141-i占avp141粗多糖重量的62.5%。
[0073]
(5)g-100凝胶柱层析纯化:g-100葡聚糖凝胶是通过分子筛原理分离多糖的一种方法,收集、合并步骤(4)中包含avp141-i相应管数的洗脱液,用蒸馏水72h低温透析后冻干;进一步的,用超纯水和葡聚糖凝胶柱纯化洗脱,采用g-100凝胶柱(葡聚糖凝胶g-100,25g,索莱宝生物科技有限公司,2.6cm
×
60cm)对avp141-i多糖进行纯化,每管测量含糖量,洗脱速度为0.5ml/min,每管收集5ml,其中g-100葡聚糖凝胶柱洗脱曲线如图2所示;收集组分avp141-1、透析、冻干,得到均一组分多糖avp141-a。
[0074]
实例2:海洋杂色曲霉胞外多糖avp141-a的纯度及基本成分分析
[0075]
分子量:将海洋杂色曲霉胞外多糖avp141-a与已知分子量葡聚糖标准品配置成5mg/ml的多糖溶液,置于样品瓶中,加入流动相,室温放置12h,采用凝胶色谱仪进行分析对海洋杂色曲霉胞外多糖avp141-a的分子量进行测试。
[0076]
色谱条件:在40℃柱温下使用brt105-104-102串联凝胶柱(8mm
×
300mm);以0.05mol/lnacl作为流动相,流速设定为0.6ml/min,进样体积20μl,用ri-10a示差检测器记录avp141-a的出峰时间图谱。
[0077]
数据分析和标准曲线绘制:以已知葡聚糖标准品相对分子质量的对数(logmw)为纵坐标,以保留时间为横坐标建立回归方程,拟合后的回归方程为:y=-0.1877x+12.021,(r2=0.9971),lgmp-rt;y=-0.2001x+12.602,(r2=0.9947),lgmw-rt;y=-0.1856x+
11.858,(r2=0.9941),lgmn-rt;得到标准曲线,根据标准曲线计算avp141-a 的相对分子量。
[0078]
实验结果如图3,avp141-a的hpgpc出峰图,其峰型为单一对称,与g-100凝胶柱层析图2所得的结果相符合,证明avp141-a为均一多糖,其峰位分子量(mp)为4792da,重均分子量(mw)为5135da,数均分子量(mn)为4082da。
[0079]
单糖组成:多糖是由若干单糖经脱水缩合而成的聚合物,分析多糖的单糖组成有助于结构解析以及分析构效关系。采用离子色谱法测定 avp141-a组分的单糖组成。精确称取烘干单糖标准品和avp141-a样品配制待测溶液,色谱条件:在柱温30℃的情况下,用dionexcarbopactmpa20(3mm
×
150mm)色谱柱,设置流速为0.3ml/min,进样5μl梯度洗脱avp141-a样品。流动相a:h2o;相b:15mmol/l naoh;相 c:15mmol/l naoh及100mmol/l naoac,用电化学检测器记录洗脱曲线。结果如图4所示,图4中2.0min左右均为氢氧化钠的峰,40min 左右均为乙酸钠的峰。对比两图的离子色谱,结果表明avp141-a由100%葡萄糖聚合而成,是一个葡聚糖。
[0080]
总糖含量:用苯酚-硫酸法在490nm下测定多糖溶液的吸光度,以干燥至恒重的葡萄糖为标准品,以葡萄糖标准品质量为横坐标,吸光值为纵坐标,绘制标准曲线,拟合后的回归方程为:y=27.367x+0.304(r2= 0.992),用苯酚-硫酸法在490nm下测定多糖avp141-a溶液的吸光度,吸光度带入回归方程计算,得出结论,如图5所示,吸光度带入回归方程计算,得出结论:粗多糖avp141的总糖含量为69.84
±
2.77%,avp141-a 的总糖含量为99.13
±
3.34%,avp141-b的总糖含量为97.71
±
2.60%,n=3。粗多糖avp141的含糖量较少,经过离子交换和凝胶渗透层析分离后组分avp141-a及avp141-b含糖量均有不同程度的提升。
[0081]
蛋白含量:采用碧云天bca蛋白浓度测定试剂盒(增强型)检测蛋白浓度。试剂配制:按照配套说明书配制蛋白标准溶液和bca工作液。用酶标仪测定562nm下的吸光度,以吸光度为横坐标,蛋白质浓度为纵坐标绘制标准曲线,拟合后的回归方程为:y=1.217x-0.227(r2=0.999),根据标准曲线和海洋杂色曲霉多糖avp141-a样品体积、浓度计算出海洋杂色曲霉多糖样品的蛋白浓度。如图6所示,吸光度带入回归方程计算,得出结论:粗多糖avp141的蛋白含量为3.52
±
0.20%,avp141-a未检测到蛋白,n=3。实验说明经过纯化的组分多糖已去除蛋白杂质。
[0082]
硫酸根含量:采用氯化钡-明胶法测定海洋杂色曲霉胞外多糖各样品中的硫酸根含量。在360nm下用分光光度计读取吸光度,以吸光度为横坐标,硫酸根浓度为纵坐标,绘制标准曲线,拟合后的回归方程为:y= 5.131x-0.617(r2=0.999)。再用氯化钡-明胶法在360nm下测定多糖溶液的吸光度,如图7所示,吸光度带入回归方程计算,得出结论:粗多糖avp141的硫酸根含量为4.37
±
0.36%,avp141-a的硫酸根含量为 3.62
±
0.26%,n=3。
[0083]
综上,海洋杂色曲霉胞外粗多糖avp141和组分多糖avp141-a的基本成分如表1所示。
[0084]
表1海洋杂色曲霉多糖的基本成分
[0085][0086]
实例3:海洋杂色曲霉胞外多糖avp141-a的结构解析
[0087]
紫外光谱:用紫外分光光度计在190-400nm波长范围内对海洋来源杂色曲霉胞外多糖溶液进行扫描,如图8所示在260nm和280nm 处没有吸收,说明多糖avp141-a几乎不含核酸和蛋白质。
[0088]
红外光谱;采用ft-ir对多糖avp141-a的特征官能团、糖环构型进行分析,其中红外光谱如图9所示。在3328cm-1
处的宽峰是由于o-h 的伸缩振动;2904cm-1处较弱的吸收峰是糖类甲基或亚甲基c-h键的伸缩振动,这两组峰说明avp141-a是一个典型的多糖结构物质。在1645 cm-1处的弱吸收峰是糖的水化物特征吸收和来自酰氨基或核酸的碱基中 c=o伸缩振动共轭体系的反对称伸缩振动。1060~955cm-1
处的强吸收为吡喃环中o-h变角振动。848cm-1
处存在α-型糖苷键的特征吸收峰,α-(1
→
4)连接的葡聚糖在930cm-1
左右有吸收峰,说明其为α-多糖。 avp141-a在1700~1735cm-1附近无吸收,提示不含糖醛酸。同时,在 1256cm-1
处有由硫酸基中的o=s=o伸缩振动产生的特征峰,提示多糖中有硫酸基修饰,ft-ir结果与硫酸根测定结果一致。
[0089]
扫描电镜分析:采用扫描电镜(sem)对胞外多糖avp141-a的表面形态结构进行观察,如图10所示,avp141-a为表面粗糙、有大量的孔洞的片状结构。
[0090]
甲基化分析:甲基化分析是多糖结构分析的一种重要手段,分析经甲基化、完全酸水解、完全乙酰化制成阿尔迪醇乙酸酯衍生物的多糖,能够从数据中分析得到avp141-a的单糖组成、糖苷键类型的重要信息。从甲基化的结果如图11、12所示,并整合相关残基信息于表2中,末端葡萄糖a残基[glcp-(1
→
]的含量为16.93%,b残基[
→
4)-glcp-(1
→
]的含量为58.80%,c残基[
→
6)-glcp-(1
→
]为7.38%,d支链糖残基[
→
4,6)
ꢀ–
glcp-(1
→
]的含量为16.89%,根据分子量大小可得出各avp141-a残基组成比例约为a:b:c:d=4:16:2:4。另外avp141-a的主链是由 [
→
4)-glcp-(1
→
]和少量[
→
6)-glcp-(1
→
]组成,[
→
4,6)-glcp-(1
→
]是连接支链或者取代基团的糖残基,支链点可能出现在c-4或者c-6的位置上。
[0091]
表2甲基化avp141-a产物分析结果
[0092][0093]
核磁共振分析:采用脉冲傅里叶变换谱仪,对样品进行扫描。得到的如图13所示的1h-nmr一维谱图,如图14所示的
13
c-nmr一维谱图,如图15所示的二维1h-1
h-cosy谱图,如
图16所示的hmbc谱图,如图17所示的hsqc谱图。通过核磁共振分析对avp141-a的四个序列残基连接顺序进行了分析,如图13和图14中,残基a为[α-d-glcp-(1
→
],残基b[
→
4)-α-d-glcp-(1
→
],残基c[
→
6)-α-d-glcp-(1
→
],残基d [
→
4,6)-α-d-glcp-(1
→
]。在图13和14中,残基a的1h-nmr化学位移 5.09ppm、5.08ppm、5.07ppm、5.46ppm及残基a
13
cnmr化学位移98.55 ppm、99.92ppm、98.05ppm、98.74ppm,图151h-1
h-cosy谱图,可以区分h-1/h-2,h-2/h-3,h-3/h-4,h-4/h-5andh-5/h-6的分离自旋体系,结合hmbc谱图,这些数据支持葡萄糖残基a的存在。同样,单糖残基a的进一步结构解析是在hmbc实验的帮助下完成的。此外,残基b、 c和d的化学位移也得到了文章的证实。δh5.09(a:h-1)与δc66.01(c: c-6)之间有交叉峰,表示在a和c之间有一个葡萄糖苷键连接,δh3.75 (d:h-4)与δc98.55(a:c-1)之间有交叉峰,也表示d和a之间存在葡萄糖苷键连接,δh5.07(c:h-1)withδc69.69(d:c-6)之间有交叉峰,表示c与d之间存在葡萄糖苷键连接,δh5.46(d:h-1)与δc69.69(d: c-6)之间有交叉峰,表示d与d之间存在葡萄糖苷键连接,δh5.09(d: h-1)与δc78.77(b:c-6)之间有交叉峰,表示d与b之间存在葡萄糖苷键连接,δh5.08(b:h-1)与δc66.01(c:c-6)之间也有交叉峰。通过分子式分析发现c-4上的硫酸基团。根据上述证据,确定该海洋杂色曲霉胞外多糖avp141-a的结构式如式1。
[0094]
表3 avp141-a糖残基的
13
c、1h的化学位移
[0095][0096]
实施例4:海洋杂色曲霉胞外多糖avp141-a的免疫活性调节
[0097]
对raw264.7细胞增殖的影响:本实验采用cck-8法检测 avp141-a对raw264.7巨噬细胞增殖的影响。结果如图18所示,在 25-200μg/ml浓度范围内,杂色曲霉胞外多糖组分avp141-a可促进巨噬细胞raw264.7的增殖,处理组细胞活力均高于对照组cg,证明在此浓度范围内avp141-a对raw264.7巨噬细胞无细胞毒性。当 avp141-a浓度为25-50μg/ml范围内,细胞活力与多糖avp141-a浓度呈正比;当avp141-a浓度为50-200μg/ml范围内时,细胞数与多糖 avp141-a浓度呈反比,这可能是由于高糖浓度促进细胞增殖后分泌抑制生长的代谢物质。
[0098]
对raw264.7细胞释放no的影响:在免疫应答中,no释放量是判断免疫调节活性的标志性指标,在免疫中具有重要地位。no在多种免疫调节性疾病中起着重要作用,例如抑制癌症、预防心血管疾病、提升生殖性能、增强体内抗氧化能力、促进细胞增殖等。测定海洋来源杂色曲霉组分多糖avp141-a处理的raw264.7巨噬细胞释放no的情况,由此判断avp141-a对巨噬细胞的刺激作用。如图19所示,与空白对照组 cg相比,50、100、200μg/mlavp141-a多
糖处理组能剂量依赖性地促进no的释放,但仍小于阳性对照2.5μg/mllps处理组的no的释放量。no释放量增加说明说明avp141-a对巨噬细胞有免疫刺激效果。
[0099]
对raw264.7细胞分泌细胞因子的影响:细胞因子是一类具有广泛生物活性的小分子蛋白质,在调节机体的免疫应答和炎症反应中发挥着重要作用,其中tnf-α及il-6就是常见的细胞因子。对avp141-a刺激巨噬细胞raw264.7分泌的细胞因子tnf-α、il-6进行测定,如图20 所示,与空白对照组cg相比,细胞因子tnf-α及il-6的分泌量在50、 100和200μg/mlavp141-a处理下呈剂量依赖性增多。
[0100]
对raw264.7细胞脂质过氧化水平的影响:如图21所示,是不同浓度avp141-a作用raw264.7细胞24h后荧光染色,用流式细胞仪检测的结果,相较于对照组,发现ros(reactiveoxygenspecies,脂质活性氧)水平提升,且所有浓度实验组脂质过氧化提升水平基本一致,提升程度与avp141-a样品浓度无关,表明avp141-a能升高细胞的脂质氧化水平。
[0101]
蛋白免疫荧光:如图22所示,是不同浓度avp141-a样品作用 raw264.7细胞24h后的免疫荧光结果,图22(b)及(c)分别是绿色荧光的平均荧光强度和绿色荧光占背景的面积,空白对照组cg无绿色荧光信号,阳性lps组有强且密集的绿色荧光信号,avp141-a实验组的绿色荧光信号随样品浓度的增加而增强,绿色荧光的平均荧光强度和绿色荧光占背景的面积也随浓度依赖性增加。表明avp141-a能剂量依赖性促进raw264.7细胞表达cox2(cyclooxygenase2,环氧酶2)蛋白,证明avp141-a有免疫调节的作用。
[0102]
蛋白质免疫印迹:如图23所示,是蛋白质免疫印迹实验中不同浓度 avp141-a作用raw264.7细胞24h后的结果,cox2、acsl4的表达随 avp141-a浓度上升而上调,结果提示avp141-a的免疫调节活性可能与炎症中的脂质代谢相关。
[0103]
实施例5:海洋杂色曲霉胞外多糖avp141-a的网络药理学-代谢组学联合分析
[0104]
胞外多糖avp141-a作用于raw264.7巨噬细胞后收集细胞,借助代谢组学分析avp141-a作用后细胞的差异代谢物的变化,利用网络药理学分析avp141-a可能作用靶点,联合分析海洋来源杂色曲霉胞外多糖avp141-a在免疫调节方面可能的作用机制。根据p《0.05以及vip (variable importance for the projection)≥1筛选,得到45个差异代谢物,其中17个代谢物上调,28个代谢物下调。其中,氨基酸、多肽及其类似物的代谢差异最大。45个代谢物共富集了92条kegg通路,根据p《0.05 以及fdr《0.05进行筛选,共得到10条显著代谢通路。将网络药理学与代谢组学所富集到的通路进行联合分析,得到3条共同的代谢通路,分别为精氨酸生物合成(arginine biosynthesis),精氨酸和脯氨酸代谢 (arginine and proline metabolism),与mtor信号通路(mtor signalingpathway)。在精氨酸生物合成通路中,显著变化的代谢物为l-谷氨酸,酮戊二酸,l-天冬氨酸,l-精氨酸。在精氨酸和脯氨酸代谢通路中,显著变化的代谢物为s-腺苷甲硫氨酸,l-谷氨酸,l-精氨酸,肌酸,胍基乙酸,4-羟脯氨酸。在mtor信号通路中,显著变化的代谢物有l-精氨酸,l-亮氨酸。三条通路都共同注释到了l-精氨酸,因此,l-精氨酸被认为是avp141-a作用细胞后细胞免疫激活的信号代谢物。
[0105]
上述为本发明较佳的实施方式,但本发明的实施方式并不受上述内容的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1