一株交替单胞菌及使用其生产单葡萄糖醛酸甘草次酸的方法与流程
1.本发明涉及微生物领域,具体涉及一株交替单胞菌,所述交替单胞菌在生产单葡萄糖醛酸甘草次酸中的应用,一种生产单葡萄糖醛酸甘草次酸的方法,所述方法制备得到的发酵产物,和所述发酵产物在制造化妆品中的应用。
背景技术:
2.甘草提取物是从甘草中提取的有药用价值的成份。甘草提取物一般包含:甘草酸、甘草甜素、甘草甙、甘草类黄酮等,是世界上使用最广泛的草药之一。甘草酸(gl)是五环三萜类化合物,由五环三萜皂苷通过β-1,2糖苷键和β-1,3糖苷键与两分子葡萄糖醛酸相连构成,属于齐墩果烷型三萜皂苷,是一种美国食品与药物管理局公认的安全物质,在医药、化妆、食品等领域均有应用。
3.单葡萄糖醛酸甘草次酸(gamg)作为gl的衍生物,只含有一分子葡萄糖醛酸,是甘草酸外侧的β-1,2糖苷键通过水解一分子的葡萄糖醛酸基所得。gamg其极性介于甘草酸和甘草次酸之间,能顺利进入细胞,在机体内的溶解度和跨膜转运能力比甘草酸和甘草次酸强,因而有更好的生物利用度。动物实验研究表明,gamg的ld
50
为5000mg/kg,远远大于甘草酸的ld
50
(805mg/kg),并且无致畸变作用。在食品工业中,gamg的甜度为蔗糖的941倍,而gl的甜度约为蔗糖的170倍,gamg甜度是gl的5倍多。在化妆品中,gamg可使油性香水增溶,用gamg制成的产品具有防止皮肤粗糙、发炎及uv引起的水肿等功效。
4.gamg的制备工艺目前常用的是化学法和生物法。化学合成gamg过程中,化学法立体选择性较差,会产生大量的甘草次酸(ga)副产物,工艺繁琐收率低。生物法合成gamg是利用微生物所生产的β-葡萄糖醛酸苷酶水解甘草酸制备而成,具有反应效率高、反应条件温和及底物特异性高的特点。cn106636290a公开了一种篮状真菌产酶生产gamg的工艺,但其需发酵120-144h,发酵周期较长。cn103352062a公开了利用产紫青霉的β-葡萄糖醛酸苷酶水解制备gamg的方法,但此方法需要两步开展,需先发酵制备β-葡萄糖醛酸苷酶粗酶液,再水解甘草提取物制备gamg。cn103981104a公开了小球壳孢属菌转化生成gamg,cn103992953a公开了一株东乡野生稻内生真菌生产gamg的方法,但这些专利均为真菌生产gamg的方法,还未见细菌发酵生产gamg的报道。
5.交替单胞菌是一种益生菌株,不仅可满足安全生产的要求,而且发酵工工艺较为成熟,发酵周期较短,成本较低。目前,交替单胞菌主要用于生物除藻、制备普鲁兰酶和菌株发酵产物制备日化用品,尚未发现将其用于工业生产gamg的相关报道。
技术实现要素:
6.本发明的目的是为了提供一株交替单胞菌,该交替单胞菌能够利用甘草酸发酵生产单葡萄糖醛酸甘草次酸,具有转化率高和副产物含量低的优点。
7.为了实现上述目的,本发明第一方面提供一株交替单胞菌alteromonas sp.,交替单胞菌alteromonas sp.的保藏编号为cgmcc no. 25260。
8.本发明第二方面提供如上所述的交替单胞菌在生产单葡萄糖醛酸甘草次酸中的应用。
9.本发明第三方面提供一种生产单葡萄糖醛酸甘草次酸的方法,该方法包括:将如上所述的交替单胞菌接种到含甘草酸的发酵培养基中进行发酵,得到含有单葡萄糖醛酸甘草次酸的发酵产物。
10.本发明第四方面提供如上所述的方法制备得到的发酵产物。
11.本发明第五方面提供如上所述的发酵产物在制造化妆品中的应用。
12.本发明的发明人筛选出能将gl特异性水解生产gamg的交替单胞菌株,并经等离子体诱变处理,得到一株gamg转化率高,且ga副产物低的菌株。该菌株保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.25260。
13.本发明提供的交替单胞菌可以利用甘草提取物进行发酵,诱导产生较高水平的β-葡萄糖醛酸苷酶,并在发酵过程中直接将底物甘草酸水解成单葡萄糖醛酸甘草次酸(gamg),gamg产量达3.67g/l,产率为90%,经酸沉和大孔树脂纯化后,纯度达到96%以上,处理工艺简单,具有良好的工业应用前景。
14.本发明提供的交替单胞菌利用甘草提取物进行发酵得到的发酵产物能够用于化妆品领域,起到保湿、舒缓、祛斑美白、抗炎、祛痘、紧致、控油、修护和滋养等作用,具有较高的经济价值。
15.生物保藏本发明提供的交替单胞菌的分类命名为alteromonas sp.,于2022年07月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心(缩写为cgmcc),其保藏编号为cgmcc no. 25260,保藏地址为北京市朝阳区北辰西路1号院3号。
附图说明
16.图1是实施例2中等离子体诱变的致死曲线。
17.图2是空白发酵液的hplc图。
18.图3是培养4天的alteromonas sp. jz0发酵液的hplc图。
19.图4是培养4天的alteromonas sp. jz-d1发酵液的hplc图。
20.图5表示在不同时间点皮肤角质层水分含量均值。
21.图6表示在不同时间点皮肤角质层水分变化率均值。
具体实施方式
22.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
23.本发明第一方面提供一株交替单胞菌alteromonas sp.,交替单胞菌alteromonas sp.的保藏编号为cgmcc no.25260。
24.本发明所述的菌株是由出发菌株alteromonas sp. jz0经等离子体诱变筛选得到。其中,出发菌株筛选自青岛近海表层海水。所述出发菌株在lb固体培养基(使用陈海水
配制)中,菌落形态呈圆形,白色,光滑湿润。显微镜观察可见杆状细菌,大小0.7-1.5μm
×
1.8-3.0μm。经革兰氏染色呈阴性,为革兰氏阴性菌。将菌株进行16s rdna测序比对,经鉴定菌株为交替单胞菌菌株(alteromonas sp.)。
25.在等离子体诱变过程中,基于致死率90%的标准,最终筛选出诱导时间为30s。在等离子体诱变后,通过高通量筛选获得gamg产量更高的菌株,经过几轮诱变筛选得到本发明的菌株alteromonas sp. jz-d1。
26.本发明提供的交替单胞菌的分类命名为alteromonas sp.,于2022年07月08日保藏于中国微生物菌种保藏管理委员会普通微生物中心(缩写为cgmcc),其保藏编号为cgmcc no. 25260,保藏地址为北京市朝阳区北辰西路1号院3号。
27.本发明第二方面提供如上所述的交替单胞菌在生产单葡萄糖醛酸甘草次酸中的应用。
28.本发明所述的交替单胞菌能够利用甘草酸生产单葡萄糖醛酸甘草次酸,具体的生产方式如第三方面所述。
29.本发明第三方面提供一种生产单葡萄糖醛酸甘草次酸的方法,该方法包括:将如上所述的交替单胞菌接种到含甘草酸的发酵培养基中进行发酵,得到含有单葡萄糖醛酸甘草次酸的发酵产物。
30.在本发明中,所述交替单胞菌可以以种子液的形式接种。所述种子液的生产方法可以为本领域常规的生产方法,比如可以在种子液体培养基中对交替单胞菌菌种(例如在甘油冻存管中冻存于例如-80℃冰箱中的菌株)进行培养,得到种子液。
31.其中,交替单胞菌菌种可以经过活化获得,活化的方式比如可以为平板划线到固体培养基上培养,使菌株活化。所述固体培养基可以为本领域常规的用于交替单胞菌培养的固体培养基,比如lb固体培养基或者海水2216琼脂培养基。
32.应当理解的是,由于出发菌株筛选自海水,因此,该菌株在培养时需要保持与海水相近的渗透压。在配制培养基时,可以使用陈海水或者相近浓度的nacl提供满足菌株生长的渗透压。
33.所述种子液体培养基可以为本领域常规的种子液体培养基(可以为lb液体培养基或者其他能够用于培养交替单胞菌的培养基),在本发明的一种优选的实施方式中,所述种子液体培养基含有:蛋白胨2-8g/l,酵母粉0.5-1.5g/l,柠檬酸铁0.05-0.2g/l,氯化钠18-21g/l,氯化镁5-7g/l,硫酸钠2.5-4g/l,氯化钙1-2.5g/l,氯化钾0.3-0.8g/l,碳酸钠0.1-0.3g/l,溴化钾0.01-0.15g/l,氯化锶0.01-0.05g/l,硼酸0.01-0.05g/l,硅酸钠0.001-0.01g/l,氟化钠0.001-0.005g/l,硝酸钠0.001-0.003g/l,磷酸氢二钠0.001-0.015g/l。所述种子液体培养基的ph优选为7-8。
34.所述培养的条件可以为本领域常规的条件,优选地,所述培养的温度为20-30℃。
35.优选地,所述培养的条件还包括:时间为12-30h。
36.所述培养比如可以在摇瓶中进行,以比如150-250rpm的转速进行培养。
37.在本发明中,将上述种子液接种到含甘草酸的发酵培养基中进行发酵培养可以获得含单葡萄糖醛酸甘草次酸的发酵产物。
38.所述种子液的接种量可以在较宽的范围内选择,优选地,所述种子液的接种量为1-10体积%。应当理解的是,可以直接将种子液接种于发酵培养基中,也可以对种子液进行
固液分离处理,得到的菌体经比如生理盐水重悬后接种于发酵培养基中,但是,接种量仍以种子液的体积计。
39.在本发明中,所述甘草酸可以以甘草提取物的方式提供。
40.优选地,所述发酵培养基含有甘草提取物和氯化钠。
41.优选地,所述发酵培养基中甘草提取物的含量为1-20g/l,更优选为5-15g/l,氯化钠的含量为15-25g/l,更优选为18-21g/l。
42.所述发酵培养基中还可以含有其他种类的无机盐,比如所述发酵培养基中还可以含有柠檬酸铁0.05-0.2g/l,氯化钠18-21g/l,氯化镁5-7g/l,硫酸钠2.5-4g/l,氯化钙1-2.5g/l,氯化钾0.3-0.8g/l,碳酸钠0.1-0.3g/l,溴化钾0.01-0.15g/l,氯化锶0.01-0.05g/l,硼酸0.01-0.05g/l,硅酸钠0.001-0.01g/l,氟化钠0.001-0.005g/l,硝酸钠0.001-0.003g/l,磷酸氢二钠0.001-0.015g/l。
43.所述发酵培养基的ph优选为7-8。
44.在本发明中,为了提高单葡萄糖醛酸甘草次酸的产量,该方法优选还包括在发酵过程中向发酵液中添加甘草提取物。
45.优选地,相比于1l发酵液,添加的甘草提取物的量为5-50g/l。
46.所述甘草提取物可以以流加的方式或者一次或多次投加的方式加入。
47.所述发酵可以在摇瓶或者发酵罐中进行,本领域技术人员可以根据生产规模选择合适的容器。本领域技术人员可以根据容器大小和实际发酵的情况选择或调整发酵过程中的转速。比如,当发酵在摇瓶中进行时,转速可以为150-250rpm。
48.所述发酵的条件可以在较宽的范围内旋转,优选地,所述发酵的条件包括:温度为20-30℃,时间为3-5天。
49.在完成发酵培养后,可以通过已知方法纯化发酵液积累的单葡萄糖醛酸甘草次酸。例如,可以通过酸沉和大孔树脂纯化诸如此类的方法来分离纯化单葡萄糖醛酸甘草次酸。
50.本发明第四方面提供如上所述的方法制备得到的发酵产物。
51.应当理解的是,所述发酵产物中含有单葡萄糖醛酸甘草次酸。
52.本发明第五方面提供如上所述的发酵产物在制造化妆品中的应用。
53.所述发酵产物能够用于化妆品中起到比如保湿、舒缓、祛斑美白、抗炎、祛痘、紧致、控油、修护和滋养中的至少一种的作用。
54.优选地,所述应用为在保湿化妆品中的应用。
55.优选地,所述应用为在舒缓化妆品中的应用。
56.优选地,所述应用为在祛斑美白、抗炎、祛痘、紧致、控油、修护和滋养化妆品中的至少一种化妆品中的应用。
57.应当理解的是,所述发酵产物还可以用于医药和食品领域。
58.以下将通过实施例对本发明进行详细描述。
59.如无特殊说明,实施例中所用的试剂和材料均为本领域常规的试剂和材料,使用的方法均为本领域常规的方法。
60.海水2216琼脂培养基:蛋白胨5g/l,酵母粉1g/l,柠檬酸铁0.1g/l,氯化钠19.45g/l,氯化镁5.98g/l,硫酸钠3.24g/l,氯化钙1.8g/l,氯化钾0.55g/l,碳酸钠0.16g/l,溴化钾
0.08g/l,氯化锶0.034g/l,硼酸0.022g/l,硅酸钠0.004g/l,氟化钠0.0024g/l,硝酸钠0.0016g/l,磷酸氢二钠0.008g/l,琼脂20g/l,ph7.6;种子液体培养基:蛋白胨5g/l,酵母粉1g/l,柠檬酸铁0.1g/l,氯化钠19.45g/l,氯化镁5.98g/l,硫酸钠3.24g/l,氯化钙1.8g/l,氯化钾0.55g/l,碳酸钠0.16g/l,溴化钾0.08g/l,氯化锶0.034g/l,硼酸0.022g/l,硅酸钠0.004g/l,氟化钠0.0024g/l,硝酸钠0.0016g/l,磷酸氢二钠0.008g/l,ph7.6;发酵培养基(以甘草提取物为唯一碳源,1l):甘草提取物10g/l、柠檬酸铁0.1g/l,氯化钠19.45g/l,氯化镁5.98g/l,硫酸钠3.24g/l,氯化钙1.8g/l,氯化钾0.55g/l,碳酸钠0.16g/l,溴化钾0.08g/l,氯化锶0.034g/l,硼酸0.022g/l,硅酸钠0.004g/l,氟化钠0.0024g/l,硝酸钠0.0016g/l,磷酸氢二钠0.008g/l,ph7.6;lb固体培养基:胰蛋白胨10g/l,酵母粉5g/l,氯化钠5g/l,琼脂粉20g/l,陈海水定容至1l体积;lb液体培养基:胰蛋白胨10g/l,酵母粉5g/l,氯化钠5g/l,陈海水定容至1l体积。
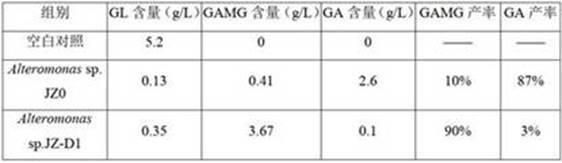
61.实施例1本实施例用于说明初始菌株的筛选与鉴定。
62.取青岛近海表层海水1ml,在超净台中加入种子液体培养基中,放入30℃摇床中200rpm/min培养一周左右,待培养基出现明显的混浊后,得到微生物悬液。将微生物悬液稀释成10-5
到10-7
浓度梯度,分别涂布于海水2216琼脂培养基上。于30℃-32℃恒温培养箱中培养36h后,挑取单克隆连续划线,直至出现较纯的单菌落。
63.借助于高通量平台,挑取海水2216琼脂培养基中的所有单菌落,接种至种子液体培养基中,30℃、200rpm/min过夜培养,获得种子液。将种子液按1%接种至发酵培养基中,培养2天后,得到菌株胞外发酵液。将发酵液开展液相检测,将能检测到最高水平gamg的发酵液对应单菌落进行保存,并标记为jz0。
64.对于菌株jz0进行形态表征。将菌株jz0涂布于lb固体培养基中,菌落形态呈圆形,白色,光滑湿润。显微镜观察可见杆状细菌,大小0.7-1.5μm
×
1.8-3.0μm。经革兰氏染色呈阴性,为革兰氏阴性菌。将菌株进行16s rdna测序比对,经鉴定菌株为交替单胞菌菌株(alteromonas sp.),命名为alteromonas sp. jz0。
65.实施例2本实施例用于说明等离子体诱变菌株的获得。
66.菌悬液制备:将交替单胞菌jz0接种至lb液体培养基中过夜培养,获得种子液;将种子液转接至新鲜lb液体培养基中,待培养至对数期,离心,采用生理盐水洗涤2次后,生理盐水稀释至od
600
值在0.6-0.8之间,活菌数约10
6-108之间的菌悬液,随后利用等离子体对于菌株jz0进行诱变。
67.诱变时间选择:于超净台中将金属载片置于无菌平板中,取10 μl菌悬液均匀涂布于载片上,使用无菌镊子将载片对应孔位,且处于气流端口2mm处。设置120w,气流量10 slm,诱变时间分别设置为15 s、30 s、45 s、60 s、90 s、120 s、150 s、180 s和240 s。诱变后分别涂布,计数进行致死率计算,其中诱变后菌悬液稀释10-2
和10-3
后涂布,并绘制出致死率曲线(图1)。基于致死率90%的标准,最终筛选出诱导时间为30s。
68.诱变实验:同样,于超净台中将金属载片置于无菌平板中,取10 μl菌悬液均匀涂
布于载片上,使用无菌镊子将载片对应孔位,且处于气流端口2mm处。设置120w,气流量10 slm,诱变时间分别设置为30s,处理完成后放置于1ml生理盐水中,并适当稀释10-2
和10-3
后涂布,30℃恒温培养箱培养24h。借助于高通量平台的qpix仪器,将平板上的单菌落接种活化后,转接至发酵培养基中,培养2天后,将胞外发酵液开展液相检测,筛选gamg产量相较原始菌株明显提高的菌株。筛选到的菌株再重复开展5次诱变实验,最终获得一株gamg 产率最高的菌株,命名为alteromonas sp. jz-d1。
69.此菌记为本发明提供的菌株,保藏于中国微生物菌株保藏管理委员会普通微生物中心,保藏编号为cgmcc no.25260。
70.实施例3本实施例用于说明交替单胞菌alteromonas sp. jz0和jz-d1发酵生产gamg。
71.1、交替单胞菌alteromonas sp. jz0和jz-d1的培养(1)分别取交替单胞菌alteromonas sp. jz0和jz-d1两株甘油菌划线接种于海水2216琼脂培养基中,在30℃倒置培养24h;(2)挑取单菌落至种子液体培养基中活化,30℃、200rpm/min条件下培养过夜,制得alteromonas sp. jz0和jz-d1两株菌的种子液;(3)将步骤(2)所制得的两株菌的种子液按1体积%转接至发酵培养基中,以不接菌的发酵液作为空白对照,放置于30℃、200rpm/min条件下培养,每隔24h添加10g/l甘草提取物,发酵培养4天结束离心取上清,得到发酵产物。
72.2、交替单胞菌alteromonas sp. jz0和jz-d1发酵液的液相检测培养4天的发酵产物进行液相样品制备,使用初始流动相稀释50倍,然后液相检测分析。所述液相色谱柱为安捷伦zorbax eclipse plus c18 250*4.6mm,5um。柱温35℃,流动相为甲醇+0.5%乙酸,洗脱程序为0-35min:甲醇57%-90%,0.5%乙酸43%-10%;35-40min:甲醇90%-57%,0.5%乙酸10%-43%,流速1ml/min,紫外检测波长为250nm。
73.对于空白发酵液、培养4天的alteromonas sp. jz0和jz-d1发酵产物的hplc液相峰图进行分析,发现空白发酵液中仅能检测到甘草酸(gl)底物,未检测到gamg和ga物质(图2)。培养4天的alteromonas sp. jz0发酵产物中底物gl含量较低,产物gamg含量也较低,而副产物ga含量最高(图3)。培养4天的alteromonas sp.jz-d1发酵产物中gamg含量最高,底物gl和副产物ga都较低(图4)。
74.基于gl、gamg和ga液相标曲,对于图2-4中的峰面积进行处理,最终得到初始发酵液、培养4天后的alteromonas sp. jz0和jz-d1发酵产物中的gl、gamg和ga含量(表1)。
75.表1从表1中数据可以看出,经诱变获得的交替单胞菌alteromonas sp. jz-d1,培养4
天后的发酵产物中gamg含量达3.67g/l,gamg产率高达90%,副产物ga仅为3%;相比诱变前的菌株alteromonas sp. jz0,gamg产率提高9倍,ga副产物产率降低29倍。
76.将交替单胞菌alteromonas sp. jz-d1的发酵产物经过酸沉和大孔树脂纯化后,得到产品中gamg纯度达到96%以上,操作简单,具有良好的工业应用前景。
77.实施例4本实施例用于说明甘草发酵产物制备的化妆品及其效果评价。
78.1、甘草发酵产物按照实施例3所述的方法,使用alteromonas sp. jz-d1发酵生产甘草发酵产物。
79.2、甘草发酵产物面霜面霜组成包括:水、异壬酸异壬酯、鲸蜡醇和甘油peg-75硬脂酸酯和鲸蜡醇聚醚-20 和硬脂醇聚醚-20、聚二甲基硅氧烷、辛酸/癸酸甘油三酯、甘草发酵产物、鲸蜡硬脂醇、角鲨烷、植物甾醇油酸酯、羟苯甲酯、卡波姆、生育酚(维生素e)、edta二钠、羟苯丙酯、三乙醇胺、香精,其中,主要活性物为步骤1得到的甘草发酵产物,浓度为2重量%。
80.3、舒缓功效评价3.1测试目的亚洲成年女性敏感肌肤受试者在正常情况下连续使用测试样品28天,通过调查问卷及照片的形式统计消费者14天、28天的使用感受并展现产品在使用中的舒缓效果。
81.3.2受试者信息本次测试受试者筛选自广州诗乐维生物科技有限公司实验室受试者信息数据库,选择符合如下入选和排除标准的健康受试者。受试者信息如表2所示。
82.表21)入选标准:年龄18至55岁健康女性和男性;
•
通过敏感肌问卷纳入的敏感肌肤受试者(敏感肌纳入标准见备注内容);
•
面部肤色不均有红血丝及散在丘疹,能或很好配合试验者,在研究期间能保持生活的规律性;
•
无严重系统疾病、无免疫缺陷或自身免疫性疾病者,受试部位没有接受过皮肤治疗、美容以及其他可能影响测试结果的测试;
•
能够阅读和理解知情同意书的所有内容,并自愿签署知情同意书;
•
试验期间只使用指定的皮肤护理样品;
•
试验期间不再参与其他任何研究中心的临床试验;
•
试验期间同意不使用任何对结果有影响的化妆品、药物和保健品。
83.备注:敏感性肌肤的纳入标准如下:根据敏感性皮肤问卷(华西问卷)进行答题评分,得分12 ~ 17为耐受型,18 ~ 23分为轻度敏感、24 ~ 32分为中度敏感、33 ~ 42分为重度敏感。将得分≥18分的受试者纳为受试对象。
84.2)排除标准凡具有下列任一条件的必须排除进入本项研究:
•
面部有皮肤疾病而可能影响对试验结果判断者;
•
严重系统性疾病及并发其他皮肤病者,如红斑狼疮、银屑病、湿疹等;
•
光敏或瘢痕体质者;
•
高度过敏体质者;
•
妊娠、哺乳或在测试期间打算怀孕的女性;
•
有严重心、肝、肾功能损害及严重免疫功能低下者;
•
有精神疾病、严重内分泌疾病者以及口服避孕药者;
•
30天内参加药物临床试验者或其它试验者,或近1周内有系统使用对试验结果有影响的药物者;
•
2周内有口服和外用可能对试验结果有影响的美容样品者;
•
不能配合试验者;
•
研究者认为不适于参加本研究者。
85.3)退出标准因在研究期间有并发症、不良事件或其他原因可退出临床研究,但应写明退出原因。
86.3.3测试依据与方法1)测试依据敏感性皮肤是在多种因素诱导下,皮肤屏障受损的基础上发生的涉及神经-血管-免疫等的炎性反应。以个体主观感受为主,问卷测评是评价敏感性皮肤的最佳方式。基于鲍曼敏感性皮肤问卷,设计了敏感性皮肤问卷(华西问卷)用来检测是否属于敏感肌人群。
87.2)测试方法根据敏感性皮肤问卷(华西问卷)的评判标准(所有分数相加):总分12~17分:耐受型皮肤;总分18~23分:轻度敏感皮肤;总分24~32分:中度敏感皮肤;总分33~42分:重度敏感皮肤。
88.观察来访者面部的泛红、脱皮、粗糙及散在丘疹情况。将分数≥18分,并观察到面部有上述一种或几种情况同时都有的来访人员入选为本次测试的受试者,并按照要求使用产品。
89.3.4测量参数1)产品安全性评估(1)安全性评估原则受试者回访时,仔细询问、检查并记录受试者在使用测试样品期间所发生的任何不良事件,包括不良事件的发现、发生时间、处理措施及转归,并对不良事件与所使用样品的关系作出判断。
90.(2)受试者不良反应自我评估受试者根据28天的样品使用情况,每天填写志愿者日志,记录样品对皮肤造成的不良反应。使用过程中,出现不适请暂停使用并立即告知随访研究人员。
91.2)判定标准(1)不良事件严重程度按下列三级标准判断轻度:受试者可忍受,不需特别处理,不影响受试者的正常生活;中度:受试者难以忍受,需要停用产品或作特殊处理,影响受试者的正常生活;重度:妨碍正常生活,需要立即停用产品或作紧急处理。
92.(2)不良反应分级标准(见表3)表3备注:皮肤不良反应分级按照国家药品监督管理局批准颁布的《化妆品安全技术规范》(2015年版)中规定的人体试用试验皮肤反应分级标准判断。
93.(3)不良事件与试验产品关系的判断标准a.肯定有关:使用试验产品及反应发生时间顺序合理,停止使用试验产品反应停止,或迅速减轻或好转,再次使用试验产品反应再现,同时有文献资料佐证,并已排除其他混杂因素影响;b.很可能有关:使用试验产品及反应发生时间顺序合理,停止使用试验产品反应停止,或迅速减轻或好转,基本可排除其他因素影响;c.可能有关:使用试验产品及反应发生时间关系密切,但引起不良反应的产品不止一种,或有其他因素不能除外;d.可能无关:使用试验产品及不良反应发生,时间的关系不密切,反应发现与己知的化妆品的不良反应不吻合;e.待评价:资料不全,等待补充资料后再评价,或因果关系难以定论,缺乏文献资料佐证;f.无法评价:缺项太多,因果关系难以定论,资料无法补充。
94.3)受试者自我评估(见表4)表4
3.5测试步骤受试者填写知情同意书,测试开始前一周,受试者停用化妆品或外用药品,发放测试样品和使用说明。测试前一天晚上,受试者在家不再涂抹任何护肤品。测试当天,在家里用清水清洗皮肤后不涂抹任何护肤品。并于来访当日记为0天,并分别于第0天、第14天和第28天填写0天、14天和28天自评调查表。
95.使用部位为脸部,每天早晚各使用一次,连续使用28天,使用方法:洁面后,使用甘草发酵产物面霜,以指腹取适量均匀涂抹脸部,避开眼周,轻柔按摩至吸收。
96.3.6测试结果1)调查问卷结果使用测试产品(甘草发酵产物面霜)28天,受试者认为肌肤泛红改善程度为81.83%,肌肤瘙痒改善程度为95.83%,肌肤刺痛改善程度为100%,肌肤灼热改善程度为100%,肌肤紧绷改善程度为90.91%。
97.2)受试者评分数据受试者分别对该面霜使用过程中泛红、瘙痒、刺痛、灼热和紧绷五个指标进行了评分,其平均值的结果如表5所示。
98.表5
3.7产品安全性评估1)测试全过程不良反应汇总表如表6所示。
99.表62)受试者不良反应自我评估整个测试过程中,20名受试者中无受试者感到不适。
100.3.8. 测试结论通过20名年龄18-50岁的亚洲成年女性敏感肌肤受试者在正常情况下连续使用测试样品28天,根据结果显示可认为受试者在使用该测试样品(甘草发酵产物面霜)28天后脸部泛红、瘙痒、刺痛、灼热、紧绷有显著改善,表明测试样品对敏感肌肤有舒缓的效果。
101.4、保湿功效评价4.1 测试目的通过亚洲成年女性受试者在正常情况下单次使用测试样品(甘草发酵产物面霜),通过测量皮肤角质层水分含量,评估该测试样品在保湿方面的功效。
102.4.2受试者信息1)招募情况女性受试者,年龄35-50岁,干性肤质,前臂皮肤角质层水分含量基础值在15-45c.u.之间,下表7为招募情况。
103.表7
2)受试者纳入与排除条件本次测试受试者筛选自功效实验室受试者信息数据库,选择符合如下入选和排除标准的健康受试者:(1)入选标准年龄35至60岁健康女性;干性肤质,前臂皮肤角质层水分含量基础值在15-45c.u.之间;无严重系统疾病、无免疫缺陷或自身免疫性疾病者,受试部位没有接受过皮肤治疗、美容以及其他可能影响结果的测试;近一月内未曾使用激素类药物及免疫抑制剂者;现在或最近三个月受试部位未参加其他临床试验者;能很好配合试验者,在研究期间能保持生活的规律性;能够阅读和理解知情同意书的所有内容,并自愿签署知情同意书;试验期间停止使用与受试样品同类项的皮肤护理产品;试验期间不再参与其他任何研究中心的临床试验;试验期间同意不使用任何对结果有影响的化妆品、药物和保健品。
104.(2)排除标准凡具有下列任一条件的必须排除进入本项研究:前臂有皮肤疾病而可能影响对试验结果判断者;高度过敏体质者;妊娠、哺乳或在测试期间打算怀孕的女性者;有严重心、肝、肾功能损害及严重免疫功能低下者;有精神疾病、严重内分泌疾病者以及口服避孕药者;30天内参加药物临床试验者或其它试验者,或近1周内有系统用对试验结果有影响的药物者;2周内有口服和外用可能对试验结果有影响的美容样品者;研究者认为不适于参加本研究者。
105.(3)退出标准因在研究期间有并发症、不良事件或其他原因可退出临床研究,但应写明退出原因。
106.4.3测试步骤根据随机表,随机选取其中一侧前臂内侧作为样品区域,另一侧作为空白对照区域。在样品区域按(2.0
±
0.1)mg/cm2的用量进行单次涂布。
107.受试部位测试前3天不能使用任何样品(化妆品或外用药品),3小时不能接触水,试验前,受试者需要统一清洁双手前臂内侧,清洁方法为用干的面巾纸擦拭干净;受试者双手前臂内侧应做好测量区域标记,试验区域面积3厘米
×
3厘米;阅读并填写知情同意书;测试前受试者在温度21
±
1℃,相对湿度50
±
10%的实验室中静坐30分钟,不能喝水和饮料。前臂暴露,呈测试状态放置,保持放松;在使用样品前、使用样品后60分钟和使用样品后120分钟,分别使用皮肤水分测定仪 corneometerr cm 825(courage+khazaka)对样品区域和空白对照区域进行皮肤角质层水分含量测定。
108.4.4 测试结果皮肤水分测试仪corneometer
®ꢀ
cm 825(courage+khazaka)用于检测皮肤角质层水分含量,测量值越大,说明皮肤角质层水分含量越高。
109.图5表示在不同时间点皮肤角质层水分含量均值,图6表示在不同时间点皮肤角质层水分变化率均值。其中,变化率=[(使用后-使用前)/使用前]
×
100%。
[0110]
从图5和6中可看出,使用样品后60分钟,20名受试者样品区域皮肤角质层水分含量均值提升了12.59%,空白对照区域皮肤角质层水分含量均值提升了0.23%。使用样品后120分钟,20名受试者样品区域皮肤角质层水分含量均值提升了10.69%,空白对照区域皮肤角质层水分含量均值降低了2.37%。
[0111]
使用样品60分钟后、120分钟后与空白对照相比,角质层水分含量明显升高,说明产品具有120分钟保湿功效。
[0112]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1