一种去端肽胶原蛋白及其制备方法和应用与流程
1.本发明涉及胶原蛋白技术领域,尤其是涉及一种去端肽胶原蛋白及其制备方法和应用。
背景技术:
2.胶原蛋白是细胞外基质的主要成分,其分子结构是由3条α肽链互相缠绕而成的3股螺旋结构,每一条肽链都由gly-x-y氨基酸序列重复而成。胶原蛋白的gly-x-y重复序列两侧存在由c端、n端的2个前肽形成的非螺旋结构,即c端肽与n端肽,ⅰ型胶原的免疫原性主要分布在分子链的端肽区域,可在胶原提取过程中通过水解去除,从而制备去端肽胶原蛋白,以降低其免疫原性。
3.目前,现有的酶切去端肽技术能够去除胶原蛋白的端肽,从而在一定程度上降低胶原蛋白的免疫原性。当胶原蛋白用于植入剂时,对其免疫原性的要求进一步提高,然而现有的去端肽技术存在端肽去除率不稳定以及无法同时保证端肽去除率及胶原蛋白收率等问题。此外,现有的胶原蛋白制备方法还存在无法将胶原蛋白中的内毒素降低至医药行业标准规定范围(0.5eu/ml以下)以及胶原蛋白冻干后的复溶问题。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供一种去端肽胶原蛋白及其制备方法和应用,该方法能够高效地去除牛皮胶原蛋白端肽,从而制得几乎无免疫原性的具有完整三螺旋结构和生物活性的去端肽胶原蛋白,产品质量稳定可靠。
6.本发明提供一种去端肽胶原蛋白的制备方法,包括如下步骤:
7.s1:对牛真皮组织进行预处理,制得预处理牛真皮组织;
8.s2:对预处理牛真皮组织进行匀浆,制得匀浆液;
9.s3:向匀浆液中加入胃蛋白酶进行酶解,酶解后灭酶,制得提取液;
10.s4:对提取液进行分离纯化,制得去端肽胶原蛋白。
11.发明人研究发现:采用现有酶切去端肽技术去端肽时,若反应不足会导致端肽去除不彻底,进而不利于降低胶原蛋白的免疫原性;若反应过度则会导致胶原蛋白进一步降解,进而使得胶原蛋白收率过低,因此无法同时保证端肽的去除率和胶原蛋白的收率。即便通过工艺优化来控制某一批次的端肽去除率和胶原蛋白收率,然而却无法保证各批次产品端肽去除率和胶原蛋白收率保持稳定,产品存在质量不稳定等问题,进而无法保证各批次产品的质量稳定性和产品安全性。
12.本发明通过酶解时检测酶解液在波长520-540nm下(例如波长527nm下)的吸光度,并在吸光度达到0.400-0.450时进行灭酶,能够在保证端肽彻底去除的前提下,最大限度地提高胶原蛋白的收率,各批次产品的端肽去除率和胶原蛋白收率相对稳定,保证了产品的质量安全,能够良好地达到医疗级组织工程的材料相关要求。
13.在本发明步骤s1中,预处理可以包括:采用6-10wt%的冰醋酸溶液对牛真皮组织进行第一次浸泡,第一次浸泡后对牛真皮组织进行搅碎,制得牛皮组织颗粒;其中,第一次浸泡温度为10-25℃,第一次浸泡时间为7-10d,对第一次浸泡时冰醋酸溶液的用量不作严格限制,只要能够浸没牛真皮组织即可。
14.进一步地,预处理还可以包括:采用0.5-2.5wt%的氢氧化钠溶液对牛皮组织颗粒进行第二次浸泡,第二次浸泡后离心,随后采用注射用水进行洗涤,洗涤后离心并冷冻备用;其中,第二次浸泡温度为18-25℃,第二次浸泡时间为2-4h;对第二次浸泡时氢氧化钠溶液的用量不作严格限制,只要能够浸没牛皮组织颗粒即可;洗涤时注射用水的体积用量可以是牛皮组织颗粒质量的8-10倍;此外,对冷冻备用时的冷冻温度不作严格限制,例如可以为-20℃。预处理时采用氢氧化钠溶液进行浸泡主要用于去除内毒素,从而防止产品内毒素超标。
15.此外,预处理还可以包括:向牛皮组织颗粒中加入27-28℃的注射用水进行融化;其中,注射用水的体积用量为牛真皮组织质量的7-9倍。对融化时间不作严格限制,可以融化至牛皮组织颗粒全部达到融化状态即可。
16.在上述步骤s2中,匀浆可以包括第一匀浆和第二匀浆;其中,第一匀浆时的转速为17000-19000rpm,匀浆时间为20-40s,第二匀浆时的转速为20000-21000rpm,匀浆时间为20-40s。此外,匀浆液中牛真皮组织的含量可以控制在20-30g/l。此外,匀浆时可以加入黄原胶进行保护,预处理牛真皮组织与黄原胶的重量比可以为1:(0.01-0.02)。
17.在上述步骤s3中,酶解时可以控制胃蛋白酶的浓度为70-90iu/ml匀浆液,采用冰醋酸控制ph值为2-3,酶解温度为20-22℃;酶解终点采用浸入式光谱吸光度测量法确定,检测波长例如为527nm,以酶解前的空白酶解液标记吸光度0点,酶解时在线吸光度检测数值在0.400-0.450的范围时,结束酶解进入灭酶工序。
18.此外,灭酶可以包括:采用8-12m的naoh溶液将酶解后的酶解液的ph值调节至9-9.5,随后在20-22℃的条件下处理10-15h。
19.本发明对提取液的分离纯化方式不作严格限制;具体地,步骤s4中,分离纯化包括:对提取液进行吸附过滤、浓缩换液、离子交换层析、二次浓缩换液、过滤除菌、离心精制。
20.具体地,吸附过滤可以包括:将提取液的ph值调节至3.9-4.1,随后加入预处理硅藻土和半乳糖醛酸进行静置吸附,收集上清液并过滤,得到吸附过滤液;其中,预处理硅藻土的制备方法包括:采用8-12mm的盐酸溶液将硅藻土浸泡2h以上,浸泡后采用纯化水清洗3次以上,得到预处理硅藻土;预处理硅藻土的加入量为14-16g/l匀浆消化液,半乳糖醛酸的加入量为1-2g/l匀浆消化液,静置吸附时间为1-3h。
21.浓缩换液和二次浓缩换液分别包括:采用100kd的超滤膜,使用ph 4-5的醋酸缓冲液换液1-3次,换液后浓缩收液。
22.离子交换层析包括:在层析柱中装入阳离子交换树脂,采用10-20mm的醋酸缓冲液冲洗平衡后上样,上样后使用10-20mm的醋酸缓冲液冲洗杂蛋白,再用含有100-200mm氯化钠的10-20mm的醋酸缓冲液进行蛋白洗脱,收集洗脱液。
23.进一步地,本发明的制备方法还可以包括步骤s5:将去端肽胶原蛋白制成悬浮液后加入冻干保护剂进行冻干,制得去端肽胶原蛋白冻干制剂。
24.具体地,冻干保护剂可以包括甘氨酸、甘露醇、氧化纤维二糖和乙酸乙酯,去端肽
胶原蛋白、甘氨酸、甘露醇和氧化纤维二糖之间的质量比为1:(1-2):(1-4):(0.2-0.6),去端肽胶原蛋白与乙酸乙酯的质量体积比为1mg:(0.05-0.1)ml。
25.对氧化纤维二糖的制备方法不作严格限制,氧化纤维二糖可以通过过氧化氢等氧化剂对纤维二糖进行氧化制得;具体地,氧化纤维二糖的制备方法可以包括:
26.a)将纤维二糖溶于水中,混匀,得到纤维二糖溶液;
27.b)向纤维二糖溶液中加入过氧化氢进行反应,制得氧化纤维二糖。
28.步骤a)中,纤维二糖溶液的质量浓度可以为4-6%,纤维二糖与过氧化氢的质量比可以为1:(0.05-0.1);步骤b)中,可以控制反应温度为20-40℃,反应时间为6-10h。
29.此外,冻干可以包括依次进行的预冻、升华干燥和解析干燥;其中,预冻包括:先在0-2℃下预冷25-35min,再在-50℃至-60℃下预冻110-130min;升华干燥包括:先在-45℃至-55℃下干燥5-15min,随后在-30℃至-40℃下干燥1500-1600min,再在-2℃至-8℃下干燥50-70min;解析干燥包括:先在2-8℃下干燥50-70min,再在25-35℃下干燥800-1000min。
30.上述冻干工艺解决了胶原蛋白冻干后过度自交联导致的复溶难题,通过将活性胶原蛋白的自交联比例控制在适宜的范围,不仅能够良好地解决注射级胶原蛋白在冻干后的复溶问题,同时还能够显著提高复溶胶原蛋白的抗酶解性能和热稳定性。
31.本发明还提供一种去端肽胶原蛋白,按照上述制备方法制得。
32.本发明还提供上述去端肽胶原蛋白在医美中的应用。
33.本发明的实施,至少具有以下优势:
34.1、本发明的制备方法通过酶解时检测酶解液在波长520-540nm下的吸光度,并在吸光度达到0.400-0.450时进行灭酶,从而在保证端肽彻底去除的前提下,最大限度地提高胶原蛋白的收率;
35.2、本发明的制备方法生产条件要求低,能够在工业规模上进行制备,解决了大规模生产去端肽胶原蛋白的问题,端肽去除率高,同时去端肽胶原蛋白的收率和纯度高;
36.3、本发明的冻干制剂复溶性、抗酶解性能和热稳定性好,根据应用场景复溶稀释为不同浓度进行不同应用,适用范围广泛;
37.4、本发明的制备方法经多批次生产实践证实具有良好的稳定性,各批获得的去端肽胶原蛋白及其冻干制剂端肽去除彻底,内毒素含量低,产品符合组织工程类医疗器械的相关质量要求。
附图说明
38.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
39.图1为实施例1的去端肽胶原蛋白的制备工艺流图。
具体实施方式
40.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常
理解的相同含义。
41.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也包括复数形式,此外,还应当理解的是,当在本说明中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
42.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
43.实施例1
44.结合图1所示,本实施例的去端肽胶原蛋白的制备方法,步骤如下:
45.1、预处理
46.采用10wt%的冰醋酸溶液对牛真皮组织进行第一次浸泡,第一次浸泡温度为15℃,第一次浸泡时间为8d,第一次浸泡后对牛真皮组织进行搅碎,制得牛皮组织颗粒。
47.采用1.5wt%的氢氧化钠溶液对牛皮组织颗粒进行第二次浸泡,第二次浸泡温度为20℃,第二次浸泡时间为3h,第二次浸泡后离心去除多余液体,随后采用8倍体积的注射用水进行洗涤离心两次,于-20℃下冷冻备用。
48.将上述冷冻备用的牛皮组织颗粒放入不锈钢桶中,按2kg牛真皮组织加16l注射用水的比例加注射用水进行温和融化(即温和复熔),注射用水的温度控制在27-28℃,浸泡直至牛真皮组织解冻成松散的组织颗粒,用玻璃棒搅匀,制得预处理牛真皮组织。
49.2、两步匀浆
50.将上述预处理牛真皮组织1l移入匀浆杯中,再加入注射用水至4l,盖好匀浆杯盖开始匀浆,匀浆包括依次进行的第一匀浆和第二匀浆,第一匀浆时的转速控制为18000rpm,匀浆时间为30s,第一匀浆时的转速控制为20800rpm,匀浆时间30s;匀浆过程中,若匀浆设备温度超过60℃,则停机降温至30℃以下后使用。
51.匀浆结束后,将匀浆液倒入200l桶中,反复操作至2kg牛真皮组织全部匀浆完毕,补注射用水至匀浆液中牛真皮组织的含量为25g/l,搅拌均匀。
52.3、低温酶解
53.向匀浆液中加冰醋酸,边加边搅拌,调节匀浆液的ph值至2.5。
54.将配好的胃蛋白酶溶液加入匀浆液中,缓慢搅拌均匀,调ph值至2.5,胃蛋白酶浓度为80iu/ml。
55.在2h内将匀浆液推入20℃的消化室中进行低温酶解,酶解时每天早晚各搅拌一次,并观察实时温度,确保温度保持在20℃左右。
56.酶解终点采用浸入式光谱吸光度测量法确定,检测波长527nm,以酶解前的空白酶解液标记吸光度0点,酶解时每隔4h搅拌一次,搅拌1h后,在线吸光度检测数值在0.400-0.450的范围时,结束酶解。
57.结束酶解后进入灭酶工序,用配制好的10mol/l的naoh溶液调节消化液的ph值至9.25,边加边搅拌,将消化液在20℃静置12h,灭活胃蛋白酶,制得提取液。
58.4、分离纯化
0.450的范围时,结束酶解。
76.结束酶解后进入灭酶工序,用配制好的8mol/l的naoh溶液调节消化液的ph值至9,边加边搅拌,将消化液在22℃静置10h,灭活胃蛋白酶,制得提取液。
77.4、分离纯化
78.用12mm盐酸溶液浸泡硅藻土2h,用纯化水清洗至无明显上清浑浊,得到预处理硅藻土。向上述提取液中等体积加入纯化水,用5m盐酸溶液调ph值至3.9左右,制得混合液;向混合液中加入预处理硅藻土14g/l和半乳糖醛酸2g/l,混匀后静置沉淀1小时,收集上清液,过滤,制得吸附过滤液。
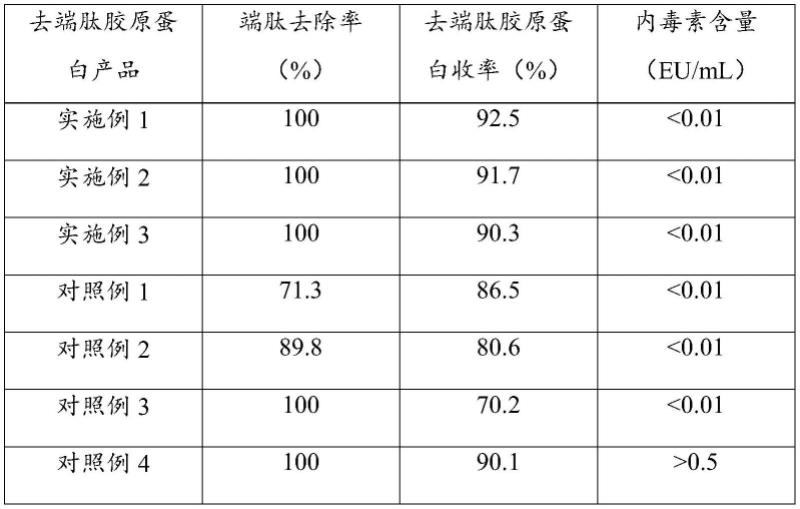
79.采用100kd超滤膜和ph 4.6的醋酸缓冲液对吸附过滤液进行浓缩-换液,随后采用阳离子交换树脂进行离子交换层析,将层析柱用20mm醋酸缓冲液(ph=4.6)冲洗平衡后上样,上样后用20mm的醋酸缓冲液冲洗杂蛋白,用含有100mm氯化钠的20mm的醋酸缓冲液进行洗脱,收集洗脱液,再次采用100kd超滤膜和ph 4.6的醋酸缓冲液对吸附过滤液进行浓缩-换液,采用0.22微米的无菌滤器进行过滤除菌,得到无菌滤液,无菌滤液通过离心获得去端肽胶原蛋白产品(分子量300kd),产品的端肽去除率、去端肽胶原蛋白收率和内毒素含量检测结果见表1。
80.实施例3
81.本实施例的去端肽胶原蛋白的制备方法,步骤如下:
82.1、预处理
83.采用8wt%的冰醋酸溶液对牛真皮组织进行第一次浸泡,第一次浸泡温度为25℃,第一次浸泡时间为7d,第一次浸泡后对牛真皮组织进行搅碎,制得牛皮组织颗粒。
84.采用0.5wt%的氢氧化钠溶液对牛皮组织颗粒进行第二次浸泡,第二次浸泡温度为25℃,第二次浸泡时间为4h,第二次浸泡后离心去除多余液体,随后采用8倍体积的注射用水进行洗涤离心两次,于-20℃下冷冻备用。
85.将上述冷冻备用的牛皮组织颗粒放入不锈钢桶中,按2kg牛真皮组织加14l注射用水的比例加注射用水进行融化,注射用水的温度控制在27-28℃,浸泡直至牛真皮组织解冻成松散的组织颗粒,用玻璃棒搅匀,制得预处理牛真皮组织。
86.2、两步匀浆
87.将上述预处理牛真皮组织1l移入匀浆杯中,再加入注射用水至4l,盖好匀浆杯盖开始匀浆,匀浆包括依次进行的第一匀浆和第二匀浆,第一匀浆时的转速控制为19000rpm,匀浆时间为20s,第一匀浆时的转速控制为20000rpm,匀浆时间20s;匀浆过程中,若匀浆设备温度超过60℃,则停机降温至30℃以下后使用。
88.匀浆结束后,将匀浆液倒入200l桶中,反复操作至2kg牛真皮组织全部匀浆完毕,补注射用水至匀浆液中牛真皮组织的含量为25g/l,搅拌均匀。
89.3、低温酶解
90.向匀浆液中加冰醋酸,边加边搅拌,调节匀浆液的ph值至3。
91.将配好的胃蛋白酶溶液加入匀浆液中,缓慢搅拌均匀,调ph值至3,胃蛋白酶浓度为90iu/ml。
92.在2h内将匀浆液推入21℃的消化室中进行低温酶解,酶解时每天早晚各搅拌一次,并观察实时温度,确保温度保持在21℃左右。
93.酶解终点采用浸入式光谱吸光度测量法确定,检测波长527nm,以酶解前的空白酶解液标记吸光度0点,酶解时每隔4h搅拌一次,搅拌1h后,在线吸光度检测数值在0.400-0.450的范围时,结束酶解。
94.结束酶解后进入灭酶工序,用配制好的12mol/l的naoh溶液调节消化液的ph值至9.5,边加边搅拌,将消化液在21℃静置15h,灭活胃蛋白酶,制得提取液。
95.4、分离纯化
96.用10mm盐酸溶液浸泡硅藻土2h,用纯化水清洗至无明显上清浑浊,得到预处理硅藻土。向上述提取液中等体积加入纯化水,用5m盐酸溶液调ph值至4.1左右,制得混合液;向混合液中加入预处理硅藻土16g/l和半乳糖醛酸1g/l,混匀后静置沉淀3小时,收集上清液,过滤,制得吸附过滤液。
97.采用100kd超滤膜和ph 4.6的醋酸缓冲液对吸附过滤液进行浓缩-换液,随后采用阳离子交换树脂进行离子交换层析,将层析柱用15mm醋酸缓冲液(ph=4.6)冲洗平衡后上样,上样后用15mm的醋酸缓冲液冲洗杂蛋白,用含有150mm氯化钠的15mm的醋酸缓冲液进行洗脱,收集洗脱液,再次采用100kd超滤膜和ph 4.6的醋酸缓冲液对吸附过滤液进行浓缩-换液,采用0.22微米的无菌滤器进行过滤除菌,得到无菌滤液,无菌滤液通过离心获得去端肽胶原蛋白产品(分子量300kd),产品的端肽去除率、去端肽胶原蛋白收率和内毒素含量检测结果见表1。
98.对照例1
99.除酶解步骤不同之外,其余与实施例1基本相同。
100.具体地,本对照例的酶解步骤如下:
101.向匀浆液中加冰醋酸,边加边搅拌,调节匀浆液的ph值至2.5。
102.将配好的胃蛋白酶溶液加入匀浆液中,缓慢搅拌均匀,调ph值至2.5,胃蛋白酶浓度为80iu/ml。
103.在2h内将匀浆液推入20℃的消化室中进行低温酶解,酶解时每天早晚各搅拌一次,并观察实时温度,确保温度保持在20℃左右,酶解6天后,结束酶解。
104.结束酶解后进入灭酶工序,用配制好的10mol/l的naoh溶液调节消化液的ph值至9.25,边加边搅拌,将消化液在20℃静置12h,灭活胃蛋白酶,制得提取液。
105.本对照例制备的去端肽胶原蛋白产品(分子量300kd)的端肽去除率、去端肽胶原蛋白收率和内毒素含量检测结果见表1。
106.对照例2
107.除酶解步骤不同之外,其余与实施例1基本相同。
108.具体地,本对照例的酶解步骤如下:
109.向匀浆液中加冰醋酸,边加边搅拌,调节匀浆液的ph值至2.5。
110.将配好的胃蛋白酶溶液加入匀浆液中,缓慢搅拌均匀,调ph值至2.5,胃蛋白酶浓度为80iu/ml。
111.在2h内将匀浆液推入20℃的消化室中进行低温酶解,酶解时每天早晚各搅拌一次,并观察实时温度,确保温度保持在20℃左右,酶解7天后,结束酶解。
112.结束酶解后进入灭酶工序,用配制好的10mol/l的naoh溶液调节消化液的ph值至9.25,边加边搅拌,将消化液在20℃静置12h,灭活胃蛋白酶,制得提取液。
113.本对照例制备的去端肽胶原蛋白产品(分子量300kd)的端肽去除率、去端肽胶原蛋白收率和内毒素含量检测结果见表1。
114.按本对照例上述制备方法制备五批去端肽胶原蛋白产品,各批产品的端肽去除率和去端肽胶原蛋白收率检测结果见表2。
115.对照例3
116.除酶解步骤不同之外,其余与实施例1基本相同。
117.具体地,本对照例的酶解步骤如下:
118.向匀浆液中加冰醋酸,边加边搅拌,调节匀浆液的ph值至2.5。
119.将配好的胃蛋白酶溶液加入匀浆液中,缓慢搅拌均匀,调ph值至2.5,胃蛋白酶浓度为80iu/ml。
120.在2h内将匀浆液推入20℃的消化室中进行低温酶解,酶解时每天早晚各搅拌一次,并观察实时温度,确保温度保持在20℃左右,酶解8天后,结束酶解。
121.结束酶解后进入灭酶工序,用配制好的10mol/l的naoh溶液调节消化液的ph值至9.25,边加边搅拌,将消化液在20℃静置12h,灭活胃蛋白酶,制得提取液。
122.本对照例制备的去端肽胶原蛋白产品(分子量300kd)的端肽去除率、去端肽胶原蛋白收率和内毒素含量检测结果见表1。
123.按本对照例上述制备方法制备五批去端肽胶原蛋白产品,各批产品的端肽去除率和去端肽胶原蛋白收率检测结果见表2。
124.对照例4
125.除预处理步骤中不采用1.5wt%的氢氧化钠溶液对牛皮组织颗粒进行第二次浸泡之外,其余与实施例1基本相同。
126.本对照例制备的去端肽胶原蛋白产品(分子量300kd)的端肽去除率、去端肽胶原蛋白收率和内毒素含量检测结果见表1。
127.表1去端肽胶原蛋白产品的检测结果
[0128][0129]
表2五批去端肽胶原蛋白产品的检测结果
[0130][0131]
实施例4
[0132]
本实施例对实施例1的去端肽胶原蛋白进行冻干,步骤如下:
[0133]
1、制备冻干混合液
[0134]
将实施例1的去端肽胶原蛋白悬浮到生理盐水中,制得10mg/ml的去端肽胶原蛋白悬浮液。
[0135]
将纤维二糖溶于水中,混匀,得到质量浓度为4%的纤维二糖溶液;向纤维二糖溶液中过氧化氢进行反应,纤维二糖与过氧化氢的质量比1:0.05,反应温度为40℃,反应时间为6h,制得氧化纤维二糖。
[0136]
向去端肽胶原蛋白悬浮液中添加甘氨酸、甘露醇、氧化纤维二糖和乙酸乙酯,混合后制得混合液;其中,去端肽胶原蛋白、甘氨酸、甘露醇、氧化纤维二糖之间的质量比为1:1:3:0.6,去端肽胶原蛋白与乙酸乙酯的质量体积比为1mg:0.05ml。
[0137]
2、冻干
[0138]
采用表3冻干条件对混合液进行冻干。
[0139]
表3冻干工艺条件
[0140]
预冻温度(℃)升温速率(min)保温时间(min)真空设置(pa)第1步1030/第2步-550120/升华干燥温度(℃)升温速率(min)保温时间(min)真空设置(pa)第1步-50010极限第2步-35301560极限第3步-53060极限解析干燥温度(℃)升温速率(min)保温时间(min)真空设置(pa)第1步53060极限第2步3030900极限
[0141]
冻干后,即制得去端肽胶原蛋白冻干制剂。
[0142]
实施例5
[0143]
本实施例对实施例2的去端肽胶原蛋白进行冻干,步骤如下:
[0144]
1、制备冻干混合液
[0145]
将实施例2的去端肽胶原蛋白悬浮到生理盐水中,制得10mg/ml的去端肽胶原蛋白悬浮液。
[0146]
将纤维二糖溶于水中,混匀,得到质量浓度为6%的纤维二糖溶液;向纤维二糖溶液中过氧化氢进行反应,纤维二糖与过氧化氢的质量比1:0.1,反应温度为20℃,反应时间为10h,制得氧化纤维二糖。
[0147]
向去端肽胶原蛋白悬浮液中添加甘氨酸、甘露醇、氧化纤维二糖和乙酸乙酯,混合后制得混合液;其中,去端肽胶原蛋白、甘氨酸、甘露醇、氧化纤维二糖之间的质量比为1:2:4:0.2,去端肽胶原蛋白与乙酸乙酯的质量体积比为1mg:0.08ml。
[0148]
2、冻干
[0149]
采用表4冻干条件对混合液进行冻干。
[0150]
表4冻干工艺条件
[0151]
预冻温度(℃)升温速率(min)保温时间(min)真空设置(pa)第1步0025/第2步-500130/升华干燥温度(℃)升温速率(min)保温时间(min)真空设置(pa)第1步-45015极限第2步-30251600极限第3步-22570极限解析干燥温度(℃)升温速率(min)保温时间(min)真空设置(pa)第1步22570极限第2步25251000极限
[0152]
冻干后,即制得去端肽胶原蛋白冻干制剂。
[0153]
实施例6
[0154]
本实施例对实施例3的去端肽胶原蛋白进行冻干,步骤如下:
[0155]
1、制备冻干混合液
[0156]
将实施例3的去端肽胶原蛋白悬浮到生理盐水中,制得10mg/ml的去端肽胶原蛋白悬浮液。
[0157]
向去端肽胶原蛋白悬浮液中添加甘氨酸、甘露醇、实施例2制备的氧化纤维二糖和乙酸乙酯,混合后制得混合液;其中,去端肽胶原蛋白、甘氨酸、甘露醇、氧化纤维二糖之间的质量比为1:1:2:0.4,去端肽胶原蛋白与乙酸乙酯的质量体积比为1mg:0.1ml。
[0158]
2、冻干
[0159]
采用表5冻干条件对混合液进行冻干。
[0160]
表5冻干工艺条件
[0161]
预冻温度(℃)升温速率(min)保温时间(min)真空设置(pa)第1步2035/第2步-600110/升华干燥温度(℃)升温速率(min)保温时间(min)真空设置(pa)第1步-5505极限
第2步-40351500极限第3步-83550极限解析干燥温度(℃)升温速率(min)保温时间(min)真空设置(pa)第1步83570极限第2步35351000极限
[0162]
冻干后,即制得去端肽胶原蛋白冻干制剂。
[0163]
对照例5
[0164]
除制备冻干混合液步骤中不添加乙酸乙酯之外,其余与实施例4基本相同。
[0165]
对照例6
[0166]
除采用叔丁醇替换实施例4的乙酸乙酯之外,其余与实施例1基本相同。
[0167]
对照例7
[0168]
除制备冻干混合液步骤中不对纤维二糖进行氧化,而直接采用纤维二糖替换氧化纤维二糖之外,其余与实施例4基本相同。
[0169]
对照例8
[0170]
除制备冻干混合液步骤不同之外,其余与实施例4基本相同。
[0171]
本对照例的冻干混合液的制备方法为:将实施例1的去端肽胶原蛋白悬浮到生理盐水中,制得10mg/ml的去端肽胶原蛋白悬浮液。
[0172]
向去端肽胶原蛋白悬浮液中添加柠檬酸、甘露醇、海藻糖和乙酸乙酯,混合后制得冻干混合液;其中,去端肽胶原蛋白、柠檬酸、甘露醇、海藻糖之间的质量比为1:1:3:0.6,活性胶原蛋白与乙酸乙酯的质量体积比为1mg:0.05ml。
[0173]
试验例1
[0174]
将实施例4-6和对照例5-8制备的去端肽胶原蛋白冻干制剂复溶于无菌水中,控制复溶后的活性胶原蛋白溶液的浓度分别为10mg/ml、30mg/ml,采用三种不同的注射器对复溶后的去端肽胶原蛋白溶液进行注射,注射情况见表6。
[0175]
表6各去端肽胶原蛋白冻干制剂的复溶试验结果
[0176][0177]
试验例2
[0178]
1、变性温度检测
[0179]
采用dsc测量法对实施例4-6和对照例5-8制备的去端肽胶原蛋白冻干制剂的热稳定性进行检测;检测条件如下:升温速度维持速率为5℃/min,温度范围为20-200℃;各去端肽胶原蛋白冻干制剂的变性温度检测结果见表7。
[0180]
2、酶解率检测
[0181]
将实施例4-6和对照例5-8的去端肽胶原蛋白冻干制剂复溶于无菌水中,制成30mg/ml的复溶去端肽胶原蛋白溶液;向复溶去端肽胶原蛋白溶液中加入胶原酶,于30℃下酶解12h,检测酶解上清液中的羟脯氨酸含量,将实施例1制备的去端肽胶原蛋白酶解产生的羟脯氨酸含量计为酶解率100%。各去端肽胶原蛋白冻干制剂的酶解率检测结果见表7。
[0182]
表7各去端肽胶原蛋白冻干制剂的抗酶解性能和热稳定性检测结果
[0183]
去端肽胶原蛋白/冻干制剂变性温度td(℃)酶解率(%)去端肽胶原蛋白51100实施例4冻干制剂7041实施例5冻干制剂6645实施例6冻干制剂6359对照例5冻干制剂5385对照例6冻干制剂5580对照例7冻干制剂5971对照例8冻干制剂5677
[0184]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进
行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1