一种锰氧化合物催化的芳基烷烃直接氧化合成芳基酮类化合物的方法
1.本发明属于有机合成方法学领域,具体涉及一种锰氧化合物催化的芳基烷烃直接氧化合成芳基酮类化合物的方法。
背景技术:
2.芳基烷烃是石油化工生产的大宗原料,通过化学转化的方式将其生产成更具价值的精细化学品具有十分重要的意义。芳基酮类的化合物是一种广泛存在的天然产物,作为食品添加剂,药物分子及其前体,有机小分子催化剂等用途十分广泛,同时也是一种重要的有机合成中间体。该类化合物的合成方法主要有:(1)醇类化合物的直接氧化;(2)酯类化合物的还原;(3)一氧化碳参与的羰基化反应,如工业上应用的贵金属催化的氢甲酰化反应;(4)烃类化合物的氧化等。其中最有发展潜力的当属对烃类化合物c-h键的直接氧化,不仅原料来源广泛,而且反应步骤短,原子利用率高很适合大规模的工业化生产。目前该类方法的研究也有一定的进展,殷弘等人(wang j,zhang c,ye x q,et al.rsc adv,2021,11(5):3003-3011)报道了硝酸铁和n-羟基-2,3-二酰亚胺(nhpi)协同催化的芳基烷烃的氧化反应,能够以不错的产率得到芳基酮类化合物,但是反应需要以苯甲腈为溶剂在90℃条件下进行,不够绿色环保;傅华等人(zhu x,liuy,liu c,et al.green chem,2020,22(13):4357-4363)利用光催化的条件也能够实现芳基烷烃的氧化,他们以三氟甲基亚磺酸钠为催化剂(25mol%),在蓝光照射下可以顺利得到目标产物,但是该反应催化剂用量较多不适宜大规模的工业生产;最近刘仁华等人(zhang j,du j,zhang c,et al.org lett,2022,24(5):1152-1157)报道了以钯碳(pd/c)为催化剂的芳基烷烃的氧化,该反应以水为氧化剂十分绿色,但是催化剂比较昂贵,同时反应条件较为苛刻,需要在130℃条件下反应48小时,限制其大规模的应用;shaabani等人利用羊毛纤维为载体制备了一种负载的二氧化锰催化剂(shaabani a,hezarkhani z,badali e.rsc adv,2015,5(76):61759-61767),可以有效的催化芳基烷烃的氧化,但是也有明显的缺陷,该反应需以邻二甲苯为溶剂在回流温度下(144℃)反应,产物的分离较为麻烦且反应条件不够绿色环保。因此寻找一种反应条件温和,催化剂廉价易于制备的芳基烷烃催化氧化新方法,不仅具有重要的理论价值,同时在工业生产上也十分重要。
技术实现要素:
3.为了克服现有技术中存在的缺点和不足,本发明的首要目的在于提供一种锰氧化合物催化的芳基烷烃直接氧化合成芳基酮类化合物的方法。本发明通过锰氧化合物活化过硫酸氢钾(pms)产生自由基,在室温的条件下将芳基烷烃直接氧化为芳基酮类化合物,本方法简单,控制方便。
4.为实现上述发明目的,本发明采用如下技术方案:
5.一种锰氧化合物催化的芳基烷烃直接氧化合成芳基酮类化合物的方法,包括如下
步骤:以芳基烷烃为反应底物、以过硫酸氢钾(pms)为氧化剂、以锰氧化合物为催化剂,在水和亲水性有机溶剂的混合溶剂中通过自由基反应制备得到产物芳基酮类化合物;
6.其中芳基烷烃的化学结构通式为:其中r1为氢,叔丁基,甲氧基,氰基,硝基,氯,溴,苯基,三氟甲基,乙酰基,甲氧羰基,叔丁氧羰基;为萘基,喹啉基,苯并呋喃基;r2甲基,乙基,丙基,苯甲基,甲氧羰基,2-溴乙基,苯基,萘基,吡啶基中的一种。
7.进一步的,所述锰氧化合物为mno2。
8.进一步的,所述mno2为α-mno2。
9.进一步的,所述α-mno2为na-α-mno2。
10.进一步的,所述反应底物与氧化剂的摩尔比为1:(6~8)。
11.进一步的,所述亲水性有机溶剂为乙腈。
12.进一步的,所述水和乙腈的体积比为1:(0.5~2)。
13.其中,本发明所述的α-mno2为在催化剂领域中常见的α-mno2,而本发明所述的na-α-mno2的合成报道在申请号为202110119652.7的专利中已经报道,在本发明中不再详细描述。
14.另外,在本发明中,终止反应、萃取、旋干溶剂等常规有机合成操作,包括最后经快速柱层析得到相应的芳基酮类化合物等操作本身都属于现有技术,其中所使用的萃取剂、洗脱剂也是现有技术,本领域技术人员可以根据最终产物的性质选择合适的试剂。
15.与现有技术相比,本发明具有如下有益效果:
16.本发明使用mno2为作为催化剂催化pms产生自由基将芳基烷烃上的碳氢键直接氧化为酮,反应活性高,而且反应能在室温下进行,反应时间短,目标产物的收率高。本发明公开的制备方法对多种芳基烷烃底物具有普适性,反应合成方法简单,易于获得,成本低,操作简便,有利于芳基酮类化合物的工业化生产。
具体实施方式
17.下面结合实施例对本发明进行详细的说明,实施例仅是本发明的优选实施方式,不是对本发明的限定。
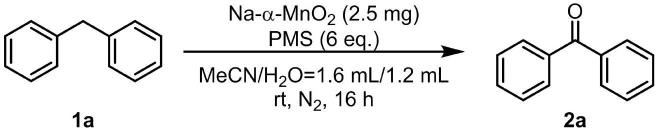
18.实施例1
[0019][0020]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1a(0.2mmol,33.6mg),pms(1.2mmol,368.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2a,收率为85%,产物表征如下:
[0021]1hnmr(400mhz,cdcl3):δ7.82-7.80(m,4h),7.61-7.57(m,2h),7.50-7.46(m,4h)
.
13
c{1h}nmr(101mhz,cdcl3):δ196.3,137.3,132.2,129.8,128.1.hrms(esi):calcd.for c
13h11o+
[m+h]
+
:183.0810;found:183.0809.
[0022]
实施例2
[0023][0024]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1b(0.2mmol,33.2mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2b,收率为70%,产物表征如下:1hnmr(400mhz,cdcl3):δ7.53-7.51(m,2h),7.36-7.51(m,4h),7.17-7.14(m,2h).
13
c{1h}nmr(101mhz,cdcl3):δ193.9,144.4,134.7,134.2,129.1,124.3,120.4.hrms(esi):calcd.for c
13
h9o
+
[m+h]
+
:181.0653;found:181.0644.
[0025]
实施例3
[0026][0027]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1c(0.2mmol,21.2mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2c,收率为80%,产物表征如下:
[0028]1hnmr(400mhz,cdcl3):δ7.96-7.94(m,2h),7.58-7.53(m,1h),7.47-7.44(m,1h).
13
c{1h}nmr(101mhz,cdcl3):δ198.3,137.2,133.2,128.6,128.4,26.7.hrms(esi):calcd.for c8h9o
+
[m+h]
+
:121.0653;found:121.0658.
[0029]
实施例4
[0030][0031]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1d(0.2mmol,27.2mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2d,收率为72%,产物表征如下:
[0032]1hnmr(400mhz,cdcl3):δ7.91(d,j=8.6hz,2h),6.91(d,j=8.6hz,2h),3.84(s,
3h),2.53(s,3h).
13
c{1h}nmr(101mhz,cdcl3):δ196.8,163.6,130.6,130.4,113.7,55.5,26.4.hrms(esi):calcd.for c9h
11o2+
[m+h]
+
:151.0759;found:151.0752.
[0033]
实施例5
[0034][0035]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1e(0.2mmol,30.2mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2e,收率为91%,产物表征如下:
[0036]1hnmr(400mhz,cdcl3):δ8.27(d,j=8.4hz,2h),8.09(d,j=8.4hz,2h),2.66(s,3h).
13
c{1h}nmr(101mhz,cdcl3):δ196.4,150.0,141.4,129.4,123.9,27.0.hrms(esi):calcd.for c8h7no3na
+
[m+na]
+
:188.0324;found:188.0320.
[0037]
实施例6
[0038][0039]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1f(0.2mmol,28mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2f,收率为78%,产物表征如下:
[0040]1hnmr(400mhz,cdcl3):δ7.86(d,j=8.6hz,2h),7.40(d,j=8.6hz,2h),2.56(s,3h).
13
c{1h}nmr(101mhz,cdcl3):δ196.6,139.4,135.3,129.6,128.7,26.4.hrms(esi):calcd.for c8h8clo
+
[m+h]
+
:155.0264;found:155.0255.
[0041]
实施例7
[0042][0043]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1g(0.2mmol,37mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2g,收率为83%,产物表征如下:
[0044]1hnmr(400mhz,cdcl3):δ7.82(d,j=8.5hz,2h),7.61(d,j=8.5hz,2h),2.59(s,
3h).
13
c{1h}nmr(101mhz,cdcl3):δ197.0,135.8,131.9,129.8,128.3,26.5.hrms(esi):calcd.for c8h8bro
+
[m+h]
+
:198.9753;found:198.9748.
[0045]
实施例9
[0046][0047]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1h(0.2mmol,36.4mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2h,收率为75%,产物表征如下:
[0048]1hnmr(400mhz,cdcl3):δ7.97(d,j=8.4hz,2h),7.62(d,j=8.5hz,2h),7.56(d,j=7.4hz,2h),7.41(t,j=7.5hz,2h),7.33(t,j=7.3hz,1h),2.57(s,3h).
13
c{1h}nmr(101mhz,cdcl3):δ197.8,145.8,139.9,135.9,129.0,128.9,128.2,127.3,127.3,26.7.hrms(esi):calcd.for c
14h13o+
[m+h]
+
:197.0961;found:197.0957.
[0049]
实施例10
[0050][0051]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1i(0.2mmol,26.2mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2i,收率为86%,产物表征如下:
[0052]1hnmr(400mhz,cdcl3):δ8.04(d,j=8.4hz,2h),7.78(d,j=8.2hz,2h),2.65(s,3h).
13
c{1h}nmr(101mhz,cdcl3):δ196.52,139.86,132.50,128.67,117.91,116.38,26.77.hrms(esi):calcd.for c9h8no
+
[m+h]
+
:146.0600;found:146.0596.
[0053]
实施例11
[0054][0055]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1j(0.2mmol,34.8mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2j,收率为80%,产物表征如下:
[0056]1hnmr(400mhz,cdcl3):δ8.06(d,j=8.1hz,2h),7.73(d,j=8.2hz,2h),2.64(s,3h).
13
c{1h}nmr(101mhz,cdcl3):δ196.96,139.65,134.41(q,j=32.7hz),128.60,125.66(q,j=3.3hz),123.57(q,j=273.3hz),26.76.hrms(esi):calcd.for c9h8f3o
+
[m+h]
+
:189.0522;found:189.0517.
[0057]
实施例12
[0058][0059]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1k(0.2mmol,29.6mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2k,收率为76%,产物表征如下:
[0060]1hnmr(400mhz,cdcl3):δ8.04(s,4h),2.65(s,6h).
13
c{1h}nmr(101mhz,cdcl3):δ197.49,140.13,128.49,26.92.hrms(esi):calcd.for c
10h11o2+
[m+h]
+
:163.0754;found:163.0752.
[0061]
实施例12
[0062][0063]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1l(0.2mmol,26.8mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2l,收率为75%,产物表征如下:
[0064]1hnmr(400mhz,cdcl3):δ7.96(d,j=7.5hz,2h),7.55(t,j=7.4hz,1h),7.45(t,j=7.7hz,2h),2.95(t,j=7.3hz,2h),1.80
–
1.74(m,2h),1.00(t,j=7.4hz,3h).
13
c{1h}nmr(101mhz,cdcl3):δ200.4,137.1,132.8,128.5,128.0,40.5,17.7,13.9.hrms(esi):calcd.for c
10h13o+
[m+h]
+
:149.0961;found:149.0958.
[0065]
实施例13
[0066][0067]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1m(0.2mmol,26.4mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然
后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2m,收率为66%,产物表征如下:
[0068]1hnmr(400mhz,cdcl3):δ7.96(d,j=7.5hz,2h),7.55(t,j=7.4hz,1h),7.45(t,j=7.7hz,2h),2.95(t,j=7.3hz,2h),1.80
–
1.74(m,2h),1.00(t,j=7.4hz,3h).
13
c{1h}nmr(101mhz,cdcl3):δ200.4,137.1,132.8,128.5,128.0,40.5,17.7,13.9.hrms(esi):calcd.for c
10h11o+
[m+h]
+
:147.0804;found:147.0798.
[0069]
实施例14
[0070][0071]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1n(0.2mmol,32.8mg),pms(1.6mmol,491.7mg),水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2n,收率为50%,产物表征如下:
[0072]1hnmr(400mhz,cdcl3):δ12.53(s,0.2h),7.93(d,j=7.6hz,2h),7.77(d,j=7.6hz,0.4h),7.60-7.57(m,1h),7.49-7.45(m,2.2h),7.42-7.38(m,0.4h),5.68(s,0.2h),4.01(s,2h),3.78(s,0.6h),3.73(s,3h).
13
c{1h}nmr(101mhz,cdcl3):δ192.3,173.3,171.3,167.8,135.7,133.6,131.1,128.6,128.4,128.3,128.2,125.9,86.8,52.3,51.2,45.5.hrms(esi):calcd.for c
10h11o3+
[m+h]
+
:179.0703;found:179.0697.
[0073]
实施例15
[0074]
为了更好的理解本发明的催化反应的机理,我们进行了h
218
o的实验。
[0075][0076]
在干净的反应瓶中配以大小合适的磁子在氮气保护下依次加入na-α-mno2(2.5mg),化合物1a(0.2mmol,21.2mg),pms(1.2mmol,368.7mg),重水+乙腈(1.2ml+1.6ml),然后在室温下反应16小时后,加入4ml饱和食盐水淬灭,并用乙酸乙酯萃取(5ml
×
3),合并有机相加入无水硫酸钠干燥,然后利用旋转蒸发仪旋干溶剂,所得粗产物通过简单的柱层析即可得氧化产物2a-18
o,所得的产物利用gc-ms分析,通过质谱图计算
18
o的标记率为92%,该结果可以证实产物中的氧原子来源于反应体系中的水。以前的报道认为氧原子来源于过氧化物产生的羟基自由基(
·
oh)(j.am.chem.soc.2017,139,10790)因此,我们的方法从机理上有别于以发表的一些方法,我们推测其反应机理可能如所示:过氧化物被α-mno2所活化产生了羟基自由基和硫酸根自由基负离子,这两种自由基可以攫取苄位的h原子,生成相应的苄基自由基,该自由基物种随后在α-mno2催化下被氧化成苄基正离子,随后
反应体系的水发生亲核进攻生成苄醇类化合物,该化合物在强氧化环境中被迅速氧化为相应的羰基化合物,即我们的目标产物。
[0077][0078]
以上所述实施例仅表达了本发明的实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制,但凡采用等同替换或等效变换的形式所获得的技术方案,均应落在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1