一种烟草原生质体制备方法与流程
1.本技术属于烟草组织器官解剖技术领域,具体涉及一种烟草原生质体制备方法。
背景技术:
2.烟草作为一种较为特殊的经济作物,不仅与国民经济发展高度相关,同时,因其生长周期相对较短,栽培管理相对简单,因此,烟草本身也是一种植物学研究中常用的模式植物。
3.植物学研究中,针对各类代谢产物或者细胞层面进行研究时,原生质体制备与获得是相关试验开展基础。植物原生质体是指除去细胞壁后而仅为原生质膜所包围的裸露细胞。
4.现有技术中,常用的原生质体制备与分离方法有机械法、化学法和酶解法等方法,其中酶解法因其安全性、有效性、相对可控性、快速性等优点,是目前较为主流的植物原生质体制备方法。但客观而言,由于不同植物细胞结构组成差异较大,加上研究目的不同,因此,植物原生质体的制备并无通用的制备方法,只能依据不同植物、以及不同植物组织器官及不同细胞区别,分别探索最适的原生质体分离制备方法。
技术实现要素:
5.本技术目的在于提供一种适用于烟草次生代谢产物研究用的原生质体制备分离方法,从而为烟草细胞代谢组学研究奠定一定技术基础。
6.本技术所采取的技术方案详述如下。
7.一种烟草原生质体制备方法,该方法适用于烟草代谢组学研究中针对根部细胞、或者烟叶(腺毛)细胞的原生质体制备分离应用,具体包括如下步骤:(一)准备酶解液以烟草根尖、或烟叶(腺毛)为原生质体制备材料(原料)来源;针对烟草根尖材料时,原生质体制备用酶解液为:含有纤维素酶cellulast、果胶酶pectolyase(或离析酶macerozyme)的mes缓冲液;具体配方组成为:mes、5mm+cac12、10mm+nacl、10mm+甘露醇manmitol(ph=5.7)、0.35m+1.5%纤维素酶cellulast+1.0~1.5%果胶酶pectolyase(或离析酶macerozyme)+0.1%bsa;针对烟叶(腺毛)材料时,原生质体制备用酶解液为:含有纤维素酶cellulast和离析酶macerozyme的cpw缓冲液;具体配方组成为:缓冲液cpw(ph5.8)+甘露醇manmitol(ph5.7)、0.4m+1%纤维素酶cellulast+0.5%离析酶macerozyme;所述缓冲液cpw(ph5.8):kh2po4、27.2mg/l+kno3、101.0mg/l+cacl2•
2h2o、1480.0mg/l+mgso4•
7h2o、246.0mg/l+ki、0.16mg/l+cuso4•
5h2o、0.025mg/l;所述纤维素酶cellulast,例如为酶活10000u/g的cellulaseonozukar-10;
所述果胶酶pectolyase,例如为酶活1000u/g的pectolyase y-23;所述离析酶macerozyme,例如为酶活3000u/g的macerozyme r-10;(2)材料预处理以无菌培养的烟草、或新鲜烟叶(腺毛)为原生质体制备材料(原料)来源;预处理时:针对根组织,取烟草发芽生长7-10天左右的根尖组织,无菌水清洗(不少于3次)后,滤纸吸干水分,沿根尖生长方向刀片切取0.5cm;针对烟叶组织,选取烟草发芽生长后4~6叶期完全伸展开的烟草叶片,置于冰上,快速切割成1mm左右宽度的细丝备用;所述烟草,具体例如k326、本氏烟或黄花烟;(3)酶解提取将步骤(2)中预处理后的根尖或者烟叶细丝,置于容器中,加入步骤(1)中所配制的对应酶解液,26℃~30℃,震荡处理1~5h(例如为:80rpm震荡处理3h);具体用量方面:每100条根尖,酶解液用量为5ml;每片鲜烟叶,酶解液用量为10ml;(4)原生质体分离待步骤(3)中震荡处理结束后,将混合液过250目细胞筛以进行过滤;针对根尖的滤液,离心,保留沉淀,将沉淀用mes缓冲液(不含裂解酶)重悬后,即为烟草根尖原生质体提取液;针对烟叶的滤液,500rpm离心5~10min,保留上清,即为含有较高活性和纯度的烟草腺毛细胞原生质体提取液。
8.在对现有植物细胞原生质体提取方法研究总结基础上,发明人结合烟草根组织、烟叶细胞的结构特点,结合次生代谢产生代谢组学研究需要(根是烟草生物碱的合成部位,烟草腺毛是萜类、尤其是二萜的主要合成部位),对酶解法制备原生质体过程中所需的生物酶类型和用量进行了进一步优化设计,构建了适合烟草根尖来源或者烟叶腺毛来源的原生质体制备方法。
9.经过相关提取工艺参数优化后,初步实验结果表明,制备所得原生质体数量多、活性高,其中烟草根提取液中原生质体的数量可达1.0
×
106个/ml,烟草腺毛细胞叶片提取液中原生质体的数量可达5.3
×
105个/ml,而且所制备原生质体的活性均较高(》85%)。同时由于相关提取方法简单快速、耗时较短,因此使得本技术具有较好的科研实用价值,可为相关细胞学研究、代谢组学研究奠定良好的技术基础。
附图说明
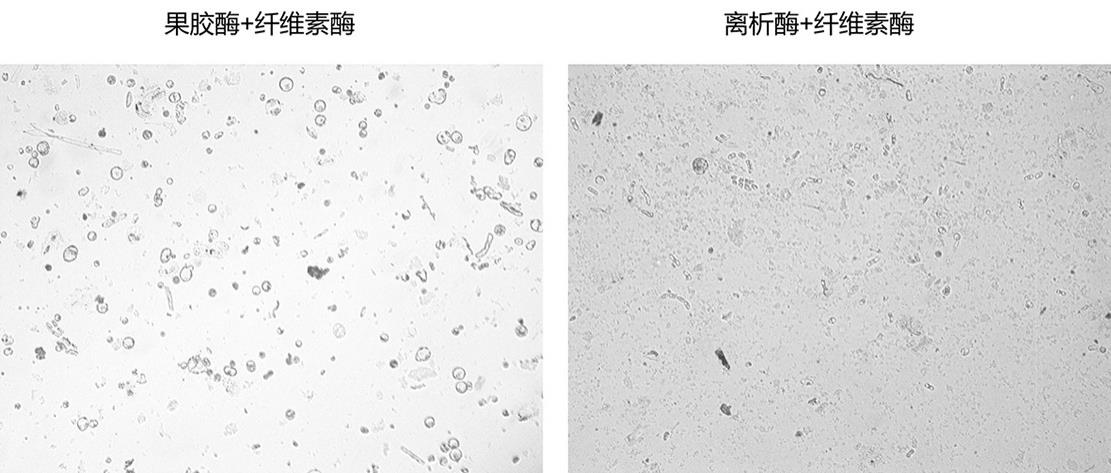
10.图1为k326不同酶组合得到的根尖原生质体;图2为k326 的不同酶浓度得到的根尖原生质体;图3为k326不同处理时间下处理获得的根尖原生质体;图4为k326不同生长时间的根尖处理后获得的根尖原生质体;图5 为不同烟草品种根原生质体的活性检测结果;图中:a:本氏烟;b:k326;彩色视图下,亮黄色:活细胞;蓝色(蓝绿色):死细胞或者细胞碎片;
图6为k326不同时间处理得到的烟叶(腺毛)原生质体;图7为 k326处理3小时后上清和沉淀中的烟叶(腺毛)原生质体细胞;图8为k326不同甘露醇处理条件下的烟叶(腺毛)原生质体;图9为k326和黄花烟叶片裂解后获得的烟叶(腺毛)原生质体。
具体实施方式
11.下面结合实施例对本技术做进一步的解释说明。在介绍具体实施例前,就下述实施例中部分实验背景情况简要介绍说明如下。
12.实验材料:纤维素酶cellulast:cellulase onozuka r-10(酶活10000u/g)、离析酶macerozyme: macerozyme r-10(酶活3000u/g)、果胶酶 pectolyase:pectolyase y-23(酶活1000u/g),均为yakult japan公司产品;烟草材料:栽培烟草k326和黄花烟,均为温室培育,采摘其4-6叶期完全伸展开的叶片进行腺毛原生质体制备;根组织材料则采用无菌条件下萌发(k326、本氏烟)生长7-10天的根组织;实验方法:细胞计数法读取原生质体数量时:先取原生质体悬液20
µ
l,加20
µ
l台盼蓝混匀;然后将10μl悬液加入细胞计数板中,静置1分钟,插入细胞计数器计数;读取细胞浓度n(个/ml)并计算细胞数:细胞数=n
×
细胞体积(ml)。
13.实施例1本实施例以烟草根组织为例,就相关原生质体的制备过程简介如下。
14.(一)准备酶解液结合现有技术总结和发明人对于烟草根组织结构分析(相较于烟片组织而言,烟草根的纤维化程度高,纤维素含量高),发明人认为根组织原生质体制备时,主要依赖纤维素酶和果胶酶的酶解,但为确定合适的生物酶用量比例,结合相关预试验结果,发明人针对若干较好的生物酶液组合进行了进一步筛选,具体而言:酶解液1:mes、5 mm + cac12、10 mm + nacl、10 mm + 甘露醇manmitol (ph=5.7)、0.35 m + 1.5% 纤维素酶cellulast + 1.5% 离析酶macerozyme+ 0.1% bsa;酶解液2:mes、5 mm + cac12、10 mm + nacl、10 mm + 甘露醇manmitol (ph=5.7)、0.35 m + 1.5% 纤维素酶cellulast + 1.5%果胶酶pectolyase + 0.1% bsa;酶解液3:mes、5 mm + cac12、10 mm + nacl、10 mm + 甘露醇manmitol (ph=5.7)、0.35 m + 1.5% 纤维素酶cellulast + 1.0%果胶酶pectolyase + 0.1% bsa;(2)材料预处理取烟草根尖组织,无菌水清洗(3次)后,滤纸吸干水分,沿根尖生长方向刀片切取
0.5cm长度根尖;(3)酶解提取将步骤(2)中预处理后的根尖,置于容器中,分别加入步骤(1)中所配制的对应酶解液,28℃,震荡处理;具体用量方面:每100条根尖,酶解液用量为5ml;(4)原生质体分离待步骤(3)中震荡处理结束后,将混合液过250目细胞筛以进行过滤;将滤液700rpm离心10min,保留沉淀,将沉淀用500μl缓冲液重悬;所述缓冲液为步骤(一)中不含生物酶的溶液(即,步骤(一)中酶解液不含纤维素酶、果胶酶、离析酶的剩余组成;重悬时,采用对应的缓冲液进行重悬,即,酶解液1处理组所得原生质体采用酶解液1中不含对应生物酶的缓冲液);利用细胞计数仪对不同处理组所得原生质体进行计数,并利用荧光显微镜进行活性检测。对不同材料来源、不同酶解处理参数所得原生质体的检测结果如图1~4所示。具体而言:采用不同类型酶解液处理时(材料均为生长7天的根组织,酶解振荡处理3h),可以看出(图1),酶解液2获得原生质体数量最多(图中为酶解液2处理组结果),表现出最好的制备效果;分析其原因在于:针对较为幼嫩的烟草根尖组织,其果胶含量相对较高,因此,采用纤维素酶和果胶酶组合应该更为合适。
15.而就酶解液中生物酶浓度而言(材料均为生长7天的根组织,酶解振荡处理3h),可以看出(图2):适当提高果胶酶用量,更有利于解离细胞壁,从而获得更多数量的原生质体。
16.就酶解处理时间而言(材料均为生长7天的根组织,采用酶解液2处理),可以看出(图3):适当提高酶解处理时间,有利于所制备原生质体的分离,从而便于后续研究应用。
17.就制备原生质体材料而言(材料为生长7天或10天的根组织,酶解液2处理3h),可以看出(图4):生长7天的根尖组织,更有利于获得较高数量的原生质体,分析认为这是由于生长10天的根尖纤维化程度较高,不利于制备获得原生质体(或者说,需要重新就相关酶解用量比例进行探索调整)。
18.另外,就不同烟草品种而言,同样裂解条件下(生长7根组织,酶解液2处理2h),结果表明:原生质体数量相当(105数量级),但本氏烟根原生质体的活性较高、碎片较少(图5a),而k326根原生质体的活性较低、碎片较多(图5b)。
19.结合上述实验结果的优化条件,发明人进一步以生长7天的根组织(k326)的根尖部位为材料来制备原生质体细胞,采用酶解液2处理3h,并进一步分离和重悬后,细胞计数结果表明,原生质体的数量可达1.0
×
106个/ml,而且细胞活性较高,表现出较好的制备效果。
20.实施例2本实施例以烟叶材料来制备原生质体,具体过程简介如下。
21.(一)准备酶解液酶解液为:含有cellulast和 离析酶macerozyme的cpw缓冲液;具体配方组成为:酶解液1:
缓冲液cpw(ph5.8)+manmitol(ph5.7)、0.4m+1%cellulast+0.5%macerozyme;酶解液2缓冲液cpw(ph5.8)+manmitol(ph5.7)、0.5m+1%cellulast+0.5%macerozyme;所述缓冲液cpw(ph5.8):kh2po4、27.2mg/l+kno3、101.0mg/l+cacl2•
2h2o、1480.0mg/l+mgso4•
7h2o、246.0mg/l+ki、0.16mg/l+cuso4•
5h2o、0.025mg/l。
22.(2)材料预处理选取烟草发芽生长后4~6叶期完全伸展开的烟草叶片,置于冰上,快速切割成1mm左右宽度的细丝备用;(3)酶解提取将步骤(2)中预处理后的根尖或者烟叶细丝,置于容器中,加入步骤(1)中所配制的对应酶解液,30℃,50rpm震荡处理;具体用量方面:每片鲜烟叶,酶解液用量为10ml;(4)原生质体分离待步骤(3)中震荡处理结束后,将混合液过250目细胞筛以进行过滤;滤液500rpm离心10min,保留上清,即为含有较高活性和纯度的烟叶(腺毛)细胞原生质体提取液。
23.利用细胞计数仪对不同处理组所得原生质体进行计数,并利用荧光显微镜进行活性检测。对不同材料来源、不同酶解处理参数所得原生质体的检测结果如图5~8所示。具体而言:就酶解处理时间而言(k326烟叶,酶解液1处理),可以看出(图6):适当延长酶解处理时间,可以有效获得更多数量的原生质体;就原生质体分离方式而言(k326烟叶,酶解液1处理3h),可以看出(图7):与根尖来源原生质体分离方式不同,离心后上清液中原生质体数量更多、更为完整;分析认为其主要原因在于:烟叶表面的腺毛细胞中,含有大量的萜类化合物和酰基糖等代谢产物,相对较轻,因此使得离心后原生质体主要分布于上清液中,也即可以认为上清液制备所得原生质体主要为烟叶腺毛细胞原生质体;而沉淀中,尽管也会存在一定数量原生质体,但由于杂质细胞和叶肉细胞较多,因此,考虑纯度等因素影响,并不适合后续代谢组学研究研究;就甘露醇浓度而言(k326烟叶,不同酶解液处理3h),可以看出(图8):0.4m甘露醇浓度制备所得原生质体结构更为完整,数量更多,这一结果表明0.4m甘露醇条件下的渗透压更为适合烟叶原生质体的制备;就烟草品种区别而言(酶解液1处理3h),可以看出(图9):两者区别不大,表明该方法具有较好的普适性,但相较而言,该方法处理k326烟叶时,制备所得原生质体分散度更好,更为适宜。
24.结合上述实验结果的优化条件,发明人进一步以k326烟叶为材料来制备原生质体细胞,采用酶解液1处理3h,并进一步分离和重悬后,细胞计数结果表明,上清液中原生质体的数量可达5.3
×
105个/ml,而且细胞活性较高,表现出较好的制备效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1