基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的评分模型、构建方法及应用
1.本发明涉及生物医学领域,特别是涉及基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的评分模型、构建方法及应用。
背景技术:
2.结肠癌(colon cancer)是常见的危及人类健康的恶性肿瘤之一。尽管外科手术理念与技术已经取得较大的进展,术后辅助化疗依旧是根治术后结肠癌综合治疗中的重要环节,多项研究证实辅助化疗可显著改善患者的生存。然而,尽管辅助化疗的治疗地位已经明确,仍有80%的结肠癌患者于原发灶切除后3年内复发,提示有相当比例的患者似乎并未从中获益,或者获益较少。另外,随着对肿瘤生物学、遗传学、免疫学等特征认识的深入以及“个体化治疗”观念的推广,既往“一招走天下”式的用药模式受到质疑。临床工作者们开始更加关注如何精准地筛选潜在的可获益患者以最终实现围手术期“个体化”治疗,进一步改善患者预后。
3.目前,基于肿瘤浸润深度(t)、淋巴结转移(n)以及远处转移(m)评估的tnm分期依旧是结肠癌患者临床最常用的预后指标,也是术后是否需要辅助化疗最直接的参考依据。然而长期的临床实践表明,tnm分期的应用存在局限:一是相同tnm分期的不同患者经过相同或类似治疗后,其临床结局亦存在显著差异;二是由于tnm分期仅根据患者的复发风险判断是否应行辅助化疗,缺乏进一步的精确指导,如tnm分期为ii期的患者是否应进行辅助化疗,iii期患者辅助化疗时程的长短等均是tnm分期无法解决的问题,这表明需要更多的生物标志物补充tnm系统,进一步推动肠癌的精准诊疗进程。
4.随着高通量检测技术水平的突飞猛进以及文库筛选技术的成熟,人们已经认识到肿瘤生物学特征差异的根源在于基因水平的改变。因此,近年来已有多种基于分子水平的肠癌分型模式被提出,例如“colorectal cancer assigner”,“colon cancer subtype,”和“consensus molecular subtype”等。然而一方面由于这些分型的判定需要用到全基因转录组且有赖于电脑黑箱判定使得临床应用成本高,难以开发成具有临床实用性的检测试剂盒、分型对于临床预后作用的研究结果不一致、对于术后辅助化疗疗效指导作用有限的相应研究数据等原因,这些分型均未成功转化为临床应用。因此,在肠癌辅助化疗获益人群筛选领域中有效的生物标志物依旧匮乏。开发预测精准、使用简便且易于转化的辅助治疗决策模型依旧是亟待解决的难题。
5.结肠癌在组织病理学上主要分为经典型腺癌、粘液腺癌、印戒细胞癌和其他更不常见的形式(小细胞癌、鳞状细胞癌、腺鳞癌、髓样癌和未分化癌)。然而,尽管一些研究表明,与经典腺癌相比,粘液腺癌和印戒细胞癌的预后更差且对更难以从当前化疗方案中获益,这两种组织病理亚型(粘液腺癌和印戒细胞癌)的患者的治疗模式目前仍遵循与经典腺癌相同的指南标准,即仅基于病理tnm分期制定手术与术后化疗策略。因此,探索粘液腺癌和印戒细胞癌的预后及疗效预测因素对指导相应患者的个体化治疗至关重要。分泌细胞是
粘液腺癌和印戒细胞癌的粘液池的主要来源。分泌细胞是一个小的分化群体,主要包括杯状细胞和肠内分泌细胞。二者均来源于lgr5
+
多能干细胞,其分化途径由notch信号控制。生理上,为了响应管腔刺激,肠内分泌细胞可分泌多种肽类激素以传统的内分泌方式和旁分泌方式作用于远处器官和邻近细胞,而杯状细胞则主要排出由水、盐、蛋白质组成的粘蛋白颗粒。目前研究认为,成人肠道分泌细胞群的更新依赖于增殖和分化之间的微妙平衡,而这种平衡被破坏是结肠癌的特征之一。
6.目前尚不清楚结肠腺癌中存在的杯状细胞和肠内分泌细胞是否在功能上促进肿瘤进展,研究结论相互矛盾。例如,尽管一些研究报道结肠癌粘膜中杯状细胞的数量显著低于正常组织,但杯状细胞也被认为是促进肿瘤进展的关键因素,因为它们可以产生对细胞存活和化疗耐药至关重要的分泌肽(如muc2和tff3);杯状细胞的标记分子也被发现高表达于braf突变型结肠癌组织,这是一种高度侵袭性的疾病亚型。此外,肿瘤内表达癌症相关转录因子brachyury的肠内分泌细胞子集可能代表具有癌症干细胞特性(例如肿瘤侵袭性和耐药性)的细胞群。在分泌细胞和肿瘤微环境关联方面,已被大量研究证实的肠道炎症过程中分泌细胞和免疫细胞之间的机制和生化交互作用,也提示了分泌细胞在形成结肠癌肿瘤微环境异质性中的潜在作用。因此,更全面地了解分泌细胞和免疫细胞之间的相互作用将有助于加深我们对癌症免疫的理解。目前尚无基于肠癌组织中粘液细胞的富集状态开发结肠癌预后预测及辅助化疗决策模型的相关研究报道和专利。
技术实现要素:
7.本发明第一个目的是提供一种基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的生物标志物,以解决上述技术问题,该标志物可通过量化结肠癌患者的肿瘤组织分泌细胞的富集模式,有效识别预后差且无法从辅助化疗获益的一类特定分泌细胞富集模式的肠癌患者群体,鉴别的准确率在不同数据集中分别为96%(合并geo结肠癌数据库)、96%(tcga结肠癌数据库)。
8.本发明第二个目的是提供一种基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的试剂盒,对于临床检测结肠癌预后及辅助化疗获益效果具有重要意义。
9.本发明第三个目的是提供一种基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的评分模型,利于预测非转移性肠癌患者的预后以及指导非转移性肠癌的个体化辅助化疗。
10.本发明第四个目的是提供一种基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的评分模型的构建方法,通过该方法筛选出7个特征基因并构建评分模型,为预测结肠癌预后及辅助化疗获益奠定基础。
11.本发明第五个目的是提供评分模型在设计预测结肠癌预后及辅助化疗获益系统或者装置中应用,通过构建的评分模型结合系统或装置辅助预测结肠癌预后及辅助化疗获益的效果。
12.为实现上述目的,本发明提供了如下方案:
13.本发明提供一种基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的生物标志物,所述生物标志物包括基因ascl2,fam84,fam13c,prkd1,akap12,a2m以及fstl1。
14.本发明还提供一种基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的试剂
盒,包括检测所述的生物标志物中的7个基因转录表达水平的试剂。
15.所述试剂盒包括核酸提取试剂、pcr试剂、基因组/转录组测序试剂、基因特异性引物或探针、基因表达产物的特异性抗体中的一种或多种。所述试剂盒还包括样品处理剂、如样品裂解试剂、样品纯化试剂及核酸提取试剂等。所述试剂是本领域已知的任何可用于检测基因表达水平的试剂在具体的实施方案中,所述试剂是用于执行以下一种或多种方法的试剂:通过测序技术、核酸杂交技术、核酸扩增技术等检测基因的转录表达水平。
16.转录组测序可通过二代测序平台快速全面地获得某一物种特定细胞或组织在某一状态下的几乎所有的转录本及基因序列,可以用于研究基因表达量、基因功能、结构、可变剪接和新转录本预测等。此外,通过设计合适的引物,可以通过pcr如逆转录pcr测定基因的转录表达水平。还可以使用基因蛋白特异性抗体,通过免疫测定例如免疫组化、elisa等方法测定各基因的蛋白表达水平。
17.本发明还提供检测所述的生物标志物的试剂在制备预测结肠癌预后和辅助化疗获益的试剂盒中的应用。
18.本发明还提供一种基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的评分模型,所述评分模型以所述的生物标志物表达水平作为输入变量,用以评估预测结肠癌预后及辅助化疗获益;其中,所述评分模型使用如下公式计算结肠癌预后及辅助化疗获益评分:scs score=fam13c+prkd1+akap12+a2m+fstl1-ascl2-fam74a。
19.本发明还提供一种基于分泌细胞富集特征的结肠癌预后及辅助化疗获益的评分模型的构建方法,包括以下步骤:
20.(1)采用共识聚类分析确定非转移性结肠癌患者肿瘤组织中分泌细胞的富集模式;
21.(2)基于步骤(1)所述富集模型的分析结果,通过boruta算法、lasso-cox回归分析筛选具有预后指示价值的特征基因,构建基于分泌细胞富集模式的评分模型;
22.所述特征基因包括基因ascl2,fam84,fam13c,prkd1,akap12,a2m以及fstl1。
23.优选的是,所述分泌细胞包括肠内分泌细胞、1型杯状细胞和2型杯状细胞。
24.优选的是,所述非转移性结肠癌患者肿瘤组织中分泌细胞的富集模式具体为:所述分泌细胞将所述非转移性结肠癌患者分为分泌细胞亚型1、分泌细胞亚型2、分泌细胞亚型3和分泌细胞亚型4;其中,分泌细胞亚型1患者表现为肠内分泌细胞与2型杯状细胞的中度富集,分泌细胞亚型2表现为肠内分泌细胞与2型杯状细胞的高度富集,分泌细胞亚型3表现为肠内分泌细胞与2型杯状细胞的缺失,分泌细胞亚型4表现为1型杯状细胞的高度富集。
25.优选的是,所述评分模型的公式为:
26.scs score=fam13c+prkd1+akap12+a2m+fstl1-ascl2-fam74a。
27.本发明还提供所述的评分模型在设计预测结肠癌预后及辅助化疗获益系统或者装置中的应用。
28.优选的是,所述评分模型通过如下判断标准预测结肠癌预后及辅助化疗获益:当所述评分模型的公式得到的结果>cut-off时,判定为预后高风险人群,对化疗存在抵抗,不推荐单独使用辅助化疗;当所述评分模型的公式得到结果≤cut-off时,判定为预后低风险人群,可从辅助化疗中获益;所述cut-off值是指将评分结果由大到小排位后前1/3与后2/3的交界值。
29.本发明公开了以下技术效果:
30.本发明基于共识聚类分析量化非转移性肠癌患者肿瘤组织分泌细胞的富集模式,有效识别预后差及无法从辅助化疗获益的一类特定组蛋白修饰模式的肠癌患者群体;结合boruta算法、lasso-cox回归分析筛选出仅有7个基因组成的评分模型,该评分模型实现了鉴别的准确率在不同数据集中分别为96%(合并geo结肠癌数据库)、96%(tcga结肠癌数据库)。
31.本发明构建的评分模型可预测非转移性肠癌患者的预后(包括复发风险和死亡风险),是患者预后预测的独立风险因素;还可以有效的鉴别存在化疗抵抗的患者,指导术后辅助化疗的决策,具有临床转化意义。
32.本发明构建的评分模型鉴别可从以氟尿嘧啶为基础的辅助化疗中获益的非转移性肠癌患者,指导非转移性肠癌的个体化辅助化疗。
附图说明
33.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
34.图1为结肠癌组织中三种分泌细胞含量之间的相关性;a:meta-geo中分泌细胞含量相关性矩阵热图;b:tcga-coad中分泌细胞含量相关性矩阵热图;a和b中圆圈的颜色和大小代表相关性系数大小;c:分泌细胞含量与患者预后关联的森林图;
35.图2为结肠癌分泌细胞富集分型的热图;a:meta-geo队列;b:tcga-coad队列;
36.图3为结肠癌分泌细胞富集分型在meta-geo队列中与结肠癌患者rfs和os的相关性;a:在meta-geo队列中,不同分泌细胞富集分型的rfs生存曲线;b:在meta-geo队列中,不同分泌细胞富集分型的os生存曲线;c:在gse39582中未接受辅助化疗的患者队列中,不同分泌细胞富集分型的os生存曲线;d:在gse39582中接受辅助化疗的患者队列中,不同分泌细胞富集分型的os生存曲线;
37.图4为结肠癌分泌细胞富集分型在tcga-coad队列中与结肠癌患者os的相关性;a:在tcga-coad队列中,不同分泌细胞富集分型的os的生存曲线;b:在tcga-coad中未接受辅助化疗的患者队列中,不同分泌细胞富集分型的os生存曲线;c:在tcga-coad中接受辅助化疗的患者队列中,不同分泌细胞富集分型的os生存曲线;
38.图5为结肠癌分泌细胞富集分型与辅助化疗获益的森林图;
39.图6为不同结肠癌分泌细胞富集分型的基于ctrp2.0数据库的氟尿嘧啶化疗敏感性;a:meta-geo队列;b:tcga-coad队列;
40.图7为scs score模型中的组成基因在不同分泌细胞富集分型中的表达;
41.图8为meta-geo数据集中scs score得分在不同分泌细胞富集分型中的分布(a),以及meta-geo数据集中scs score得分对于scs2型患者的鉴别作用(b);
42.图9为tcga-coad数据集中scs score得分在不同分泌细胞富集分型中的分布(a),以及tcga-coad数据集中scs score得分对于scs2型患者的鉴别作用(b);
43.图10为scs score在meta-geo队列的临床应用情况;a:对rfs的作用;b:对os的指
示作用;c:辅助化疗在不同scs score组的获益;d:对氟尿嘧啶抵抗患者的鉴别作用;
44.图11为scs score在tcga-coad队列的临床应用情况;a:对os的指示作用;b:辅助化疗在不同scs score组的获益;c:对氟尿嘧啶抵抗患者的鉴别作用;
45.图12为scs score在tcga-coad队列的临床应用情况;a:与肠内分泌细胞、1型杯状细胞、2型杯状细胞含量的相关性;b:对氟尿嘧啶抵抗患者的鉴别。
具体实施方式
46.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
47.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
48.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
49.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
50.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
51.实施例1鉴定结肠癌患者肿瘤组织中分泌细胞的含量及临床相关性
52.1、结肠癌公共数据集的下载与整理
53.分别从ncbi的gene expression omnibus(geo)数据库(https://www.ncbi.nlm.nih.gov/geo/)与tcga数据库下载非转移肠癌患者的转录组数据。其中,从geo数据库下载的数据集分别包括:gse17538、gse33113、gse37892、gse38832、gse39582。这些数据集的共同特征为:
①
样品使用的检测芯片均为昂飞hg-u133 plus2.0(geo accession number gpl570);
②
每个数据集包含的i-iii期肠癌患者人数均大于50人;
③
数据集中的每个患者均有tnm分期信息。每个数据集所包含的患者临床信息将通过“geoquery”包获取。各数据集的原始表达谱数据全部利用全局归一化(robust multiarray averaging,rma)的方法进行预处理校正,并使用sva包的combat函数对批次效应进行去除合并,形成合并geo结肠癌数据库(meta-geo)数据。tcga数据库中的结肠癌转录组count数据于ucsc xena网站中“tcga colon cancer(coad)(25datasets)”条目栏下载并进行voom转化,形成tcga结肠癌数据库(tcga-coad)。geo与tcga数据集附带的临床数据分别通过“geoquery”包和ucsc xena网站下载,整理对应至样本的转录组数据后去除iv期患者的数据形成待分析数据集,其中meta-geo数据集包含988名患者样本,tcga-coad数据集包含382
名患者样本。
54.2、解析结肠癌组织中分泌细胞的富集含量并探索不同类型分泌细胞的含量与肿瘤微环境构成、生物学意义与临床相关性的联系
55.使用文献报道的分泌细胞的特征性标志物,在r软件中运用iobr包中的主成分分析(pca)算法,对meta-geo结肠癌数据集中的988名结肠癌患者和tcga-coad数据集中382名结肠癌患者肿瘤组织中分泌细胞的含量进行解析。所用的标志物来源于gao等通过单细胞测序解析成人肠粘膜组织识别的三类分泌细胞的特征基因,分别是:肠内分泌细胞、1型杯状细胞、2型杯状细胞。
56.如图1所示,通过相关性分析显示,肠内分泌细胞与2型杯状细胞的含量高度显著正相关,而1型杯状细胞的浸润独立于上述两种细胞。进一步临床相关性分析表明,肠内分泌细胞与2型杯状细胞的含量越高的患者复发风险显著增高;而在接受辅助化疗的患者群中,肠内分泌细胞与2型杯状细胞的含量与患者的死亡风险显著正相关;此外,1型杯状细胞与患者的无复发生存时间(rfs)及总生存时间(os)间未见显著关联。
57.实施例2鉴定结肠癌患者组蛋白修饰调节分子的表达状况及临床相关性
58.1、解析肠癌组织中分泌细胞分型
59.为了评估上述三种分泌细胞富集含量是否有助于对非转结肠癌患者进行分类,首先分别在实施例1的“1、结肠癌公共数据集的下载与整理”中整理好的meta-geo及tcga-coad队列中“consensuclusterplus”包基于k-means无监督聚类的方法进行分型,参数设置为:maxk=10,reps=1000,pitem=0.95,以及pfeature=1。结果显示三种分泌细胞可将患者分为稳健的4种类型,分别为:分泌细胞亚型1(scs1)、分泌细胞亚型2(scs2)、分泌细胞亚型3(scs3)和分泌细胞亚型4(scs4)。其中,scs1型患者表现为肠内分泌细胞与2型杯状细胞的中度富集,scs2表现为肠内分泌细胞与2型杯状细胞的高度富集,scs3表现为肠内分泌细胞与2型杯状细胞的缺失,而scs4型表现为1型杯状细胞的高度富集。
60.2、明确结肠癌患者分泌细胞富集分型的临床意义
61.接下来,探讨不同分泌细胞富集分型是否有临床意义。
62.在meta-geo数据库中绘制了不同分型患者的生存曲线并计算。四类分型的患者在无复发生存预后存在显著差异(log-rank比较结果:p=0.0032)。其中,以scs2型患者复发风险最高,四型患者的五年无复发生存率分别为(以scs1、scs2、scs3、scs4的顺序,下同):73.1%,64.3%,75.8%,74.9%。而在总生存期方面,不论在meta-geo队列还是在tcga-coad队列的总体患者群中,均未显示出分泌细胞富集分型与生存时间的统计学关联(见图2)。但是,在接受氟尿嘧啶为基础的辅助化疗患者亚组中,scs2亚型患者的os显著差于其他三组分型的患者。在meta-geo队列的该亚组中四型患者的五年总生存率分别为:79.1%,52.5%,82.3%,87.9%(见图3)。在tcga-coad队列的该亚组中四型患者的五年总生存率分别为:79.1%,52.5%,82.3%,87.9%(见图4)。如图5和图6所示,在化疗获益方面,通过prrophetic包运用岭回归,基于ctrp2.0数据库对meta-geo和tcga-coad队列患者的氟尿嘧啶化疗敏感性预测显示:scs2型患者对于氟尿嘧啶化疗的敏感性在所有分型中最低;其次为scs1;scs3和scs4型患者氟尿嘧啶化疗的敏感性较scs1及scs2型显著升高,差异具有统计学意义。这一结果提示,不同分泌细胞富集分型患者的化疗敏感性与肠内分泌细胞及2型杯状细胞的浸润丰度有关。生存分析结果同样显示:基于氟尿嘧啶的辅助化疗,在gse39582
及tcga-coad队列中均不仅未给scs1及scs2型患者带来获益,相反更增加了scs2型患者的死亡风险。在scs3及scs4型患者中,辅助化疗可降低患者的死亡风险。因此,鉴于scs2型患者预后最差且对氟尿嘧啶反应最差,我们认为这类患者不适宜单用辅助化疗进行治疗,开发一种可有效识别scs2型患者的工具具有重要的临床意义。
63.实施例3基于结肠癌分泌细胞富集分型的分泌细胞分型评分模型scs score建立与评估
64.1、分析不同组蛋白分型的差异基因
65.鉴于scs2型患者的特殊临床特征(预后最差且具有氟尿嘧啶化疗敏感性最低),拟开发一个评分工具以量化非转移性肠癌患者分泌细胞浸润特征并精准识别出scs2型患者。为达到这一目的,首先通过“limma”包在gse39582队列中将scs2型患者与所有非scs2型患者行差异分析,以查找在scs2型中特异表达的基因,差异基因的筛选标准为|log2fc|》1和矫正p《0.01。结合筛选标准,共获628个差异基因(608个在scs2中上调及20个下调)。
66.2、运用boruta算法对差异基因进行降维
67.随后,在r软件中应用“boruta”包,运用boruta算法在meta-geo数据集(训练集)中,再对scs2中高表达与低表达的差异基因群体进行分别降维,运算参数设置为:dotrace=2,maxruns=100,ntree=500。通过降维,将在scs2中高表达608个基因缩减为102个基因,命名为a类基因;而在scs2中低表达基因群降维后剩余12个基因,命名为b类基因。
68.3、运用lasso-cox回归分析进一步挑选具有预后指示价值的差异基因形成scs score模型
69.进一步在上述降维基因中挑选具有预后指示作用的基因。首先,通过单因素cox回归分析114个差异基因与无复发生存的联系,并识别出102个p《0.05的基因。移除1个在tcga-coad数据库中没有检测到的基因,并对剩余101个基因行lasso-cox回归筛选。这里使用“glmnet”包并以十倍交叉验证进行lasso-cox算法运算。当“partial likelihood deviance”值最小时对应的变量组合即为建模基因。最终,挑选出7个基因构建模型,分别为:ascl2,fam84,fam13c,prkd1,akap12,a2m,fstl1。由这7个基因的转录表达相加减获得最终得分,具体预测公式为:scs score=fam13c+prkd1+akap12+a2m+fstl1-ascl2-fam74a。
70.4、评估scs score模型对于scs2型患者鉴别的准确度
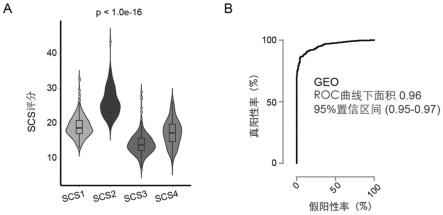
71.使用roc曲线分析判断模型对scs2型患者鉴别的准确性,发现在meta-geo队列中,scs score评分对scs2型患者的鉴别auc为0.96(0.95-0.97)。接着,以tcga-coad数据集作为验证集,通过roc分型在验证集中进一步明确模型对scs2型患者鉴别的准确性,auc为0.96(0.94-0.98)。
72.结果如图7-图9所示,图7为scs score模型包含的7个基因在meta-geo数据库不同分泌细胞富集分型患者中转录表达情况的热图。其中,fam13c,prkd1,akap12,a2m,fstl1基因在scs2型患者中的表达较其他分型患者明显升高。而ascl2,fam84a则在scs2型患者呈现低表达。图8a为meta-geo队列中患者scs score得分情况在不同分泌细胞富集分型中的分布的小提琴图;可以看到在scs2型患者中分布最高,其次是scs1型患者,而在scs3型中最低。同时,从图8b中可以看出meta-geo数据集中scs score得分对于scs2型患者的鉴别作用,roc曲线下面积为0.96,95%置信区间为0.95-0.97,说明鉴别的准确性比较高。图9a为
tcga-coad队列中患者scs score得分情况在不同分泌细胞富集分型中的分布的小提琴图;可以看到在scs2型患者中分布最高,其次是scs1型患者,而在scs3型中最低。图9b中可以看出tcga-coad数据集中scs score得分对于scs2型患者的鉴别作用,roc曲线下面积为0.96,95%置信区间为0.94-0.98,说明鉴别的准确性比较高。
73.实施例4运用分泌细胞富集模型scs score在meta-geo队列中对结肠癌患者预后、辅助化疗获益及氟尿嘧啶敏感性进行预测
74.首先,在meta-geo队列中探索scs score的使用效果,发现scs score与geo数据集肠癌患者的无复发生存显著相关。高scs score评分的患者复发风险显著高于低scs score评分患者(hr=1.75,95%ci=1.36-22.6),且scs score是无复发风险的独立预测因素(见图10a)。而在总生存期方面,如图10b森林图显示scs score对于总生存期的指示作用取决于患者接受辅助化疗与否,仅有在接受辅助化疗的患者中高scs score得分显著预示不良预后(hr=1.82,95%ci=1.09-3.07),提示scs score与辅助化疗存在交互作用,具有指示辅助化疗获益的作用。进一步我们探索了辅助化疗在不同scs score评分组对患者生存的影响,如图10c所示结果发现:高scs score的结肠癌患者中辅助化疗的实施增加了患者的死亡风险(hr=1.16,95%ci=0.68-2.00),而在低scs score的结肠癌患者中辅助化疗的实施带来了生存获益(hr=0.58,95%ci=0.38-0.91),提示scs score可预测辅助化疗获益,指导辅助化疗实施的决策。最后,我们使用通过prrophetic包运用岭回归基于ctrp2.0数据库对meta-geo队列患者的氟尿嘧啶(非转移性结肠癌患者辅助化疗的基础用药)化疗敏感性预测显示氟尿嘧啶不反应的患者scs score得分显著升高,运用scs score可有效鉴别氟尿嘧啶不反应患者,准确率为85.7%(见图10d)。
75.实施例5运用分泌细胞富集模型scs score在tcga-coad队列中对结肠癌患者预后、辅助化疗获益及氟尿嘧啶敏感性进行预测
76.为了进一步明确scs score的使用效果,在tcga-coad数据库行进一步探索,同样发现在tcga-coad数据集中,scs score对于总生存期的指示作用同样与辅助化疗存在交互,在接受了辅助化疗的患者中高scs score得分显著预示不良预后(hr=7.27,95%ci=1.90-27.40)(见图11a)。进一步探索了辅助化疗在不同scs score评分组对患者生存的影响发现,高scs score的结肠癌患者中辅助化疗的实施同样增加了患者的死亡风险(hr=1.26,95%ci=0.54-2.95),提示scs score在tcga-coad数据集中也可预测辅助化疗获益,指导辅助化疗实施的决策(见图11b)。最后,使用通过prrophetic包运用岭回归基于ctrp2.0数据库对tcga-coad队列患者的氟尿嘧啶化疗敏感性预测,结果显示氟尿嘧啶不反应的患者scs score得分显著升高,运用scs score可有效鉴别氟尿嘧啶不反应患者,准确率为81.3%(见图11c)。
77.实施例6scs score在中山大学肿瘤医院数据集中对结肠癌患者肿瘤组织中分泌细胞富集以及氟尿嘧啶敏感性的指示作用
78.为了进一步确认scs score的临床价值,申请人在中山大学肿瘤医院数据集中验证scs score对患者肠内分泌细胞、1型杯状细胞、2型杯状细胞含量及氟尿嘧啶敏感性的预测作用。在分泌细胞含量相关性方面,scs score与肠内分泌细胞、1型杯状细胞、2型杯状细胞含量呈显著正相关,而与1型杯状细胞含量无明显关系(见图12a)。申请人使用通过prrophetic包运用岭回归基于ctrp2.0数据库对中山大学肿瘤医院数据集患者的氟尿嘧啶
化疗敏感性预测显示氟尿嘧啶不反应的患者scs score得分显著升高,运用scs score可有效鉴别氟尿嘧啶不反应患者,roc分析显示鉴别的auc值为0.84(见图12b)。以上数据表明:scs score在识别肠内分泌细胞与2型杯状细胞高度富集的患者类型及氟尿嘧啶抵抗的非转移性结肠癌患者方面的作用,具有良好的可重复性和稳健性。
79.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1