6-溴代环淫羊藿素色满3,4-二酮类衍生物的合成及其抗肿瘤应用
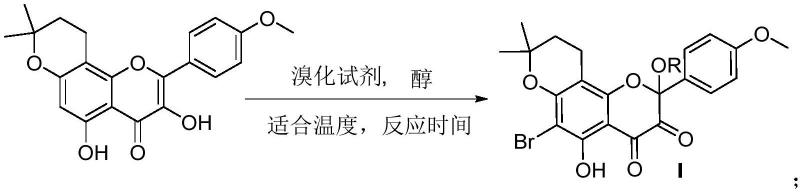
1.本发明属于新药设计与合成领域,具体涉及一类6-溴代环淫羊藿素色满3,4-二酮类衍生物的合成及其抗肿瘤应用。
背景技术:
2.淫羊藿苷是黄酮类化合物之一,具有多种药理和生物学活性,如神经保护作用、促进成骨分化、抑制破骨细胞分化以及抗肿瘤活性。
[0003][0004]
卤化是经典的有机化学反应,卤素基团作为良好的药效基团,能有效改变药物分子的亲油性,还能增加药物活性。基于上述原因,申请人设计:利用溴化反应在淫羊藿素的c-6位引入卤素基团,以提高淫羊藿素的亲脂性。据此,合成制备得到了一系列新型6-溴代淫羊藿素色满3,4-二酮类衍生物。
技术实现要素:
[0005]
本发明针对现有技术的不足,研究并设计一系列新型6-溴代淫羊藿素色满3,4-二酮类衍生物,活性研究表明该类新衍生物对肝癌和乳腺癌有较好的抑制作用。
[0006]
本发明的目的之一是提供6-溴代环淫羊藿素色满3,4-二酮类衍生物,其结构式如式i所示,
[0007][0008]
其中r选自饱和烷基或取代的烷基。
[0009]
优选地,6-溴代环淫羊藿素色满3,4-二酮类衍生物i,r选自c1-c5的饱和烷基或苄基。
[0010]
另一方面,本发明提供了如上所述的6-溴代环淫羊藿素色满3,4-二酮类衍生物i的合成方法,合成路线为:
[0011][0012]
具体为:以环淫羊藿素为原料,与溴化试剂在适当的醇试剂下在适当条件下反应得到6-溴代环淫羊藿素色满3,4-二酮类衍生物i。
[0013]
如上所述的6-溴代环淫羊藿素色满3,4-二酮类衍生物i的合成方法,其中,溴化试剂选自n-溴代丁二酰亚胺(简称nbs)、液溴(简称br2)、氢溴酸(hbr),nabr/h2o2、nbs/aibn或α,β-二溴肉桂酸;优选为nbs。
[0014]
如上所述的i的合成方法,其中,适合的醇选自饱和烷基醇或取代的烷基醇;优选为,c1-c5的饱和烷基醇或苄基醇。
[0015]
如上所述的i的合成方法,其中,适当条件包括反应时间为1~48小时,反应温度为0℃至所用醇试剂的回流温度;优选地,反应时间为2~6小时,反应温度为0℃至室温。
[0016]
如上所述的i的合成方法,其中,适当条件还包括反应中环淫羊藿素:溴化试剂的投摩尔比为1:1~1:8,环淫羊藿素:醇试剂的投摩尔比为1:1~1:100。
[0017]
进一步的,本发明还提供了6-溴代环淫羊藿素色满3,4-二酮类衍生物在制备抗肿瘤药物中的用途。优选的,具体是在制备人肝癌和人乳腺癌两种抗肿瘤药物中的用途。
[0018]
本发明的有益效果:合成方法中采用的原料、试剂以及溶剂价廉易得;合成方法条件温和,易于实施操作。本发明合成得到的6-溴代淫羊藿素色满3,4-二酮类衍生物对hepg2和mcf-7肿瘤细胞具有较好的抑制作用。
具体实施方式
[0019]
下面通过具体实施方式进一步详细说明:
[0020]
下述实施例中,除非另有说明,所述的试验方法通常按照常规条件或制造厂商建议的条件实施;所示的原料、试剂均可通过市售购买的方式获得。
[0021]
实施例1化合物ia-j的制备
[0022]
(1)6-溴代淫羊藿素色满3,4-二酮类化合物(ia)的制备
[0023][0024]
在氮气氛围下,往圆底烧瓶中加入环淫羊藿素(50mg,0.135mmol)和甲醇(2ml)。然后将混合物冷却至0℃,并分批加入nbs(48mg,2eq.)。然后将反应混合物加热到室温并搅拌4小时。通过tlc检测,当原料消失后,将反应溶剂减压浓缩。剩余物加入ch2cl2(10ml)和水(2ml)以稀释混合物。有机相萃取分离,硫酸镁干燥。使用石油醚:乙酸乙酯=6:1洗脱机通过色谱柱纯化残留物,得到标题化合物ia,收率65%,浅黄色固体。m.p.149.5-150.2℃,rf=0.34(石油醚:乙酸乙酯=2:1).1h nmr(400mhz,cdcl3)δ=11.30(s,1h),7.67(dd,j=
18.7,8.7hz,2h),6.98(dd,j=14.6,8.8hz,2h),4.71(d,j=49.1hz,1h),3.84(dd,j=4.3,1.4hz,3h),3.06(s,1h),3.01(s,3h),2.89
–
2.77(m,1h),2.71
–
2.63(m,1h),1.87(q,j=6.9hz,2h),1.42(s,6h)。
13
c nmr(100mhz,cdcl3)δ:192.33,160.39,160.10,157.44,154.08,129.97,129.76,125.16,113.80,113.31,106.12,102.97,99.77,92.87,55.26,50.51,50.11,31.59,27.27,26.36,16.41。hrms-esi(m/z):分子式为c
22h21
bro7na,[m+na]
+
:计算值499.0363,测得值499.0362.
[0025]
(2)化合物ib的制备
[0026][0027]
参照以上合成方法,采用乙醇作为反应试剂和溶剂,得到化合物ib,收率67%,浅黄色固体。m.p.153.5-154℃,rf=0.45(石油醚:乙酸乙酯=2:1),1h nmr(400mhz,cdcl3)δ=11.31(s,1h),7.68(dd,j=18.4,8.8hz,2h),7.02
–
6.90(m,2h),3.84(d,j=5.2hz,3h),3.43
–
3.32(m,1h),3.24
–
3.10(m,1h),3.01(s,1h),2.81(ddt,j=16.8,8.2,6.4hz,1h),2.63(dq,j=17.4,6.1hz,1h),1.87(dt,j=13.3,6.5hz,1h),1.46
–
1.34(m,6h),0.97(dt,j=11.6,7.1hz,3h)。
13
c nmr(100mhz,cdcl3)δ=191.47,160.77,160.14,157.58,154.25,129.82,124.71,113.70,106.37,102.93,99.64,91.93,89.76,59.72,55.34,31.56,27.24,26.31,16.46,14.98。hrms-esi(m/z):分子式为c
23h23
bro7na,[m+na]
+
:计算值513.0519,测得值513.0519.
[0028]
(3)化合物ic的制备
[0029][0030]
参照以上合成方法,采用丙醇作为反应试剂和溶剂,得到化合物ic,收率61%,浅黄色固体,m.p.163-164℃,rf=0.5(石油醚:乙酸乙酯=2:1).1h nmr(400mhz,cdcl3)δ11.31(s,1h),7.69(d,j=8.7hz,2h),6.98(d,j=8.6hz,2h),3.84(s,3h),3.31(dt,j=9.3,6.6hz,1h),3.06(dt,j=9.3,6.8hz,1h),2.78(q,j=3.6,2.9hz,1h),2.70
–
2.61(m,1h),1.89
–
1.79(m,2h),1.41(d,j=2.5hz,6h),1.36(qd,j=6.8,2.0hz,2h),0.63(t,j=7.4hz,3h)。
13
c nmr(100mhz,cdcl3)δ191.48,160.77,160.12,157.57,154.25,129.89,124.57,113.69,106.14,103.00,99.65,91.90,89.80,65.56,55.34,31.57,27.18,26.33,22.55,16.50,10.45。hrms-esi(m/z):分子式为c
24h25
bro7k[m+k]
+
:计算值543.0415,测得值543.0821.
[0031]
(4)化合物id的制备
[0032][0033]
参照以上合成方法,采用异丙醇作为反应试剂和溶剂,得到化合物id,收率54%,浅黄色固体,m.p.186.5-188℃,rf=0.34(石油醚:乙酸乙酯=2:1).1h nmr(400mhz,cdcl3)δ=11.28(s,1h),7.79(d,j=8.8hz,2h),6.98(d,j=8.9hz,2h),3.85(s,3h),3.82(d,j=4.6hz,1h),2.87
–
2.80(m,1h),2.72
–
2.65(m,1h),1.90
–
1.85(m,1h),1.81(d,j=7.3hz,1h),1.41(d,j=11.8hz,6h),1.02(d,j=6.2hz,3h),0.75(d,j=6.2hz,3h).
13
c nmr(100mhz,cdcl3)δ=160.91,160.29,157.67,154.86,130.40,125.46,106.83,102.84,99.54,91.84,90.01,26.97,26.76,23.86,22.94,16.99.hrms-esi(m/z):分子式为c
24h25
bro7na,[m+na]
+
:计算值527.0676,测得值527.0675.
[0034]
(5)化合物ie的制备
[0035][0036]
参照以上合成方法,采用正丁基醇作为反应试剂和溶剂,得到化合物ie,收率60%,浅黄色固体,m.p.158.5-160℃,rf=0.36(石油醚:乙酸乙酯=2:1).1h nmr(400mhz,cdcl3)δ11.31(s,1h),7.70(d,j=8.5hz,2h),6.99(d,j=8.5hz,2h),3.84(d,j=8.6hz,3h),3.34(dd,j=9.5,6.6hz,1h),3.16
–
3.10(m,1h),2.84
–
2.77(m,1h),2.68
–
2.63(m,1h),1.86(q,j=6.8,6.4hz,1h),1.83
–
1.77(m,1h),1.41(s,6h),1.35
–
1.29(m,2h),1.12
–
1.03(m,2h),0.70(t,j=7.4hz,3h)。
13
c nmr(100mhz,cdcl3)δ191.45,160.79,160.12,157.57,154.23,129.87,128.91,124.54,113.98,113.71,106.16,102.96,99.63,91.90,89.79,63.61,55.34,31.59,31.27,27.13,26.37,19.02,16.51,13.60。hrms-esi(m/z):分子式为c
25h27
bro7na,[m+na]
+
:计算值541.0832,测得值541.0832。
[0037]
(6)化合物if的制备
[0038][0039]
参照以上合成方法,采用正戊醇作为反应试剂和溶剂,得到化合物if,收率50%,浅黄色固体,m.p.121-123℃,rf=0.48(石油醚:乙酸乙酯=2:1),1h nmr(400mhz,cdcl3)δ11.31(s,1h),7.68(d,j=8.8hz,2h),6.98(d,j=8.9hz,2h),3.84(s,3h),3.33(dd,j=
9.5,6.4hz,1h),3.11(dt,j=9.4,6.8hz,1h),2.83
–
2.76(m,1h),2.69
–
2.62(m,1h),1.90
–
1.77(m,2h),1.41(s,6h),1.37
–
1.31(m,2h),1.07(ddd,j=13.0,7.9,5.0hz,2h),1.03
–
0.96(m,2h),0.71(t,j=7.1hz,3h).
13
c nmr(100mhz,cdcl3)δ=191.65,160.70,160.09,157.55,154.25,129.89,124.57,113.64,106.17,103.03,99.70,91.88,89.88,78.07,63.78,55.32,31.58,28.89,28.02,27.12,26.42,22.15,16.51,13.94.hrms-esi(m/z):分子式为c
26h29
bro7na,[m+na]
+
:计算值555.0989,测得值555.0988。
[0040]
(7)化合物ig的制备
[0041][0042]
参照以上合成方法,采用3-甲基-1-丁醇作为反应试剂和溶剂,得到化合物ig,收率55%,浅黄色固体,m.p.108-110℃,rf=0.56(石油醚:乙酸乙酯=2:1).1h nmr(400mhz,cdcl3)δ11.30(s,1h),7.68(d,j=8.5hz,2h),6.98(d,j=8.6hz,2h),3.84(s,3h),3.37
–
3.30(m,1h),3.20
–
3.13(m,1h),2.86
–
2.77(m,2h),2.69
–
2.61(m,1h),1.90
–
1.84(m,1h),1.83
–
1.76(m,1h),1.40(s,6h),1.22(d,j=7.4hz,2h),0.69(d,j=6.6hz,3h),0.61(d,j=6.6hz,3h).
13
c nmr(100mhz,cdcl3)δ191.52,160.76,160.11,157.56,154.22,129.86,124.54,113.70,106.18,102.95,99.63,91.90,89.81,62.19,55.34,38.00,31.59,27.05,26.89,26.44,24.68,22.49,22.04,16.53.hrms-esi(m/z):分子式为c
26h29
bro7na,[m+na]
+
:计算值555.0989,测得值555.0988.
[0043]
(3)化合物ih的制备
[0044][0045]
参照以上合成方法,采用苄醇作为反应试剂和溶剂,得到化合物ih,收率35%,浅黄色固体,m.p.98-100℃,rf=0.38(石油醚:乙酸乙酯=2:1).1h nmr(400mhz,cdcl3)δ=11.32(s,1h),7.78(d,j=8.9hz,2h),7.17(dd,j=4.9,1.8hz,3h),7.02(d,j=8.9hz,2h),6.97(q,j=2.9,2.3hz,2h),4.46(d,j=12.1hz,1h),4.24(d,j=12.2hz,1h),3.86(d,j=5.3hz,3h),2.73(ddd,j=14.9,8.6,6.3hz,2h),2.53
–
2.46(m,1h),1.83
–
1.77(m,1h),1.36(d,j=3.5hz,6h).
13
c nmr(100mhz,cdcl3)δ:160.35,157.75,128.37,127.72,114.03,103.21,31.61,29.84,16.53.hrms-esi(m/z):分子式为c
28h25
bro7na,[m+na]
+
:计算值575.0676,测得值575.0675.
[0046]
实施例2 6-溴代环淫羊藿素色满3,4-二酮类化合物的抗肿瘤活性测试
[0047]
细胞株和溶剂采用:人肝癌细胞hepg2;人乳腺癌细胞mcf-7;肿瘤细胞培养于含
10%胎牛血清的dmem培养基中;溶剂为二甲亚砜(简称dmso)。
[0048]
cck-8染色法检测细胞抗肿瘤活性实施方案:取对数生长期细胞进行实验。细胞经消化、计数、制成细胞悬液,接种于96孔板中(100μl/孔),置于37℃,5%co2培养箱中培养24小时;每孔加入含相应浓度的受试物,同时设立阴性对照组及空白组,每5复孔;将板置于培养箱中培养72小时后,显微镜下观察各组细胞形态,每孔加入10μl cck-8溶液,在细胞培养箱内继续孵育4小时,450nm下测定吸光值,计算细胞的抑制率。设定浓度梯度,得出ic 50
值(μm),实验结果详见表1。
[0049]
表1 6-溴代环淫羊藿素色满3,4-二酮ia-h对肿瘤细胞的抑制率和ic
50
值(μm)
[0050][0051]
从表1的实验结果看出,本发明设计并合成的如i式所示的6-溴代环淫羊藿素色满3,4-二酮对人肝癌和人乳腺癌都具有很好的抗肿瘤效果。该类化合物新型衍生物可用于制备抗肿瘤药物,尤其是用于肝癌和乳腺癌药物的制备中。
[0052]
以上所述的仅是本发明的实施例,方案中公知的具体结构及特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明结构的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1