检测PML-RARα融合基因的荧光原位杂交探针组及其制备方法和应用与流程
检测pml-rar
α
融合基因的荧光原位杂交探针组及其制备方法和应用
技术领域
1.本发明属于基因检测技术领域,具体涉及一种检测pml-rarα融合基因的荧光原位杂交探针组及其制备方法和应用。
背景技术:
2.急性早幼粒细胞白血病(apl)是急性髓细胞白血病(aml)的一种特殊类型(m3),apl具有独特的临床表型及细胞形态学、细胞遗传学和分子生物学特征。约95%的apl患者具有特异性染色体易位t(15;17)(q22;q12),形成pml-rarα融合基因,其蛋白产物导致细胞分化阻滞和凋亡不足,是apl的主要发病机制。apl易见于中青年人,平均发病年龄44岁,apl占同期aml的10%~15%,发病率约为0.23/10万。apl临床表现凶险,起病及诱导治疗过程中容易发生出血和栓塞而引起死亡。近三十年来,由于全反式维甲酸(atra)及砷剂的规范化应用,apl已成为基本不用进行造血干细胞移植即可治愈的白血病。
3.荧光原位杂交技术(fluorescence in situ hybridization,简称fish)可以用于评估pml-rarα融合基因的融合状态。传统的商业化fish探针主要使用bac(bacterial artificial chromosome)克隆作为探针经过荧光分子标记后进行杂交检测。然而,bac克隆制备的探针存在一些非重复序列,探针特异性不高,需要使用cot1-dna进行非封闭性封闭,且探针片段普遍偏大,长度在200~500bp之间,杂交效率偏低,杂交时间长。
技术实现要素:
4.为了解决上述问题,本发明提供了一种检测pml-rarα融合基因的荧光原位杂交探针组,该探针组由说明书表1中所示的1054个核苷酸序列制备得到。使用该探针组检测pml-rarα融合基因的融合状态时敏感性高、特异性强且杂交背景干净,信噪比低。
5.本发明制备上述探针组的方法包括以下步骤:
6.s1、以pml和rarα的核苷酸序列为依据,筛选得到说明书表1中所示的1054个核苷酸序列;
7.s2、在每个核苷酸序列的5'端添加序列为taatacgactcactataggg的标签,在3'端添加序列为ccgctgagcaataactagca的标签,得到一系列带标签的特征性引物;
8.s3、合成所述特征性引物并设计其pcr扩增引物对;
9.s4、以所述特征性引物为模板进行pcr扩增,对扩增产物进行纯化得到所述探针组。
10.在一些可选的实施方式中,步骤s1包括以下步骤:以pml和rarα的核苷酸序列为依据,在不含重复序列的区域分别设计含45个核苷酸序列,设定探针tm为50℃,g-c含量范围为40~60%,舍弃包含aaaa/tttt/cccc/gggg的序列后,得到1609条候选探针,再经过blast比对分析后,得到如说明书表1所示的1054个核苷酸序列。
11.在一些可选的实施方式中,步骤s3中所述pcr扩增引物对的正向引物的核苷酸序
列为taatacgactcactatagg,反向引物的序列为tgctagttattgctcagcgg。
12.在一些可选的实施方式中,步骤s3中pcr扩增的反应体系如下:10
×
buffer5μl、正反引物各(10μm)2μl、带标签的模板1μl、10mm datp 1μl、10mm dctp 1μl、10mm dgtp 1μl、10mm dttp 0.75μl、1mm荧光染料标记的dutp2.5μl、taq dna polymerase 0.5μl、ddh2o 35.25μl;pcr扩增的程序为:94℃5min、55℃5min;72℃2min、94℃1min、55℃1min,30个循环;72℃5min、4℃保温。
13.在一些可选的实施方式中,所述荧光染料为alexafluor系列荧光染料,优选alexafluor555或alexafluor 488。
14.本发明还提供了一种用于检测pml-rarα融合基因的试剂盒,该试剂盒包含上述探针组。
15.在一些可选的实施方案中,试剂盒还包含如下杂交缓冲液:20ng/μlpml基因探针,20ng/μlrarα基因探针,45v/v%去离子甲酰胺,10v/v%葡聚糖,0.2mol/l柠檬酸钠缓冲液,50mmol/l ph=8.0~8.8的tris-hcl缓冲液。
16.本发明的有益效果是:本发明直接在pml和rarα基因的目标区域,构建与目标区域完全互补的长度为45bp的单链dna片段作为候选探针,然后将每一个核苷酸序列进行批量blast比对,保证杂交的每一条探针序列的高特异性;同时精确控制目标区域的靶向,突破探针尺寸限制,提高探针的分辨率;在制备的过程中,采用pcr掺入法,保证产物中含有更多的荧光基团。采用本发明的探针组检测pml-rarα融合基因的融合状态,成本较低,且在30分钟左右即可完成骨髓样本的fish杂交,敏感性高,特异性强且杂交背景干净、信噪比低。
附图说明
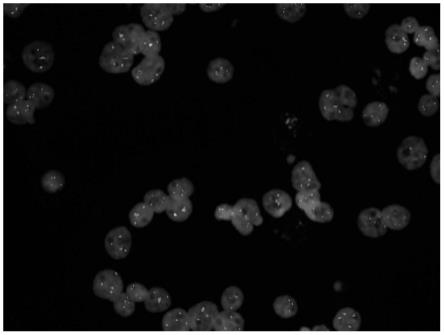
17.图1为本发明中骨髓样本pml-rarα融合基因荧光原位杂交后在显微镜下的照片。
具体实施方式
18.以下结合具体实施例对本发明的技术方案进行清楚、完整的描述,以使本领域技术人员更加清楚地理解本发明。显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施例,都属于本发明所保护的范围。本领域技术人员依据以下实施方式所作的任何等效变换或替代,均属于本发明的保护范围之内。
19.以下实施例中所使用的试剂盒、试剂、培养基等的来源或主要成分如下:
20.人外周血淋巴细胞培养基:购买自以色列biological industries(bioind)公司;
21.固定液:甲醇与乙酸按体积比3:1混合。
22.洗涤液i:含0.6mol/l氯化钠和50mmol/ltris-hcl缓冲液。
23.洗涤液ii:含0.6m氯化钠、50mm tris-hcl和0.3%np-40。
24.荧光原位杂交样品处理试剂盒细胞核染色液:购自thermo fisher scientific公司。
25.胃蛋白酶工作溶液:0.2wt%胃蛋白酶溶液。
26.实施例1
27.本实施例提供了一种检测pml-rarα融合基因的荧光原位杂交探针组的制备方法,
包括以下步骤:
28.s1、以pml和rarα的核苷酸序列为依据,在不含重复序列的100kb区域分别设计含45个核苷酸序列,设定探针tm为50℃,g-c含量范围为40~60%,舍弃包含aaaa/tttt/cccc/gggg的序列后,得到1609条候选探针,再经过全基因(hg38)blast比对分析后,得到如表1所示的1054个核苷酸序列;
29.表1 1054个核苷酸序列
30.31.32.33.34.35.36.37.38.39.40.41.42.[0043][0044]
s2、分别在步骤s1中得到的每个核苷酸序列的5'端添加序列为taatacgactcactataggg的标签,在3'端添加序列为ccgctgagcaataactagca的标签,得到一系列带标签的特征性引物;
[0045]
s3、采用高通量芯片合成技术,按照半导体芯片制备步骤s2中的特征性引物并设计其pcr扩增引物,pcr扩增的正向引物的序列为:taatacgactcactatagg,反向引物的序列为tgctagttattgctcagcgg;
[0046]
s4、将特征性引物从半导体芯片中洗脱,以洗脱后的特征性引物作为模板进行pcr扩增;pcr扩增的反应体系为:10
×
buffer5μl、正反向引物各(10μm)2μl、带标签的模板1μl、10mm datp 1μl、10mm dctp 1μl、10mm dgtp 1μl、10mm dttp 0.75μl、1mm alexafluor555标记的dutp2.5μl、taq dna polymerase 0.5μl、ddh2o 35.25μl;pcr扩增的程序为:94℃5min、55℃5min;72℃2min、94℃1min、55℃1min,30个循环;72℃5min、4℃保温;采用qiagen pcr纯化试剂盒(购自qiagen公司)对pcr扩增产物进行纯化,得到荧光原位杂交探针组。
[0047]
将制备得到的探针组按照表2中的组分和用量混合制备得到杂交缓冲液,并进一步制备成试剂盒。
[0048]
表2 10人份的杂交缓冲液的组成
[0049]
成分10人份终浓度实施例1的探针组合10μl20ng/μl(各探针)去离子甲酰胺45μl45%50%葡聚糖20μl10%20
×
柠檬酸钠缓冲液(ssc)10μl2
×
ssc(0.2m)tris-hcl(ph8.0~8.8)5μl50mm水10μl/
[0050]
探针组敏感性试验
[0051]
材料:人外周血淋巴细胞培养基、秋水仙素、低渗液(0.4%kcl)、固定液。
[0052]
按照如下方法对探针组的敏感性进行试验:
[0053]
p1、细胞培养及同步化:取0.4ml肝素抗凝全血置于人外周血淋巴细胞培养基中,混匀后于37℃、5%co2恒温培养箱内培养72h,并于终止前4h向培养基中加入秋水仙素至其终浓度为0.1μg/ml,继续培养4h;
[0054]
p2、收集和固定:收集培养基,以500g离心力离心5min后,弃上清,再加入10ml 0.4%kcl低渗液孵育30min,然后用固定液固定细胞,室温静置10min,以500g离心力离心、沉淀细胞,重复细胞固定步骤一遍,弃上清液后,根据细胞数量加入适当固定液得到细胞悬液;
[0055]
p3、制片:吸取7~10μl细胞悬液,自70~80cm高处滴在一张干燥清洁的载玻片上,吹干后,56℃烤片2h;
[0056]
p4、变性杂交:取10μl实施例1中制得的杂交缓冲液滴加到p3制备的载玻片杂交区域,立即加盖盖玻片,用橡皮胶封边,避免盖玻片与载玻片之间产生气泡;置于杂交仪内95℃共变性2min,42℃杂交30min;
[0057]
p5、杂交后洗涤:用镊子小心撕去盖玻片周围封片胶,避免粘掉或者移动盖玻片;将载玻片放入洗涤液i中浸泡1min,待盖玻片自然脱落,再将载玻片放入洗涤液ii中于52℃中浸泡5min,最后将载玻片放入37℃预热的去离子水中浸泡10s,暗处自然干燥载玻片;
[0058]
p6、dapi(4',6-二脒基-2-苯基吲哚)复染:向载玻片正中心滴加荧光原位杂交样品处理试剂盒细胞核染色液,用盖玻片封片,置于荧光显微镜下,先在低倍物镜(10
×
)下确认细胞区域;转到40
×
物镜下,找到一个细胞分布均匀的位置,再在高倍物镜(100
×
)下观察细胞核的fish结果。检测含有50个中期淋巴细胞的载玻片,结果如下表3所示:
[0059]
表3探针组敏感性试验结果
[0060][0061][0062]
从表3中可以看出,pml基因探针的fish信号点都在99个,敏感性达到99%;rarα基
因探针的fish信号点都在99个,敏感性达到99%。
[0063]
骨髓样本pml-rarα融合基因fish试验
[0064]
按照如下方法对骨髓样本pml-rarα融合基因进行fish试验:
[0065]
q1、骨髓样本前处理:将3ml骨髓样本转入15ml离心管,放入离心机以500g离心力离心3min,小心吸取上清并弃掉;加入5ml1
×
pbs缓冲液吹打混匀重悬细胞沉淀;再放入离心机以500g离心力离心3min,小心吸取上清并弃掉;重复前述重悬和离心步骤;然后向离心管中加入10ml低渗液(0.4%kcl,提前37℃温浴),于37℃水浴低渗20~30min;向完成低渗处理的细胞悬液中均匀加入1ml(10%体积)预冷的固定液,迅速轻柔吹打混匀后室温静置10分钟,以500g离心力离心3min,去除上清,留约200μl残液重悬细胞;转移细胞悬液到1.5ml离心管中,缓慢加入1ml预冷的固定液,以500g离心力离心3min,去除上清,用约300μl固定液重悬细胞沉淀;重复重悬和离心步骤至细胞发白为止;
[0066]
q2、制片:取保存于-20
±
5℃的细胞悬液,以500g离心力离心3分钟,吸取上清并弃掉,加入适量新鲜配制的固定液混匀;吸取2μl细胞悬液,使细胞悬液自然滴到载玻片上;将玻片置于电热板上于56℃保持30分钟;取出载玻片,置于1
×
pbs缓冲液中,洗涤5分钟;甩干多余水分,滴加1%多聚甲醛溶液,室温孵育10分钟后放入1
×
pbs缓冲液中,浸泡3分钟;取出载玻片,置于37℃预热的0.005%胃蛋白酶工作溶液中2~5分钟;取出载玻片,置于1
×
pbs缓冲液中,浸泡3分钟;取出载玻片,依次置于70%、85%、100%梯度乙醇中,每个浓度的乙醇中保持2分钟,室温晾干;
[0067]
q3、变性杂交:取10μl实施例1制得的杂交缓冲液滴加到步骤q2制备的载玻片杂交区域,立即加盖盖玻片,用橡皮胶封边,避免盖玻片与载玻片之间产生气泡;置于杂交仪内95℃共变性2min,45℃杂交30min;
[0068]
q4、杂交后洗涤:用镊子小心撕去盖玻片周围封片胶,避免粘掉或者移动盖玻片;将载玻片放入洗涤液i中浸泡1min,待盖玻片自然脱落,再将载玻片放入洗涤液ii于52℃中浸泡5min,最后将载玻片放入37℃预热的去离子水中浸泡10s,暗处自然干燥载玻片;
[0069]
q5、dapi复染:向载玻片正中心滴加荧光原位杂交样品处理试剂盒细胞核染色液,用盖玻片封片,置于荧光显微镜下,先在低倍物镜(10
×
)下确认细胞区域;转到40
×
物镜下,找到一个细胞分布均匀的位置,再在高倍物镜(100
×
)下观察细胞核的fish结果。观察到的结果如图1所示,从图1中可以看出,骨髓细胞中pml和rarα基因探针信号明亮清晰可见且没有杂信号点,说明本发明的探针组用于检测pml-rarα融合基因的融合状态时,具有敏感性高、特异性强、杂交背景干净、信噪比低的优势。
[0070]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明的保护范围。对于任何熟悉本领域的技术人员来说,本发明可以有各种更改和变化。任何依据本发明申请保护范围及说明书内容所作的简单的等效变化和修饰,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1