一种全细胞固定化催化转化制备熊去氧胆酸及中间产物的方法
1.本发明属于生物工程技术领域,涉及一种连续催化制备熊去氧胆酸及中间产物的方法,具体涉及一种全细胞固定化催化转化制备熊去氧胆酸及中间产物7-酮石胆酸的方法。
背景技术:
2.熊去氧胆酸是一种次级胆汁酸,为熊胆汁的主要功效成分,具有杀菌、抗炎、免疫调节、保护肝细胞、溶解胆结石等作用,与其它类型的胆酸相比,熊去氧胆酸毒副作用小,具有显著的疗效,已被广泛应用于治疗胆囊胆固醇性结石和胆汁淤积性肝病,在临床上有重要的应用价值。
3.由于熊去氧胆酸的天然来源有限,但当前其需求量巨大,导致熊去氧胆酸市场供不应求。目前,熊去氧胆酸主要由传统提取、化学合成与生物转化方式获取,化学合成虽在一定程度上缓解了熊去氧胆酸供不应求的局面,但其合成过程中涉及多种有毒和危险试剂,工艺繁琐、副反应多,不符合国家绿色发展战略。近年来,熊去氧胆酸生物合成已成为研究热点,熊去氧胆酸可由生物体肠道内细菌分泌的羟基类固醇脱氢酶催化转化合成,通过分离培养肠道细菌,将价廉易得的胆酸(ca)与鹅去氧胆酸(cdca)转化为熊去氧胆酸已取得了一定进展。其中,梭菌、瘤胃球菌等已被研究用于cdca向udca的差向异构化转变,但由于野生厌氧型菌种培养条件苛刻、酶学性能不稳定及底物水溶性差等问题,在实际的工业化生产中仍存在较大挑战。
技术实现要素:
4.针对上述现有技术所存在的问题,本发明提供一种全细胞固定化催化转化制备熊去氧胆酸及中间产物的方法,旨在通过将细胞进行固定化,并采用填充式生物反应器,实现全细胞连续催化转化,高产率的获得目标产物。
5.本发明为实现发明目的,采用如下技术方案:
6.一种全细胞固定化催化转化制备熊去氧胆酸及中间产物的方法,其特点在于:以cdca或者cdca的环糊精包合物为底物,将真菌或细菌进行固定化后,再连续催化底物转化为熊去氧胆酸udca和/或中间产物7-酮石胆酸7k-lca。具体包括如下步骤:
7.步骤1、真菌或细菌的固定化
8.在无菌条件下,将菌种种子液接种于培养基中,放于摇床培养至对数生长期,将菌种离心收集;
9.将内水相生物材料溶于无菌水中,加入离心收集的菌种(湿菌),磁力搅拌均匀,获得内水相;
10.将外水相生物材料溶于无菌水中,获得外水相;
11.将内水相匀速滴于外水相中,交联固化后(常温100r/min磁力搅拌15-60min就可
完成交联固化),用无菌水洗净,获得固定化菌种微球,放置4℃冰箱备用;
12.步骤2、搭建连续流动反应装置
13.设置立式生物反应器和料液存储罐;所述料液存储罐的出料口通过第一管道连通于所述立式生物反应器的进料口,所述立式生物反应器的出料口通过第二管道连通于所述料液存储罐的进料口;在所述第一管道上设置有蠕动泵;
14.在立式生物反应器内填充所述固定化菌种微球;
15.步骤3、催化转化
16.将cdca或者cdca的环糊精包合物溶于培养基中,形成底物溶液,然后加入到料液存储罐内;
17.通过蠕动泵将底物溶液泵入立式生物反应器内,并在立式生物反应器和料液存储罐之间循环流动;底物在固定化菌种微球的室温催化下,转化为udca和/或7k-lca;
18.步骤4、产物收集
19.一批次底物溶液循环流动至底物完全用完后,将料液存储罐内的反应液倒出,离心取上清液,即获得udca和/或7k-lca;
20.步骤5、连续处理
21.重复步骤3和步骤4,进行下一批次底物溶液的催化转化。
22.进一步地,所述真菌或细菌为大肠杆菌、单胞菌和丝状真菌中的一种或几种。
23.进一步地,步骤1中,所述内水相生物材料和所述外水相生物材料为壳聚糖cts、氯化壳聚糖chc、海藻酸钠naalg、纤维素硫酸钠nacs、透明质酸ha、氯化钙cacl2、三聚磷酸钠stpp和六偏磷酸钠shpp中的一种或几种,且所述内水相生物材料和所述外水相生物材料不同。
24.进一步地,步骤1中,所述内水相中内水相生物材料的质量浓度为2%-8%、菌种湿重与内水相生物材料的重量比为1:1-5,所述外水相中外水相生物材料的质量浓度为1%-9%,所述内水相与所述外水相的体积比为1:2~6。
25.进一步地,步骤1中,所述交联固化的时间为15min-60min。
26.进一步地,步骤2中:所述立式生物反应器的进料口位于底部、出料口位于顶部,使底物溶液在反应器内从下至上流动;或者,所述立式生物反应器的进料口位于顶部、出料口位于底部,使底物溶液在反应器内从上至下流动。
27.进一步地,步骤2中,固定化菌种微球在立式生物反应器内的填充量为10%-90%(即占反应器容积的10%-90%)。
28.进一步地,步骤3中,底物溶液中cdca的浓度为0.5-2.5mg/ml。
29.进一步地,步骤3中,底物溶液循环流动的流速为0.2-2.0ml/min。
30.进一步地,步骤1与步骤3中所述培养基为营养肉汤培养基或真菌液体发酵培养基。
31.进一步地,步骤4中,上清液经0.45μm滤膜过膜,使用hplc-elsd检测(流动相:乙腈:水(甲酸调ph=3.0)=60:40(v:v),柱温:30℃,流速:1.0ml/min),检测结果与标准品做比较,根据标准品标准曲线,计算出产物转化率。结果显示,利用大肠杆菌、单胞菌或丝状真菌,以cdca或水溶性更高的cdca/β-环糊精包合物为底物,皆成功转化出终产物熊去氧胆酸以及中间产物7-酮石胆酸。
32.与现有技术相比,本发明的有益效果体现在:
33.1、本发明将好氧型转化菌种进行固定化包埋,利用生物材料形成的半通透性膜的优异特性,使用填充生物反应器,建立连续流动反应系统,通过控制接触时间,可减少底物和产物的抑制,提高菌种的回收利用率和循环次数。本发明解决了菌种培养苛刻、酶学稳定性及底物溶解性差等问题,可以有效降低转化成本,提高udca及重要中间产物7k-lca转化率,有利于实现全细胞催化的产业化利用。
34.2、与化学合成方法相比,本发明固定化全细胞转化udca和/或7k-lca的方法,可减少化学有毒危险试剂的使用,成本低廉、反应条件温和、副产物少,利于产物与杂质的分离,符合绿色环保要求。
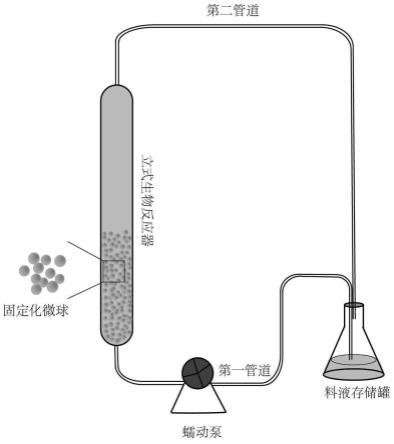
35.3、本发明采用性能良好的生物材料将菌种进行固定化,利用生物质半通透性膜的优异特性,即内部腔室与微孔结构、良好的传质与扩散性能,可提高菌种的回收利用率和循环次数,可维持良好的酶学稳定性能,有效降低生产成本。
36.4、本发明所采用的连续发酵装置可促进物质的流动与交换,使菌种保持稳定的催化转化特性,同时通过蠕动泵控制流速,从而控制底物接触时间,可减少底物与产物抑制,有利于促进水溶性包合物底物的连续转化。
附图说明
37.图1为实施例1所得固定化菌种微球的扫描电镜图,其中(a)、(b)对应不同放大倍数。
38.图2为本发明所搭建的连续流动反应装置的示意图。
39.图3为本发明填充有固定化菌种微球的立式生物反应器的实物图。
40.图4为熊去氧胆酸、7-酮石胆酸与鹅去氧胆酸三种标准品的高效液相色谱图,熊去氧胆酸出峰时间为5.425min、7-酮石胆酸出峰时间为6.886min、鹅去氧胆酸出峰时间为9.615min。
41.图5为实施例2中,以cdca/β-环糊精包合物为底物进行固定化连续化催化转化,所得转化产物的高效液相色谱图,图中显示分别在5.419min、6.886min与9.512min时间点有出峰,与标准品对比,转化产物成分有熊去氧胆酸与7-酮石胆酸及部分未反应的鹅去氧胆酸。
具体实施方式
42.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。以下内容仅仅是对本发明的构思所做的举例和说明,所属本技术领域的技术人员对所描述的具体实施案例做各种各样的修改或补充或采用类似的方式代替,只要不偏离发明的构思或者超越本权利要求书所定义的范围,均应属于本发明的保护范围。
43.下述实施例所用cdca/β-环糊精包合物的制备方法为:
44.按照cdca与β-cd的摩尔比为1:1,准确称取1.178g的cdca,溶解于无水乙醇,待用。再准确称取3.405g的β-cd溶解于水中,形成β-cd饱和水溶液。边搅拌边滴加上述配制的cdca的乙醇溶液,无水乙醇与水体积比为1∶3,45℃水浴搅拌4h。加热除去无水乙醇,0.45μm
滤头过膜,除去未包合的cdca,滤液即为cdca/β-cd包合物水溶液,冷冻后真空干燥。
45.实施例1
46.本实施例制备nacs-chc-shpp固定化菌种微球连续催化转化udca和/或7k-lca,具体步骤如下:
47.步骤1、真菌或细菌的固定化
48.在无菌条件下,将大肠杆菌种子液(od600=1.5~2.5)按2%接种量接种于营养肉汤培养基中,放于摇床培养至对数生长期,将菌种离心收集。
49.将内水相生物材料氯化壳聚糖chc溶于无菌水中,加入离心收集的菌种,磁力搅拌均匀,获得内水相;内水相中内水相生物材料的质量浓度为8%、菌种湿重与内水相生物材料的重量比为1:2。
50.将外水相生物材料纤维素硫酸钠nacs与六偏磷酸钠shpp溶于无菌水中,获得外水相;外水相中外水相生物材料的质量浓度为4%(nacs与shpp质量比为1:1)。
51.按照内水相与外水相的体积比为1:2,将内水相匀速滴于外水相中,交联固化15min后,用无菌水洗净,获得固定化菌种微球,放置4℃冰箱备用。图1为本实施例所得固定化菌种微球的扫描电镜图,其中(a)、(b)对应不同放大倍数。可以看出,微球表面光滑,内部呈壳核(腔室)结构,菌种嵌于其中。
52.步骤2、搭建连续流动反应装置
53.如图2所示,设置立式生物反应器和料液存储罐;料液存储罐的出料口通过第一管道连通于立式生物反应器的底部进料口,立式生物反应器的顶部出料口通过第二管道连通于料液存储罐的进料口;在第一管道上设置有蠕动泵。在立式生物反应器内填充固定化菌种微球,其实物图如图3所示。具体的,本实施例中,立式生物反应器呈圆柱形,尺寸为200mm/24*2,固定化菌种微球在反应器中的填充量为50%。
54.步骤3、催化转化
55.将cdca/β-环糊精包合物溶于营养肉汤培养基中,形成cdca终浓度为1.0mg/ml的底物溶液,然后加入150ml到料液存储罐内;
56.通过蠕动泵将底物溶液以流速1.0ml/min泵入立式生物反应器内,并在立式生物反应器和料液存储罐之间循环流动;底物在固定化菌种微球的室温催化下进行转化。
57.步骤4、产物收集
58.一批次底物溶液循环流动至底物完全用完后(本实施例用时4天),将料液存储罐内的反应液倒出,离心取上清液,经0.45μm滤膜过膜,使用hplc-elsd检测(流动相:乙腈:水(甲酸调ph=3.0)=60:40(v:v),柱温:30℃,流速:1.0ml/min),检测结果与标准品做比较,根据标准品标准曲线,计算出7k-lca转化率为10.52%。
59.步骤5、连续处理
60.重复步骤3和步骤4,进行下一批次底物溶液的催化转化。经检测,第二批次7k-lca转化率为9.79%,第三批次7k-lca转化率为6.41%。
61.实施例2
62.本实施例制备nacs-chc-stpp固定化菌种微球连续催化转化udca和/或7k-lca,具体步骤如下:
63.步骤1、真菌或细菌的固定化
64.在无菌条件下,将大肠杆菌与单胞菌种子液(od600=1.5~2.5)按2%接种量接种于营养肉汤培养基中,放于摇床中培养至对数生长期,将菌种离心收集。
65.将内水相生物材料氯化壳聚糖chc溶于无菌水中,加入离心收集的菌种,磁力搅拌均匀,获得内水相;内水相中内水相生物材料的质量浓度为5%、菌种湿重与内水相生物材料的重量比为1:1。
66.将外水相生物材料纤维素硫酸钠nacs与三聚磷酸钠stpp溶于无菌水中,获得外水相;外水相中外水相生物材料的质量浓度为2%(nacs与stpp质量比为1:1)。
67.按照内水相与外水相的体积比为1:4,将内水相匀速滴于外水相中,交联固化30min后,用无菌水洗净,获得固定化菌种微球,放置4℃冰箱备用。
68.步骤2、搭建连续流动反应装置。
69.如图2所示,设置立式生物反应器和料液存储罐;料液存储罐的出料口通过第一管道连通于立式生物反应器的底部进料口,立式生物反应器的顶部出料口通过第二管道连通于料液存储罐的进料口;在第一管道上设置有蠕动泵。在立式生物反应器内填充固定化菌种微球。具体的,本实施例中,立式生物反应器呈圆柱形,尺寸为200mm/24*2,固定化菌种微球在反应器中的填充量为70%。
70.步骤3、催化转化
71.将cdca/β-环糊精包合物溶于营养肉汤培养基中,形成cdca终浓度为1.5mg/ml的底物溶液,然后加入150ml到料液存储罐内;
72.通过蠕动泵将底物溶液以流速0.5ml/min泵入立式生物反应器内,并在立式生物反应器和料液存储罐之间循环流动;底物在固定化菌种微球的室温催化下进行转化。
73.步骤4、产物收集
74.一批次底物溶液循环流动至底物完全用完后(本实施例用时6天),将料液存储罐内的反应液倒出,离心取上清液,经0.45μm滤膜过膜,使用hplc-elsd检测(流动相:乙腈:水(甲酸调ph=3.0)=60:40(v:v),柱温:30℃,流速:1.0ml/min),检测结果与标准品做比较,根据标准品标准曲线,计算出udca转化率为7.32%、7k-lca转化率为13.65%。
75.步骤5、连续处理
76.重复步骤3和步骤4,进行下一批次底物溶液的催化转化。经检测,第二批次udca转化率为5.63%、7k-lca转化率为10.30%,第三批次udca转化率为4.22%、7k-lca转化率为7.71%。
77.实施例3
78.本实施例制备naalg-chc-cacl2固定化菌种微球连续催化转化udca和/或7k-lca,具体步骤如下:
79.步骤1、真菌或细菌的固定化
80.在无菌条件下,将单胞菌种子液(od600=1.5~2.5)按2%接种量接种于营养肉汤培养基中,放于摇床中培养至对数生长期,将菌种离心收集。
81.将内水相生物材料海藻酸钠naalg溶于无菌水中,加入离心收集的菌种,磁力搅拌均匀,获得内水相;内水相中内水相生物材料的质量浓度为2%、菌种湿重与内水相生物材料的重量比为1:2。
82.将外水相生物材料氯化壳聚糖chc与氯化钙cacl2溶于无菌水中,获得外水相;外
水相中chc、cacl2的质量浓度分别为3%、6%。
83.按照内水相与外水相的体积比为1:2,将内水相匀速滴于外水相中,交联固化60min后,用无菌水洗净,获得固定化菌种微球,放置4℃冰箱备用。
84.步骤2、搭建连续流动反应装置。
85.如图2所示,设置立式生物反应器和料液存储罐;料液存储罐的出料口通过第一管道连通于立式生物反应器的底部进料口,立式生物反应器的顶部出料口通过第二管道连通于料液存储罐的进料口;在第一管道上设置有蠕动泵。在立式生物反应器内填充固定化菌种微球。具体的,本实施例中,立式生物反应器呈圆柱形,尺寸为200mm/24*2,固定化菌种微球在反应器中的填充量为40%。
86.步骤3、催化转化
87.将cdca溶于营养肉汤培养基中,形成cdca终浓度为0.5mg/ml的底物溶液,然后加入150ml到料液存储罐内;
88.通过蠕动泵将底物溶液以流速0.5ml/min泵入立式生物反应器内,并在立式生物反应器和料液存储罐之间循环流动;底物在固定化菌种微球的室温催化下进行转化。
89.步骤4、产物收集
90.一批次底物溶液循环流动至底物完全用完后(本实施例用时8天),将料液存储罐内的反应液倒出,离心取上清液,经0.45μm滤膜过膜,使用hplc-elsd检测(流动相:乙腈:水(甲酸调ph=3.0)=60:40(v:v),柱温:30℃,流速:1.0ml/min),检测结果与标准品做比较,根据标准品标准曲线,计算出udca转化率为5.10%、7k-lca转化率为9.83%。
91.(5)连续处理
92.重复步骤3和步骤4,进行下一批次底物溶液的催化转化。经检测,第二批次udca转化率为4.37%、7k-lca转化率为7.30%,第三批次udca转化率为2.75%、7k-lca转化率为5.49%。
93.实施例4
94.本实施例制备naalg-cacl2固定化菌种微球连续催化转化udca和/或7k-lca,具体步骤如下:
95.步骤1、真菌或细菌的固定化
96.在无菌条件下,将大肠杆菌与单胞菌种子液(od600=1.5~2.5)各1%的接种量接种于营养肉汤培养基中,放于摇床中培养至对数生长期,将菌种离心收集。
97.将内水相生物材料海藻酸钠naalg溶于无菌水中,加入离心收集的菌种,磁力搅拌均匀,获得内水相;内水相中内水相生物材料的质量浓度为4%、菌种湿重与内水相生物材料的重量比为1:2
98.将外水相生物材料氯化钙cacl2溶于无菌水中,获得外水相;外水相中外水相生物材料的质量浓度为3%。
99.按照内水相与外水相的体积比为1:4,将内水相匀速滴于外水相中,交联固化60min后,用无菌水洗净,获得固定化菌种微球,放置4℃冰箱备用。
100.步骤2、搭建连续流动反应装置。
101.如图2所示,设置立式生物反应器和料液存储罐;料液存储罐的出料口通过第一管道连通于立式生物反应器的底部进料口,立式生物反应器的顶部出料口通过第二管道连通
于所述料液存储罐的进料口;在第一管道上设置有蠕动泵。在立式生物反应器内填充固定化菌种微球。具体的,本实施例中,立式生物反应器呈圆柱形,尺寸为200mm/24*2,固定化菌种微球在反应器中的填充量为30%。
102.步骤3、催化转化
103.将cdca/β-环糊精包合物溶于营养肉汤培养基中,形成cdca终浓度为0.8mg/ml的底物溶液,然后加入150ml到料液存储罐内;
104.通过蠕动泵将底物溶液以流速1.5ml/min泵入立式生物反应器内,并在立式生物反应器和料液存储罐之间循环流动;底物在固定化菌种微球的室温催化下进行转化。
105.步骤4、产物收集
106.一批次底物溶液循环流动至底物完全用完后(本实施例用时6天),将料液存储罐内的反应液倒出,离心取上清液,经0.45μm滤膜过膜,使用hplc-elsd检测(流动相:乙腈:水(甲酸调ph=3.0)=60:40(v:v),柱温:30℃,流速:1.0ml/min),检测结果与标准品做比较,根据标准品标准曲线,计算出udca转化率为6.30%,7k-lca转化率为11.70%。
107.(5)连续处理
108.重复步骤3和步骤4,进行下一批次底物溶液的催化转化。经检测,第二批次udca转化率为5.70%、7k-lca转化率为10.42%,第三批次udca转化率为3.78%,、7k-lca转化率为8.94%。
109.实施例5
110.本实施例制备naalg-cacl2固定化菌种微球连续催化转化udca和/或7k-lca,具体步骤如下:
111.步骤1、真菌或细菌的固定化
112.在无菌条件下,将丝状真菌接种于真菌液体发酵培养基中,放于摇床中培养5-6天左右,将菌种离心收集。
113.将内水相生物材料海藻酸钠naalg溶于无菌水中,加入离心收集的菌种,磁力搅拌均匀,获得内水相;内水相中内水相生物材料的质量浓度为6%、菌种湿重与内水相生物材料的重量比为1:4。
114.将外水相生物材料氯化钙cacl2溶于无菌水中,获得外水相;外水相中外水相生物材料的质量浓度为2%。
115.按照内水相与外水相的体积比为1:3,将内水相匀速滴于外水相中,交联固化40min后,用无菌水洗净,获得固定化菌种微球,放置4℃冰箱备用。
116.步骤2、搭建连续流动反应装置。
117.如图2所示,设置立式生物反应器和料液存储罐;料液存储罐的出料口通过第一管道连通于立式生物反应器的底部进料口,立式生物反应器的顶部出料口通过第二管道连通于所述料液存储罐的进料口;在第一管道上设置有蠕动泵。在立式生物反应器内填充固定化菌种微球。具体的,本实施例中,立式生物反应器呈圆柱形,尺寸为200mm/24*2,固定化菌种微球在反应器中的填充量为80%。
118.步骤3、催化转化
119.将cdca/β-环糊精包合物溶于真菌液体发酵培养基中,形成cdca终浓度为2.0mg/ml的底物溶液,然后加入150ml到料液存储罐内;
120.通过蠕动泵将底物溶液以流速2.0ml/min泵入立式生物反应器内,并在立式生物反应器和料液存储罐之间循环流动;底物在固定化菌种微球的室温催化下进行转化。
121.步骤4、产物收集
122.一批次底物溶液循环流动至底物完全用完后(本实施例用时3天),将料液存储罐内的反应液倒出,离心取上清液,经0.45μm滤膜过膜,使用hplc-elsd检测(流动相:乙腈:水(甲酸调ph=3.0)=60:40(v:v),柱温:30℃,流速:1.0ml/min),检测结果与标准品做比较,根据标准品标准曲线,计算出7k-lca转化率为8.79%。
123.(5)连续处理
124.重复步骤3和步骤4,进行下一批次底物溶液的催化转化。经检测,第二批次7k-lca转化率为7.98%,第三批次7k-lca转化率为6.03%。
125.以上仅为本发明的示例性实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所做的任何修改,等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1