一种培养间充质干细胞的方法与流程
1.本发明属于生物医学领域,更具体地,涉及间充质干细胞的培养方法,尤其是一种适用于糖尿病治疗以及胰岛细胞分化用途的间充质干细胞的培养方法。
背景技术:
2.i型糖尿病患者存在胰岛β细胞胰岛素分泌缺陷,需要依赖胰岛素来治疗。一些ii型糖尿病患者在后期通过药物已经无法控制血糖,也需要依赖胰岛素。然而,依赖胰岛素的治疗只能延缓疾病的病程,并不能从根本上治愈糖尿病,随着疾病的进展,各种并发症会随之而来,将严重影响患者的生存质量。
3.大量研究结果证实,间充质干细胞(mesenchymal stem cells,msc)移植可以帮助患者恢复生理血糖控制,提高生活质量,是一种很有前景的治疗方法,同时由于间充质干细胞具有组织修复特性,对于患者的其它器官也能起到修复的作用。间充质干细胞是干细胞的一种,其来源于发育早期的中胚层和外胚层,它最早被发现于骨髓中,因其能分化为间质组织而得名,其具有亚全能分化潜能,在一定条件下可诱导分化为多种组织细胞。同时由于msc不表达mhc
‑ⅱ
型分子,故其具有较低的免疫原性,在异体移植时不会引起排异反应。
4.研究表明将一定数量的msc通过动脉导管注入到胰腺等组织中,在胰腺组织微环境的诱导下分化增殖为胰岛样细胞,替代损伤的胰岛β细胞合成胰岛素等功能,能起到治疗糖尿病的作用。亦有研究表明,msc可通过旁分泌、细胞融合等机制改善胰岛细胞微环境,达到改善糖尿病的作用。但目前各种研究显示,单纯通过间充质干细胞或间充质干细胞联合一些药物治疗糖尿病虽然有一定的效果,但效果不显著,主要表现在经过一定周期治疗后,对患者血糖、c肽等关键性指标的检测中,变化不明显。
技术实现要素:
5.本发明的目的一方面在于提供一种培养间充质干细胞的方法,所得到的间充质干细胞能够适用于糖尿病治疗及胰岛细胞分化用途,该方法包括:步骤s1,利用组织样品培养获得间充质干细胞的原代细胞和/或传代细胞;步骤s2,将步骤s1中培养获得的所述原代细胞和/或传代细胞进行传代培养;步骤s3,在低氧条件下对步骤s3中培养获得的细胞进行培养;步骤s4,将步骤s3中培养获得的细胞在低氧高糖条件下进行培养;以及,步骤s5,将步骤s4中培养获得的细胞进行激活培养。
6.优选地,在步骤s1,将步骤s1中培养获得的原代细胞和/或传代细胞在细胞于细胞培养液中在37℃、5%co2条件下进行传代培养,所用的细胞培养液是额外添加有0.1~0.5%(v/v)人血白蛋白、0.2~2%(v/v)的胰岛素-转铁蛋白-硒、2~10%(v/v)人源血小板裂解液以及0.1~0.5%(v/v)b27的低糖dmem培养基,其中细胞培养液中的葡萄糖终浓度调整为4~7mmol/l。步骤s1进一步优选在具有正常氧浓度的环境中进行,每2~4天更换一次细胞培养液。为了便于后续利用或构建细胞种子库,可以在原代细胞长满后进行冻存或传代后冻存,冻存的细胞代次优选为p0~p3代。
7.优选地,在步骤s2,将步骤s1中培养获得的原代细胞或传代细胞复苏后,于细胞培养液中在37℃、5%co2条件下进行传代培养,连续培养1~3个代次。所用的细胞培养液优选是额外添加有0.1~0.5%(v/v)人血白蛋白、0.2~2%(v/v)的胰岛素-转铁蛋白-硒、2~10%(v/v)人源血小板裂解液以及0.1~0.5%(v/v)b27的低糖dmem培养基,其中细胞培养液中的葡萄糖终浓度调整为4~7mmol/l。步骤s2进一步优选在具有正常氧浓度的环境(即,大气中氧浓度为21%
±
1%的环境)中进行,且优选避免在具有低氧浓度的环境中进行。
8.优选地,在步骤s3,所述低氧条件是培养环境中氧浓度为8~18%的条件,优选通过在培养箱内填充氮气来降低环境中的氧浓度使得达到氧浓度为8~18%的条件。将步骤s2中培养获得的细胞收集后,于细胞培养液中在37℃、5%co2以及所述低氧条件下培养至细胞生长达到传代密度。所用的细胞培养液优选是额外添加有0.1~0.5%(v/v)人血白蛋白、0.2~2%(v/v)的胰岛素-转铁蛋白-硒、2~10%(v/v)人源血小板裂解液以及0.1~0.5%(v/v)b27的低糖dmem培养基,细胞培养液中的葡萄糖终浓度调整为4~7mmol/l。
9.优选地,在步骤s4,所述低氧高糖条件是培养环境中氧浓度为8~18%同时细胞培养液中葡萄糖终浓度为8~25mmol/l的培养条件,将步骤s3中培养获得的细胞于细胞培养液中在37℃、5%co2以及低氧高糖的条件下培养至细胞生长达到传代密度。所用的细胞培养液优选是额外添加有0.1~0.5%(v/v)人血白蛋白、0.2~2%(v/v)的胰岛素-转铁蛋白-硒、2~10%(v/v)人源血小板裂解液以及0.1~0.5%(v/v)b27的低糖dmem培养基,细胞培养液中的葡萄糖终浓度调整为8~25mmol/l。
10.优选地,在步骤s5,将步骤s4中生长的细胞于细胞培养液中继续在37℃、5%co2以及低氧高糖条件下培养至细胞融合度达到20%~80%时,加入胰高糖素样肽-1或其类似物对细胞进行激活培养,其中培养体系中胰高糖素样肽-1或其类似物的终浓度为5~100nmol/l。所用的细胞培养液优选是额外添加有0.1~0.5%(v/v)人血白蛋白、0.2~2%(v/v)的胰岛素-转铁蛋白-硒、2~10%(v/v)人源血小板裂解液以及0.1~0.5%(v/v)b27的低糖dmem培养基,细胞培养液中的葡萄糖终浓度调整为8~25mmol/l。优选地,加入胰高糖素样肽-1或其类似物后将细胞继续培养至细胞融合度达到90~100%后,将细胞收集用于冻存、制备用于治疗糖尿病的细胞制剂或诱导培养成胰岛细胞。
11.优选地,所述胰高糖素样肽-1或其类似物选自以下任何一种或多种:天然提取的胰高糖素样肽-1或其类似物,利用通过基因重组技术原核或真核表达系统合成的胰高糖素样肽-1或其类似物,或者通过化学方式合成的胰高糖素样肽-1或其类似物。
12.优选地,所述组织样品选自脐带、胎盘、牙髓、脂肪或骨髓中的任意一种或多种。
13.本发明的发明人在研究中惊奇地发现,在间充质干细胞培养的不同阶段改变培养环境中的氧浓度,同时在培养体系中添加胰高糖素样肽-1,能够大幅提高间充质干细胞治疗糖尿病的效果,同时在用药安全方面与传统的间充质干细胞无差异。并且,通过本发明的方法培养的间充质干细胞在诱导分化胰岛细胞方面,各项生物学指标也表现出明显提升。
14.本发明所提供的培养间充质干细胞的方法能适用于以各种合适的组织样品为原材料来培养获得间充质干细胞,所培养得到的间充质干细胞活性稳定,而且可重复性好,按照该方法培养的不同批次间充质干细胞活性无明显差异。
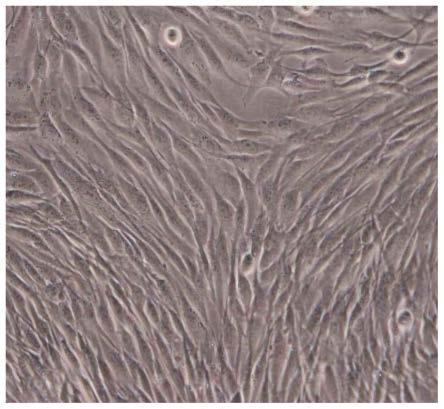
15.利用本发明的方法培养得到的间充质干细胞适合用于制备细胞制剂,而且所制得的细胞制剂具有稳定且优异的细胞活率保持状态,在糖尿病治疗方面表现出明显的疗效。
16.此外,利用本发明的方法培养得到的间充质干细胞还适合用于诱导分化培养胰岛细胞等用途,所分化得到的胰岛细胞比常规方法培养的间充质干细胞诱导分化的胰岛细胞具有更高的转化率及胰岛素分泌能力。
附图说明
17.图1是示出实施例1的脐带间充质干细胞成脂细胞分化结果的图;
18.图2是示出实施例1的脐带间充质干细胞成骨细胞分化结果的图;
19.图3是示出实施例1的脐带间充质干细胞成软骨细胞分化结果的图;
20.图4a和图4b是示出针对实施例1的脐带间充质干细胞进行流式细胞测定的结果的图;
21.图5是示出实施例2的胎盘羊膜间充质干细胞p6代形态的图;
22.图6是示出对实施例3的脂肪间充质干细胞进行细胞周期检测的结果的图;
23.图7是示出由实施例1、2、3的方法培养的间充质干细胞制备的细胞制剂的细胞活率随时间变化的图;
24.图8示出了利用按照实施例1的操作培养获得的间充质干细胞作为起始原料细胞诱导分化培养的胰岛细胞的形态。
具体实施方式
25.下面将结合本发明的实施例,对本发明实施例中的技术方案进行清晰完整描述,不能理解为对本发明保护范围的限制,本领域普通技术人员根据上述发明内容所做出的一些非本质的改进和调整,仍属于本发明的保护范围。
26.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径获得。
27.本文所用的术语“低氧”是指培养环境中氧浓度低于正常大气氧浓度的条件,考虑到地理性差异,本发明中所涉及的正常大气氧浓度是指环境大气中维持在21%
±
1%的氧浓度。关于术语“高糖”,本发明中所涉及的正常葡萄糖浓度是指葡萄糖在细胞培养液的终浓度为4~7mmol/l,高于此范围的葡萄糖浓度即为“高糖”。
28.本发明提供一种培养间充质干细胞的方法,培养得到的间充质干细胞适用于糖尿病治疗及胰岛细胞分化用途。
29.本发明的培养间充质干细胞的方法包括:步骤s1,利用组织样品培养获得间充质干细胞的原代细胞和/或传代细胞;步骤s2,将步骤s1中培养获得的原代细胞和/或传代细胞进行传代培养;步骤s3,在低氧条件下对步骤s2中培养获得的细胞进行培养;步骤s4,将步骤s3中培养获得的细胞在低氧高糖条件下进行培养;以及,步骤s5,将步骤s4中培养生长的细胞进行激活培养。激活培养后的细胞可用于冻存、制备用于治疗糖尿病的细胞制剂或诱导分化成胰岛细胞。
30.组织样品优选选自:脐带、胎盘、骨髓、脂肪或牙髓中的任意一种或多种。
31.首先,将采集得到的组织样品转移至含有30~50ml运输保存液的无菌容器中,12h内开始进行组织处理。运输保存液中优选不添加任何抗生素,优选使用一次性无菌容器来装载组织样品,运输保存液预先装载在无菌容器中,采集组织样品后,立即将其转移至无菌
容器密闭。优选地,运输保存液是额外添加有0.05~0.5%(v/v)肝素钠注射液、0.1~0.5%(v/v)人血白蛋白以及20~35μg/l表皮生长因子的dmem培养基。运输保存液中的dmem培养基可以用α-mem、dmem/f12来代替。
32.在步骤s1,利用以上处理后的组织样品培养获取间充质干细胞的原代细胞。所用的细胞培养液是额外添加有0.1~0.5%(v/v)人血白蛋白、0.2~2%(v/v)的胰岛素-转铁蛋白-硒、2~10%(v/v)人源血小板裂解液以及0.1~0.5%(v/v)b27的低糖dmem培养基,使用无菌葡萄糖溶液将细胞培养液中的葡萄糖终浓度调整为4~7mmol/l。优选地,细胞培养液是额外添加有0.2%(v/v)人血白蛋白、1%(v/v)胰岛素-转铁蛋白-硒、5%(v/v)人源血小板裂解液以及0.2%(v/v)b27的低糖dmem培养基,其中细胞培养液中的葡萄糖终浓度调整为5.5mmol/l。将步骤s1中处理后的组织样品于细胞培养液中在37℃、5%co2的培养箱中进行培养,此时培养箱内氧浓度为正常大气氧浓度。在步骤s1对间充质干细胞进行培养的过程中,每2~4天更换一次细胞培养液,待细胞长满后传代或冻存。优选地,为了避免最终使用细胞代次过高,可直接冻存培养得到的p0代细胞(即,原代细胞),或将p0代细胞连续传代后进行冻存,冻存的细胞不超过p3代。更优选地,选择冻存p1代细胞。
33.在步骤s2,使用与步骤s1中相同的细胞培养液将步骤s1中培养获得的原代细胞和/传代细胞复苏后,在37℃、5%co2以及正常大气氧浓度条件下连续培养1~3个代次,优选连续培养2个代次。
34.在步骤s3,将步骤s2中生长的细胞收集后,加入与步骤s1中相同的细胞培养液,在37℃、5%co2以及环境中氧浓度为8~18%的低氧条件下培养至细胞达到传代密度。优选地,采用填充氮气的方式将培养环境中的氧浓度降低到8~18%,更优选降低到15%。
35.在步骤s4,收集步骤s3中生长达到传代密度的细胞,然后加入细胞培养液,在37℃、5%co2以及环境中氧浓度为8~18%、优选为15%的低氧条件下培养至细胞达到传代密度。步骤s4中所用的细胞培养液是添加了0.1~0.5%(v/v)人血白蛋白、0.2~2%(v/v)的胰岛素-转铁蛋白-硒、2~10%(v/v)人源血小板裂解液、0.1~0.5%(v/v)b27的低糖dmem培养基,使用无菌葡萄糖溶液将细胞培养液中的葡萄糖终浓度调整为8~25mmol/l,优选为15mmol/l。
36.在步骤s5中,将步骤s4中生长的细胞于细胞培养液中在37℃、5%co2且环境中氧浓度为8~18%、优选为15%的低氧条件下继续培养。所用的细胞培养液优选是添加了0.1~0.5%(v/v)人血白蛋白、0.2~2%(v/v)的胰岛素-转铁蛋白-硒、2~10%(v/v)人源血小板裂解液以及0.1~0.5%(v/v)b27的低糖dmem培养基,使用无菌葡萄糖溶液将细胞培养液中的葡萄糖终浓度调整为8~25mmol/l,优选为15mmol/l。待细胞融合度至20~80%、优选40~60%时,加入终浓度为5~100nmol/l、优选为40nmol/l的胰高糖素样肽-1(glp-1)或其类似物进行激活培养,培养至细胞融合度达到90~100%时收集细胞,用于冻存、制备用于治疗糖尿病的细胞制剂或者诱导分化培养胰岛细胞。
37.优选地,胰高糖素样肽-1(glp-1)或其类似物包括但不限于:天然提取的胰高糖素样肽-1(glp-1)或其类似物,利用通过基因重组技术原核或真核表达系统合成的胰高糖素样肽-1(glp-1)或其类似物,以及通过化学方式合成的胰高糖素样肽-1(glp-1)或其类似物。
38.考虑到临床应用的安全性和可靠性,用于调整细胞培养液葡萄糖浓度的无菌葡萄
糖溶液优选是葡萄糖注射液,更优选是主要成分为葡萄糖、辅料为注射用水的医用葡萄糖注射液,当葡萄糖注射液本身葡萄糖含量过高,无法调节本发明中低糖条件,可以使用医用注射用水预先稀释葡萄糖注射液的葡萄糖浓度后,再用于调整细胞培养液葡萄糖浓度。
39.上述各步骤的细胞培养液中所涉及的低糖dmem可以使用其他合适的培养基来代替,例如市售的gibco公司的α-mem、dmem/f12。
40.各步骤的细胞培养液中所添加的人源血小板裂解液可以是任何合适的商品化人源血小板裂解液,优选的一个实例是helios公司的ultragro
tm-advanced。
41.实施例1:脐带间充质干细胞的培养和鉴定以及细胞制剂的活率稳定性评价
42.1、间充质干细胞的培养和鉴定
43.本实施例选取足月脐带作为组织样品用于培养获取间充质干细胞。
44.将新鲜采集的足月脐带转移至含有50ml运输保存液的无菌容器中,12h内转移至实验室并开始进行处理。所用的运输保存液是额外添加有0.05%(v/v)肝素钠注射液、0.1%(v/v)人血白蛋白以及20μg/l表皮生长因子的dmem培养基。
45.首先,在步骤s1,采用组织贴块法将处理后的组织样品在37℃、5%co2以及正常氧浓度条件下培养获取间充质干细胞的原代细胞。所用的细胞培养液是额外添加了0.1%(v/v)人血白蛋白、0.2%(v/v)的胰岛素-转铁蛋白-硒、2%(v/v)uitragrotm-advanced(helios,货号:hpcfdcrl50)以及0.1%(v/v)b27的低糖dmem(gibco
tm
,货号:10567022)培养基,用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为4mmol/l。培养过程中每3天更换一次细胞培养液,待细胞长满后将p0代细胞(即,原代细胞)进行冻存。
46.接下来,进行步骤s2。将以上冻存的p0代细胞复苏后置于与步骤s1中相同的细胞培养液中,在37℃、5%co2以及正常大气氧浓度条件下培养获取p2代细胞。
47.接下来,进行步骤s3。收集步骤s2中培养生长的p2代细胞,加入与步骤s1中相同的细胞培养液,在37℃、5%co2以及用氮气调整至细胞培养箱内氧浓度为8%的低氧条件下培养获取p3代细胞。
48.接下来,进行步骤s4。收集步骤s3中培养生长的p3代细胞,加入细胞培养液,在37℃、5%co2以及用氮气调整至细胞培养箱内氧浓度为8%的低氧条件下培养生长p4代细胞。所用的细胞培养液是额外添加了0.1%(v/v)人血白蛋白、0.2%(v/v)的胰岛素-转铁蛋白-硒、2%(v/v)uitragrotm-advanced以及0.1%(v/v)b27的低糖dmem培养基,用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为8mmol/l。
49.接下来,进行步骤s5。在培养生长p4代细胞的过程中,当细胞融合度达到20%时,加入胰高糖素样肽-1(glp-1)(利拉鲁肽注射液,国药准字j20160037),使其在培养体系终浓度为5nmol/l,在与步骤s4相同的条件下对细胞进行激活培养。继续培养直至细胞生长至细胞融合度达到90%时收集细胞,并进行冻存、制备用于治疗糖尿病的细胞制剂和/或诱导培养转化成胰岛细胞。
50.本实施例培养获得的间充质干细胞为p4代细胞。
51.按上述操作分别培养获得3个不同批次的间充质干细胞,对它们进行细胞活率检测,结果分别为98.5%、99.3%和99.1%,均处于高细胞活率水平,表明用本实施例的方法培养得到的间充质干细胞活性稳定。
52.对该3个批次的间充质干细胞分别进行细菌、真菌和支原体检测,结果均为阴性。
采用核酸/抗体检测法检测该3个批次的间充质干细胞中的hiv-1/2、hbv、hcv、htlv-1/2、ebv、cmv、tp、b19、hpv、hhv等病原菌感染情况,结果均为阴性。
53.随机选取其中一个批次的间充质干细胞,进行成脂细胞、成骨细胞及成软骨细胞分化,结果分别如图1至图3所示,结果表明该间充质干细胞分化性良好。
54.通过流式测定法检测间充质干细胞的表面标志物,结果如图4a和图4b所示,结果显示cd73、cd90、cd105、cd44、cd166≥95%,cd11b、cd19、cd79a、cd34、cd45、hla-dr≤2%。
55.随机选取其中一个批次的间充质干细胞,通过流式测定其细胞周期,结果显示被检细胞可正常通过检测点,无杂峰。
56.2、细胞制剂的活率稳定性评价
57.利用上述培养获得的3个批次的间充质干细胞制备细胞制剂,并进行细胞制剂的活率稳定性评价。将利用按常规方法培养得到的间充质干细胞制成的细胞制剂作为对照组。
58.每份细胞制剂的终体积为100ml,置于生理盐水袋中,制剂中的细胞总数量为5
×
107个,含8%体积分数的人血白蛋白(杰特贝林,注册证号s20170005),其余组分为生理盐水。
59.对照组所用的间充质干细胞是按以下过程培养得到的:取本实施中上述培养操作中同一脐带中的部分组织,处理后放置于额外添加有5%(v/v)uitragrotm-advanced(helios,货号:hpcfdcrl50)且葡萄糖终浓度调整为5.5mmol/l的低糖dmem培养基中,在37℃、5%co2以及正常大气氧浓度条件下培养并传代至p4代细胞。收集该p4代细胞并制备成细胞制剂,每份制剂的终体积为100ml,置于生理盐水袋中,细胞数量为5
×
107个,含8%体积分数的人血白蛋白(杰特贝林,注册证号s20170005),其余组分为生理盐水。
60.将制备好的细胞制剂至于4℃环境下,在12h内的不同时间点测定细胞活率。结果如表1和图7所示,结果显示,对照组细胞制剂的细胞活率平均下降7.37%,而实验组细胞制剂12h内细胞活率平均下降2.14%,实验组细胞活率的下降幅度明显小于对照组。这一结果表明按照本实施例操作培养获得的间充质干细胞在细胞制剂中具有更好的细胞活率保持状态。
61.表1
[0062][0063]
实施例2:胎盘羊膜间充质干细胞的培养和鉴定以及细胞制剂的活率稳定性评价
[0064]
1、间充质干细胞的培养和鉴定
[0065]
本实施例选取足月胎盘羊膜作为组织样品用于培养获得间充质干细胞。
[0066]
从新鲜采集的足月胎盘剥取羊膜层并转移至含有50ml运输保存液的无菌容器中,12h内转移至实验室并开始进行处理。运输保存液是额外添加有0.5%(v/v)肝素钠注射液、0.5%(v/v)人血白蛋白以及35μg/l表皮生长因子的dmem培养基。
[0067]
首先,在步骤s1,采用组织贴块法将处理后的组织样品在37℃、5%co2以及正常氧
浓度条件下培养获取间充质干细胞的原代细胞。所用的细胞培养液是额外添加了0.5%(v/v)人血白蛋白、2%(v/v)的胰岛素-转铁蛋白-硒、10%(v/v)uitragrotm-advanced(helios,货号:hpcfdcrl50)以及0.5%(v/v)b27的低糖dmem培养基(gibco
tm
,货号:10567022),使用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为7mmol/l。培养过程中每3天更换一次细胞培养液,待细胞长满后传代培养至p3代细胞,随后将p3代细胞进行冻存。
[0068]
接下来,进行步骤s2。将冻存的p3代细胞复苏后加入细胞培养液,在37℃、5%co2以及正常氧浓度条件下开始培养生长p4代细胞。细胞培养液是额外添加有0.5%(v/v)人血白蛋白、2%(v/v)的胰岛素-转铁蛋白-硒、10%(v/v)uitragrotm-advanced以及0.5%(v/v)b27的低糖dmem培养基,用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为7mmol/l。
[0069]
接下来,进行步骤s3。收集步骤s2中培养生长的p4代细胞,加入细胞培养液,在37℃、5%co2以及用氮气调整环境中氧浓度为18%的低氧条件下培养生长p5代细胞。细胞培养液是额外添加了0.5%(v/v)人血白蛋白、2%(v/v)的胰岛素-转铁蛋白-硒、10%(v/v)uitragrotm-advanced以及0.5%(v/v)b27的低糖dmem培养基,用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为7mmol/l。
[0070]
接下来,进行步骤s4。收集步骤s3中培养生长的p5代细胞,加入细胞培养液,在37℃、5%co2以及用氮气调整环境中氧浓度为18%的低氧条件下培养生长p6代细胞。细胞培养液是额外添加了0.5%(v/v)人血白蛋白、2%(v/v)的胰岛素-转铁蛋白-硒、10%(v/v)ultragrotm-advanced以及0.5%(v/v)b27的低糖dmem培养基,用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为25mmol/l。
[0071]
接下来,进行步骤s5。在培养生长p6代细胞的过程中,当细胞融合度达到80%时,向培养体系中加入胰高糖素样肽-1(glp-1)(biovision,货号为7839-200),胰高糖素样肽-1在培养体系中的终浓度为100nmol/l,在与步骤s4相同的条件下对细胞进行激活培养,当细胞继续生长至细胞融合度达到90~100%(见图5)时收集细胞,进行冻存、制备用于治疗糖尿病的细胞制剂和/或诱导培养转化成胰岛细胞。
[0072]
按照上述操作培养获得3个不同批次的间充质干细胞,对它们进行细胞活率检测,结果分别为99.5%、99.2%、98.3%,均处于高细胞活率水平,表明按本实施例的操作培养得到的间充质干细胞活性稳定。
[0073]
随机选取其中一个批次的间充质干细胞进行成脂细胞、成骨细胞及成软骨细胞分化,结果表明该间充质干细胞的分化性良好。
[0074]
对该3个批次的间充质干细胞分别进行细菌、真菌和支原体检测,结果均为阴性。采用核酸/抗体检测法检测该3个批次的间充质干细胞中的hiv-1/2、hbv、hcv、htlv-1/2、ebv、cmv、tp、b19、hpv、hhv等病原菌感染情况,结果均为阴性。
[0075]
通过流式测定法检测间充质干细胞的表面标志物,结果显示cd73、cd90、cd105、cd44、cd166≥95%,cd11b、cd19、cd79a、cd34、cd45、hla-dr≤2%。
[0076]
随机选取其中一个批次的间充质干细胞,通过流式法测定细胞周期,结果显示被检细胞可正常通过检测点,无杂峰。
[0077]
2、细胞制剂的活率稳定性评价
[0078]
利用上述3个批次的间充质干细胞制备细胞制剂,并对细胞制剂的活率稳定性进行评价。将利用按常规方法培养得到的间充质干细胞制成的细胞制剂作为对照组。
[0079]
每份细胞制剂的终体积为100ml,置于生理盐水袋中,制剂中的细胞数量为5
×
107个,含8%体积分数的人血白蛋白(杰特贝林,注册证号s20170005),其余组分为生理盐水。
[0080]
对照组的间充质干细胞是按以下过程培养获得的:取上述培养操作中同一胎盘羊膜中的部分组织,处理后放置于额外添加有5%(v/v)uitragrotm-advanced(helios,货号:hpcfdcrl50)且葡萄糖终浓度调整为5.5mmol/l的低糖dmem培养基中,在37℃、5%co2以及正常氧浓度下培养并传代至p6代细胞。收集p6代细胞制备细胞制剂,细胞制剂的终体积为100ml,置于生理盐水袋中,制剂中的细胞数量为5
×
107个,含8%体积分数的人血白蛋白(杰特贝林,注册证号s20170005),其余组分为生理盐水。
[0081]
将制备好的细胞制剂至于4℃环境下,在12h内的不同时间点测定细胞活率。结果如表2和图7所示,结果显示,对照组细胞制剂的细胞活率平均下降9.89%,而实验组细胞制剂12h内细胞活率平均下降2.50%,实验组细胞活率下降幅度明显小于对照组。这一结果表明按照本实施例操作培养获得的间充质干细胞在细胞制剂中具有更好的细胞活率保持状态。
[0082]
表2
[0083][0084]
实施例3:脂肪间充质干细胞的培养和鉴定以及细胞制剂的活率稳定性评价本实施例选取脂肪组织作为组织样品选用于培养获得间充质干细胞。
[0085]
利用抽脂方法采集30ml脂肪,转移至含有50ml运输保存液的无菌容器中,12h内送至专门的实验室并开始进行组织处理。运输保存液是额外添加有0.275%(v/v)肝素钠注射液、0.3%(v/v)人血白蛋白以及27.5μg/l表皮生长因子的dmem培养基。
[0086]
首先,进行步骤s1。采用胶原酶消化法提取脂肪干细胞,随后加入细胞培养液,在37℃、5%co2以及正常氧浓度条件下培养获取间充质干细胞的原代细胞。细胞培养液是额外添加有0.2%(v/v)人血白蛋白、1%(v/v)的胰岛素-转铁蛋白-硒、5%(v/v)uitragro
tm-advanced、0.2%(v/v)b27的低糖dmem培养基,用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为5.5mmol/l。培养过程中每3天更换一次细胞培养液。待细胞长满后传代培养至p3细胞,并冻存该p3代细胞。
[0087]
接下来,进行步骤s2。将步骤s1中冻存的p3代细胞复苏后,加入细胞培养液,在37℃、5%co2以及正常氧浓度条件下培养生长p4代细胞。细胞培养液是额外添加有0.2%(v/v)人血白蛋白、1%(v/v)的胰岛素-转铁蛋白-硒、5%(v/v)uitragro
tm-advanced以及0.2%(v/v)b27的低糖dmem培养基,用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为5.5mmol/l。
[0088]
接下来,进行步骤s3。收集步骤s2中培养得到的p4代细胞,加入细胞培养液,在37℃、5%co2以及用氮气调整环境中氧浓度为15%的低氧条件下培养生长p5代细胞。细胞培
养液是额外添加有0.2%(v/v)人血白蛋白、1%(v/v)的胰岛素-转铁蛋白-硒、5%(v/v)uitragro
tm-advanced以及0.2%(v/v)b27的低糖dmem培养基,用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为5.5mmol/l。
[0089]
接下来,进行步骤s4。收集步骤s3中培养得到的p5代细胞,加入细胞培养液,在37℃、5%co2以及用氮气调整环境中氧浓度为15%的低氧条件下培养生长p6代细胞。细胞培养液是额外添加有0.2%(v/v)人血白蛋白、1%(v/v)的胰岛素-转铁蛋白-硒、5%(v/v)uitragro
tm-advanced以及0.2%(v/v)b27的低糖dmem培养基,用葡萄糖注射液将细胞培养液中的葡萄糖终浓度调整为25mmol/l。
[0090]
接下来,进行步骤s5。在培养生长p6代细胞的过程中,当细胞融合度达到50%时,向培养体系中加入胰高糖素样肽-1(glp-1)(biovision,货号:7839-200),培养体系中胰高糖素样肽-1的终浓度为40nmol/l,在与步骤s4相同的条件下对细胞进行激活培养,细胞继续生长至细胞融合度达到90~100%时收集间充质干细胞,用于冻存、制备用于治疗糖尿病的细胞制剂和/或诱导胰岛细胞培养。
[0091]
按上述方法培养获得3个不同批次的间充质干细胞,对它们进行细胞活率检测,结果分别为99.9%、99.8%、99.4%,均处于高细胞活率水平,表明用本实施例的方法培养得到的间充质干细胞活性稳定。
[0092]
将上述培养得到的间充质干细胞进行成脂细胞、成骨细胞及成软骨细胞分化,结果表明这些间充质干细胞均表现出良好的分化性。
[0093]
对该3个批次的间充质干细胞分别进行细菌、真菌和支原体检测,结果均为阴性。采用核酸/抗体检测法检测该3个批次的间充质干细胞中的hiv-1/2、hbv、hcv、htlv-1/2、ebv、cmv、tp、b19、hpv、hhv等病原菌感染情况,结果均为阴性。
[0094]
通过流式测定法检测间充质干细胞的表面标志物,结果显示cd73、cd90、cd105、cd44、cd166≥97%,cd11b、cd19、cd79a、cd34、cd45、hla-dr≤0.05%。
[0095]
通过流式法对这些间充质干细胞进行细胞周期测定,结果如图6所示,结果显示被检细胞可正常通过检测点,无杂峰。
[0096]
2、细胞制剂的活率稳定性评价
[0097]
利用上述3个批次的间充质干细胞制备细胞制剂,并对细胞制剂的活率稳定性进行评价。将利用按常规方法培养得到的间充质干细胞制成的细胞制剂作为对照组。
[0098]
每份细胞制剂的终体积为100ml,置于生理盐水袋中,制剂中的细胞数量为5
×
107个,含8%体积分数的人血白蛋白(杰特贝林,注册证号s20170005),其余组分为生理盐水。
[0099]
对照组的间充质干细胞是按以下过程培养获得的:取上述培养操作中同一脂肪组织中的部分组织,处理后放置于额外添加有5%(v/v)uitragrotm-advanced(helios,货号:hpcfdcrl50)且葡萄糖终浓度调整为5.5mmol/l的低糖dmem培养基中,在37℃、5%co2以及正常氧浓度下培养并传代至p6代细胞。收集p6代细胞制备细胞制剂,细胞制剂的终体积为100ml,置于生理盐水袋中,制剂中的细胞数量为5
×
107个,含8%体积分数的人血白蛋白(杰特贝林,注册证号s20170005),其余组分为生理盐水。
[0100]
将制备好的细胞制剂至于4℃环境下,在12h内的不同时间点测定细胞活率。结果如表3和图7所示,结果显示,对照组细胞制剂的细胞活率平均下降7.29%,而实验组细胞制剂12h内细胞活率平均下降2.19%,实验组细胞活率下降幅度明显小于对照组。这一结果表
明,按照本实施例操作培养获得的间充质干细胞在细胞制剂中具有更好的细胞活率保持状态。
[0101]
表3
[0102][0103]
实施例4:间充质干细胞用于诱导培养胰岛细胞以及胰岛细胞的糖刺激应答
[0104]
1、利用间充质干细胞诱导培养胰岛细胞
[0105]
以按照实施例1~3的操作培养获得的间充质干细胞作为起始原料细胞,按照发明专利申请公开文献cn114276980a中所公开的方法,进行胰岛细胞的诱导分化培养。图8示例性地示出了以按照实施例1的操作培养获得的间充质干细胞作为起始原料细胞诱导分化培养的胰岛细胞的形态。
[0106]
以按照常规培养法培养得到的间充质干细胞作为对照组的起始原料细胞,同样按照cn114276980a所公开的方法诱导培养胰岛细胞。按照常规培养法培养获得间充质干细胞的具体操作如下:取实施例3中同一脂肪中的部分组织,处理后在额外添加有含5%(v/v)uitragrotm-advanced(helios,货号:hpcfdcrl50)且葡萄糖终浓度调整为5.5mmol/l的低糖dmem培养基中,在37℃、5%co2以及正常氧浓度下培养传代至p6代细胞。将该p6代细胞作为起始原料细胞,按照cn114276980a所公开的方法,诱导培养胰岛细胞。
[0107]
通过细胞计数仪在诱导前对所有起始原料细胞进行计数,精准取1.00
×
107个细胞。每组分别进行3个不同批次的诱导培养,胰岛细胞的转化率如下表4所示。
[0108]
表4
[0109][0110]
从表4的结果可看出,与cn114276980a所公开的转化率相比,利用按照上述实施例1~3的操作所培养获得的间充质干细胞作为起始原料细胞分别进行的各自3个批次的诱导培养的胰岛细胞转化率均提高3倍以上,而且各批次间转化率的差异很小。对照组与cn114276980a中公开的转化率基本相同,各批次间转化率的差异较小。
[0111]
2、胰岛细胞的糖刺激应答
[0112]
从上述诱导培养得到的各组胰岛细胞取样,按照cn114276980a的实施例3中“4、胰岛细胞糖刺激应答”的方案进行糖刺激应答实验,采用电化学发光法检测胰岛素含量变化。
[0113]
实验分组如下:
[0114]
空白组1:按实施例3的操作培养获得的间充质干细胞,1
×
106个/ml;
[0115]
空白组2:按照本实施例上文中涉及的常规培养法培养得到的间充质干细胞,1
×
106个/ml;
[0116]
实验组1:利用按实施例1的“1、间充质干细胞的培养和鉴定”中所述操作培养的间充质干细胞作为起始原料细胞诱导培养得到的胰岛细胞;
[0117]
实验组2:利用按照实施例1中涉及的对照组间充质干细胞为起始原料细胞诱导培养得到的胰岛细胞;
[0118]
实验组3:利用按照实施例2的“1、间充质干细胞的培养和鉴定”中所述操作培养的间充质干细胞为起始原料细胞诱导培养得到的胰岛细胞;
[0119]
实验组4:利用按照实施例3的“1、间充质干细胞的培养和鉴定”中所述操作培养的间充质干细胞为起始原料细胞诱导培养得到的胰岛细胞;
[0120]
实验组5:从人胰腺组织提取的胰岛细胞。
[0121]
结果汇总示于表5。
[0122]
表5
[0123][0124]
从表5的结果可看出,空白组1和空白组2是未进行诱导分化培养的间充质干细胞,无糖刺激反应。实验组1~实验组5在葡萄糖刺激后,均表现出不同程度的糖刺激应答。实验组1、实验组3和实验组4分别是利用按实施例1~3的操作培养的间充质干细胞作为起始原料细胞诱导分化培养的胰岛细胞,它们均表现出比实验组2(即,利用常规方法培养的间充质干细胞作为起始原料细胞诱导分化培养的胰岛细胞)更加明显的糖刺激效果,即单位胰岛细胞分泌的胰岛素更多,且实验组1、实验组3和实验组4的糖刺激效果基本在同一水平。此外,与实验组5(从人胰腺组织提取的胰岛细胞)相比,实验组1、实验组3和实验组4的胰岛细胞同样表现出更加明显的糖刺激效果。以上结果表明,利用本发明方法培养的间充质干
细胞诱导分化培养的胰岛细胞更有利于解决移植后受试者胰岛素分泌不足的状态。
[0125]
实施例5:间充质干细胞制剂治疗1型糖尿病小鼠的效果
[0126]
将用按实施例1的“1、间充质干细胞的培养和鉴定”中所述操作培养获得的间充质干细胞制备的细胞制剂作为实例来评价间充质干细胞制剂治疗1型糖尿病小鼠的效果。同时,将利用同一脐带中的部分组织按常规方法培养获得的间充质干细胞(参见实施例1中“2、细胞制剂的活率稳定性评价”部分的描述)作为常规的间充质干细胞对照。参照实施例1的过程制备细胞制剂,细胞制剂中含8%体积分数的人血白蛋白。
[0127]
所用的实验动物是balb/c foxp3-dtr-egfp阳性小鼠,这是一种靶向敲除“调节性t细胞”的转基因小鼠,特点是在内源性foxp3(叉状头转录调控因子)的调控下,调节性t细胞表达白喉毒素受体(dtr)。因此,当白喉毒素(dt)打入小鼠体内,白喉毒素与白喉毒素受体结合,实现靶向敲除“调节性t细胞”的目的。
[0128]
取balb/c foxp3-dtr-egfp阳性小鼠50只,随机选择6只作为正常对照组,剩余44只小鼠通过腹腔注射链脲佐菌素及白喉毒素制备1型糖尿病模型,由于1型糖尿病模型属于常规造模方法,此处不再赘述。最终35只小鼠造模成功,从中取28只小鼠将它们随机分为4组。
[0129]
各组受试动物的数量和具体处理方式如下。
[0130]
正常小鼠对照组:6只未注射链脲佐菌素及白喉毒素进行造模的正常小鼠,不给予任何处理;
[0131]
模型小鼠对照组:6只造模成功的小鼠,每只给予200ul生理盐水;
[0132]
常规胰岛素治疗组:6只造模成功的小鼠,每只皮下注射胰岛素10μg;
[0133]
常规间充质干细胞组:8只造模成功的小鼠,给予利用按常规方法培养获得的间充质干细胞制成的细胞制剂,每只按1
×
106/只(200ul体积)的量经尾静脉移植;
[0134]
本发明间充质干细胞组:8只造模成功的小鼠,给予利用按实施例1的操作培养获得的间充质干细胞制成的细胞制剂,每只按1
×
106/只(200ul体积)的量经尾静脉移植。
[0135]
将以上各组小鼠在相同条件和环境下饲养。
[0136]
每周治疗1次,连续治疗4周后,监测各组小鼠的血糖、c肽及体质量变化情况。
[0137]
表6示出了治疗前后各组小鼠血糖变化的结果。
[0138]
表6(n=6,mmol/l)
[0139]
组别0周(治疗前)4周(治疗后)正常小鼠对照组6.8
±
0.36.8
±
0.2模型小鼠对照组28.8
±
0.8b29.3
±
0.7b常规胰岛素治疗组28.9
±
2.9b25.7
±
3.8b常规间充质干细胞组28.1
±
2.1b23.8
±
2.6
bc
本发明间充质干细胞组29.3
±
3.3b11.5
±
2.7
ad
[0140]
与正常小鼠对照组相比,ap《0.05,bp《0.01;与模型小鼠组相比,cp《0.05,dp《0.01
[0141]
从表6的结果可看出,连续治疗4周后,正常小鼠对照组小鼠的血糖仍维持在正常范围内,模型小鼠对照组小鼠的血糖在基线水平上升高,两组对比差异有统计学意义(p《0.01)。常规胰岛素治疗组小鼠的血糖有下降趋势,但与模型小鼠对照组对比差异无统计学意义(p》0.05)。常规间充质干细胞组和本发明间充质干细胞组小鼠的血糖有均明显下降,
与模型小鼠对照组对比差异有统计学意义(p<0.05),其中本发明间充质干细胞组小鼠的血糖下降尤为显著,与模型小鼠对照组对比差异有显著统计学意义(p《0.01),同时与常规间充质干细胞组也有显著统计学意义(p《0.01),且趋于正常对照组水平。
[0142]
从上述结果可知,常规方法培养得到的间充质干细胞虽然对糖尿病有一定治疗意义,但其治疗效果与现有技术中的大多数报道相近,对1型糖尿病小鼠的血糖水平无特别明显的改善作用,而本发明法培养的间充质干细胞在连续4次的治疗后能显著降低小鼠的血糖。这就表明利用本发明的方法培养得到的间充质干细胞对1型糖尿病小鼠的血糖控制效果明显,相比于按照常规方法培养获得的间充质干细胞更为优异。
[0143]
表7示出了治疗前后各组小鼠体质量变化
[0144]
表7(n=6,g)
[0145][0146][0147]
与正常小鼠对照组相比,ap《0.01;与模型小鼠组相比,bp《0.05,cp《0.01
[0148]
从表7的结果可看出,4周后,正常小鼠对照组小鼠的体质量明显增加,模型小鼠组小鼠体质量下降,两组对比差异有统计学意义(p《0.01)。常规胰岛素治疗组、常规间充质干细胞组、本发明间充质干细胞组小鼠的体质量均有不同程度的增加,与模型小鼠对照组对比,常规胰岛素治疗组小鼠的体质量变化不显著(p》0.05)。与模型小鼠对照组对比,常规间充质干细胞组、本发明间充质干细胞组小鼠的体质量明显升高,它们之间的差异有统计学意义(p《0.05),其中本发明间充质干细胞组小鼠的体质量升高更加显著(p《0.01),本发明间充质干细胞组小鼠的它们的体质量增量接近正常对照组水平。
[0149]
由此可知,常规方法培养的间充质干细胞虽然在一定程度上有助于小鼠体质量增加,但与常规胰岛素治疗的差异不大。而利用本发明的方法培养的间充质干细胞治疗后的小鼠体质量较其他组增加较为明显,这就证明利用本发明方法培养的间充质干细胞能够明显改善1型糖尿病小鼠的体质量。
[0150]
表8示出了各组小鼠空腹及餐后2h的c肽水平。
[0151]
表8(n=6,ng/l)
[0152]
组别0h餐后2h正常小鼠对照组395
±
28481
±
31模型小鼠对照组121
±
31b219
±
18b常规胰岛素治疗组114
±7b
210
±
10b常规间充质干细胞组255
±
21
bc
335
±
19
bc
本发明间充质干细胞组297
±
14
bc
436
±
27
ac
[0153]
与正常对照组对比,ap《0.05,bp《0.01;与模型组对比,cp《0.01
[0154]
从表8的结果可看出,4周后,正常小鼠对照组小鼠的c肽水平在合适范围内,模型小鼠组小鼠的c肽水平明显下降,两组之间的差异有统计学意义(p《0.01)。与模型小鼠组相比,常规胰岛素治疗组小鼠的血清c肽水平变化不显著(p》0.05),常规间充质干细胞组和本发明间充质干细胞组小鼠的血清c肽水平显著升高,与模型小鼠组之间的差异有统计学意义(p《0.01)。其中,本发明间充质干细胞组小鼠的血清c肽水平改善最明显,接近正常小鼠对照组的水平。
[0155]
由以上结果可知,常规方法培养的间充质干细胞虽然对糖尿病有一定治疗效果,在一定程度上有助于改善c肽水平,但其效果与现有技术中的大多数报道相近,并不尽人意。而利用本发明的方法培养的间充质干细胞治疗后的小鼠餐后c肽分泌明显上升,证明本发明的方法所培养得到的间充质干细胞能够明显改善1型糖尿病小鼠的c肽分泌。
[0156]
上文结合说明书附图对本发明的实施例做了详细的说明与描述,但是本领域技术人员应该理解,以上实施例仅为本发明的示例性实施方案,详尽的说明只是为了帮助读者更好地理解本发明精神,而并非对本发明保护范围的限制,相反,任何基于本发明的发明精神所作的任何改进或修饰都应当落在本发明的保护范围之内。
[0157]
例如,尽管所提供的各实施例中针对具体的组织样品描述了间充质干细胞的培养过程和条件,然而各实施例的培养过程和条件可以互换。比如,实施例1描述了以足月脐带作为组织样品培养间充质干细胞的操作过程和条件,该操作过程和条件同样适用于利用胎盘羊膜、脂肪、牙髓或骨髓等作为组织样品来培养间充质干细胞。同样的情况适用于实施例2和实施例3。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1