一组用于鉴定醋龟甲的特异性引物组及其试剂盒与应用
1.本发明属于中药鉴定技术领域,具体涉及一组用于鉴定醋龟甲的特异性引物组及其试剂盒与应用。
背景技术:
2.龟甲(testudinis carapax et plastrum),为龟科动物乌龟chinemys reevesii(gray)的背甲及腹甲,始记载于《神农本草经》,被列为上品。龟甲性微寒,味咸、甘,归肝、肾、心经,能滋阴潜阳,益肾强骨,养血补心,固经止崩;主治阴虚潮热,骨蒸盗汗,头晕目眩,虚风内动,筋骨痿软,心虚健忘,崩漏经多等。醋龟甲是龟甲的炮制品,取净龟甲用砂烫至表面淡黄色,取出,醋淬,干燥即得,在临床上应用最为广泛。醋龟甲的炮制在《中国药典》上仅概括描述了炮制后的饮片的样子,对于炮制温度、时间、用量没有明确的规定。而炮制过程及炮制程度对其内成分的破坏程度具有极大影响。对于一些大分子,不耐热的物质,经炮制后难以检测到,而且经过一系列的加工处理后,醋龟甲的外在特征几乎被破坏殆尽,难以应用形态学考察等常规方法进行有效鉴别。
3.由于dna存在于大多数生物组织中且非常稳定,检测用量少,因此可以选择乌龟特有的dna片段作为用于专属性鉴定醋龟甲炮制品的特征识别物。在运用分子标记技术鉴定龟甲的研究中,现有技术仅能够应用于龟甲基原、药材及生品,但容易出现假阴性的结果,即样品检测不显示来源于乌龟,无法鉴别醋龟甲炮制品,难以为临床用药的安全性和有效性提供有力保障。此外,也有研究人员利用基于coi序列的dna条形码技术对乌龟及常见混伪品进行分子鉴定,该方法亦仅可用于基原、药材及生品,且碱基错配、生物进化速率等因素使得种内变异阈值难以确定,检验结果的准确性存疑。此外,还存在步骤繁琐、耗时等诸多缺陷。常规pcr进行物种的鉴定时,由于技术灵敏度的局限性,对于dna存量极低的醋龟甲难以发挥作用,并且需要后续电泳才能观测结果,操作繁琐,以及观察时存在一定主观性,均易于导致假阴性的产生,从而影响鉴定结果;而且,该技术不能对动物药炮制品中的dna进行定量分析。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一组用于鉴定醋龟甲的特异性引物组及其试剂盒与应用。本发明针对醋龟甲以及常见伪品的基原分别设计、筛选出特异性引物,并利用特异性引物组扩增技术鉴别醋龟甲炮制品。操作简单、专属性强、鉴别快速、无需测序,能准确、直观地鉴别醋龟甲炮制品的真伪以及掺伪。为醋龟甲炮制品的专属性鉴定提供一条新的途径,有助于监控醋龟甲炮制品的质量,从而有利于保障临床用药的安全性、有效性,具有重要的应用价值。
5.本发明通过如下技术手段得以实现:本发明提供了一组用于鉴定醋龟甲的定量pcr检测特异性引物组,引物组中包含有根据乌龟线粒体基因设计的引物对crp;其上游引物crp-f核苷酸序列如seq_1所示,下游
引物crp-r核苷酸序列如seq_2所示。
6.进一步的,为了对醋龟甲中是否含有掺伪品进行鉴定,上述特异性引物组中还包括有msp引物对、tsp引物对和csp引物对中的一种或多种;其中,所述msp引物对包括引物msp-f和msp
‑ꢀ
r,其核苷酸序列分别如seq_3、seq_4所示;所述tsp引物对包括引物tsp-f和tsp
‑ꢀ
r,其核苷酸序列分别如seq_5、seq_6所示;所述csp引物对包括引物csp-f和csp
‑ꢀ
r,其核苷酸序列分别如seq_7、seq_8所示;在某一具体实施例中,本发明还提供了上述特异性引物组在鉴定醋龟甲炮制品的真伪及掺伪中的应用。
7.在某一具体实施例中,本发明还提供了一种重组阳性质粒,所述的重组阳性质粒的苷酸序列如seq_9所示。
8.在某一具体实施例中,本发明还提供一种特异性鉴定醋龟甲炮制品真伪的试剂盒,所述试剂盒包括上述的特异性引物crp引物对,重组阳性质粒以及荧光定量pcr扩增体系。
9.优选的,为了鉴定是否为掺伪品,所述试剂盒还包含有上述的msp引物对、tsp引物对和csp引物对中的一种或多种。
10.在某一具体实施例中,本发明还提供一种特异性鉴定醋龟甲炮制品的方法,所述方法包括采用上述的引物组对待测样品的基因组dna进行荧光定量pcr检测,结合有无荧光信号产生与扩增产物的tm值判定结果。
11.其中,所述待测样品的基因组dna的制备方法包括步骤:(1)将待测样品粉碎,称取适量粉末加入料液比50~200:1 mg/ml 的sds裂解液和蛋白酶k混合液中,涡旋混匀,置恒温混匀仪55℃~65℃提取1 h~6 h,离心取上清液;(2)依次将与上清液等体积的tris平衡酚-三氯甲烷、三氯甲烷-异戊醇混合,离心取上清液;(3)在上清液中加入上清液体积0.1倍量的乙酸钾溶液和上清液等体积的预冷异丙醇,混合,置-20℃过夜,离心后弃去上清液;(4)预冷的70%乙醇洗涤沉淀,离心并弃去上清液,沉淀物于室温下晾干或冻干,用te缓冲液溶解,质量检查,-20℃或4℃下保存,得到待测样品的基因组dna。
12.优选的,所述pcr检测的反应体系以20 μl为例,包括:10 μl beyofast
tm sybr green qpcr mix,0.1 μm~0.6 μm引物对,模板dna 0.01 ng~300 ng,加灭菌双蒸水补足至20 μl。
13.所述pcr检测的pcr扩增程序为:95℃,2 min;95℃,15 s;63℃,15 s;循环数28~35。
14.所述pcr检测的熔解程序为:60℃,1 min;以+0.3℃/s的斜率上升至95℃,并保持15 s。
15.与现有技术相比,本发明的有益效果是:(1)本发明的四组特异性引物针对乌龟、中华花龟、巴西龟及鳄龟的线粒体基因中短串联重复序列附近的基因(约300 bp)设计,与公开已知的特异性引物相比,其稳定性好,能对同一属的不同物种进行区分,实现醋龟甲炮制品的真伪以及掺伪品的鉴定;此外,扩增
的目的产物很短(≤100 bp),非常有益于炮制品中残余dna小片段扩增,大大降低炮制后模板降解导致扩增假阴性的机率,克服因醋龟甲炮制程度不一所导致的醋龟甲含成分难以检测的缺陷。
16.(2)本发明鉴定醋龟甲炮制品的方法与常规pcr和基于coi基因的dna条形码鉴定技术相比,适用范围更广,可适用于醋龟甲炮制品,更适用于龟甲基原、药材及其饮片。该方法抗干扰能力强、操作简单、无需进行测序、便捷经济、高通量,能直观而准确地对醋龟甲炮制品进行鉴定,并且通过以一定浓度梯度的重组阳性质粒进行荧光定量pcr,建立标准曲线,可以对其dna成分进行定量分析。
17.(3)与目前现有的常规pcr和基于coi基因的dna条形码技术相比较,本发明荧光定量pcr具有特异性好、灵敏度高、实时检测、重复性好、操作简便等优势,实现对醋龟甲炮制品进行直接、高通量准确鉴定,可定量检测中药炮制品中的痕量dna,大大降低了假阴性的机率,比常规pcr和dna条形码研究技术更为直观、经济、快速,且具有适用范围广、抗干扰能力强、特异性高、可识别掺伪品等特点,为醋龟甲炮制品的真伪快速鉴定提供了一种新方案。
附图说明
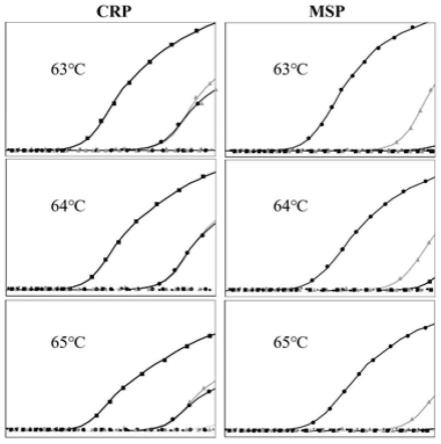
18.图1是引物crp及msp在不同退火温度的优化曲线;图2是引物tsp及csp在不同退火温度的优化曲线;图3是各引物的特异性验证结果图;图4是特异性引物的标准曲线图。
具体实施方式
19.本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。以下实施案例中的方法、设备、材料,如果未进行特别说明,均为本领域常规方法、设备和材料,均可由市场购得。
20.试剂:十二烷基硫酸钠、氯化钠、盐酸、乙二胺四乙酸二钠、三氯甲烷、异戊醇、无水乙醇、硼酸,试剂均为分析纯。蛋白酶k(sigma-aldrich)、三羟甲基氨基甲烷、tris平衡酚(solarbio,t0250)、beyofast
tm sybr green qpcr mix(2
ꢀ×
,high rox,beyotime,030521220105)、agarose(beyotime)、溴化乙锭溶液(生工生物技术有限公司,h223ka8984),以上试剂均为生物级。
21.本发明实施例中涉及到的样品简写及名称如下:zcg1~6为6批醋龟甲,其中,1、2来自浙江湖州不同市场,3来自江苏无锡,4来自江苏盐城,5来自江苏镇江,6来自浙江诸暨;zchg1~2为2批醋龟甲伪品-中华花龟,其中,1来自浙江杭州,2来自江苏无锡;zcbx1~2为2批醋龟甲伪品-巴西龟,其中,1来自江苏镇江,2来自江苏无锡;zce1~2为2批醋龟甲伪品-鳄龟,其中,1来自四川泸州,2来自江苏苏州。
22.cg1~17为17批市售醋龟甲,其中,1~10购自安徽省亳州佰世信中药饮片有限公
司不同批次,11购自上药宜兴药业,12购自亳州市瑞草中药饮片有限责任公司,13购自北京同仁堂饮片有限责任公司,14购自安徽省万生中药饮片有限公司,15购自运城神农中药材有限公司,16购自云南泰华丰功药业有限公司,17购自江苏华洪药业科技有限公司。
23.实施例1:醋龟甲试剂盒特异性引物的设计为了鉴定醋龟甲的真伪及其中是否含有中华花龟、巴西龟、鳄龟等掺伪品,本发明分别依据乌龟chinemys reevesii(accession no.: nc_006082.1)、中华花龟mauremys sinensis(accession no.: nc_016685.1)、巴西龟trachemys scripta(accession no.: nc_011573.1)及鳄龟chelydra serpentina(accession no.: nc_011198.1)的线粒体基因中短串联重复序列附近的基因(约300 bp),设计引物,筛选出能够扩增出相应物种来源的醋龟甲dna。在此基础上,进行再次筛选,选择相应物种来源的醋龟甲dna扩增后得到的ct值与其他物种醋龟甲dna的ct值差距最大的作为特异性引物;筛选后得到乌龟的特异性引物对crp,中华花龟的特异性引物对msp,巴西龟的特异性引物对tsp,鳄龟的特异性引物对csp;特异性引物的核苷酸序列如seq_1~8所示。表1是特异性引物信息表,所有引物均由生工生物技术有限公司合成。
24.表1. 特异性引物信息实施例2:醋龟甲试剂盒特异性引物的优化将购买的各批醋龟甲及伪品作为样品(包括醋龟甲及其常见伪品;醋龟甲真品-乌龟(zcg)、醋龟甲伪品-中华花龟(zchg)、醋龟甲伪品-巴西龟(zcbx)、醋龟甲伪品-鳄龟(zce))粉碎,分别称取上述样品粉末50 mg,加入995 μl的sds裂解液和5 μl蛋白酶k,涡旋混匀,56℃下于恒温混匀仪(拓普森科学仪器有限公司)600 rpm提取3 h,离心取上清液;依次将tris平衡酚-三氯甲烷(1:1)、三氯甲烷-异戊醇(24:1)分别与上清液等体积混合,离心取上清液;在上清液中加入0.1倍体积的5 m乙酸钾溶液和等体积的预冷异丙醇,混合,置-20℃过夜,离心后弃去上清液;加入500 μl预冷的70%乙醇洗涤沉淀,离心弃上清;室温晾干或冻干,以适量te缓冲液溶解,得到基因组dna供试品溶液,质量检查,-20℃或4℃下保存,备用。
25.配制荧光定量pcr反应体系:10 μl beyofast
tm sybr green qpcr mix,0.1 μm~0.6 μm引物对,模板dna 20 ng,加灭菌双蒸水补足至20 μl。
26.离心后,置于荧光定量pcr仪(stepone plus,美国thermofisher scientific公司)进行扩增,扩增程序为:95℃,2 min;95℃,15 s;63℃,15 s;循环数30~33。熔解程序为:95℃,15 s;60℃,1 min;以+0.3℃/s的斜率上升至95℃,并保持15 s。分别通过调节引物浓度、退火温度等参数对特异性引物crp、msp、tsp及csp的扩增条件进行优化。表2~5分别是不同浓度下各特异性引物的ct值。
27.表2. 不同浓度下特异性引物msp的ct值表3. 不同浓度下特异性引物tsp的ct值表4. 不同浓度下特异性引物csp的ct值表5. 不同浓度下特异性引物crp的ct值
图1是引物crp及msp在不同退火温度的优化曲线,图2是引物tsp及csp在不同退火温度的优化曲线。
28.由图1~2,表2~5可见,在31个循环扩增反应下,引物msp在退火温度为63℃,引物浓度为0.4 μm时,扩增效果较好。在31个循环扩增反应下,引物tsp在退火温度为63℃,引物浓度为0.5 μm时,扩增效果较好。在33个循环扩增反应下,引物csp在退火温度为63℃,引物浓度为0.4 μm时,扩增效果较好。在30个循环扩增反应下,引物crp在退火温度为63℃,引物浓度为0.1 μm时,扩增效果较好。
29.实施例3:醋龟甲试剂盒特异性引物的验证以已鉴定基原的醋龟甲及其伪品纯化的dna为模板,在优化的条件下进行荧光定量pcr扩增,根据是否检测到荧光信号及扩增产物的tm值验证特异性。dna扩增产物送由生工生物技术有限公司进行双向测序,以验证特异性扩增的准确性。表6是特异性引物测序结果与目的片段比对表。
30.表6. 特异性引物测序结果与目的片段比对表
由表6可见,经测序比对结果显示,其测序结果与目的产物序列基本一致,在ncbi数据库中可以匹配到相应的物种,表明所获得的扩增产物确实为预期扩增的目的片段。
31.图3是各引物的特异性验证结果图;如图3所示,醋龟甲及其伪品的dna可以被相应物种的特异性引物成功扩增。与对应物种的dna样品进行扩增后得到较强的荧光信号,阴性对照和源于其他三个物种的dna样品未产生扩增信号。所有熔解曲线都显示一个单峰,没有产生引物二聚体。由此表明,本发明所提供的醋龟甲及其伪品的鉴别方法具有良好的特异性,可用于醋龟甲及其伪品的鉴别。
32.实施例4:醋龟甲试剂盒检测方法将醋龟甲产品粉碎,称取粉末50 mg,加入995 μl的sds裂解液和5 μl蛋白酶k,涡旋混匀,置恒温混匀仪56℃提取3 h,离心取上清液;依次将与上清液等体积的tris平衡酚-三氯甲烷(1:1)、三氯甲烷-异戊醇(24:1)分别与上清液混合,离心取上清液;在上清液中加入上清液体积0.1倍量的5 m乙酸钾溶液和上清液等体积的预冷异丙醇,混合,置-20℃过夜,离心后弃去上清液;加入预冷的70%乙醇500 μl洗涤沉淀,离心后弃去上清液;室温晾干或冻干,用25 μl te缓冲液溶解,得到基因组dna供试品溶液,质量检查,-20℃或4℃下保存,备用。准备好dna供试品溶液后通过pcr进行检测:pcr反应体系:10 μl beyofast
tm sybr green qpcr mix,0.1 μm~0.6 μm引物对,模板dna 20 ng,加灭菌双蒸水补足至20 μl。
33.pcr扩增程序为:95℃,2 min;95℃,15 s;63℃,15 s;循环数30~33,熔解程序为:60℃,1 min,以+0.3℃/s的斜率上升至95℃,并保持15 s。
34.实施例5:醋龟甲试剂盒中的dna的定量检测通过peasy
®-basic seamless cloning and assembly kit构建重组质粒,将重组质粒转化入大肠杆菌top10感受态细胞(生工生物技术有限公司)后进行培养,提取质粒进行测序验证得到序列如seq_9所示的重组阳性质粒,并注明其中质粒的拷贝数。
35.将得到的重组阳性质粒连续稀释10倍,浓度为1
×
102~1
×
10
7 copies/
µ
l在优化后的条件下进行荧光定量pcr扩增。之后,以质粒拷贝数的对数为横坐标,ct值为纵坐标,建立标准曲线。
36.图4是特异性引物的标准曲线图;如图4所示,建立的醋龟甲dna的标准曲线为y =
ꢀ−
3.203x + 36.58(r2=0.9956,eff% =105.2),表明在浓度为1
×
102~1
×
10
7 copies/
µ
l之间具有良好的线性关系。根据建立的标曲可以对市售醋龟甲中的dna实现定量检测。
37.实施例6:不同批次市售醋龟甲样品的检测本实施例中按照实施例2的方法对购买的不同批次市售醋龟甲炮制品检测。将不同批次市售醋龟甲炮制品粉碎,称取粉末50 mg,通过sds法进行提取纯化及质量检查。此后,配制荧光定量pcr反应体系,将其置于荧光定量pcr仪按上述优化的条件进行扩增。根据扩增信号的有无以及扩增产物的tm值以判定醋龟甲的真伪。表7是特异性引物对不同批次市售醋龟甲的检测结果。
38.表7. 特异性引物对不同批次市售醋龟甲的检测结果
codecrpmsptspcspcopies/
µ
l真伪掺杂cg126.31
±
0.093
‑‑‑
10
3.21
+--cg226.90
±
0.072
‑‑‑
10
3.02
+--cg328.59
±
0.098
‑‑‑
10
2.49
+--cg428.72
±
0.190-29.30
±
0.148-10
2.45
--+cg529.76
±
0.087
‑‑‑
10
2.13
+--cg629.75
±
0.08129.72
±
0.184
‑‑
10
2.13
--+cg728.80
±
0.103
‑‑‑
10
2.43
+--cg829.68
±
0.053
‑‑‑
10
2.15
+--cg926.33
±
0.033
‑‑‑
10
3.20
+--cg1028.39
±
0.033
‑‑‑
10
2.56
+--cg1127.92
±
0.064
‑‑‑
10
2.70
+--
cg1227.04
±
0.205
‑‑‑
10
2.98
+--cg13-29.11
±
0.04424.70
±
0.184---+-cg1429.90
±
0.026
‑‑‑
10
2.09
+--cg15
‑‑
28.57
±
0.027---+-cg16
‑‑‑
30.93
±
0.116--+-cg17
‑‑
30.43
±
0.162---+-
如表7所示,11批市售醋龟甲,包括cg1~cg3、cg5、cg7~cg12和cg14,被引物crp扩增后均产生荧光信号,ct值为26.1~29.76,浓度为10
2.13
~10
3.21 copies/μl,其被伪品引物扩增后未产生荧光信号,结果表明这些醋龟甲来源于乌龟,且不含有其他三个伪品物种,被鉴定为正品。然而,cg4和cg6分别被引物crp和tsp或msp扩增后产生荧光信号,表明cg4来源于乌龟和巴西龟,cg6来源于乌龟和中华花龟,因此这两批醋龟甲被鉴定为掺伪品。其余四批醋龟甲被引物crp扩增后未产生荧光信号,cg13、cg15~cg17分别被引物msp和tsp、tsp或csp扩增产生荧光信号,表明这些醋龟甲不含有乌龟来源,而是来源于其他三个伪品物种,被鉴定为伪品。
39.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1