一种丙二酸酯类化合物、制备方法及其用途
1.本发明涉及化学技术领域,具体来说涉及一种丙二酸酯类化合物,该化合物的制备方法以及对黄瓜花叶病毒、黄瓜灰霉病菌、有害疣孢霉菌、嗜菌葡枝霉菌、猕猴桃溃疡病菌、应变假单胞杆菌具有抑制作用的用途。
背景技术:
2.植物病毒、植物细菌性疾病和植物真菌性疾病每年都给农业生产带来了巨大的损失,黄瓜花叶病毒(cucumber mosaic virus,cmv)是典型的植物病毒病,其危害严重,寄主方位广泛,是世界上最流行的植物病毒之一。cmv可引起番茄叶片丝状畸形、黄瓜植株黄化、香蕉花心腐烂、辣椒叶片畸形顶部坏死等,当前广泛使用的宁南霉素、病毒唑等抑制剂防治黄瓜花叶病毒,但是这些药剂存在防效低和使用效果不理想等问题,猕猴桃溃疡病菌、应变假单胞杆菌是常见的植物细菌性病害,严重限制了农产品的发展,由真菌引起的干泡病、蛛网病等作物病害导致农作物的谷物产量显着下降,并增加了生物多样性丧失的风险,市面上使用的杀菌剂,如比美噻唑,硫代二唑铜等的滥用也给环境造成更多的压力,为此,创制出高效、新型、对环境友好的抗植物病毒剂和杀菌剂仍是农药研究者的一大挑战。
3.杂环化合物在农药的研究开发中一直是重要的内容之一,异恶唑及其异恶唑类化合物是重要的杂环化合物,它们是机合成中是重要的合成中间体,具有非常广泛的生物活性,如具有对心血管病、钙质调节、阿尔茨海默病的治疗作用及可杀菌、杀微生物等,因此对异恶唑类化合物的结构改进和其的生物活性研究一直没有停止过。
4.1996年,阮等(阮朗.异恶唑二羧酸衍生物的合成及除草活性研究[j].农药译丛,1996(1):6.)以取代氰氧物2-氯-2肟基乙酰胺、β-酮脂等为起始原料,设计合成了一系列异恶唑二羧酸类衍生物。生物活性测试结果表明,部分化合物显示出良好的除草活性。
[0005]
2001年,qi等(qi,c.m.;wang,y.f.;zhang,g.x.;feng,s. j.;,shujuan f.sythensis and biological activity of novel isoxazoles[j]. journal of beijing normal university,2001,6.)以硝基乙酸酯、取代苯甲醛等为原料,经过环合反应,合成了一系列新型的异恶唑类衍生物。生物活性测试结果表明,,部分化合物表现出一定的除草活性和植物生长调节活性。
[0006]
2018年,li等(li,m.h.;song,b.;imerhasan,m.progress insynthesis and bioactivity of spiroisoxazoline compounds[j].organicchemistry,2018,38:378.)归纳了五种螺异恶唑啉类化合物的合成方法,并报道该类化合物的抑制幼虫生长活性和抗菌活性。
[0007]
综上所述,异恶唑类衍生物表现出了一定的除草活性和杀菌活性,其他方面的活性还未见报道,为创制新型高效的抗病毒剂和抗菌剂,在前期工作的基础上,设计合成了系列丙二酸酯类化合物,期望筛选出高活性的抗病毒药物和抗菌药物。
技术实现要素:
[0008]
本发明目的在于提供一种丙二酸酯类化合物及其制备方法。
[0009]
本发明的另一目的在于防治黄瓜花叶病毒、黄瓜灰霉病菌、有害疣孢霉菌、嗜菌葡枝霉菌、猕猴桃溃疡病菌、应变假单胞杆菌的用途。
[0010]
本发明的技术方案是:一种丙二酸酯类化合物,其通式为下式(i):
[0011][0012]
其中:r1为c1-c3烷基;r2苯基、取代苯基、呋喃基、环己基或戊基。
[0013]
所述的c1-c3烷基为甲基、乙基或异丙基。
[0014]
所述的取代苯基的取代基为卤素、甲基或甲氧基。
[0015]
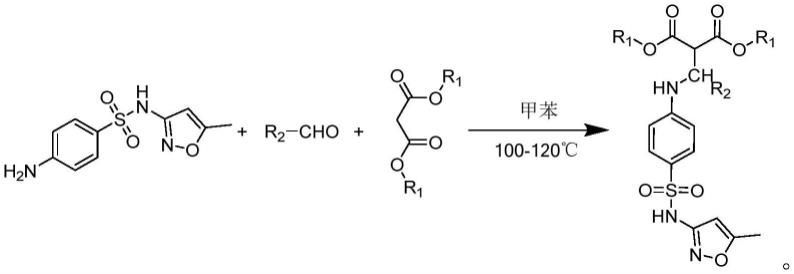
所述的一种丙二酸酯类化合物的制备方法,以4-氨基-n-(5-甲基异恶唑-3-基)苯磺酰胺、取代醛、丙二酸酯为原料,以甲苯为溶剂,一锅法合成丙二酸酯类化合物,其合成路线为:
[0016][0017]
合成步骤和工艺条件为:将4-氨基-n-(5-甲基异恶唑-3-基)苯磺酰胺、取代醛、丙二酸酯为原料投入单口瓶,加入甲苯,升温至回流,反应4-6小时结束,减压回收甲苯,经过柱色谱分离得到目标产物。
[0018]
所述的柱色谱分离条件为正己烷:乙酸乙酯=7:1v/v。
[0019]
所述的一种丙二酸酯类化合物在制备防治作物病害的药物和药剂中的应用。
[0020]
所述的作物病害包括抗黄瓜花叶病毒、黄瓜灰霉病菌、有害疣孢霉菌、嗜菌葡枝霉菌、猕猴桃溃疡病菌、应变假单胞杆菌活性。
[0021]
其中部分化合物(i
1-i7)的结构特征如下:
[0022]
i1:r1=et r2=ph;
[0023]
i2:r1=i-pr r2=4-cl-ph;
[0024]
i3:r1=me r2=4-me-ph;
[0025]
i4:r1=et r2=4-ome-ph;
[0026]
i5:r1=et r2=furyl;
呋喃甲醛(0.001mol)、丙二酸二乙酯(0.0015mol),加入甲苯(40ml)为溶剂,升温回流,tlc监测反应进程,5小时候结束反应,减压回收甲苯,经过柱色谱分离(正己烷:乙酸乙酯=7:1 v/v)得到目标产物。
[0040]
实施例6:2-(环己基((4-(n-(5-甲基异恶唑-3-基)氨磺酰基)苯基)氨基)甲基)丙二酸二甲酯;
[0041]
在100ml单口瓶中,加入4-氨基-n-(5-甲基异恶唑-3-基)苯磺酰胺(0.001mol)、环己基甲醛(0.001mol)、丙二酸二甲酯(0.0015mol),加入甲苯(40ml)为溶剂,升温回流,tlc监测反应进程,5小时候结束反应,减压回收甲苯,经过柱色谱分离(正己烷:乙酸乙酯=7:1 v/v)得到目标产物。
[0042]
实施例7:2-(1-((4-(n-(5-甲基异恶唑-3-基)氨磺酰基)苯基) 氨基)己基)丙二酸二乙酯;
[0043]
在100ml单口瓶中,加入4-氨基-n-(5-甲基异恶唑-3-基)苯磺酰胺(0.001mol)、己醛(0.001mol)、丙二酸二乙酯(0.0015mol),加入甲苯(40ml)为溶剂,升温回流,tlc监测反应进程,5小时候结束反应,减压回收甲苯,经过柱色谱分离(正己烷:乙酸乙酯=7:1v/v) 得到目标产物。
[0044]
对上述实施例i
1-i7合成的丙二酸酯类化合物的收率、物理形态与元素分析如表1所示,核磁共振氢谱(1h nmr)数据如表2所示、核磁共振碳谱(
13
c nmr)数据如表3所示,红外光谱(ir)数据如表 4所示,质谱(ms)数据如表5所示:
[0045]
表1目标化合物的理化性质与元素分析
[0046][0047]
表2目标化合物的1h nmr数据
[0048]
[0049][0050]
表3目标化合物的
13
c nmr数据
[0051]
[0052][0053]
表4目标化合物的红外数据
[0054]
化合物ir(kbr)(cm-1
)i13378,3238,1629,1473,1383,1254,1231,1022,1016,832,679,652i23368,3225,1690,1453,1345,1262,1220,1064,1048,846,619,685i33482,3378,1730,1429,1341,1236,1158,1004,963,819,649i43348,3226,1620,1426,1356,1228,1265,1019,965,828,728i53315,3243,1631,1469,1308,1237,1171,1088,974,830,769i63364,3236,1685,1494,1346,1232,1219,1137,1046,934,846i73337,3280,1646,1467,1371,1223,1166,1058,1012,851,668
[0055]
表5目标化合物的质谱
[0056]
化合物ms(esi):m/zi1502([m+h]
+
),524([m+na]
+
),540([m+k]
+
).i2564([m+h]
+
),586([m+na]
+
),602([m+k]
+
)i3488([m+h]
+
),510([m+na]
+
),526([m+k]
+
)i4532([m+h]
+
),554([m+na]
+
),570([m+k]
+
)i5492([m+h]
+
),514([m+na]
+
),530([m+k]
+
)i6480([m+h]
+
),502([m+na]
+
),518([m+k]
+
)i7496([m+h]
+
),518([m+na]
+
),534([m+k]
+
)
[0057]
实施例8:目标化合物抗黄瓜花叶病毒治疗、钝化和保护活性
[0058]
(1)测试方法
[0059]
a.病毒提纯
[0060]
采用张建方法(zhang,j.;et al.,2017),选取接种3周以上,cmv 系统侵染寄主nicotiana tabacum.l植株上部叶片,在磷酸缓冲液中匀浆,双层纱布过滤,8000g离心,经过2次聚乙二醇处理,再离心,沉淀用磷酸缓冲液悬浮,即得到cmv精提液体。整个实验在4℃下进行,用紫外分光光度计测定260nm波长的吸光度,根据公式计算病毒浓度。
[0061]
病毒浓度(mg/ml)=(a260
×
稀释倍数)/e0.1%1cm 260nm
[0062]
其中e表示消光系数,即波长260nm时,浓度为0.1%(1mg/ml) 的悬浮液,在光程为l厘米时的光吸收(光密度)值。cmv的e0.1%1 cm 260nm是5.0。
[0063]
b、药剂对cmv侵染的活性治疗作用:选长势一致的5-6叶期笕色黎打顶,向全叶撒匀金刚砂,用排笔蘸取病毒汁(6
×
10-3mg/ml) 全叶接种病毒,自然晾干后用清水冲洗。待叶片干后,用毛笔在左半叶轻轻涂施药剂,右半叶涂施对应溶剂的浓度作为对照,6-7天后记录枯斑数,按下列公式计算抑制率。
[0064]
c、药剂对cmv侵染的活体保护作用
[0065]
药剂对cmv侵染的活体保护作用:选长势一致的5-6叶期笕色黎打顶,用毛笔在左半叶轻轻涂施药剂,右半叶涂施对应浓度的溶剂作对照,24小后向全叶撒匀金刚砂,用排笔蘸取病毒汁(6
×ꢀ
10-3mg/ml)全叶接种病毒,用清水冲洗,6-7天后记录枯斑数,按下列公式
计算抑制率。
[0066]
d、药剂对cmv侵染的活体钝化作用
[0067]
药剂对cmv侵染的活体钝化作用:选长势一致的5-6叶期笕色黎打顶,向全叶撒匀金刚砂,用磷酸缓冲液将cmv;病毒稀释至6
×ꢀ
10-3mg/ml,将化合物与等体积的病毒汁液混合钝化30分钟,用排笔人工摩擦接种于撒有金刚砂的适龄笕色黎左半业,对应剂量的溶剂与病毒汁液混合接种于撒有金刚砂的适龄笕色黎右半叶,6-7天后记录枯斑数,按下列公式计算抑制率。
[0068]
x%=(ck-t)/ck
×
100
[0069]
x:相对抑制率(%),
[0070]
ck:未涂施药剂半叶的平均枯斑数
[0071]
t:涂施药剂半叶的平均枯斑数
[0072]
其中,ck与t都采用各组三次重复的平均数
[0073]
(2)生物测试结果
[0074]
表6目标化合物对黄瓜花叶病毒的治疗、保护、钝化活性
[0075][0076]
采用半叶枯斑法,浓度为500mg/l,以宁南霉素为对照药剂测试了目标化合物的抗cmv活性,从表6生物活性测定结果可以看出丙二酸酯类化合物对cmv均具有中等到优秀的抑制活性,其中化合物 i5在治疗、保护、钝化方面,均优于对照药剂宁南霉素。
[0077]
为了进一步研究丙二酸酯类化合物抗cmv活性,我们测定了该类化合物中i3和i5的治疗ec
50
值,结果见表7。
[0078]
表7部分目标化合物对cmv的治疗活性的ec
50
值
[0079][0080]
结果可以看出,化合物中i3和i5对cmv治疗活性的ec
50
分别为209.4和193.5μg/ml,均优于对照药剂宁南霉素235.1μg/ml。
[0081]
实施例9:目标化合物对黄瓜灰霉病菌、有害疣孢霉菌、嗜菌葡枝霉菌的抑制活性
[0082]
(1)测试方法
[0083]
采用离体生长速率法(tarun,k.c.;et al.,2006)测定化合物的抑菌活性。加热马铃薯葡萄糖琼脂培养基(pda培养基:马铃薯200g、琼脂20g、葡萄糖20g、蒸馏水1000ml)至溶融状态(40~60℃),将10 ml药液(10倍终浓度的药液)倒入90ml pda培养基中,充分摇匀,均匀倒入直径9cm的培养皿内,水平放置,待冷却凝固。在已经培养4d的新鲜病原菌菌落边缘用打孔器打取直径为4mm的菌碟,将菌碟倒置于含药剂pda平板中央,然后置于27℃恒温恒湿培养箱中倒置培养,待空白对照菌落生长至接近平皿三分之二处时开始观测,十字交叉法测量菌落直径,取平均值(宋素琴,等,2004)。空白对照不加药剂,但含有同样浓度的溶剂和0.5%tween 20,每处理重复三次。通过以下公式计算药剂对菌丝生长的抑制率:
[0084]
i(%)=(c-t)/(c-0.4)
×
100%
[0085]
其中i为抑制率,c为空白对照直径(cm),t为处理直径(cm)。
[0086]
(2)生物测试结果
[0087]
表8目标化合物对黄瓜灰霉病菌、有害疣孢霉菌、嗜菌葡枝霉菌的抑制活性
[0088][0089]
从表8生测活性测试结果可以看出,在50μg/ml浓度下,大多数化合物对黄瓜灰霉病菌、有害疣孢霉菌、嗜菌葡枝霉菌表现出较高的抑制活性。其中化合物中i5对黄瓜灰霉病菌、有害疣孢霉菌、嗜菌葡枝霉菌的抑制率均高于90%,明显优于商品化对照药剂恶霉灵。
[0090]
实施例10:目标化合物对猕猴桃溃疡病菌、应变假单胞杆菌的抑制活性
[0091]
(1)测试方法
[0092]
采用浊度法(yang l.;et al.,2017)测定化合物的杀菌活性。制备浓度为100μg/ml的被测化合物。配制nb培养基(3.0g牛肉提取物, 5.0g蛋白胨,1.0g酵母粉,10.0g葡萄糖,1000ml蒸馏水,ph 7.0-7.2),分别用接菌环划一小块含有烟草青枯病菌、魔芋软腐病菌的培养基放入两个nb培养基中,塞好塞子,在28℃,180rpm恒温摇床振荡培养到生长对数期(od=0.6-0.8)备用。取40μl的菌液、 4ml水-吐温(1%吐温20)、1ml配制好的化合物溶液,将试管 28
±
1℃下培养,并以180rpm连续摇动1-3天。通过测量600nm (od600)处的光密度来监测细菌的生长,但含有同样浓度的溶剂和 0.1%tween 20作为空白对照,噻菌铜作为对照药剂,每处理重复三次。通过以下公式计算药剂对细菌的抑制率:
[0093]
i=(ctur-ttur)/ctur
×
100%
[0094]
其中i为抑制率,ctur代表未经药物处理的试管中细菌生长的校正的浊度值(空白
对照),ttur代表经化合物处理的试管中细菌生长的校正的浊度值。
[0095]
(2)生物测试结果
[0096]
表9目标化合物对猕猴桃溃疡病菌、应变假单胞杆菌的抑制活性
[0097][0098]
从表9生测活性测试结果可以看出,在100μg/ml浓度下,部分化合物对猕猴桃溃疡病菌、应变假单胞杆菌表现出较好的抑制活性,其中化合物i5对猕猴桃溃疡病菌、应变假单胞杆菌的抑制活性与商品化对照药剂噻菌铜相当。
[0099]
本发明实施例辅以说明本发明的技术方案。本发明效果是合成路线简单、产率较高,得到新型、高效的对黄瓜花叶病毒、黄瓜灰霉病菌、有害疣孢霉菌、嗜菌葡枝霉菌、猕猴桃溃疡病菌、应变假单胞杆菌具有抑制作用的新药剂。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1