一种基于2,7-二溴-9-芴酮-4-甲酸的衍生物及其合成方法
1.本发明属于有机合成技术领域,具体涉及一种基于2,7-二溴-9-芴酮-4-甲酸的衍生物及其合成方法。
背景技术:
2.有机薄膜晶体管(organic thin film transistor,otft)是以有机半导体材料为有源层的场效应晶体管器件,otfts具有众多的优点,例如成本低廉、延展性好、成膜技术方便、器件尺寸小、集成度高、制作工艺简单、柔韧性好、较好的生物兼容性,质量轻且携带方便,可实现大面积化显示器的控制,材料来源广泛等(kumar,b.;kaushik,b.k.;negi,y.s.,organic thin film transistors:structures,models,materials,fabrication,and applications:a review.polymer reviews 2014,54(1),33-111.)。自其开始发展以来,就受到国内外研究人员的青睐和追捧,目前的研究热点是如何制备出具有高迁移率且在空气稳定存在的半导体材料。
3.在聚合物太阳能电池(pscs)领域,pscs以其制备工艺简单,价格低廉,材料来源广泛,分子结构设计多样,质轻和可制成大面积柔性光伏材料等优点成为传统太阳能电池有力的竞争者(hoppe h,sariciftci n s.organic solar cells:an overview[j].j.mater.res.,2004,19(7):1924-1945.),目前,给受体材料的发展使得pscs的效率有了很大提高,制备高迁移率,低带隙且具有长期稳定性的共轭聚合物是持续的研究热点之一。
[0004]
在光电材料领域,芴类化合物一直受到人们的青睐。芴具有特殊的刚性平面联苯结构,具有较高的热稳定性和光化学稳定性,有较大的共轭吸收波长,活性位点易于修饰和引入多种官能团,产量高成本低等优点,基于芴的衍生物通常有较大的电子离域,较好的空穴传输性能,已经被广泛用于制备有机光电功能材料,但其性能仍需要进一步提高,因此还需要进一步研究。
技术实现要素:
[0005]
本发明提供了一种基于2,7-二溴-9-芴酮-4-甲酸的衍生物及其合成方法,通过酯化反应在2,7-二溴-9-芴酮-4-甲酸的4位引入一个酯基,一方面可以改善基于此类单体聚合物的溶解性,另一方面改善聚合物的共面性能,从而有利于电荷的传输,提高迁移率,适于制备晶体管;而在9位的羰基活性位点,引入丙二腈或者烷基取代的罗丹宁,可以获得较窄带隙的聚合物,改善聚合物的光谱吸收,从而能够进一步提高聚合物太阳能电池的开路电压及光电转换效率,因此适宜于制备太阳能电池。
[0006]
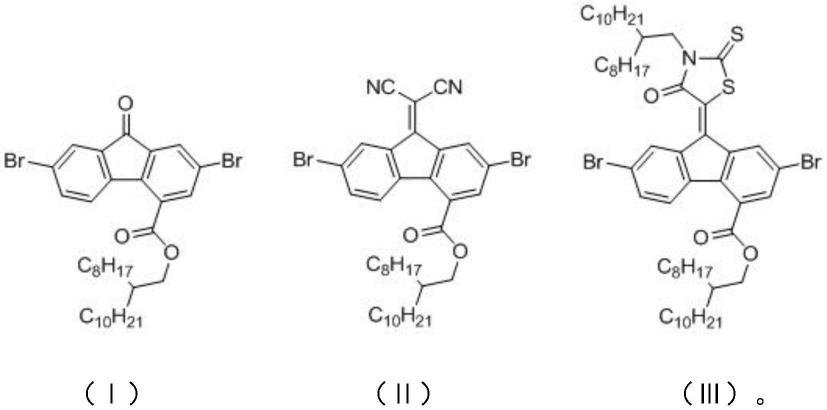
一种基于2,7-二溴-9-芴酮-4-甲酸的衍生物,其结构如式(ⅰ)~(ⅲ)所示:
[0007][0008]
优选地,所述基于2,7-二溴-9-芴酮-4-甲酸的衍生物的合成方法,包括以下步骤:
[0009]
s1:以氢氧化钾与罗丹宁为原料,制得3-罗丹宁钾盐;3-罗丹宁钾盐与1-溴-2-辛基十二烷反应,制得3
–
(2
–
辛基十二烷基)罗丹宁;
[0010]
联苯二甲酸与二溴异氰尿酸反应,制得4,4
’‑
二溴-2,2
’‑
二羧基联苯;4,4
’‑
二溴-2,2
’‑
二羧基联苯与浓硫酸反应制得2,7-二溴-9-芴酮-4-甲酸;
[0011]
s2:s1制得的2,7-二溴-9-芴酮-4-甲酸与草酰氯反应,制得式(ⅰ)化合物;
[0012]
s3:式(ⅰ)化合物与丙二腈、吡啶反应,制得式(ⅱ)化合物;
[0013]
式(ⅰ)化合物和s1制得的3
–
(2
–
辛基十二烷基)罗丹宁、吡啶反应,制得式(ⅲ)化合物;
[0014]
其反应路线如下所示:
[0015][0016]
优选地,所述3-罗丹宁钾盐具体是通过以下步骤制得:
[0017]
将氢氧化钾和罗丹宁溶于乙醇,80℃反应2h后,冷却、析出固体,洗涤所得固体、干燥,制得3-罗丹宁钾盐;
[0018]
所述氢氧化钾和罗丹宁的摩尔比为6.3∶4;所述氢氧化钾与乙醇的用量比为0.063mol:12ml。
[0019]
优选地,所述3
–
(2
–
辛基十二烷基)罗丹宁是通过以下步骤制得:
[0020]
将所述3-罗丹宁钾盐和1-溴-2-辛基十二烷溶于n,n-二甲基甲酰胺中,100℃反应4h,水洗、萃取、干燥、过柱,即得3
–
(2
–
辛基十二烷基)罗丹宁;
[0021]
所述3-罗丹宁钾盐与1-溴-2-辛基十二烷的摩尔比为1∶1。
[0022]
优选地,所述4,4
’‑
二溴-2,2
’‑
二羧基联苯具体是通过以下步骤制得:
[0023]
将联苯二甲酸溶于浓硫酸,之后0℃加入二溴异氰尿酸,室温反应24h,冷却、过滤、洗涤、重结晶、干燥,制得4,4
’‑
二溴-2,2
’‑
二羧基联苯;
[0024]
所述联苯二甲酸与二溴异氰尿酸的摩尔比为1∶1,所述联苯二甲酸与所述浓硫酸的用量比为1mol:7.3l。
[0025]
优选地,所述2,7-二溴-9-芴酮-4-甲酸具体是通过以下步骤制得:
[0026]
将4,4
’‑
二溴-2,2
’‑
二羧基联苯溶于浓硫酸,120℃反应1h,冷却、过滤、水洗、干燥、重结晶,制得2,7-二溴-9-芴酮-4-甲酸;
[0027]
所述4,4
’‑
二溴-2,2
’‑
二羧基联苯与浓硫酸的用量比为1.25mol:1l。
[0028]
优选地,所述式(ⅰ)化合物具体是通过以下步骤制得:
[0029]
2,7-二溴-9-芴酮-4-甲酸溶于二氯甲烷,滴加n,n-二甲基甲酰胺,并加入草酰氯,室温反应3h,去除溶剂、固体洗涤;生成的酰氯加入2-辛基十二醇,130℃反应过夜,冷却、柱层析,制得式(ⅰ)化合物;
[0030]
所述2,7-二溴-9-芴酮-4-甲酸与草酰氯的摩尔比为1∶1.5,所述2,7-二溴-9-芴酮-4-甲酸与二氯甲烷的用量比为1mol:12.7l。
[0031]
优选地,所述式(ⅱ)化合物具体是通过以下步骤制得:
[0032]
将所述式(ⅰ)化合物和丙二腈溶于氯仿,并加入吡啶,加热回流,搅拌过夜,去除溶剂、柱层析,制得式(ⅱ)化合物;
[0033]
所述式(ⅰ)化合物与丙二腈的摩尔比为1∶2.2,所述式(ⅰ)化合物和吡啶的摩尔比为1∶3,所述式(ⅰ)化合物与氯仿的用量比为1mol:15.3l。
[0034]
优选地,所述式(ⅲ)化合物具体是通过以下步骤制得:
[0035]
将所述式(ⅰ)化合物和所述3
–
(2
–
辛基十二烷基)罗丹宁溶于氯仿,并加入吡啶,加热回流,搅拌过夜,去除溶剂、柱层析,制得式(ⅲ)化合物;
[0036]
所述式(ⅰ)化合物和所述3
–
(2
–
辛基十二烷基)罗丹宁的摩尔比为1∶1.5,所述式(ⅰ)化合物和吡啶的摩尔比为1∶3,所述式(ⅰ)化合物与氯仿的用量比为1mol:15.3l。
[0037]
本发明与现有技术相比具有如下有益效果:
[0038]
(1)本发明提供的衍生物基于2,7-二溴-9-芴酮-4-甲酸,在其4位引入一个酯基,一方面保证这种衍生物和基于这种衍生物聚合物的溶解性,另一方面改善聚合物的结构单位的共平面性,相比之前在其他单体上引入改性基团造成结构单元的扭曲、共平面性下降的情形,基于上述衍生物的聚合物拥有更好的平面性能,有利于电子或者空穴的传输,从而提高器件性能;
[0039]
(2)本发明提供的衍生物基于2,7-二溴-9-芴酮-4-甲酸,在化合物(ⅰ)的基础上,在9位引入吸电子基团,可以改善化合物的光谱吸收,改变基于此种单体的聚合物的光物理和电化学性质,从而有利于器件性能的提高;
[0040]
(3)本发明提供的衍生物原材料来源丰富,合成路线简单,产率高;
[0041]
(4)本发明提供的衍生物在氯仿、二氯甲烷、四氢呋喃中有着良好的溶解性。
附图说明
[0042]
图1是实施例1制得的式(ⅰ)化合物的氢谱:
[0043]
图2是实施例1制得的式(ⅰ)化合物的碳谱;
[0044]
图3是实施例1制得的式(ⅱ)化合物的氢谱:
[0045]
图4是实施例1制得的式(ⅱ)化合物的碳谱;
[0046]
图5是实施例1制得的式(ⅲ)化合物的氢谱:
[0047]
图6是实施例1制得的式(ⅲ)化合物的碳谱。
具体实施方式
[0048]
为了使本领域技术人员更好地理解本发明的技术方案能予以实施,下面结合具体实施例和附图对本发明作进一步说明,但所举实施例不作为对本发明的限定。
[0049]
实施例1
[0050]
(1)3-罗丹宁钾盐的合成
[0051]
将氢氧化钾(2.80g,0.063mol)溶于12ml乙醇,然后将其滴加到罗丹宁(5.33g,0.04mol)的乙醇溶液中,升温至80℃,反应两个小时,先冷却至室温,后置于冰浴中,将析出的固体过滤,用冷的乙醇洗涤,干燥得产品3-罗丹宁钾盐(4.84g,产率:56%),产品直接用于下一步;
[0052]
(2)3
–
(2
–
辛基十二烷基)罗丹宁的合成
[0053]
将3-罗丹宁钾盐(1.713g,0.01mol)加入到15ml无水n,n-二甲基甲酰胺中,缓慢加入1-溴-2-辛基十二烷(3.6g,0.01mol),之后升温至100℃反应四个小时,反应结束后,倒入30ml水中,用二氯甲烷萃取,用水洗涤有机相,之后用无水硫酸钠干燥,减压除去溶剂,粗品柱层析提纯得浅黄色油状物(2.73g,产率:66%);
[0054]1h nmr(300mhz,cdcl3,ppm)δ:3.96(s,2h),3.37(d,j=6.2hz,2h),1.77-1.71(m,1h),1.35-1.26(m,32h),0.87(t,j=6.4hz,6h).
[0055]
13
c nmr(75mhz,cdcl3,ppm)δ:202.57,187.60,39.47,38.91,37.28,33.11,31.90,31.86,29.79,29.61,29.52,29.48,29.32,29.27,26.44,22.67,22.65,14.10.
[0056]
(3)4,4
’‑
二溴-2,2
’‑
二羧基联苯的合成
[0057]
联苯二甲酸(5g,20.64mmol)溶于150ml浓硫酸,置于冰浴下,向上述溶液中逐份加入二溴异氰尿酸(6.04g,21.05mmol),反应液升至室温,搅拌24小时,反应结束后,将反应液倒入冰中,过滤,滤饼用水洗涤,干燥,粗品用甲醇进行低温重结晶得纯品;
[0058]
(4)2,7-二溴-9-芴酮-4-甲酸的合成
[0059]
4,4
’‑
二溴-2,2
’‑
二羧基联苯(7g,17.5mmol)溶于14ml浓硫酸中,反应液升温至120℃,搅拌一小时,反应结束后,冷却倒入冰中,过滤,滤饼用水洗涤,干燥得粗品。粗品用乙酸重结晶,得黄色固体(4.75g,产率:71%);
[0060]1h nmr(300mhz,[d6]dmso,ppm)δ:8.38(d,j=7.1hz,1h),7.90(s,1h),7.72-7.67(m,3h).
[0061]
(5)式(ⅰ)化合物的合成
[0062]
2,7-二溴-9-芴酮-4-甲酸(1.2g,3.15mmol)溶于40ml无水二氯甲烷中,加入两滴无水的n,n-二甲基甲酰胺(dmf),于冰浴下逐滴加入草酰氯(0.62g,4.84mmol),恢复室温继续搅拌三小时,减压除去溶剂,固体用正己烷洗涤,直接用于下一步;将生成的酰氯置于25ml单口圆底烧瓶中,加入5ml 2-辛基十二醇,130℃回流过夜,tlc监控,反应结束后,将反应液冷至室温,柱层析提纯得黄色油状物(1.36g,产率:65%);
[0063]
由图1可得,1h nmr(400mhz,cdcl3,ppm)δ:8.22(d,j=8.4hz,1h),8.06(d,j=2.0hz,1h),7.9(d,j=2.0hz 1h),7.79(d,j=1.9hz,1h),7.63-7.60(dd,j1=2.0hz,j2=2.0hz,1h),4.31(d,j=5.8hz,2h),1.84-1.79(m,1h),1.43-1.25(m,32h),0.88-0.85(m,6h).
[0064]
由图2可得,
13
c nmr(100mhz,cdcl3,ppm)δ:190.18,165.20,142.08,141.20,
138.51,137.80,136.69,135.59,130.49,128.59,128.10,127.40,124.31,122.68,69.00,37.36,31.91,31.88,31.35,29.92,29.65,29.63,29.60,29.55,29.34,29.31,26.74,22.68,22.67,14.11.
[0065]
(6)式(ⅱ)化合物的合成
[0066]
氩气氛围下,将式(ⅰ)化合物(0.65g,0.98mmol)和丙二腈(0.14g,2.2mmol)溶于15ml的氯仿中,加入吡啶(0.24ml,2.94mmol),加热至回流,搅拌过夜。tlc监控反应,反应结束后,减压除去溶剂,所得粗品柱层析提纯得桔红色固体(0.63g,产率:90.4%);
[0067]
由图3可得,1h nmr(300mhz,cdcl3,ppm)δ:8.68(d,j=1.3hz,1h),8.54(d,j=1.0hz,1h),8.14(d,j=8.5hz,1h),8.01(d,j=1.4hz 1h),7.65-7.61(dd,j1=1.4hz,j2=1.4hz,1h),4.32(d,j=5.8,2h),1.83-1.80(m,1h),1.36-1.25(m,32h),0.88(t,j=6hz,6h).
[0068]
由图4可得,
13
c nmr(75mhz,cdcl3)δ:165.21,157.44,139.22,138.65,138.33,137.85,136.92,135.83,131.96,129.34,129.09,127.54,124.27,122.52,112.60,112.52,78.24,69.35,37.37,31.92,31.90,31.33,29.93,29.65,29.61,29.57,29.36,29.32,26.74,22.70,14.13.
[0069]
(7)式(ⅲ)化合物的合成
[0070]
氩气氛围下,将式(ⅰ)化合物(0.65g,0.98mmol)和3
–
(2
–
辛基十二烷基)罗丹宁(0.61g,1.47mmol)溶于15ml的氯仿中,加入吡啶(0.24ml,2.94mmol),加热至回流,搅拌过夜,tlc监控反应,反应结束后,减压除去溶剂,所得粗品柱层析提纯得桔红色油(0.92g,产率:89%);
[0071]
由图5可得,1h nmr(300mhz,cdcl3,ppm)δ:9.73-9.57(m,1h),8.05-8.02(m,1h),7.93-7.91(m,1h),7.85-7.82(m,1h),7.49-7.46(m,1h),4.32-4.30(m,2h),3.53-3.49(m,2h),1.85-1.81(m,2h),1.36-1.26(m,64h),0.87(t,j=5.6hz,12h).
[0072]
由图6可得,
13
c nmr(75mhz,cdcl3,ppm)δ:189.79,189.36,178.50,166.53,166.30,141.70,140.58,140.22,138.59,137.53,137.23,134.84,134.19,133.58,131.73,130.45,130.23,129.25,128.60,127.84,126.47,125.35,123.72,122.47,121.80,120.58,69.00,68.86,38.68,37.44,33.21,31.92,31.89,31.35,29.95,29.82,29.64,29.57,29.54,29.51,29.35,26.76,26.49,22.68,14.11.
[0073]
本发明通过酯化反应在2,7-二溴-9-芴酮-4-甲酸在的4位引入一个酯基,一方面可以改善基于此类衍生物聚合物的溶解性,另一方面改善聚合物的共面性能,从而有利于电荷的传输,提高迁移率,适于制备晶体管;而在9位的羰基活性位点,引入丙二腈或者烷基取代的罗丹宁,可以获得较窄带隙的聚合物,改善聚合物的光谱吸收,从而能够进一步提高聚合物太阳能电池的开路电压及光电转换效率,因此适宜于制备太阳能电池。
[0074]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1