一种基于XAD16大孔树脂提取表面活性素的快速提取方法与流程
h,得到种子液;s2:按照1%的接种量将所述种子液转接至50ml的msm培养基中,并在msm培养基加入1mlxad16,在30℃、200rpm的条件下发酵48h,即得发酵菌液。
8.优选的,所述步骤s1中,含有表面活性素的菌株为b.siamensisjfl15菌株。
9.优选的,所述步骤s1中,lb平板培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml,琼脂粉20g;所述lb平板培养基的ph值为7.2-7.4。
10.优选的,所述步骤s1中,lb液体培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml;所述lb液体培养基的ph值为7.2-7.4。
11.优选的,所述步骤s2中,msm培养基的组分为:蔗糖20g,nh4cl4g,kh2po43g,na2hpo410g,mgso40.2g,酵母膏0.2g,cacl20.7μg,mnso41μg,蒸馏水1l;所述msm培养基的ph值为7.0。
12.优选的,所述步骤s2中,所述xad16大孔树脂在使用前需要对其进行预处理,对xad16大孔树脂进行预处理的步骤如下:步骤a:取250g的xad16大孔树脂悬浮在1.5l去离子水中,而后用5%的hcl调节悬浮液的ph值至7.0~7.5,待xad16大孔树脂全部沉降至底部后,倒掉上清液,得到xad16大孔树脂沉淀物;步骤b:使用去离子水对步骤a中得到的xad16大孔树脂沉淀物清洗3-4次;而后在xad16大孔树脂沉淀物中加入丙酮,至丙酮没过xad16大孔树脂1cm,浸泡0.5~1.5h后,倒掉丙酮;步骤c:重复步骤b的操作,3次后在xad16大孔树脂沉淀物中加入甲醇至没过xad16大孔树脂1cm,浸泡2-4h后倒掉甲醇;而后使用双蒸水对xad16大孔树脂进行冲洗,3~4次后再使用600ml的双蒸水保存xad16大孔树脂,并对其进行分装,在121℃的条件下灭菌30min后备用。
13.与现有技术相比,本发明具有如下有益效果:本发明所采用的提取工艺,整个提取过程耗时5h左右,与酸沉淀法的72h相比,提取速率提高了14.4倍,极大的提高了提取效率;同时,本发明的提取工艺仅通过对细胞进行破碎操作即可对胞内的表面活性素进行提取,操作简单,有效的降低了提取成本。
附图说明
14.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍。
15.图1为表面活性素标准品的hplc色谱图;图2为表面活性素的标准曲线图;图3为采用本发明实施例1-3的方法提取的表面活性素的hplc色谱图。
具体实施方式
16.为了使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的部分实施例,而不是全部实施例。
17.本发明提供的一种基于xad16大孔树脂提取表面活性素的快速提取方法,包括如下步骤:步骤1:取50ml发酵菌液转移至50ml的离心管中,在7000-9000rpm的条件下离心5-15min,得到上清液1、及含有菌体以及xad16大孔树脂的沉淀物1;步骤2:在所述沉淀物1中加入甲醇,而后进行超声处理,15-30min后将混合物倒入三角瓶中,先在25-35℃、150-200rpm的条件下震荡2-4h,而后在7000-9000rpm的条件下离心10-20min,得到上清液2;步骤3:将所述上清液2通过滤纸过滤到100ml的尖底烧瓶中,并使用旋转蒸发仪进行真空浓缩,得到粗提物;步骤4:使用0.5-1.5ml的甲醇对所述粗提物进行溶解,完全溶解后,使用移液枪吸出复溶的粗提物,在11000-13000rpm的条件下离心5-15min,即得到表面活性素溶液。
18.其中,所述步骤1中发酵菌液的制作步骤如下:s1:将含有表面活性素的菌株接种至lb平板培养基上,在37℃的条件下活化培养12h;而后取活化后的单菌落转接于lb液体培养基中,在37℃、200rpm的条件下培养12h,得到种子液。具体的,含有表面活性素的菌株为b.siamensisjfl15菌株;所述步骤s1中,lb平板培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml,琼脂粉20g;所述lb平板培养基的ph值为7.2-7.4;所述步骤s1中,lb液体培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml;所述lb液体培养基的ph值为7.2-7.4。
19.s2:按照1%的接种量将所述种子液转接至50ml的msm培养基中,并在msm培养基加入1mlxad16,在30℃、200rpm的条件下发酵48h,即得发酵菌液;其中所述msm培养基的组分为:蔗糖20g,nh4cl4g,kh2po43g,na2hpo410g,mgso40.2g,酵母膏0.2g,cacl20.7μg,mnso41μg,蒸馏水1l;所述msm培养基的ph值为7.0。
20.所述xad16大孔树脂在使用前需要对其进行预处理,对xad16大孔树脂进行预处理的步骤如下:步骤a:取250g的xad16大孔树脂悬浮在1.5l去离子水中,而后用5%的hcl调节悬浮液的ph值至7.0~7.5,待xad16大孔树脂全部沉降至底部后,倒掉上清液,得到xad16大孔树脂沉淀物;步骤b:使用去离子水对步骤a中得到的xad16大孔树脂沉淀物清洗3-4次;而后在xad16大孔树脂沉淀物中加入丙酮,至丙酮没过xad16大孔树脂1cm,浸泡0.5~1.5h后,倒掉丙酮;步骤c:重复步骤b的操作,3次后在xad16大孔树脂沉淀物中加入甲醇至没过xad16大孔树脂1cm,浸泡2-4h后倒掉甲醇;而后使用双蒸水对xad16大孔树脂进行冲洗,3~4次后再使用600ml的双蒸水保存xad16大孔树脂,并对其进行分装,在121℃的条件下灭菌30min后备用。
21.实施例1:对xad16大孔树脂进行预处理,步骤如下:步骤a:取250g的xad16大孔树脂悬浮在1.5l去离子水中,而后用5%的hcl调节悬浮液的ph值至7.0~7.5,待xad16大孔树脂全部沉降至底部后,倒掉上清液,得到xad16大孔
树脂沉淀物;步骤b:使用去离子水对步骤a中得到的xad16大孔树脂沉淀物清洗3-4次;而后在xad16大孔树脂沉淀物中加入丙酮,至丙酮没过xad16大孔树脂1cm,浸泡0.5h后,倒掉丙酮;步骤c:重复步骤b的操作,3次后在xad16大孔树脂沉淀物中加入甲醇至没过xad16大孔树脂1cm,浸泡2h后倒掉甲醇;而后使用双蒸水对xad16大孔树脂进行冲洗,3~4次后再使用600ml的双蒸水保存xad16大孔树脂,并对其进行分装,在121℃的条件下灭菌30min后备用。
22.制作发酵菌液,步骤如下:s1:将含有表面活性素的菌株接种至lb平板培养基上,在37℃的条件下活化培养12h;而后取活化后的单菌落转接于lb液体培养基中,在37℃、200rpm的条件下培养12h,得到种子液。具体的,含有表面活性素的菌株为b.siamensisjfl15菌株;所述步骤s1中,lb平板培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml,琼脂粉20g;所述lb平板培养基的ph值为7.2-7.4;所述步骤s1中,lb液体培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml;所述lb液体培养基的ph值为7.2-7.4。
23.s2:按照1%的接种量将所述种子液转接至50ml的msm培养基中,并在msm培养基加入1mlxad16,在30℃、200rpm的条件下发酵48h,即得发酵菌液;其中所述msm培养基的组分为:蔗糖20g,nh4cl4g,kh2po43g,na2hpo410g,mgso40.2g,酵母膏0.2g,cacl20.7μg,mnso41μg,蒸馏水1l;所述msm培养基的ph值为7.0。
24.提取表面活性素,包括如下步骤:步骤1:取50ml发酵菌液转移至50ml的离心管中,在7000rpm的条件下离心5min,得到上清液1、及含有菌体以及xad16大孔树脂的沉淀物1;步骤2:在所述沉淀物1中加入20ml甲醇,而后进行超声处理,15min后将混合物倒入三角瓶中,先在25℃、150rpm的条件下震荡2h,而后在7000rpm的条件下离心10min,得到上清液2;步骤3:将所述上清液2通过滤纸过滤到100ml的尖底烧瓶中,并使用旋转蒸发仪进行真空浓缩,得到粗提物;步骤4:使用0.5ml的甲醇对所述粗提物进行溶解,完全溶解后,使用移液枪吸出复溶的粗提物,在11000rpm的条件下离心5min,即得到表面活性素溶液。
25.实施例2对xad16大孔树脂进行预处理,步骤如下:步骤a:取250g的xad16大孔树脂悬浮在1.5l去离子水中,而后用5%的hcl调节悬浮液的ph值至7.0~7.5,待xad16大孔树脂全部沉降至底部后,倒掉上清液,得到xad16大孔树脂沉淀物;步骤b:使用去离子水对步骤a中得到的xad16大孔树脂沉淀物清洗3-4次;而后在xad16大孔树脂沉淀物中加入丙酮,至丙酮没过xad16大孔树脂1cm,浸泡1h后,倒掉丙酮;步骤c:重复步骤b的操作,3次后在xad16大孔树脂沉淀物中加入甲醇至没过xad16大孔树脂1cm,浸泡3h后倒掉甲醇;而后使用双蒸水对xad16大孔树脂进行冲洗,3~4次后
再使用600ml的双蒸水保存xad16大孔树脂,并对其进行分装,在121℃的条件下灭菌30min后备用。
26.制作发酵菌液,步骤如下:s1:将含有表面活性素的菌株接种至lb平板培养基上,在37℃的条件下活化培养12h;而后取活化后的单菌落转接于lb液体培养基中,在37℃、200rpm的条件下培养12h,得到种子液。具体的,含有表面活性素的菌株为b.siamensisjfl15菌株;所述步骤s1中,lb平板培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml,琼脂粉20g;所述lb平板培养基的ph值为7.2-7.4;所述步骤s1中,lb液体培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml;所述lb液体培养基的ph值为7.2-7.4。
27.s2:按照1%的接种量将所述种子液转接至50ml的msm培养基中,并在msm培养基加入1mlxad16,在30℃、200rpm的条件下发酵48h,即得发酵菌液;其中所述msm培养基的组分为:蔗糖20g,nh4cl4g,kh2po43g,na2hpo410g,mgso40.2g,酵母膏0.2g,cacl20.7μg,mnso41μg,蒸馏水1l;所述msm培养基的ph值为7.0。
28.提取表面活性素,包括如下步骤:步骤1:取50ml发酵菌液转移至50ml的离心管中,在8000rpm的条件下离心10min,得到上清液1、及含有菌体以及xad16大孔树脂的沉淀物1;步骤2:在所述沉淀物1中加入30ml甲醇,而后进行超声处理,20min后将混合物倒入三角瓶中,先在30℃、180rpm的条件下震荡3h,而后在8000rpm的条件下离心15min,得到上清液2;步骤3:将所述上清液2通过滤纸过滤到100ml的尖底烧瓶中,并使用旋转蒸发仪进行真空浓缩,得到粗提物;步骤4:使用1ml的甲醇对所述粗提物进行溶解,完全溶解后,使用移液枪吸出复溶的粗提物,在12000rpm的条件下离心10min,即得到表面活性素溶液。
29.实施例3对xad16大孔树脂进行预处理,步骤如下:步骤a:取250g的xad16大孔树脂悬浮在1.5l去离子水中,而后用5%的hcl调节悬浮液的ph值至7.0~7.5,待xad16大孔树脂全部沉降至底部后,倒掉上清液,得到xad16大孔树脂沉淀物;步骤b:使用去离子水对步骤a中得到的xad16大孔树脂沉淀物清洗3-4次;而后在xad16大孔树脂沉淀物中加入丙酮,至丙酮没过xad16大孔树脂1cm,浸泡1.5h后,倒掉丙酮;步骤c:重复步骤b的操作,3次后在xad16大孔树脂沉淀物中加入甲醇至没过xad16大孔树脂1cm,浸泡4h后倒掉甲醇;而后使用双蒸水对xad16大孔树脂进行冲洗,3~4次后再使用600ml的双蒸水保存xad16大孔树脂,并对其进行分装,在121℃的条件下灭菌30min后备用。
30.制作发酵菌液,步骤如下:s1:将含有表面活性素的菌株接种至lb平板培养基上,在37℃的条件下活化培养12h;而后取活化后的单菌落转接于lb液体培养基中,在37℃、200rpm的条件下培养12
h,得到种子液。具体的,含有表面活性素的菌株为b.siamensisjfl15菌株;所述步骤s1中,lb平板培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml,琼脂粉20g;所述lb平板培养基的ph值为7.2-7.4;所述步骤s1中,lb液体培养基的组分为:胰蛋白胨10g,酵母提取粉5g,nacl5g,蒸馏水1000ml;所述lb液体培养基的ph值为7.2-7.4。
31.s2:按照1%的接种量将所述种子液转接至50ml的msm培养基中,并在msm培养基加入1mlxad16,在30℃、200rpm的条件下发酵48h,即得发酵菌液;其中所述msm培养基的组分为:蔗糖20g,nh4cl4g,kh2po43g,na2hpo410g,mgso40.2g,酵母膏0.2g,cacl20.7μg,mnso41μg,蒸馏水1l;所述msm培养基的ph值为7.0。
32.提取表面活性素,包括如下步骤:步骤1:取50ml发酵菌液转移至50ml的离心管中,在9000rpm的条件下离心15min,得到上清液1、及含有菌体以及xad16大孔树脂的沉淀物1;步骤2:在所述沉淀物1中加入35ml甲醇,而后进行超声处理,30min后将混合物倒入三角瓶中,先在35℃、200rpm的条件下震荡4h,而后在9000rpm的条件下离心20min,得到上清液2;步骤3:将所述上清液2通过滤纸过滤到100ml的尖底烧瓶中,并使用旋转蒸发仪进行真空浓缩,得到粗提物;步骤4:使用1.5ml的甲醇对所述粗提物进行溶解,完全溶解后,使用移液枪吸出复溶的粗提物,在13000rpm的条件下离心15min,即得到表面活性素溶液。
33.采用高效液相色谱(hplc)法对实施例1-3所得的表面活性素溶液中的表面活性素含量进行测定;色谱条件为:检测器:紫外检测器;色谱柱:ods-sp(5.0μm,4.6
×
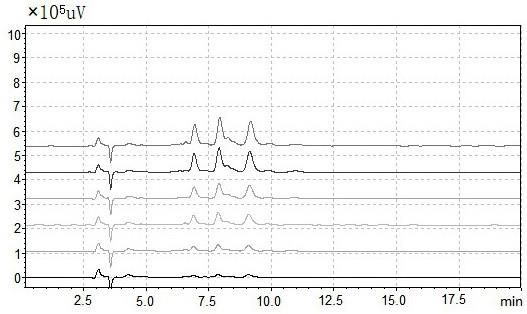
250mm,glsciences);紫外检测波长:205nm;柱温:30℃;流动相:甲醇/水(含0.1%三氟乙酸)=90:10;流速:1ml/min;进样量:10μl。
34.步骤如下:绘制表面活性素标准曲线:准确称取2mg表面活性素标准品,溶解于1ml甲醇中,制成2mg/ml的标准品母液;根据实验需要,将标准品母液依次稀释成浓度为1、0.8、0.5、0.4、0.2、0.1mg/ml的标准品溶液;将上述系列浓度的标准品溶液经过0.22μm微孔滤膜过滤后,进行hplc检测;所述表面活性素标准品的色谱图如图1所示,图1中展示了表面活性素标准品溶液自上而下分别为1、0.8、0.5、0.4、0.2、0.1mg/ml时的色谱图;以峰面积为(y)纵坐标,其浓度(x)为横坐标进行线性回归,绘制表面活性素的标准曲线如图2所示,同时得回归方程y=6e+06x+123147,r2=0.9956,显示线性关系良好,可以采用该方法对表面活性素的含量进行测定。
35.对实施例1-3的表面活性素溶液经过0.22μm微孔滤膜过滤后,进行hplc检测,色谱图如图3所示(自上而下分别为实施例1、实施例2、实施例3),结果显示,采用本发明的方法提取表面活性素,其与细胞的其他组分分离度高,提取率高。
36.所述对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1