一种生产丙二酸的重组大肠杆菌及其制备方法与应用与流程
本发明属于生物工程领域,涉及一种生产丙二酸的重组大肠杆菌及其制备方法与应用。
背景技术:
1、丙二酸含有活泼的亚甲基,是一种重要的有机合成中间体,目前主要用于香料和医药中间体,尤其是在医药工业中,用于生产巴比妥酸、维生素b1,维生素b2等。另外还可以应用于胶粘剂和树脂添加剂等的生产,也可用于皮革制品或铝制品表面处理剂、泡沫塑料发泡剂和核反应器的化学清洗剂。其下游产品覆盖面非常大,涉及到塑料、染料、医药、农药、电镀等行业。随着目前国内和国际化工行业的快速发展,加上丙二酸的用途的大力开发,丙二酸的产量和品质在日剧上升。
2、丙二酸现在应用于实际生产中的主要合成方法为化学合成法。主要有两种生产路线,一是丙二酸酯在80-90℃下通过硫酸水解,该法特点是工艺路线及生产周期短、三废少,但该水解过程属于可逆反应,且丙二酸受高温容易发生脱羧反应分解生成乙酸、水和二氧化碳,故产品收率低;二是酯交换工艺,但该工艺需要用到乙酸、有刺鼻酸味、另有副产乙酸乙酯和乙醇的混合溶液产生,不好处理。
3、目前,已有研究机构开始研究丙二酸的生物合成途径,如通过基因工程改造大肠杆菌,在胞内构建了丙二酸生物合成途径。但目前的研究主要集中在丙二酸途径的构建,而在这一过程中,碳流失比较严重,导致原料利用率低,且改造后的菌株在发酵过程中会产生乳酸、乙酸、甲酸等杂质,影响产量的同时,增加了后期分离纯化的难度。
技术实现思路
1、因此,本发明主要针对丙二酸生物合成过程中碳流失严重、副产杂酸,影响丙二酸产量及分离纯化的问题,通过代谢改造的方法,促进碳流尽可能多的流向丙二酸的代谢路径,最终获得了能高产丙二酸,低产杂酸的大肠杆菌生产菌株。具体来说,该菌株敲除了副产物途径关键酶丙酮酸激酶和/或丙酮酸甲酸裂解酶和/或乳酸脱氢酶和/或磷酸转乙酰酶—乙酸激酶减少了碳流的支路代谢,并消除或减少副产物乳酸/甲酸/乙酸的生成,同时分模块组成型过量表达磷酸烯醇式丙酮酸羧化酶、天冬氨酸转氨酶和天冬氨酸-α-脱羧酶以及β-丙氨酸丙酮酸转氨酶、琥珀酸半醛脱氢酶和丙酮酸羧化酶。本发明构建的丙二酸合成途径示意图如图1所示。
2、在一个方面,本发明提供一种重组大肠杆菌(escherichia coli),能够以葡萄糖为原料,由草酰乙酸-天冬氨酸途径合成丙二酸,该重组大肠杆菌具有降低的丙酮酸激酶pyka和/或丙酮酸甲酸裂解酶pflb和/或乳酸脱氢酶ldha和/或磷酸转乙酰酶—乙酸激酶pta-acka的表达量和/或活性,并分模块组成型过量表达大肠杆菌来源的磷酸烯醇式丙酮酸羧化酶ppc、天冬氨酸转氨酶aspc和天冬氨酸-α-脱羧酶pand以及铜绿假单胞菌(pseudomonas aeruginosa)来源的β-丙氨酸丙酮酸转氨酶pa0132、大肠杆菌来源的琥珀酸半醛脱氢酶ynei和谷氨酸棒状杆菌(corynebacterium glutamicum)来源的丙酮酸羧化酶pyc。
3、在一些实施方案中,上述重组大肠杆菌中,所述降低的丙酮酸激酶pyka的表达量和/或活性是通过敲除丙酮酸激酶的编码基因pyka来实现的;
4、所述降低的丙酮酸甲酸裂解酶pflb的表达量和/或活性是通过敲除丙酮酸甲酸裂解酶的编码基因pflb来实现的;
5、所述降低的乳酸脱氢酶ldha的表达量和/或活性是通过敲除乳酸脱氢酶的编码基因ldha来实现的;和/或
6、所述降低的磷酸转乙酰酶—乙酸激酶pta-acka的表达量和/或活性是通过敲除磷酸转乙酰酶—乙酸激酶的编码基因pta-acka来实现的。
7、在一些实施方案中,上述重组大肠杆菌中,通过使用cripsr-cas9技术敲除所述pyka基因和/或pflb基因和/或ldha基因和/或pta-acka基因;
8、通过敲除pyka基因,减少流入tca循环的碳通量,实现通过抑制竞争途径的方式提高大肠杆菌合成丙二酸的产量;
9、通过敲除pflb基因、ldha基因、pta-acka基因,减少分支产生的甲酸、乳酸、乙酸,减少nadh(丙酮酸生成乳酸过程消耗nadh)及碳流的消耗,提高大肠杆菌合成丙二酸的产量。
10、在一些实施方案中,上述任一所述的重组大肠杆菌中,运用crispr/cas9技术敲除大肠杆菌e.coli bl21(de3)基因组中的pyka基因和/或pflb基因和/或ldha基因和/或pta-acka基因,得到以下菌株:
11、4株单独敲除ldha基因、pflb基因、pta-acka基因、pyka基因的大肠杆菌:bl21△ldha、bl21△pflb、bl21△pta-acka及bl21△pyka;
12、3株组合双敲除pyka基因和选自ldha基因、pta-acka基因、pflb基因中的一种的大肠杆菌:bl21△pyka△ldha、bl21△pyka△pta-acka及bl21△pyka△pflb;
13、1株敲除ldha基因、pflb基因和pta-acka基因的大肠杆菌:bl21△ldha△pflb△pta-acka;和
14、1株敲除pyka基因、ldha基因、pflb基因和pta-acka基因的大肠杆菌:bl21△pyka△ldha△pflb△pta-acka。
15、在一些实施方案中,上述任一所述的重组大肠杆菌中,所述分模块组成型过量表达所述磷酸烯醇式丙酮酸羧化酶ppc、所述天冬氨酸转氨酶aspc、所述天冬氨酸-α脱羧酶pand、所述β-丙氨酸丙酮酸转氨酶pa0132、所述琥珀酸半醛脱氢酶ynei和所述丙酮酸羧化酶pyc是指单独表达这些酶。
16、在一些优选的实施方案中,上述任一所述的重组大肠杆菌中,所述分模块组成型过量表达磷酸烯醇式丙酮酸羧化酶ppc、所述天冬氨酸转氨酶aspc、所述天冬氨酸-α-脱羧酶pand、所述β-丙氨酸丙酮酸转氨酶pa0132、所述琥珀酸半醛脱氢酶ynei和所述丙酮酸羧化酶pyc是指将所述磷酸烯醇式丙酮酸羧化酶ppc和所述天冬氨酸转氨酶aspc融合表达,将所述天冬氨酸-α-脱羧酶pand和所述丙酮酸羧化酶pyc单独表达,将所述琥珀酸半醛脱氢酶ynei和所述β-丙氨酸丙酮酸转氨酶pa0132融合表达。
17、在一些实施方案中,上述任一所述的重组大肠杆菌中,所述分模块组成型过量表达使用的启动子是组成型启动子ml2719,其序列如seq id no:39所示。
18、在一些实施方案中,上述任一所述的重组大肠杆菌中,以大肠杆菌bl21(de3)为宿主。
19、在一些实施方案中,上述任一所述的重组大肠杆菌中,所述磷酸烯醇式丙酮酸羧化酶ppc、所述天冬氨酸转氨酶aspc和所述天冬氨酸-α-脱羧酶pand来自大肠杆菌bl21(de3)。
20、在一些实施方案中,上述任一所述的方法中,所述琥珀酸半醛脱氢酶ynei来自大肠杆菌k12。
21、在一些实施方案中,上述任一所述的重组大肠杆菌中,所述磷酸烯醇式丙酮酸羧化酶ppc的蛋白序列如seq id no:35中第1-883位所示;
22、所述天冬氨酸转氨酶aspc的蛋白序列如seq id no:35中第904-1299位所示;
23、所述天冬氨酸-α-脱羧酶pand的蛋白序列如seq id no:38所示;
24、所述β-丙氨酸丙酮酸转氨酶pa0132的蛋白序列如seq id no:36中第483-930位所示;
25、所述琥珀酸半醛脱氢酶ynei的蛋白序列如seq id no:36中第1-462位所示;和/或
26、所述丙酮酸羧化酶pyc的蛋白序列如seq id no:37所示。
27、在一些实施方案中,上述任一所述的重组大肠杆菌中,所述磷酸烯醇式丙酮酸羧化酶ppc和所述天冬氨酸转氨酶aspc融合表达的蛋白的连接肽序列如seq id no:26所示。
28、在一些实施方案中,上述任一所述的重组大肠杆菌中,所述琥珀酸半醛脱氢酶和所述β-丙氨酸丙酮酸转氨酶pa0132融合表达的蛋白的连接肽的序列如seq id no:26所示。
29、在一些实施方案中,上述任一所述的重组大肠杆菌中,所述磷酸烯醇式丙酮酸羧化酶ppc和所述天冬氨酸转氨酶aspc融合表达的蛋白序列如seq id no:35所示。
30、在一些实施方案中,上述任一所述的重组大肠杆菌中,所述琥珀酸半醛脱氢酶ynei和所述β-丙氨酸丙酮酸转氨酶pa0132融合表达的蛋白序列如seq id no:36所示。
31、在一些实施方案中,上述任一所述的重组大肠杆菌为bl21(scr)-1至bl21(scr)-9,优选为bl21(scr)-9,其是在宿主大肠杆菌bl21(de3)中敲除了pyka基因、pflb基因、ldha基因和pta-acka基因,同时融合表达了所述磷酸烯醇式丙酮酸羧化酶ppc和所述天冬氨酸转氨酶aspc,单独表达了所述天冬氨酸-α-脱羧酶pand和所述丙酮酸羧化酶pyc,融合表达了所述琥珀酸半醛脱氢酶ynei和所述β-丙氨酸丙酮酸转氨酶pa0132。
32、在第二个方面,本发明提供一种构建上述任一所述的重组大肠杆菌的方法,包括敲除大肠杆菌宿主中的pyka和/或pflb和/或ldha和/或pta-acka基因,从而得到基因缺陷的基因工程菌株,将含有编码大肠杆菌来源的磷酸烯醇式丙酮酸羧化酶的基因ppc、天冬氨酸转氨酶的基因aspc、天冬氨酸-α-脱羧酶的基因pand以及编码铜绿假单胞菌来源的β-丙氨酸丙酮酸转氨酶的基因pa0132、编码大肠杆菌来源的琥珀酸半醛脱氢酶的基因ynei和编码谷氨酸棒状杆菌来源的丙酮酸羧化酶的基因pyc的一个或多个质粒转入其中进行分模块组成型过量表达。
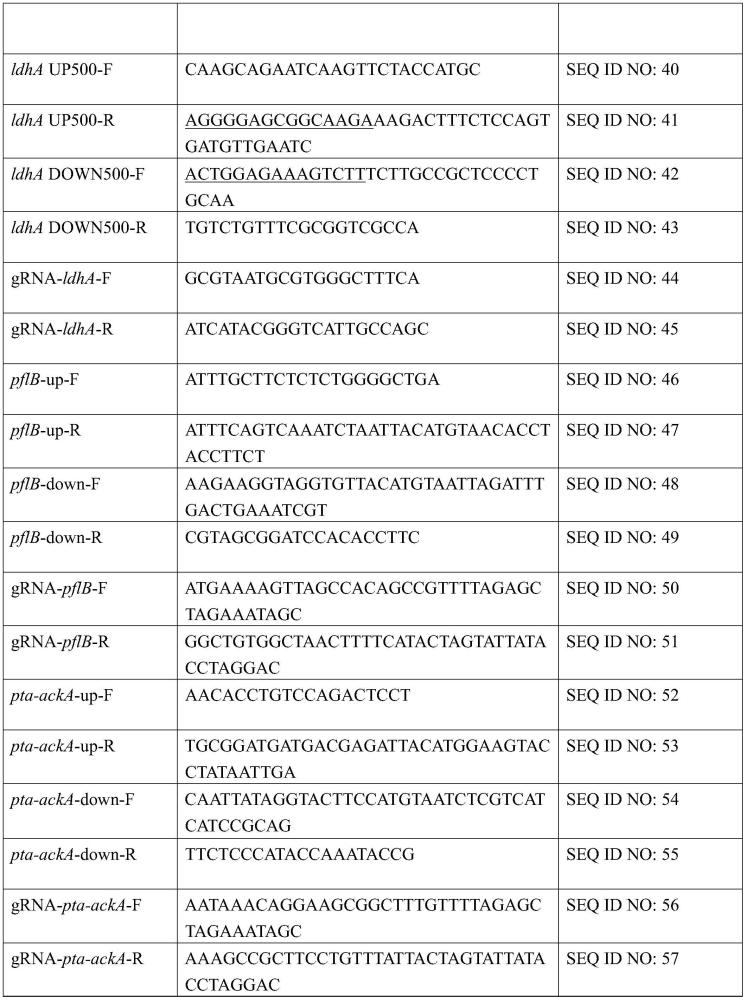
33、在一些实施方案中,上述方法中,通过使用cripsr-cas9技术敲除所述pyka基因和/或pflb基因和/或ldha基因和/或pta-acka基因,例如敲除大肠杆菌e.coli bl21(de3)基因组中的pyka基因和/或pflb基因和/或ldha基因和/或pta-acka基因,得到以下基因缺陷的基因工程菌株:
34、4株单独敲除ldha基因、pflb基因、pta-acka基因、pyka基因的大肠杆菌:bl21△ldha、bl21△pflb、bl21△pta-acka及bl21△pyka;
35、3株组合双敲除pyka基因和选自ldha基因、pta-acka基因、pflb基因中的一种的大肠杆菌:bl21△pyka△ldha、bl21△pyka△pta-acka及bl21△pyka△pflb;
36、1株敲除ldha基因、pflb基因和pta-acka基因的大肠杆菌:bl21△ldha△pflb△pta-acka;和
37、1株敲除pyka基因、ldha基因、pflb基因和pta-acka基因的大肠杆菌:bl21△pyka△ldha△pflb△pta-acka。
38、以敲除ldha基因为例,可以以如下方式进行:
39、(1)以ptargetf质粒为模板,以grna-ldha-f(seq id no:44)和grna-ldha-r(seqid no:45)为引物扩增获得靶向ldha基因的ptargetf骨架;使用吉布森组装使其自连,获得重组质粒ptarget-δldha-grna质粒;
40、(2)上下游同源臂片段的获得:以ldha up500-f(seq id no:40)、ldha up500-r(seq id no:41)和ldha down500-f(seq id no:42)、ldha down500-r(seq id no:43)为两对引物,以大肠杆菌bl21(de3)的基因组dna为模板,通过pcr反应分别扩增出上游同源臂片段和下游同源臂片段;以上游同源臂片段和下游同源臂片段为模板,以ldha up500-f和ldha down500-r为引物,通过融合pcr将上游同源臂片段和下游同源臂片段连接成同源臂片段;
41、(3)ldha基因的敲除:以大肠杆菌bl21(de3)作为待敲菌株,制备电转感受态;首先将pcas质粒导入感受态中,挑取转化子进行pcr验证,将阳性转化子接种于含阿拉伯糖的lb培养基中继续制备电转感受态细胞;将ptarget-δldha-grna质粒及同源臂片段转入感受态中,挑取转化子进行pcr验证,以grna-ldha-f(seq id no:44)和grna-ldha-r(seq idno:45)为引物,选取具有单一条带且大小正确的单菌落,即为正确的敲除ldha基因的菌株;
42、(4)敲除菌株ptarget-δldha-grna质粒及pcas质粒的消除:将敲除ldha基因的菌株接种于lb培养基中培养,同时加iptg进行诱导,随后将浑浊的菌液接种于含有壮观霉素的lb培养基中培养,若菌株不生长,则说明ptarget-δldha-grna质粒已消除;将已消除ptarget-δldha-grna质粒的菌株接种于lb培养基中培养,随后将浑浊的菌液接种于含有硫酸卡那霉素的lb培养基中培养,若菌株不生长,则说明pcas质粒已消除;将已消除这两种质粒的菌株命名为bl21△ldha,此为单独敲除ldha基因的大肠杆菌;
43、ldha基因、pflb基因和pta-acka基因可以参照类似的方法进行敲除。
44、在一些实施方案中,上述任一所述的方法中,所述分模块组成型过量表达是指将编码磷酸烯醇式丙酮酸羧化酶基因ppc、天冬氨酸转氨酶基因aspc、天冬氨酸-α-脱羧酶基因pand以及编码铜绿假单胞菌来源的β-丙氨酸丙酮酸转氨酶基因pa0132、编码大肠杆菌来源的琥珀酸半醛脱氢酶基因ynei和编码谷氨酸棒状杆菌来源的丙酮酸羧化酶基因pyc的一个或多个质粒转入其中进行分模块组成型过量表达,使这些蛋白单独表达。
45、在一些优选的实施方案中,上述任一所述的方法中,所述分模块组成型过量表达是指将融合表达磷酸烯醇式丙酮酸羧化酶基因ppc和所述天冬氨酸转氨酶基因aspc的质粒,单独表达所述天冬氨酸-α-脱羧酶基因pand和所述丙酮酸羧化酶基因pyc的质粒以及融合表达所述琥珀酸半醛脱氢酶基因ynei和所述β-丙氨酸丙酮酸转氨酶基因pa0132的质粒转入其中进行分模块组成型过量表达。
46、在一些实施方案中,上述任一所述的方法中,所述分模块组成型过量表达时使用的启动子是组成型启动子ml2719,其序列如seq id no:39所示。
47、在一些实施方案中,上述任一所述的方法中,大肠杆菌宿主为大肠杆菌bl21(de3)。
48、在一些实施方案中,上述任一所述的方法中,所述磷酸烯醇式丙酮酸羧化酶基因ppc、天冬氨酸转氨酶基因aspc和天冬氨酸-α脱羧酶基因pand来自大肠杆菌bl21(de3)。
49、在一些实施方案中,上述任一所述的方法中,所述琥珀酸半醛脱氢酶基因ynei来自大肠杆菌k12。
50、在一些实施方案中,上述任一所述的方法中,所述磷酸烯醇式丙酮酸羧化酶基因ppc的序列如seq id no:9所示;
51、所述天冬氨酸转氨酶基因aspc的序列如seq id no:10所示;
52、所述天冬氨酸-α-脱羧酶基因pand的序列如seq id no:18所示;
53、所述β-丙氨酸丙酮酸转氨酶的基因pa0132的序列如seq id no:2所示;
54、所述琥珀酸半醛脱氢酶的基因ynei的序列如seq id no:1所示;和/或
55、所述丙酮酸羧化酶的基因pyc的序列如seq id no:17所示。
56、在一些实施方案中,上述任一所述的方法中,所述融合表达磷酸烯醇式丙酮酸羧化酶基因ppc和所述天冬氨酸转氨酶基因aspc的质粒为pcdf-ppc-linker-aspc;
57、所述单独表达所述天冬氨酸-α-脱羧酶基因pand和所述丙酮酸羧化酶基因pyc的质粒为ptrc99a-pyc-pand;和/或
58、所述融合表达所述琥珀酸半醛脱氢酶基因ynei和所述β-丙氨酸丙酮酸转氨酶基因pa0132的质粒为prsf-ynei-linker-pa0132。
59、在一些实施方案中,上述方法中,所述pcdf-ppc-linker-aspc是将linker片段和pcdf-ppc-aspc质粒片段同源重组构建的;所述linker片段是以seq id no:25所示linker基因为模板,以linker-pcdf-f(seq id no:27)、linker-pcdf-r(seq id no:28)进行pcr扩增,得到linker片段;pcdf-ppc-aspc质粒片段是以pcdf-ppc-aspc质粒为模板,用引物pcdf-linker-f(seq id no:29)、pcdf-linker-r(seq id no:30)进行pcr扩增,得到的线性化pcdf-ppc-aspc质粒片段;
60、所述prsf-ynei-linker-pa0132是将linker片段和prsf-ynei-pa0132质粒片段的同源序列发生重组的方法构建的;所述linker片段是以seq id no:25所示linker基因为模板,以linker-prsf-f(seq id no:31)、linker-prsf-r(seq id no:32)进行pcr扩增,得到linker片段;所述prsf-ynei-pa0132质粒片段是以prsf-ynei-pa0132质粒为模板,用引物prsf-linker-f(seq id no:33)、prsf-linker-r(seq id no:34)进行pcr扩增,得到线性化prsf-ynei-pa0132质粒片段;
61、所述ptrc99a-pyc-pand是将pyc、pand片段和ptrc99a质粒片段的同源序列发生重组的方法构建的。
62、在一些实施方案中,上述方法中,所述pcdf-ppc-aspc质粒是将ppc、aspc片段和pcdfduet-1质粒片段的同源序列发生重组构建的,所述ppc片段是以seq id no:9所示ppc基因为模板,用引物ppc-f(seq id no:11)和ppc-r(seq id no:12)进行pcr扩增,得到ppc片段;所述aspc片段是以seq id no:10所示aspc基因为模板,用引物aspc-f(seq id no:13)和aspc-r(seq id no:14)进行pcr扩增,得到aspc片段;所述pcdfduet-1质粒片段是以pcdfduet-1质粒为模板,用引物pcdf-f(seq id no:15)和pcdf-r(seq id no:16)进行pcr扩增,得到线性化pcdfduet-1质粒片段;
63、所述prsf-ynei-pa0132质粒是将ynei、pa0132片段和prsfduet-1质粒片段的同源序列发生重组构建的,其中所述ynei片段是以seq id no:1所示ynei基因为模板,用引物ynei-f(seq id no:3)和ynei-r(seq id no:4)进行pcr扩增,得到ynei片段;所述pa0132片段是以seq id no:2所示pa0132基因为模板,用引物pa0132-f(seq id no:5)和pa0132-r(seq id no:6)进行pcr扩增,得到pa0132片段;所述prsfduet-1质粒片段以prsfduet-1质粒为模板,用引物prsf-f(seq id no:7)和prsf-r(seq id no:8)进行pcr扩增,得到线性化prsfduet-1质粒片段;
64、所述pyc片段是以seq id no:17所示pyc基因为模板,用引物pyc-f(seq id no:19)和pyc-r(seq id no:20)进行pcr扩增,得到pyc片段;所述pand片段是以seq id no:18所示pyc基因为模板,用引物pand-f(seq id no:21)和pand-r(seq id no:22)进行pcr扩增,得到pand片段;所述ptrc99a质粒片段以ptrc99a质粒为模板,用引物ptrc99a-f(seq idno:23)和ptrc99a-r(seq id no:24)进行pcr扩增,得到线性化ptrc99a质粒片段。
65、在一些实施方案中,上述任一所述的方法中,构建的重组大肠杆菌为bl21(scr)-1至bl21(scr)-9,优选为bl21(scr)-9,其构建过程包括:在宿主大肠杆菌bl21(de3)中通过cripsr-cas9技术敲除pyka基因、pflb基因、ldha基因和pta-acka基因,得到基因缺陷的基因工程菌株bl21△pyka△ldha△pflb△pta-acka,再将融合表达磷酸烯醇式丙酮酸羧化酶基因ppc和所述天冬氨酸转氨酶基因aspc的质粒pcdf-ppc-linker-aspc,单独表达所述天冬氨酸-α-脱羧酶基因pand和所述丙酮酸羧化酶基因pyc的质粒ptrc99a-pyc-pand和融合表达所述琥珀酸半醛脱氢酶基因ynei和所述β-丙氨酸丙酮酸转氨酶基因pa0132的质粒prsf-ynei-linker-pa0132转入其中,该菌株具有降低的丙酮酸激酶、丙酮酸甲酸裂解酶、乳酸脱氢酶和磷酸转乙酰酶—乙酸激酶表达量和活性,表达融合蛋白ppc-linker-aspc(序列如seq id no:35所示)和ynei-linker-pa0132(序列如seq id no:36所示)以及蛋白pyc(序列如seq id no:37所示)和pand(序列如seq id no:38所示)。
66、在第三个方面,本发明提供一种发酵生产丙二酸的方法,包括将上述任一所述的重组大肠杆菌接种于含4-8g/l葡萄糖的sob培养基中,在溶解氧(do)浓度为15%-35%的环境下,30-42℃、200-800r/min发酵至少12h,例如可以为120h。
67、在一些实施方案中,上述发酵方法中,sob培养基中,蛋白胨20g/l,酵母提取物5g/l,mgso4·7h2o 2.47g/l,nacl 0.5g/l,kcl 0.186g/l;培养基中添加的抗生素氨苄青霉素(amp)、卡那霉素(kan)和链霉素(str)的终浓度均为1mm。
68、在一些实施方案中,上述任一所述的发酵方法中,0-3h的转速为200-300r/min,3h后设置为溶氧与转速联动,以保证溶氧在15%-35%,搅拌转速范围为300-800r/min;0h-12h的发酵温度为37℃;12h-24h的发酵温度为34℃;24h-32h的发酵温度为32℃;32h至发酵结束的发酵温度为30℃;每当葡萄糖浓度降为0g/l时,补加葡萄糖至终浓度为8g/l。
69、在一些实施方案中,上述任一所述的发酵方法中,所述重组大肠杆菌还经过种子液培养;所述种子液培养是将所述重组大肠杆菌在lb培养基中培养,获得种子液,再接种至发酵培养基中发酵,初始od600为0.4-0.6。例如,种子液的制备方法可以为挑取单菌落接种于盛有25ml的lb液体培养基的150ml锥形瓶中,37℃、230rpm摇瓶过夜或培养12h,次日取1ml菌液转接于50ml lb液体培养基中,37℃、230rpm培养至od600达到4-6,转接于sob培养基中进行发酵。
70、在第四个方面,本发明提供上述任一所述的重组大肠杆菌或上述任一所述的发酵方法在制备丙二酸及其衍生产品方面的应用。
71、在一些实施方案中,上述应用中,所述衍生产品包括但不限于丙二酸二乙酯。
72、在一种实施方式中,上述应用中,所述衍生产品包括但不限于巴比妥类药物,维生素b1或维生素b6。
73、本发明的优点在于:
74、本发明构建的丙二酸生物合成菌株,其合成途径反应数更少,因此碳源的损失更少;并进一步敲除了副产物途径关键酶,减少碳流的支路代谢,并消除或减少副产物乳酸/甲酸/乙酸的生成,进一步提高了丙二酸的产量;
75、本发明构建的菌株为组成型表达菌株,发酵过程不需要iptg诱导,且产生的酸类杂质少,可简化后期分离纯化流程,极大的节约了生产成本,有利于工业化生产。
- 还没有人留言评论。精彩留言会获得点赞!