AP2-MYBL2分子模块在调控原花色素生物合成中的应用
ap2-mybl2分子模块在调控原花色素生物合成中的应用
技术领域
1.本发明属于基因工程应用的技术领域,具体涉及ap2-mybl2分子模块在调控原花色素生物合成中的应用。
背景技术:
2.原花色素是植物中具有重要活性的类黄酮次生代谢产物。不仅在种子休眠、寿命和萌发的调控中起着重要作用,而且还参与调控植物的生物和非生物逆境胁迫;棕色棉是目前应用最广泛的天然彩色棉,其纤维中的棕色色素就是原花色素;紫花苜蓿中原花色素含量高于干重的2%时,可以有效地防止牛、羊等反刍动物鼓胀病的发生;除此之外,还具有抗氧化、抗炎和抗癌等有益于人类健康的功效。因此,原花色素生物合成和调控方面的研究,成为植物次生代谢领域内的一个重要研究方向。
3.原花色素在植物的生长发育和逆境胁迫中起着重要的调控作用,对人类健康有诸多益处。诸多现有技术研究暗示存在未知的关键基因负调控tt2或与之相关的mbw三元复合物的功能,进而负调控原花色素的积累,但什么基因参与其中,及其调控的分子机理仍然不清楚。cn110241124a中公开了ap2突变体种皮颜色比野生型更深,积累更多原花色素。但该专利中只涉及到ap2调控原花色素的表观结果,但其调控的分子机理仍然不清楚。本发明旨在确定ap2调控原花色素生物合成途径中的靶基因和关键转录因子,确定了ap2-mybl2分子模块在转录水平和蛋白水平上协同调控原花色素生物合成的分子机制,阐明ap2调控原花色素生物合成的遗传网络。
技术实现要素:
4.为了解决上述技术问题,本发明提供了ap2调控原花色素的分子机理,确定ap2调控原花色素生物合成途径中的靶基因和关键转录因子,确定了ap2-mybl2分子模块在转录水平和蛋白水平上协同调控原花色素生物合成的分子机制,阐明ap2调控原花色素生物合成的遗传网络,为改良植物原花色素生物合成和代谢提供重要的理论支撑。
5.根据本技术的一方面,提供了ap2-mybl2分子模块在调控原花色素生物合成中的应用。
6.在本技术的具体实施方式中,经试验证明,mybl2为ap2蛋白的直接靶基因。
7.在本技术的优选实施方式中,ap2蛋白在转录水平上直接结合mybl2基因的启动子从而激活mybl2基因的表达。
8.在本技术的优选实施方式中,ap2蛋白在植物体内通过结合顺式作用元件m5,激活mybl2基因的表达。
9.在本技术的优选实施方式中,ap2蛋白遗传上作用于mybl2的上游,通过激活mybl2基因的表达来调控原花色素的生物合成。
10.根据本技术的另一方面,还提供了ap2-mybl2-tt8或ap2-mybl2-egl3蛋白复合物在调控原花色素生物合成中的应用。
11.在本技术的具体实施方式中,ap2蛋白与mybl2蛋白的c端存在相互作用,mybl2蛋白的n端与tt8蛋白或egl3蛋白发生相互作用。
12.在本技术的具体实施方式中,ap2蛋白在蛋白水平上通过与mybl2蛋白相互作用,形成了ap2-mybl2-tt8或ap2-mybl2-egl3的蛋白复合物,抑制了myb-bhlh-wd三元复合物的形成。
13.在本技术的具体实施方式中,ap2蛋白遗传上作用于myb-bhlh-wd三元复合物中tt2和tt8的上游。
14.本发明的有益效果为:
15.(1)本技术提供了ap2-mybl2分子模块、ap2-mybl2-tt8或ap2-mybl2-egl3蛋白复合物在调控原花色素生物合成中的应用。ap2蛋白在转录水平上通过直接结合其直接靶基因mybl2的启动子从而激活mybl2基因的表达,调控原花色素生物合成。另一方面,ap2蛋白在蛋白水平上通过与mybl2蛋白相互作用,形成了ap2-mybl2-tt8或ap2-mybl2-egl3的蛋白复合物,抑制了myb-bhlh-wd三元复合物的形成,从而调控原花色素的生物合成。
16.(2)本技术提供了ap2调控原花色素的分子机理,确定ap2调控原花色素生物合成途径中的靶基因和关键转录因子,确定了ap2-mybl2分子模块在转录水平和蛋白水平上协同调控原花色素生物合成的分子机制,阐明ap2调控原花色素生物合成的遗传网络,为相关的品种培育提供重要的理论支撑,为品种改良提供了新的解决方案。
附图说明
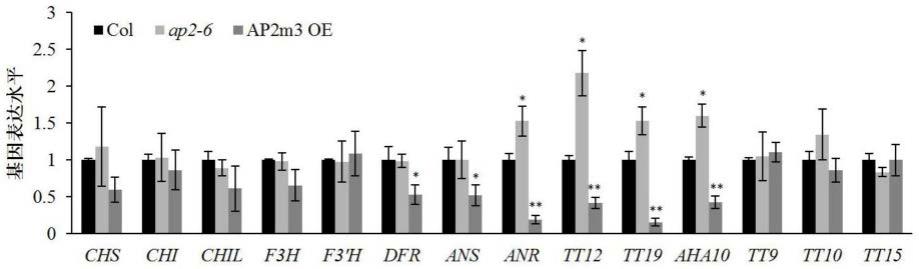
17.图1是ap2调控原花色素生物合成途径中结构基因的表达结果;
18.图2是ap2调控原花色素生物合成途径中转录调控基因的表达结果;
19.图3是ap2转录激活mybl2基因的结果;
20.图4是ap2突变体中不同发育时期的荚果中mybl2的基因表达结果;
21.图5是ap2直接结合mybl2基因启动子的at-rich元件,激活mybl2基因表达的结果;
22.图6是ap2蛋白与原花色素生物合成途径中的蛋白在酵母中的相互作用分析;
23.图7是ap2和mybl2在烟草中的蛋白相互作用;
24.图8是ap2与mybl2c端在酵母中蛋白相互作用;
25.图9是tt8与mybl2n端在酵母中蛋白相互作用;
26.图10是gl3与mybl2c端在酵母中蛋白相互作用;
27.图11是egl3与mybl2n端在酵母中蛋白相互作用;
28.图12是ap2和mybl2c端,tt8和mybl2n端在烟草中的蛋白相互作用;
29.图13是mybl2与gl3或egl3在烟草中的相互作用;
30.图14是免疫共沉淀实验(coip)证实ap2与mybl2蛋白相互作用以及mybl2与tt8、gl3或者egl3蛋白相互作用;
31.图15是免疫共沉淀实验(coip)证实ap2-mybl2-tt8或ap2-mybl2-egl3在植物体内能够形成蛋白复合物;
32.图16是ap2通过mybl2抑制mbw(tt2-tt8-ttg1)三元复合物的转录活性;
33.图17是ap2遗传上作用于mybl2的上游,ap2通过mybl2调控原花色素的生物合成;
34.图18是ap2遗传上作用于mbw三元复合物成员tt2和tt8的上游;
35.图19是ap2调控原花色素生物合成的分子机制。
具体实施方式
36.下面结合具体实施例对本发明进行详细说明,以下实施例仅为方便本领域技术人员理解本发明技术方案,实现或使用本发明所做的说明,并不以此限定本发明的保护范围。
37.本发明中,如未指定,所采用的试剂、原料和设备等均可从市场购得或是本领域常用的。
38.实施例中的方法,如无特殊说明,均为本领域的常规方法。
39.实施例1 ap2基因调控原花色素生物合成途径中结构基因和转录调控基因的表达水平
40.ap2基因((at4g36920))的突变体ap2-6从arabidopsis biological resource center(the ohio state university,columbus,oh,usa)购买。通过克隆了ap2的全长cds序列,并通过点突变技术获得了ap2m3的全长cds序列,克隆进入植物表达载体pb2gw7中,进一步转入gv3101农杆菌中,利用花侵染法转入拟南芥野生型中,利用定量pcr的方法鉴定并获得过量表达植株。
41.ap2和ap2m3的序列参见网站www.arabidopsis.org。ap2的cds序列为chr4的17400948bp至17403140bp;ap2m3的cds序列为ap2的cds序列分别在17403020的t突变为a、17403023的a突变为t、17403026的a突变为t、17403029的a突变为c、17403032的a突变为t、17403035的a突变为t,尽管核苷酸序列不同,但它们编码的蛋白序列相同。
42.通过选择了授粉后4天的荚果为材料,检测了ap2基因的突变体和过量表达材料中原花色素生物合成途径中结构基因和转录调控基因的表达水平。研究发现:原花色素生物合成途径中早期结构基因的表达水平不受ap2基因的调控;原花色素合成途径中后期关键基因dfr、ans、anr、tt12、tt19和aha10等基因表达水平在过量表达ap2基因的材料中被显著的抑制;anr、tt12、tt19和aha10等基因表达水平在ap2基因的突变体中被显著地上调(图1)。与此同时,研究也发现与原花色素生物合成密切相关的转录调控因子中tt2基因的表达水平被ap2基因负调控,而起抑制原花色素生物合成的mybl2的基因表达水平显著地被ap2基因正调控(图2)。这些结果表明,ap2基因可能通过正调控mybl2和负调控tt2的基因表达水平,从而通过进一步影响结构基因或转运相关基因的表达水平,最终负调控原花色素的生物合成。
43.实施例2确定ap2基因的直接靶基因
44.(1)通过转录活性分析等实验确定ap2基因转录激活mybl2基因的表达
45.为了检测ap2基因调控的潜在靶基因,该研究克隆了原花色素生物合成途径中基因的启动子,共计25个基因的启动子,如表1所示,具体的序列信息参见拟南芥官网https://www.arabidopsis.org/。通过检测luciferase的活性,研究分析了ap2基因对它们的转录活性调控。数据显示:mybl2基因被ap2基因显著地激活表达(图3),这些结果与上述图2的结果一致。
46.进一步分析了ap2基因的突变体中不同发育时期的荚果中mybl2的基因表达水平,数据显示:与野生型相比较,ap2基因的突变体中mybl2的基因表达水平均降低(图4),这个结果也支持了ap2基因激活mybl2基因的表达。这些结果表明ap2基因激活mybl2的基因表
达,mybl2可能为ap2基因的靶基因。
47.(2)mybl2基因是ap2基因的直接靶基因,ap2蛋白直接结合mybl2基因的启动子从而激活mybl2基因的表达
48.表1
49.基因名称基因号基因起始密码子atg之前的启动子长度(bp),chsat5g139301328chiat3g551201126chilat5g052701726f3hat3g512401123f3'hat5g079901912dfrat5g428001208ansat4g228801097anrat1g61720689tt12at3g590301701tt19at5g172201264aha10at1g17260618tt9at3g284301845tt10at5g481001190tt15at1g436201372tt2at5g355502245myb5at3g13540918tt8at4g098201501gl3at5g413151210egl3at1g636501233ttg1at5g245201090mybl2at1g71030974tt1at1g347901392tt16at5g232601497ttg2at2g372601490stkat4g099601595
50.转录激活实验的方法和步骤:ap2m3的cds全长序列和所有的基因启动子序列分别被克隆进入pentr/sd/d-topo,然后基因测序证实所有的序列均正确无误;然后将pentr-ap2m3进一步克隆进入p2gw7效应载体中,同时将所有的pentr-启动子分别克隆进入p2gw7-luc报告基因载体中,利用无内毒素大量提取试剂盒提取质粒。分离4周龄拟南芥叶片的原生质体,将效应质粒10微克、报告基因质粒6微克和1微克的内参质粒混合,利用peg法转入原生质体中,在25℃的培养箱中黑暗培养16-20小时,收集原生质体并测定荧光素酶的活性。实验结果显示,mybl2基因可能为ap2基因直接调控的靶基因。前人的研究(dinh tt,girke t,liu x,yant l,schmid m,chen x(2012)the floral homeotic protein apetala2 recognizes and acts through an at-rich sequence element.development)
也显示ap2蛋白通过结合顺式作用元件at-rich,抑制或激活下游靶基因的表达。因此,研究首先分析发现mybl2基因启动子区共有5个at-rich元件(tttgtt或aacaaa)(图5a),然后分别突变成cccccc,产生了一系列突变的启动子,通过检测luciferase的活性,分析了这些突变如何影响ap2基因对它们的转录活性调控。研究的数据显示:顺式作用元件m5(aacaaa)为ap2基因调控mybl2的关键位点(图5b)。
51.进一步通过chip实验,chip实验的方法和步骤:首先,构建过量表达ap2m3融合myc的载体,花序侵染法转化拟南芥,利用qrt-pcr鉴定获得阳性转基因株系;收获开花后3-5天的拟南芥荚果,浸泡在1%的甲醛溶液中,抽真空15分钟;然后用chip级别的myc抗体,按照标准的染色质免疫沉淀实验步骤进行实验,实验结果证实了ap2蛋白在植物体内通过结合顺式作用元件m5,激活mybl2基因的表达(图5c)。这些数据表明mybl2基因是ap2基因的直接靶基因。
52.实施例3确定与ap2蛋白相互作用的蛋白
53.(1)通过酵母双杂交实验确定ap2相互作用的蛋白
54.为了研究ap2蛋白是否与原花色素生物合成途径中的转录因子之间有蛋白的相互作用,克隆了与原花色素生物合成相关的11个转录因子和蛋白的cds序列,构建到pgadt7载体上。与此同时,将ap2的cds序列构建到pgbkt7载体上。酵母双杂交的实验方法和步骤:制备酵母菌株ah109的感受态,将构建好的诱饵质粒pgbkt7利用licl-peg法转入酵母中,在sd/-trp培养基中筛选获得阳性克隆;然后在不同浓度3-at的sd/-trp/-his培养基上培养3-5天确定最适宜的3-at浓度为15mm/l;制备含有诱饵质粒的ah109感受态,利用licl-peg法将猎物质粒pgadt7转入酵母中,在sd/-trp/-leu培养基中筛选获得阳性克隆;最后在含有15mm/l的3-at的sd/-trp/-leu/-his/-ade培养基上鉴定蛋白的相互作用。实验结果表明:ap2与mybl2有较强的蛋白相互作用,ap2与tt2和myb5有较弱的蛋白相互作用(图6)。
55.(2)通过双分子荧光互补实验(bifc)确定ap2相互作用的蛋白
56.为了进一步证实上述的蛋白相互作用,该研究将ap2基因构建到bifc实验的载体pbi-2yn-cat,将mybl2、tt2和myb5分别构建到pbi-2yc-cat。双分子荧光互补实验(bifc)的实验方法和步骤:将构建好的载体,转入农杆菌gv3101中。通过常规pcr鉴定获得阳性克隆,28℃培养至od600为0.5-0.8;5000rpm离心10分钟收集菌液,然后用mes缓冲液(mes终浓度为0.05m/l、磷酸钠终浓度为2mm/l、乙酰丁香酮终浓度为0.1mm/l和0.5%的无水葡萄糖,ph为5.6)重悬菌体至od600为0.5-0.8时;注射生长4周的本氏烟,继续生长36-48小时,用激光共聚焦显微镜观察蛋白相互作用产生的荧光信号。在共表达ap2基因与mybl2基因的本氏烟细胞核中检测到强的蛋白相互作用的荧光信号(图7),而在ap2与tt2或myb5之间没有检测到明显的荧光信号。因此,bifc的实验结果证实了ap2蛋白与mybl2蛋白在植物体内有蛋白相互作用。
57.实施例4确定ap2与mybl2蛋白的相互作用
58.(1)确定ap2、mybl2和tt8/gl3/egl3之间的蛋白相互作用结构域
59.为了更深入的探明ap2与mybl2蛋白的相互作用,构建了ap2n(包含ap2基因的cds的前870bp)或ap2c(包含ap2基因的cds的后435bp)到pgbkt7载体上,mybl2n(包含mybl2基因的cds的前270bp)、mybl2c(包含mybl2基因的cds的后318bp)、mybl2dc(包含mybl2基因的cds的前546bp)、mybl2dn(包含mybl2基因的cds的后42bp)、mybl2ne(包含mybl2基因的cds
的前423bp)和mybl2ce(包含mybl2基因的cds的后165bp)到pgbkt7载体上。酵母双杂交的实验方法和步骤如上,但最适宜的3-at浓度为2mm/l。酵母双杂交实验结果表明,ap2蛋白与mybl2c端在酵母中蛋白相互作用(图8)。
60.为了分析mybl2和tt8、gl3或者egl3在酵母中的蛋白相互作用,将mybl2的cds构建到pgbkt7载体上,将tt8、gl3和egl3的cds分别构建到pgadt7载体上。酵母双杂交的实验方法和步骤如上,但最适宜的3-at浓度为2mm/l。进一步深入分析了它们之间相互作用,发现tt8蛋白和egl3蛋白与mybl2n端在酵母中相互作用,而gl3蛋白与mybl2c端在酵母中相互作用(图9-11)。
61.随后,将tt8、gl3和egl3基因的全长cds分别构建到bifc实验的载体pbi-2yn-cat,将mybl2c(包含mybl2基因的cds的后318bp)和mybl2n(包含mybl2基因的cds的前270bp)分别构建到pbi-2yc-cat。利用bifc实验(实验方法和步骤同上)进一步证实在植物体内ap2蛋白与mybl2的c端在烟草中蛋白相互作用,tt8蛋白与mybl2的n端在烟草中蛋白相互作用,而gl3蛋白或egl3蛋白与mybl2蛋白在烟草中蛋白相互作用(图12-13)。
62.(2)通过免疫共沉淀实验(coip)证实ap2蛋白与mybl2蛋白相互作用以及mybl2蛋白与tt8蛋白、gl3蛋白或者egl3蛋白相互作用
63.为了更深入考察ap2蛋白与mybl2蛋白是否在植物体内蛋白相互作用以及mybl2蛋白与tt8蛋白、gl3蛋白或者egl3蛋白是否在植物体内蛋白相互作用,研究构建了ap2m3蛋白融合myc、mybl2蛋白融合flag、tt8/gl3/egl3蛋白分别融合ha的载体。免疫共沉淀实验(coip)的实验方法和步骤:将构建好的载体,转入农杆菌gv3101中。通过常规pcr鉴定获得阳性克隆,28℃培养至od600为0.5-0.8;5000rpm离心10min收集菌液,然后用mes缓冲液(mes终浓度为0.05m/l、磷酸钠终浓度为2mm/l、乙酰丁香酮终浓度为0.1mm/l和0.5%的无水葡萄糖,ph为5.6)重悬菌体至od600为0.5-0.8时;注射生长4周的本氏烟,继续生长36-48小时。收获被注射的烟草叶片,在液氮中研磨成细粉,然后按照碧云天公司的蛋白免疫沉淀试剂盒(磁珠法)提取蛋白,进行免疫沉淀。最后,按照常规的westernblot实验方法和步骤进行免疫沉淀蛋白的检测。在共转化ap2m3-myc和mybl2-flag的烟草叶片中,用myc抗体能够成功地免疫沉淀出mybl2-flag,表明ap2蛋白与mybl2蛋白在植物体内蛋白相互作用(图14a)。coip实验也证实了mybl2蛋白与tt8蛋白、gl3蛋白或egl3蛋白在植物体内蛋白相互作用(图14b-d)。
64.(3)通过免疫共沉淀实验(coip)证实ap2-mybl2-tt8或ap2-mybl2-egl3形成蛋白复合体
65.上述的数据表明,ap2蛋白能够与mybl2的c端相互作用,而mybl2的n端与tt8蛋白或egl3蛋白发生相互作用。因此,研究推测ap2-mybl2-tt8或ap2-mybl2-egl3可能在植物体内形成蛋白复合物。coip实验(实验方法和步骤同上),结果也显示,ap2-mybl2-tt8或ap2-mybl2-egl3在植物体内形成蛋白复合物(图15a-b),而ap2-mybl2-gl3不能够植物体内形成蛋白复合物(图15c)。
66.(4)ap2通过mybl2抑制mbw三元复合物的转录活性
67.上述的结果表明,ap2-mybl2-tt8或ap2-mybl2-egl3在植物体内形成蛋白复合物。mbw(myb-bhlh-wd,myb包括tt2和myb5,tt2是主效基因;bhlh包括tt8、gl3和egl3;wd为ttg1)三元复合物直接调控原花色素生物合成途径中关键基因的转录,在原花色素生物合
成过程中起着非常重要的作用。ap2-mybl2-tt8或ap2-mybl2-egl3蛋白复合物是否会影响mbw(tt2-tt8-ttg1)三元复合物的转录活性。为了回答这个科学问题,研究分析了它们对调控原花色素生物合成的第一个分支酶anr的表达。进行转录激活实验(实验方法和步骤同上),数据表明,当没有mybl2存在时,ap2不能抑制三元复合物对anr基因的激活作用;当同时存在ap2和mybl2时,能够显著地抑制三元复合物对anr基因的激活作用(图16)。这些结果表明,ap2通过mybl2抑制mbw三元复合物的转录活性。
68.(5)遗传上ap2作用于mybl2和mbw三元复合物的上游,通过mybl2调控原花色素的生物合成
69.ap2通过mybl2调控原花色素的生物合成。为了进一步从遗传上分析ap2和mybl2和mbw三元复合物的关系,该研究获得了mybl2基因的突变体mybl2-1和mybl2-2,以及mybl2基因的过量表达株系mybl2 oe h3和mybl2 oe h6,以及tt2和tt8基因的突变体,然后分别与ap2基因的突变体ap2-6和过量表达株系ap2m3 oe进行遗传杂交,进一步获得纯合体。定性和定量地分析了原花色素的含量(图17),与野生型col相比较,mybl2基因的过量表达株系mybl2 oe h3和mybl2 oe h6的种皮颜色均较浅,原花色素的含量也显著地低于野生型。当在ap2-6突变体中过量表达mybl2基因时,原花色素的含量接近于mybl2过量表达材料;另一方面,当在ap2过量表达材料中突变了mybl2基因,导致原花色素含量接近于mybl2突变体,这些结果表明:ap2遗传上作用于mybl2的上游,通过mybl2调控原花色素的生物合成。
70.同时,研究也从遗传上分析了ap2和mbw三元复合物的关系。结果表明,双突变体ap2-6/tt2和ap2-6/tt8分别于单突变体tt2或tt8的原花色素含量相似(图18)。因此,ap2遗传上作用于mbw三元复合物成员tt2和tt8的上游。
71.根据上述所有的研究结果,ap2调控原花色素生物合成的分子机制包括两个方面:一方面,ap2可以在转录水平上,通过直接结合mybl2的启动子区,进而激活mybl2基因的表达;另一方面,ap2可以在蛋白水平上直接与mybl2相互作用,通过mybl2蛋白与tt8或egl3蛋白相互作用,形成ap2-mybl2-tt8或ap2-mybl2-egl3蛋白复合物,破坏了mbw三元复合物的形成,最终抑制了原色素生物合成途径中后期基因(lbgs)dfr、ans、anr、tt12、tt19和aha10等的表达,抑制了原花色素的生物合成(图19)。
72.ap2-mybl2分子模块作为改良植物原花色素生物合成的新的重要候选基因,可在植物育种工作中利用ap2-mybl2分子模块增加或减少原花色素的含量;为了增加原花色素的含量,可通过突变ap2-mybl2分子模块,使得mbw蛋白复合物更加稳定,促进原花色素的积累;为了减少原花色素的含量,可通过增加ap2基因的表达,ap2又会进一步正调控mybl2基因的表达,或可以同时增加ap2-mybl2分子模块基因的表达,从而产生更多的ap2蛋白,协同产生更多的mybl2蛋白,进一步在植物体内产生更多的ap2-mybl2-tt8或ap2-mybl2-egl3蛋白复合物,从而抑制了mbw蛋白复合物的形成,最终减少原花色素的含量。
73.以上所述,仅为本技术的实施例而已,本技术的保护范围并不受这些具体实施例的限制,而是由本技术的权利要求书来确定。对于本领域技术人员来说,本技术可以有各种更改和变化。凡在本技术的技术思想和原理之内所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1