一种检测亚硫酸氢盐和指示鱼肉新鲜度的双功能近红外发射荧光探针及其合成方法和应用
1.本发明涉及一种检测亚硫酸氢盐和指示鱼肉新鲜度的双功能近红外发射荧光探针及其合成方法和应用。
背景技术:
2.亚硫酸氢盐(hso
3-)在食品工业中常被用作抗菌剂、防腐剂、酶抑制剂和抗氧化剂,用于延长食品保质期或货架期。例如,在葡萄酒工业中,亚硫酸氢盐被用于防止葡萄酒氧化和微生物生长,也可作为白葡萄酒的漂白剂以保持其颜色。尽管亚硫酸氢盐用处很大,但误食过量亚硫酸氢盐会导致哮喘、过敏、胃肠道反应、呼吸系统疾病和其他疾病等,因此,开发可用于食品中检测hso
3-的方法引起了科研工作者的广泛关注。
3.我国海产品资源丰富,特别是海水鱼味道鲜美、营养价值高,是人们餐桌上不可缺少的美食,但海水鱼在远途运输、加工储存过程中极易发生腐败变质,消费者食用会给身体带来损害。目前,深海鱼多以切片、切段处理后进行销售,为了延长鱼肉保质期,一般用塑料袋密封或真空包装,而判断鱼肉新鲜度往往需要打开包装,利用电子鼻、电子舌或其他仪器测试鲜度指标来综合判定是否腐败,而这些操作必须破坏产品包装,使用复杂仪器,耗费时间长,无法满足现场检测等。由于鱼肉腐败会产生大量挥发性胺,因此,可开发简单便捷的方法用于检测挥发性胺,进而实现对鱼肉新鲜度的监测。
4.近年来,荧光分析法由于其高灵敏度、快速响应、选择性好、不需要复杂仪器、可实时检测等优点而引起了广泛关注。近三十年,已经开发出大量单独检测hso
3-或挥发性胺的荧光探针,这些探针也表现出较好的应用性能,但相比于多功能探针,单一功能的探针往往需要花费更大的研发成本,较低的利用率,因此,开发多功能探针更具有应用前景。目前,能够同时检测hso
3-和挥发性胺的荧光探针还未见报道。鉴于食品安全检测的需要,迫切需要开发一种多功能近红外荧光探针,既能用于食品中亚硫酸氢盐的检测,又能用于三文鱼鱼肉新鲜度的指示。
技术实现要素:
5.本发明要解决的技术问题是提供一种检测亚硫酸氢盐和指示鱼肉新鲜度的双功能近红外发射荧光探针及其合成方法和应用,该荧光探针具有合成路线简单,近红外发射,识别速度快,比色和荧光双通道响应等优点。该探针可检测红酒、白糖等真实食物样品中的hso
3-,以及对活细胞中hso
3-和正丙胺进行荧光成像。同时,将探针负载到滤纸上制备成指示标签,可实现对鱼肉新鲜度定性分析,且无需破坏样品及复杂的前处理,结果准确可靠,可用于三文鱼鱼肉新鲜度无损快速实时检测。
6.本发明的技术方案是:
7.一种检测亚硫酸氢盐和指示鱼肉新鲜度的双功能近红外发射荧光探针及其合成
方法和应用,该荧光探针结构式如下:
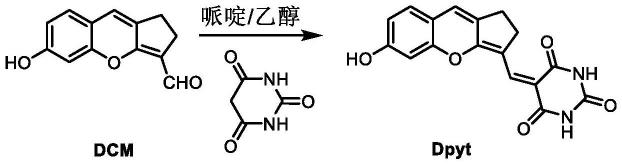
8.进一步的,该荧光探针具体合成步骤如下:
9.以乙醇(10~100ml)为溶剂,将苯并吡喃衍生物与巴比妥酸按照摩尔比1:(1.5~3)进行投料,所述苯并吡喃衍生物为6-羟基-1,2-二氢环戊烷并[b]苯并吡喃-3-甲醛然后,按照苯并吡喃衍生物与哌啶的质量比25:1加入哌啶;在油浴中加热回流搅拌8小时~12小时,冷却至室温,抽滤,收集固体用乙醇洗涤,得到近红外发射荧光探针
[0010]
一种检测亚硫酸氢盐和指示鱼肉新鲜度的双功能近红外发射荧光探针及其合成方法和应用,其特殊之处在于:在纯水体系(pbs,ph=7.4)中对hso
3-进行检测,所述应用为非疾病诊断和非疾病治疗目的。
[0011]
一种检测亚硫酸氢盐和指示鱼肉新鲜度的双功能近红外发射荧光探针及其合成方法和应用,其特殊之处在于:5s内可实现对hso
3-的检测,所述应用为非疾病诊断和非疾病治疗目的。
[0012]
一种检测亚硫酸氢盐和指示鱼肉新鲜度的双功能近红外发射荧光探针及其合成方法和应用,其特殊之处在于:可对白糖和红酒中的hso
3-进行检测,所述应用为非疾病诊断和非疾病治疗目的。
[0013]
一种检测亚硫酸氢盐和指示鱼肉新鲜度的双功能近红外发射荧光探针及其合成方法和应用,其特殊之处在于:可对活细胞中hso
3-和正丙胺进行荧光成像,所述应用为非疾病诊断和非疾病治疗目的。
[0014]
一种检测亚硫酸氢盐和指示鱼肉新鲜度的双功能近红外发射荧光探针及其合成方法和应用,其特殊之处在于:负载探针的滤纸作为指示标签,可监测三文鱼鱼肉新鲜度,所述应用为非疾病诊断和非疾病治疗目的。
[0015]
指示标签具体制备过程如下:
[0016]
称取3.24mg的荧光探针溶于10ml dmso中,将切好的直径2cm的圆形滤纸放置上述溶液浸泡过夜,然后取出放于烘箱中干燥,即可得到指示标签。
[0017]
一种三文鱼鱼肉新鲜度指示标签在判定三文鱼鱼肉新鲜度中的应用。
[0018]
一种三文鱼鱼肉新鲜度指示标签在判定三文鱼新鲜度中的应用,将指示标签与鱼肉样品放置在包装盒内,且指示标签不与样品直接接触,根据指示标签颜色变化与标准比色卡进行对比,对三文鱼鱼肉新鲜度进行实时监测,识别三文鱼鱼肉的新鲜度。
[0019]
在可见光下,指示标签颜色为紫色表明为新鲜,指示标签颜色为蓝紫色表明为合格,指示标签颜色为蓝灰色表明为不合格;
[0020]
在365nm的紫外光照射下,指示标签颜色为强烈红色荧光时表明为新鲜,指示标签颜色为橙黄色荧光时表明为合格,指示标签颜色为黄色荧光时表明为不合格。
[0021]
本发明的有益效果:
[0022]
(1)该荧光探针发射波长位于658nm处,达到近红外发射区,因此,受到散射和荧光背景干扰较小。在纯水中能够5s内识别hso
3-以及能够对多种挥发性胺有响应,检测限较低,且颜色变化明显。
[0023]
(2)负载荧光探针的指示标签配合标准比色卡,可以比色和荧光双通道指示鱼肉新鲜度。一个探针具有两种功能,可节约研发成本,提高了探针的利用率。
[0024]
综上,本发明所设计合成的荧光探针不仅可以在纯水体系下快速识别hso
3-,也可以在 mecn/h2o(v/v=1:1)体系中识别多种胺溶液,同时,还能制备成指示标签识别多种挥发性胺。所设计的指示标签制备过程简单,可以实现比色和荧光双通道检测鱼肉新鲜度,定性分析更准确可靠。该指示标签可非接触、无损化对海水鱼鱼肉新鲜度进行快速实时监测,能为生产商、零售商以及消费者及时提供有效的新鲜度信息,具有较好的实际应用价值。
附图说明
[0025]
图1是本发明荧光探针dpyt的1h nmr谱图;
[0026]
图2是本发明荧光探针dpyt的
13
c nmr谱图;
[0027]
图3是本发明荧光探针dpyt的质谱谱图;
[0028]
图4是本发明荧光探针dpyt与0.hs-,1.ch3coo-,2.so
32-,3.scn-,4.s2o
32-,5.s
2-,6.ppi, 7.no
2-,8.n
3-,9.i-,10.so
42-,11.hpo
42-,12.hco
3-,13.f-,14.co
32-,15.cl-,16.c2o
42-,17.br-, 18.hso
3-作用前后的紫外吸收光谱图和日光颜色变化图;
[0029]
图5是本发明荧光探针dpyt与hs-,ch3coo-,so
32-,scn-,s2o
32-,s
2-,ppi,no
2-,n
3-,i-, so
42-,hpo
42-,hco
3-,f-,co
32-,cl-,c2o
42-,br-,hso
3-等19种阴离子作用前后的荧光发射光谱图;
[0030]
图6是本发明荧光探针dpyt识别hso
3-时抗18种阴离子干扰的紫外吸收检测图;
[0031]
图7是本发明荧光探针dpyt识别hso
3-时抗18种阴离子干扰的荧光检测图;
[0032]
图8是本发明荧光探针dpyt与不同浓度hso
3-作用前后的荧光发射光谱变化图;
[0033]
图9是本发明荧光探针dpyt识别hso
3-的检测限图;
[0034]
图10是本发明荧光探针dpyt加入hso
3-后荧光强度随时间变化的响应图;
[0035]
图11是本发明荧光探针dpyt加入hso
3-前后在不同ph下的荧光强度变化图;
[0036]
图12是本发明荧光探针dpyt溶液中加入hso
3-后的高分辨率质谱图;
[0037]
图13是本发明荧光探针dpyt在白糖和红酒样品中检测出的hso
3-浓度图;
[0038]
图14是本发明不同浓度的荧光探针dpyt在mcf-7细胞中孵育24小时后的细胞活力变化图;
[0039]
图15是本发明荧光探针dpyt在mcf-7细胞中对hso
3-荧光成像图;细胞中加入dpyt 共培养30min后继续加入a)0μm,d)10μm,g)100μm,j)200μm,m)400μm hso
3-后在明场拍摄的荧光图;b)0μm,e)10μm,h)100μm,k)200μm,n)400μm hso
3-后在暗场拍摄的荧光图;c)0μm,f)10μm,i)100μm,l)200μm,o)400μm hso
3-后在叠加场拍摄的荧光图。
[0040]
图16是本发明荧光探针dpyt加入各种胺(1.苯胺、2.环己二胺、3.二乙胺、4.正丙胺、 5.氨水、6.三乙胺、7.乙胺、8.精胺、9.尸胺、10.腐胺、11.2-苯乙胺、12.酪胺、13.色胺、14. 三甲胺、15.二甲胺)化合物前后的紫外吸收光谱图和日光颜色变化图;
[0041]
图17是本发明荧光探针dpyt加入各种胺(苯胺、环己二胺、二乙胺、正丙胺、氨水、三乙胺、乙胺、精胺、尸胺、腐胺、2-苯乙胺、酪胺、色胺、三甲胺、二甲胺)化合物前后的荧光发射光谱图;
[0042]
图18是本发明荧光探针dpyt加入不同浓度正丙胺后的荧光发射光谱图;
[0043]
图19是本发明荧光探针dpyt识别正丙胺的检测限图;
[0044]
图20是本发明荧光探针dpyt加入正丙胺前后在不同ph中的荧光强度变化图;
[0045]
图21是本发明荧光探针dpyt加入正丙胺后荧光强度随时间的变化图;
[0046]
图22是本发明荧光探针dpyt在mcf-7细胞中加入不同浓度正丙胺后的荧光成像图;细胞中加入dpyt共培养30min后继续加入a)0μm,d)10μm,g)100μm,j)200μm,m)500 μm正丙胺后在明场拍摄的荧光图;b)0μm,e)10μm,h)100μm,k)200μm,n)500μm 正丙胺后在暗场拍摄的荧光图;c)0μm,f)10μm,i)100μm,l)200μm,o)500μm正丙胺后在叠加场拍摄的荧光图。
[0047]
图23是本发明制备的指示标签识别挥发性胺前后的日光颜色变化(上面)和荧光颜色(下面)照片;
[0048]
图24是三文鱼鱼肉在4℃下随着贮藏时间的延长,鱼肉的tvb-n含量及ph的变化图;
[0049]
图25是三文鱼鱼肉在4℃下随着贮藏时间的延长,指示标签的色差值变化图;
[0050]
图26是三文鱼鱼肉在4℃下随着贮藏时间的延长,鱼肉的tvb-n含量与对应的指示标签在自然光和紫外光照射下的颜色照片;
[0051]
图27是根据鱼肉tvb-n值与对应指示标签在自然光和紫外光照射下的颜色制作的标准比色卡;标准比色卡上层从左到右分别为新鲜自然光比色区、合格自然光比色区、腐败自然光比色区,标准比色卡下层从左到右分别为新鲜紫外光比色区、合格紫外光比色区、腐败紫外光比色区;
[0052]
图28是本发明制备的指示标签与三文鱼样品在4℃下贮藏,标签的日光和紫外光颜色变化结合标准比色卡监测三文鱼鱼肉的新鲜度;4℃贮藏第0天鱼肉属于新鲜品,当贮藏第4 天时,此时鱼肉属于合格品,当贮藏第8天时,鱼肉属于不合格产品。
具体实施方式
[0053]
下面结合具体实施例对本发明的技术方案作进一步详细地说明。
[0054]
实施例1
[0055]
荧光探针dpyt的具体合成步骤如下:
[0056][0057]
化合物dcm(214mg,1mmol)、巴比妥酸(192mg,1.5mmol)、哌啶(8.5mg),溶于乙醇(10ml)中,混合物在油浴中被回流搅拌8小时,冷却至室温,抽滤,收集粗产物紫色固体,用乙醇洗涤,得到荧光探针dpyt,产率为69.4%;1h nmr谱、
13
c nmr谱和质谱图如图1-3所示。
[0058]1h nmr(400mhz,dmso-d6)δ10.88(s,1h),10.70(s,1h),10.55(s,1h),8.22(s,1h), 7.36(d,j=8.3hz,1h),7.24(s,1h),6.81(s,1h),6.77(d,j=8.4hz,1h),3.14
–
3.05(m,2h), 2.80(s,2h).
[0059]
13
c nmr(100mhz,dmso-d6)δ162.10,160.31,153.43,150.61,141.31,135.23,128.82, 127.57,116.30,114.82,113.93,106.64,102.65,28.58.
[0060]
hrmsfor c
17h13
n2o
5+
[m+h]
+
calcd:325.0819,found:325.0823.
[0061]
实施例2
[0062]
化合物dcm(2.14g,10mmol)、巴比妥酸(2.56g,20mmol)、哌啶(85.6mg),溶于乙醇(40ml)中,混合物在油浴中被回流搅拌10小时,冷却至室温,抽滤,收集粗产物紫色固体,用乙醇洗涤,得到荧光探针dpyt,产率为73.1%;本实施例荧光探针dpyt的1h nmr 谱图如图1,
13
c nmr谱图如图2,高分辨质谱如图3所示。
[0063]
实施例3
[0064]
化合物dcm(10.71g,50mmol)、巴比妥酸(19.21g,150mmol)、哌啶(428.44mg),溶于乙醇(100ml)中,混合物在油浴中被回流搅拌12小时,冷却至室温,抽滤,收集产生的粗产物,用乙醇洗涤,得到荧光探针dpyt,产率为62.3%;本实施例荧光探针dpyt的1h nmr 谱图如图1,
13
c nmr谱图如图2,高分辨质谱如图3所示。
[0065]
一、荧光探针dpyt识别hso
3-的选择性检测:
[0066]
10μmol/l荧光探针dpyt的pbs(ph=7.4)缓冲溶液,向其中分别加入20μl(50mmol/l) 19种阴离子(hs-、ch3coo-,so
32-,scn-,s2o
32-,s
2-,ppi,no
2-,n
3-,i-,so
42-,hpo
42-,hco
3-,f-, co
32-,cl-,c2o
42-,br-,hso
3-),检测溶液的吸收光谱变化。从图4中可以看出,在596nm处有明显的吸收峰,当向其中加入30μmol/l的hso
3-时,吸光度显著降低,可以观察到溶液颜色由蓝色变成无色,而其他阴离子加入溶液中时,吸光度和溶液颜色基本没有发生变化,说明探针dpyt紫外识别较好。另外,用560nm波长激发荧光探针后,dpyt溶液的荧光发射光谱变化如图5所示,当加入阴离子时,只有hso
3-可以引起658nm处的荧光强度显著淬灭,而其他阴离子对荧光强度没有明显影响,由此可知,荧光探针dpyt通过紫外和荧光识别hso
3-具有较好的选择性。
[0067]
二、荧光探针dpyt识别hso
3-的抗干扰检测:
[0068]
10μmol/l荧光探针dpyt的pbs(ph=7.4)溶液,向其中分别加入20μl(50mmol/l) 19种阴离子(hs-、ch3coo-,so
32-,scn-,s2o
32-,s
2-,ppi,no
2-,n
3-,i-,so
42-,hpo
42-,hco
3-,f-, co
32-,cl-,c2o
42-,br-,hso
3-),测试溶液的紫外吸收和荧光发射光谱。然后向含有各个阴离子的溶液中再分别加入300μmol/l的hso
3-,测试溶液的紫外吸收和荧光发射光谱。结果如图 6和图7所示,当加入不同的阴离子时,在596nm处的吸光度和在658nm处的荧光强度无显著变化(圆柱体),向上述溶液中继续添加hso
3-(300μmol/l),观察到吸光度和荧光强度均显著下降(长方体),表明即使有其他阴离子存在时,探针dpyt仍能识别hso
3-,具有较好的抗干扰能力。
[0069]
三、荧光探针dpyt对hso
3-的滴定测试:
[0070]
10μmol/l的荧光探针dpyt的pbs(ph=7.4)缓冲溶液,分别加入0~300μmol/l的hso
3-,测试溶液的荧光发射光谱变化,如图8所示。随着hso
3-浓度的不断增大,在658nm处的发射峰强度逐渐降低,当加入300μmol/l的hso
3-时发射峰强度不再变化,说明此时达到了饱
和。
[0071]
四、荧光探针dpyt对hso
3-的检测限测试:
[0072]
在探针dpyt的pbs(ph=7.4)缓冲溶液中,测试不少于11个平行样的荧光强度,根据公式∑(x
i-x)2=(x
1-x)2+(x
2-x)2+
……
+(x
n-x)2求出平方差的总和(xi为每次测量受体本身荧光强度值,x为荧光强度平均值,n为测试次数,n≥11),然后根据公式:s=[∑(x
i-x)2/(n-1)]
0.5
求出灵敏度s,再根据检测限公式:检测限=3s/k,k为所选直线部分的斜率(注:直线是根据滴定做点图,横坐标为离子浓度,纵坐标为荧光强度),求出检测限为7.34μmol/l(见图9),说明该探针具有较低的检测限,有一定的实际应用价值。
[0073]
五、荧光探针dpyt对hso
3-的响应时间测试:
[0074]
测试探针dpyt的pbs(ph=7.4)缓冲溶液荧光强度随时间的变化,结果如图10所示,当加入300μmol/l的hso
3-后,探针在658nm处的荧光强度显著降低,在5s秒内即可达到平稳,表明探针dpyt能够超快检测hso
3-。
[0075]
六、荧光探针dpyt对hso
3-的ph响应测试:
[0076]
为了证实dpyt的实用性,我们考察了不同ph的影响。如图11所示,探针dpyt只有在 ph 7-10时有较强的荧光发射,随后向探针dpyt中加入hso
3-,只有在ph为7-9时荧光强度降低幅度较大,说明dpyt能够在ph为7-9的范围内检测hso
3-。
[0077]
七、本发明的荧光探针对hso
3-的检测原理如下:
[0078][0079]
为了确定探针dpyt识别hso
3-的机制,dpyt+hso
3-的高分辨质谱被测试。如图12所示, dpyt+hso
3-在m/z=405.0392处出现新峰,是探针[m-h]-相对应的峰(理论值为405.0398),说明hso
3-与dpyt发生了亲核加成反应,破坏共轭体系,阻碍了dpyt的分子内电荷转移,导致荧光淬灭和溶液颜色由蓝色褪至无色,从而实现“裸眼”和荧光识别hso
3-。
[0080]
八、荧光探针dpyt在红酒和白糖中的应用:
[0081]
将0.5g白糖用pbs(ph=7.4)缓冲溶液稀释,向其中加入250μl探针dpyt溶液,并稀释至25ml容量瓶中,获得试验所需的试验溶液。取1毫升红酒用pbs(ph=7.4)稀释至100倍,用该溶液将250μl探针dpyt稀释到25ml容量瓶中,得到所需的测试溶液。随后,向含有红酒和白糖的dpyt(10μmol/l)溶液中添加不同浓度的hso
3-,记录在658nm处的荧光强度变化(表1和图13),经计算红酒样品的回收率介于94.6%-109.3%之间,白糖样品的回收率介于95.6%-105.1%,回收率良好,说明探针dpyt可准确检测红酒和白糖实际样品中的 hso
3-含量。
[0082]
表1本发明荧光探针dpyt在白糖和红酒样品中检测hso
3-的回收率和标准偏差
[0083][0084]
实验重复三次。
[0085]
九、荧光探针dpyt的细胞毒性实验及对hso
3-的细胞成像:
[0086]
为了考察探针dpyt的生物学应用,先用cck-8试剂盒测试dpyt的毒性。如图14所示,dpyt 浓度为0-50μmol/l时,细胞在24小时的存活率大于80%,说明dpyt的细胞毒性较小,并具有良好的生物相容性。将mcf-7细胞与10μmol/l的探针dpyt在37℃下共孵育30min,在暗场中有明显的红色荧光。然后用pbs洗涤3次,加入不同浓度的hso
3-(10、100、200和400μmol/l) 并孵育30min,随着hso
3-浓度的增加,红色荧光逐渐减弱直至无荧光(图15),表明dpyt能够对活细胞中的hso
3-进行荧光成像。
[0087]
十、荧光探针dpyt对胺类化合物的选择性
[0088]
在2ml mecn:h2o(v/v=1:1)的溶液中加入荧光探针dpyt溶液配置成10μmol/l的溶液待用,再分别加入20μl,50mmol/l各种胺溶液(1.苯胺、2.环己二胺、3.二乙胺、4.正丙胺、 5.氨水、6.三乙胺、7.乙胺、8.精胺、9.尸胺、10.腐胺、11.2-苯乙胺、12.酪胺、13.色胺、14. 三甲胺、15.二甲胺),观察其紫外和荧光变化。从图16紫外光谱可以看出,除了苯胺外,其他14种胺类化合物溶液均引起dpyt的590nm处的最大吸收峰红移至630nm,且溶液颜色由紫色变成蓝色,从图17荧光光谱可以看出,除了苯胺外,其他14种胺类化合物溶液均引起dpyt的660nm处的荧光发射显著增强,这些结果表明dpyt在mecn/h2o(v/v=1/1)溶液中可比色和荧光识别多种胺类化合物,识别范围较广。
[0089]
十一、荧光探针dpyt对代表性胺类化合物正丙胺的识别性能
[0090]
首先,测试了dpyt对胺类化合物的荧光滴定。以正丙胺为例,测试了10μmol/l的dpyt 在mecn/h2o(v/v=1:1)溶液中的荧光强度与正丙胺溶液浓度之间的关系。如图18所示,当加入的正丙胺浓度逐渐增大时,615nm处的荧光强度逐渐减弱,660nm处的荧光强度逐
渐增大,当加入260μmol/l的正丙胺溶液时,荧光强度不再变化,说明达到了饱和状态。除苯胺外,其他胺类化合物具有相似变化。
[0091]
其次,计算了dpyt识别正丙胺的检测限。用10μmol/l的dpyt溶液,测试不少于11个平行样的荧光强度,根据公式:∑(x
i-x)2=(x
1-x)2+(x
2-x)2+
……
+(x
n-x)2求出平方差的总和(xi为每次测量受体本身荧光强度值,x为荧光强度平均值,n为测试次数,n≥11),然后根据公式:s=[∑(x
i-x)2/(n-1)]
0.5
求出灵敏度s,再根据检测限公式:检测限=3s/k,k为所选直线部分的斜率(注:直线是根据滴定做点图,横坐标为离子浓度,纵坐标为荧光强度),求出检测限为2.23μmol/l(见图19),这说明该探针在含水溶液中检测正丙胺具有较好的灵敏度,有实际应用的潜力。
[0092]
再次,探究了ph对检测胺类化合物的影响。以正丙胺为例,不同ph条件下dpyt的荧光强度如图20所示,探针dpyt在ph为2-9范围内具有较低的荧光强度,探针中加入正丙胺溶液后,ph在4-13均引起了荧光显著增强,结合识别前后荧光变化的显著程度,我们可得出ph在4-8范围内,荧光探针dpyt对正丙胺有较好的识别效果。
[0093]
实现快速检测,响应时间是关键因素。在含有dpyt的溶液中加入260μmol/l的正丙胺溶液后,监测溶液在660nm处的荧光强度随时间的变化。如图21所示,dpyt溶液在1.5秒内发生了明显的荧光信号增强直至平缓,如此超快的响应速度为后续制备指示标签实时监测鱼肉新鲜度奠定了基础。
[0094]
最后,测试了dpyt对正丙胺的细胞成像。将mcf-7细胞与10μmol/l的探针dpyt在37℃下共孵育30min,如图22所示,在暗场中无荧光。然后用pbs洗涤3次,加入不同浓度的正丙胺(0、10、100、200、500μmol/l)并孵育30min,随着正丙胺浓度的逐渐增加,红色荧光逐渐增强,表明探针dpyt能够在活细胞中对正丙胺进行荧光成像。
[0095]
十二、指示标签在模拟环境中(高65mm,直径18mm的圆柱形玻璃瓶),对挥发性胺的识别效果
[0096]
指示标签制备过程如下:称取3.24mg的荧光探针溶于10ml dmso中,将切好的直径2cm的圆形滤纸放置上述溶液浸泡过夜,然后取出放于烘箱中干燥,即可得到指示标签。
[0097]
在鱼肉变质过程中会产生一些代谢挥发物,如三乙胺、正丙胺、二乙胺等,检测这些代谢挥发物可以监测鱼肉新鲜度。为了验证制作的指示标签对挥发性胺是否具有选择性,我们将指示标签置于0.5%挥发性胺水溶液的顶部空间,模拟鱼肉变质环境下,指示标签对挥发性胺是否有响应。
[0098]
首先,取1ml浓度为50mmol/l挥发性胺,加入1ml蒸馏水中,配制成25mmol/l挥发性胺溶液;分别选用环己二胺、二乙胺、正丙胺、氨水、三乙胺、乙胺、精胺、尸胺、腐胺、2-苯乙胺、酪胺、色胺、苯胺、三甲胺和二甲胺十五种胺作为实验组,指示标签的空瓶作为空白对照组。如图23所示,指示标签日光颜色为紫色,荧光颜色为桃色,当接触不同的胺后,除色胺日光颜色没有明显变化外,其他14种胺在日光下有的变成红色、黄绿色、浅蓝绿色、灰色等,荧光颜色变成橙色、红色、紫罗兰色等,日光和荧光颜色均有明显变化,说明指示标签对挥发性胺敏感,具有良好的比色和荧光双重响应,也表明指示标签具有指示鱼肉新鲜度的潜力。
[0099]
十三、标签标准比色卡的制备
[0100]
为了制备标准比色卡,我们需要监测鱼肉从新鲜到腐败过程中,指示标签的自然光颜色和荧光灯照射下颜色的变化。我们选用三文鱼鱼肉为实验对象,取背部肉做去皮处
理,将鱼肉分割成多份5~6g的小块鱼肉,分别放置在一次性圆形透明塑料培养皿中,在培养皿盖子顶空处放入指示标签,扣紧盖子,放置于4℃冰箱贮藏,每间隔24小时检测1次三文鱼肉的tvb-n含量、ph值和色差值(见图24和图25),并采集指示标签自然光照片和荧光照片,获得的数据如图26所示。新鲜的三文鱼肉tvb-n含量从起始的4.9
±
0.06mg/100g整体呈上升趋势,tvb-n含量在第4天达到15.7
±
0.06mg/100g,到第8天达到了30.57
±
0.06mg/100g,而tvb-n可接受的极限值为30mg/100g。因此,三文鱼鱼肉为在4℃贮藏第8天可视为贮藏变质的临界值。在自然光下,指示标签由最初的紫色,变成蓝紫色,最终变成蓝灰色;在365 nm紫外光下,指示标签由最初的红色荧光,变成橙黄色荧光,最终变成黄色荧光。
[0101]
根据中华人民共和国国家标准gb/t 18108-2019(鲜海水鱼通则)中规定,海水鱼中tvb-n 含量最高限量为30mg/100g。tvb-n值≤15mg/100g时样品为优级;当15mg/100g《tvb-n 值≤30mg/100g时样品为合格;当tvb-n值》30mg/100g时,此时样品为不合格。
[0102]
根据实测的tvb-n值及对应的指示标签自然光颜色和紫外光颜色照片,我们选取tvb-n 值为4.9mg/100g和8.3mg/100g对应的指示标签在自然光下分别呈现为紫色和浅紫色,紫外光照射下呈现红色荧光和橙红色荧光,作为标准比色卡中新鲜部分的参照标准,当指示标签显示上述颜色状态之一时,可判断此样品为新鲜产品(见图27中新鲜区)。选取tvb-n值为15.7mg/100g和18.6mg/100g对应的指示标签在自然光下分别呈现为蓝紫色和浅蓝紫色,在紫外光照射下呈现橙黄色荧光,作为标准比色卡中合格部分的参照标准,当指示标签显示上述颜色状态之一时,可判断此样品为合格产品(见图27中合格区)。选取tvb-n值为30.57 mg/100g和33.53mg/100g对应的指示标签在自然光下呈现为蓝灰色,在紫外光照射下呈现黄色荧光,作为标准比色卡中不合格部分的参照标准,当指示标签显示上述颜色状态之一时,可判断此样品为不合格产品(见图27中腐败区)。
[0103]
十四、指示标签的实际应用
[0104]
使用指示标签对三文鱼新鲜度进行了实际监测应用,三文鱼样品处理与上述描述相同。图28中显示了4℃冰箱贮藏下三文鱼随贮藏时间的增加指示标签的颜色变化。新购买的三文鱼中指示标签在自然光下呈现紫色,紫外光下发出强烈的红色荧光,与标准比色卡中新鲜部分相对应;当贮藏时间为第4天时,指示标签自然光颜色为蓝紫色,紫外光下为中等强度的橙黄色荧光时,表明此时仍为合格产品。进一步增加贮藏时间到达第8天时,指示标签自然光颜色为蓝灰色,紫外光下为弱的黄色荧光时,表明此时三文鱼已经腐败,不合格产品不可食用。这种指示标签通过双模式信号变化,与标准比色卡对照可准确判断三文鱼鱼肉的实际鲜度,能帮助消费者购买合格的鱼肉产品,对海产品的安全检测具有重要意义。
[0105]
综上所述,我们制备的多功能近红外发射荧光探针dpyt,可用于hso
3-和胺类物质的检测,具有明显的颜色和荧光变化。在纯pbs(ph=7.4)缓冲溶液中,dpyt能超快检测hso
3-,具有良好的灵敏度。同时dpyt已成功应用于红酒和糖样中检测hso
3-,并可对活细胞中hso
3-和正丙胺进行荧光成像,具有生物应用价值。此外,本发明的指示标签制备过程简单,可以实现比色和荧光双通道指示鱼肉新鲜度,定性分析更准确可靠。该指示标签可非接触、无损化对鱼肉新鲜度进行快速实时监测,能为生产商、零售商、消费者提供及时有效的新鲜度信息,具有较好的实际应用价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1