同时检测MDPV和GPV的微滴数字PCR试剂盒及其检测方法与流程
本发明属于动物病毒学和分子生物学,具体涉及一种同时检测mdpv和gpv的微滴数字pcr试剂盒及其检测方法。
背景技术:
1、番鸭细小病毒(mdpv)和鹅细小病毒(gpv)均为细小病毒科细小病毒属的成员,病毒直径20~24nm,无囊膜、呈二十面体对称,基因组大小约5k。番鸭细小病毒病临床上主要发生于1~3周龄雏番鸭,以腹泻、软脚、喘气为特征,发病率为27%~62%,病死率为22%~43%,且病愈鸭大部分成为僵鸭;鹅细小病毒主要侵害30日龄以内的雏鹅和雏番鸭,病鸭以腹泻、肠黏膜脱落形成栓塞为主要特征,发病率50%~70%、病死率40%~65%。mdpv和gpv都严重损害免疫器官,造成免疫抑制,且存在混合感染,已成为影响养殖业健康发展的重要疫病之一,造成了养禽业巨大的经济损失。
2、 微滴数字pcr(droplet digital pcr,ddpcr)是一种新的分子技术,基将核酸样品分配到大量独立、平行的微反应单元(纳升级)中,部分反应单元包含靶标分子(阳性),而其他不包含(阴性),接着进行扩增,并利用taqman化学试剂或染料标记探针检测靶标序列,能够实现靶标分子的绝对计数。与第一、二代pcr技术相比,数字pcr具有很多优势:一是特异性、灵敏性均有显著提高;二是在不依赖内参和标准曲线的前提下,可直接得到绝对量化指标;三是微反应单元相互独立、封闭,避免了pcr抑制剂及不同核酸分子扩增产物间的相互干扰,准确度和可重复性较高。由于可以实现绝对定量和增强检测灵敏度,数字pcr技术可用于检测病毒感染、病毒潜伏期检测、残留病毒载量等。目前我国已有报道针对鸭坦布苏病毒(dtmuv)、猪圆环病毒(pcv)、猪伪狂犬病毒(prv)等单种致病病毒的微滴数字pcr检测方法,尚未有关于检测mdpv或gpv以及同时检测两种病毒的微滴数字pcr检测方法。
技术实现思路
1、本发明公开了一种能够同时检测mdpv和gpv两种病毒的微滴数字pcr试剂盒及其检测方法,其具有特异性好、灵敏度高等优点,为实验室鉴别检测mdpv和gpv提供了有效的技术手段。
2、本发明是采用如下技术方案实现的:
3、同时检测mdpv和gpv的微滴数字pcr试剂盒,其包括以下引物和探针,
4、用于检测mdpv的引物为:
5、mdpv-fq:5’-tgagctctttgcttcagttgct -3’(seq id no.1);
6、mdpv-rq:5’-cccacgggttttctttctctt-3’(seq id no.2);
7、用于检测mdpv的探针为:
8、mdpv-p:vic-ctctgccttccagtccggacacatct-bhq3(seq id no.3);
9、用于检测gpv的引物为:
10、gpv-fq:5’-tttacggatgacgagcatcaac-3’(seq id no.4);
11、gpv-rq:5’-ggaacggcggcatggt-3’(seq id no.5);
12、用于检测gpv的探针为:
13、gpv-p:cy5-cccgtatgtcctgggctcggc-bhq1(seq id no.6)。
14、同时检测mdpv和gpv的检测方法,所述检测方法是同时检测mdpv和gpv两种病毒的微滴数字pcr检测方法,其包括以下步骤:
15、(1)样品处理:取待测样品0.5 g,放入装有无菌钢珠的2 ml灭菌离心管中,加入1ml生理盐水,利用磨碎仪研磨至糜状,离心后取上清液200 µl,通过核酸提取试剂盒自动抽提dna后备用;所述待测样品为水禽的组织样品;
16、(2)扩增反应液配制:将步骤(1)中得到的dna作为模板进行ddpcr扩增反应,采用如seq id no.1~no.6所示的引物和探针配制扩增反应液,所述扩增反应液总体积为25μl,其包括:perfecta qpcr toughmix ung (quantabio) 12.5µl,浓度为1µmol/μl的fluorescein sodium salt 2.5µl,模板2.5µl,浓度为25pmol/μl的mdpv-fq和mdpv-rq各0.6µl,浓度为25pmol/μl的mdpv-p 0.2µl,浓度为25pmol/μl的gpv-fq 和gpv-rq各1.2µl,浓度为25pmol/μl的gpv-p 0.4µl,余量为无rna酶双蒸水;
17、(3)微滴生成和pcr扩增:将步骤(2)中配制得到的扩增反应液加入到sapphire芯片的孔井中并封闭孔井,然后将其转移到naica geode微滴生成和扩增系统中进行微滴生成和pcr扩增,所述pcr扩增的反应程序为:
18、step1:95℃预变性15s;
19、step2:95℃变性5s,59℃退火34s,共进行45个循环;
20、(4)微滴信号的读取和分析:将经过步骤(3)处理的sapphire芯片移入naciaprism 3仪器中,选择好荧光通道和芯片位置后开始读取芯片中的微滴数和荧光值,然后仪器会自动对每个芯片拍照,并对芯片中的每个微滴进行三色检测器扫描,确定阴阳性微滴信号,并且根据泊松分布原理计算出绝对检测浓度。
21、在步骤(1)中,所述待测样品包括水禽的气管、肺、肝、脾、肾、胸腺和法氏囊中的任意一种或多种组织样品。
22、本发明与现有技术相比较具有以下有益效果:
23、1、本发明根据mdpv的vp1基因序列段和gpv的vp3基因序列段,综合设计特异性引物和探针,优化用于微滴数字pcr检测的样品选取及处理方法、扩增反应液组成和配比、微滴生成和pcr扩增步骤的工作条件,特别是优化引物浓度、退火温度、扩增循环数等条件,并且对该方法进行敏感性、特异性、重复性试验,最后得到能够同时检测mdpv和gpv两种病毒的微滴数字pcr试剂盒及其检测方法,其具有特异性好、绝对定量、无需阳性对照、对pcr抑制剂的耐受力好等优点,为mdpv和gpv病毒的快速、准确的检测、监测和流行病学调查提供了有效的技术手段。
24、 2、本发明方法操作简单,并且按照本发明方法检测的检出下限为0.3copies/μl,即达到1×10-1copies/μl,相比qpcr检测方法,本发明具有更高的灵敏度和准确度,而且对于mdpv和gpv的共感染检出率明显高于qpcr检测方法,并且本发明方法还具有高度的线性和特异性所以,由此可见,本发明方法更适合应用在样本中病毒浓度较低或存在混合感染的情况。
25、实施方式
26、以下通过实施例进一步说明本发明,但不作为对本发明的限制。下列实施例中未注明的具体实验条件和方法,所采用的技术手段通常为本领域技术人员所熟知的常规手段。
27、实施例1:
28、同时检测mdpv和gpv的微滴数字pcr试剂盒,其包括以下引物和探针,
29、用于检测mdpv的引物为:
30、mdpv-fq:5’-tgagctctttgcttcagttgct -3’(seq id no.1);
31、mdpv-rq:5’-cccacgggttttctttctctt-3’(seq id no.2);
32、用于检测mdpv的探针为:
33、mdpv-p:vic-ctctgccttccagtccggacacatct–bhq3(seq id no.3);
34、上述用于检测mdpv的引物的扩增产物大小为73bp;
35、用于检测gpv的引物为:
36、gpv-fq:5’-tttacggatgacgagcatcaac-3’(seq id no.4);
37、gpv-rq:5’-ggaacggcggcatggt-3’(seq id no.5);
38、用于检测gpv的探针为:
39、gpv-p:cy5-cccgtatgtcctgggctcggc-bhq1(seq id no.6);
40、上述用于检测gpv的引物的扩增产物大小为70bp。
41、同时检测mdpv和gpv的检测方法,所述检测方法是同时检测mdpv和gpv两种病毒的微滴数字pcr检测方法,其包括以下步骤:
42、(1)样品处理:取待测样品0.5 g,放入装有无菌钢珠的2 ml灭菌离心管中,加入1ml生理盐水,利用磨碎仪研磨至糜状,离心后取上清液200 µl,通过核酸提取试剂盒自动抽提dna后备用;所述待测样品为水禽的组织样品,所述待测样品包括水禽的气管、肺、肝、脾、肾、胸腺和法氏囊中的任意一种或多种组织样品;所述核酸提取试剂盒为西安天隆科技有限公司生产的核酸提取试剂盒(ex-dna/rna病毒,dt6);
43、(2)扩增反应液配制:将步骤(1)中得到的dna作为模板进行ddpcr扩增反应,采用如seq id no.1~no.6所示的引物和探针配制扩增反应液,所述扩增反应液总体积为25μl,其包括:perfecta qpcr toughmix ung (quantabio) 12.5µl,浓度为1µmol/μl的fluorescein sodium salt 2.5µl,模板2.5µl,浓度为25pmol/μl的mdpv-fq和mdpv-rq各0.6µl,浓度为25pmol/μl的mdpv-p 0.2µl,浓度为25pmol/μl的gpv-fq 和gpv-rq各1.2µl,浓度为25pmol/μl的gpv-p 0.4µl,余量为无rna酶双蒸水;
44、(3)微滴生成和pcr扩增:将步骤(2)中配制得到的扩增反应液加入到sapphire芯片的孔井中并封闭孔井,然后将其转移到naica geode微滴生成和扩增系统中进行微滴生成和pcr扩增,所述pcr扩增的反应程序为:
45、step1:95℃预变性15s;
46、step2:95℃变性5s,59℃退火34s,共进行45个循环;
47、(4)微滴信号的读取和分析:将经过步骤(3)处理的sapphire芯片移入naciaprism 3仪器中,选择好荧光通道和芯片位置后开始读取芯片中的微滴数和荧光值,然后仪器会自动对每个芯片拍照,并对芯片中的每个微滴进行三色检测器扫描,确定阴阳性微滴信号,并且根据泊松分布原理计算出绝对检测浓度;
48、在微滴生成和pcr扩增步骤中产生18000到25000个可分析液滴,理论动态范围为5log,范围从0.2 copies/μl到20000copies/μl。采用naica prism3(stillatechnologies)分析仪器通过结合泊松分布计算正液滴与总液滴的比率,自动得到每个样品的绝对浓度。
49、实验例:
50、对本发明所述的两种水禽病病毒的微滴数字pcr试剂盒及其检测方法分别进行特异性、敏感性和重复性的试验分析,具体试验分析过程如下:
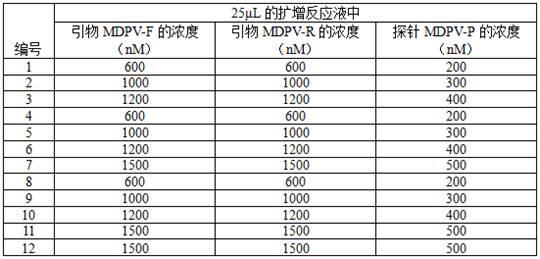
51、s1、实验用各种病毒的总核酸提取及反转录:
52、分别取mdpv疫苗株(fm株)和 gpv疫苗株(gd株)病毒液各200 µl,采用ex-dna/rna病毒核酸提取试剂盒提取总dna;分别取鸭坦布苏病毒(dtmuv)疫苗株(fx2010-180p株)、h5亚型禽流感病毒(aiv)疫苗株(re-12株)、h7亚型aiv疫苗株(re2株)、h9亚型aiv疫苗株(jy株)、ndrv分离株(gx-2020株)、mdrv疫苗株(ca株)、减蛋综合征病毒(edsv)疫苗株(hsh23株)、传染性法氏囊病病毒(ibdv)疫苗株(b87株)、鸭瘟病毒(dev)疫苗株病毒液各200 µl,采用ex-dna/rna病毒核酸提取试剂盒提取dna/rna ,将提取的dna和经过反转录后所得到的cdna置于-20℃下保存备用。
53、 s2、mdpv和gpv重组质粒标准品的制备:
54、以步骤s1中得到的mdpv和gpv的dna作为模板,采用pcr扩增的反应程序为:step1:95℃预变性5min;step2:95℃变性5s,59℃退火30s,72℃30s,共进行35个循环;step3:72℃10min,扩增反应进行扩增。回收扩增产物,连接至pmd18-t载体,转化到dh5α感受态细胞,涂amp+lb平板,过夜培养后挑选阳性菌落进行增菌,提取质粒后进行pcr和测序鉴定。正确构建重组质粒后,将它们作为阳性标准品,并且分别命名为pmdpv和pgpv,用紫外分光光度计质粒od260 nm值,计算质粒浓度并换算成拷贝数(copies/μl)。
55、 s3、ddpcr扩增反应的引物和探针浓度优化:
56、取步骤s2中得到的pmdpv阳性标准品作为模板,按照实施例1中所述方法进行检测,其中对扩增反应液进行调整,设置11组不同浓度的引物和探针组合,编号12是以无rna酶双蒸水作为模板的阴性对照(具体浓度见表1),ddpcr扩增的反应程序为:step1:95℃预变性15s;step2:95℃变性5s,59℃退火34s,共进行45个循环。
57、 表1 扩增反应液中各个引物和探针的浓度
58、
59、取步骤s2中得到的pgpv阳性标准品作为模板,按照实施例1中所述方法进行检测,其中对扩增反应液进行调整,设置11组不同浓度的引物和探针组合,编号12是以无rna酶双蒸水作为模板的阴性对照(具体浓度见表2),ddpcr扩增的反应程序为:step1:95℃预变性15s;step2:95℃变性5s,59℃退火34s,共进行45个循环。
60、 表2 扩增反应液中各个引物和探针的浓度
61、
62、s4、ddpcr扩增反应的退火温度优化:
63、取步骤s2中得到的pmdpv和pgpv的阳性标准品作为模板,按照实施例1中所述方法进行检测,其中对pcr扩增的反应程序进行调整,设置不同的退火温度(具体温度见表3),其它的反应程序和扩增反应液的配制均不变。
64、 表3 pcr扩增的反应程序的退火温度
65、
66、因为最佳退火温度、引物和探针浓度的选择是反应特异性的关键参数。根据液滴生产数、微滴密集程度和阳性液荧光信号值高度等情况综合考虑分析,两种病毒的最佳退火温度为59℃,可产生最多的正液滴数和总液滴数。选择阳性液荧光信号值最高,且微滴密集程度较好,阴阳性液荧光信号值区分明显,且中间弥散的微滴数占比较低的浓度组合,即所述扩增反应液中还有以下浓度的引物和探针:600nm的mdpv-f,600nm的mdpv-r,200nm的mdpv-p,1200nm的gpv-f,1200nm的gpv-r,400nm的gpv-p。
67、 s5、特异性试验:
68、ddpcr无需重组质粒标准品作为阳性对照,直接取步骤s1中得到的mdpv和gpv的dna,以及dtmuv、h5亚型aiv、h7亚型aiv、h9亚型aiv、mdrv、ndrv、edsv、ibdv、dev的总dna或cdna,将它们进行10000倍稀释后,各取2.5μl作为模板,并且以无rna酶双蒸水(ntc)为阴性对照,按照实施例1中所述方法进行检测。结果显示,本发明方法仅能检测出mdpv和gpv两种病毒,而其它各种模板均为阴性,表明本发明的检测方法与其它病毒没有交叉反应,具有较强的特异性。
69、 s6、ddpcr和qpcr的敏感性对比试验:
70、分别取步骤s2中得到的pmdpv和pgpv的阳性标准品配制成浓度为1.15×105copies/μl的溶液,然后10倍倍比稀释至1.15×10-1copies/μl,接着再分别取2.5 µl作为模板进行qpcr检测,检测程序与ddpcr一致,均为实施例1中所述方法进行检测,具体ct结果见表4,qpcr的标准曲线中pmdpv对应的标准曲线为mdpv: y=-3.454+43.887,r2=0.999;pgpv对应的标准曲线为gpv: y=-3.38+41.372,r2=1;
71、同时分别取2.5 µl作为模板,并且以无rna酶双蒸水为阴性对照,按照实施例1所述方法进行检测,具体结果见表5,以测量pmdpv和pgpv得到的平均拷贝数的对数函数值(log10)为y轴,阳性标准品的初始浓度的对数函数值(log10)为x轴,制图得到对应标准曲线图,其中pmdpv对应的标准曲线为y =0.9384x - 13.39,r2=1;pgpv对应的标准曲线为y =0.9044x - 13.846,r2 =1。
72、 对比试验结果显示,qpcr的检测下限为1.15×101copies/μl。相比之下,通过ddpcr检测的下限为0.3copies/μl,比qpcr检测高出约100倍,可见与qpcr检测相比,本发明所述的微滴数字pcr检测具有更好的灵敏度。同时通过测量浓度的log值与起始浓度的log值作图来获得量化相关性,微滴数字pcr检测得到mdpv的r2为1,gpv的r2为1,而通过得到的ct值与起始浓度的log值作图来获得量化相关性,qpcr检测得到mdpv的r2为0.999,gpv的r2为1,两种方法的结果都表现出极好的线性。
73、 表4 qpcr与ddpcr敏感性对比试验数据
74、
75、综上所述,本发明所述的微滴数字pcr检测方法是一种灵敏且准确有效的检测方法,浓度检测范围可以为10-1~104。
76、 (qpcr的扩增体系总体积为25μl,具体包括1× premix ex taq (probe qpcr)12.5μl,浓度为600nm的mdpv-f,浓度为600nm的mdpv-r,浓度为200nm的mdpv-p,浓度为1200nm的gpv-f,浓度为1200nm的gpv-r,浓度为400nm的gpv-p,余量为无rna酶双蒸水;扩增程序为:step1:95℃预变性2min;step2:95℃变性5s,59℃退火34 s,40个循环。所有反应均提供阴性和阳性对照,每个样品一式三份测定。ct值由荧光pcr仪器内置软件生成,ct 值小于35判定为阳性。)。
77、 s7、重复性试验:
78、分别取步骤s2中得到的pmdpv和pgpv的阳性标准品配制成浓度为1.15×103copies/μl的溶液,然后10倍倍比稀释至1.15×10-1copies/μl,分别取2.5μl作为模板按照实施例1所述方法进行检测,而且组内及组间重复性试验各进行3次,具体结果见表5。结果显示,组内的变异系数cv范围在1.92%和7.96%之间,组间的cv范围在1.53%和3.94%之间,说明本发明方法具有较好的重复性。
79、 表5 ddpcr的重复性试验数据
80、
81、s8、临床样品检测试验:
82、将采自2021年广西沿海地区的水禽临床样本52份,采集它们的气管、肺、肝、脾、肾、胸腺和法氏囊一同放入装有无菌钢珠的2 ml灭菌离心管中共计0.5 g,加入1 ml生理盐水,利用磨碎仪研磨至糜状,离心后取上清液200 µl,通过核酸提取试剂盒自动抽提总dna后作为模板,以无rna酶双蒸水为阴性对照,将所抽提的dna进行10000倍稀释,然后按照实施例1所述方法进行检测。同时按照上述敏感性试验中所述qpcr方法进行检测并以1.15×104copies/μl pmdpv和pgpv作为阳性对照,具体结果见表6。
83、 结果显示,qpcr方法检出mdpv和gpv阳性分别8份和10份(以ct值<35为准),2份gpv疑似阳性样品(ct值为35.45和36.13),ddpcr检测结果为mdpv和gpv阳性分别8份和12份,核酸浓度最低达到为0.18拷贝/μl ddpcr,结果判断为阳性;ddpcr与qpcr mdpv检测结果的符合率为100%,kappa至分析一致性为1>0.75;gpv检测结果的符合率为0.96%,kappa至分析一致性为0.885>0.75;证明两种检测方法一致性较高。因qpcr无法对可疑样本进行准确判断,而ddpcr敏感性更高,可视化芯片扫描结果可以清晰区分阳性微滴和杂质污染导致的假阳性结果,对低拷贝的样品检测结果更为准确可靠。
84、 表6 ddpcr和qpcr检测结果的比较
85、
86、此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式,上述实施例中的实验方法和试验材料,如无特殊说明,均为常规方法和市售材料。
- 还没有人留言评论。精彩留言会获得点赞!