一种(R)-氘代苯丙氨酸衍生物及其制备方法
一种(r)-氘代苯丙氨酸衍生物及其制备方法
技术领域
1.本发明涉及阻燃剂技术领域,具体为一种(r)-氘代苯丙氨酸衍生物及其制 备方法。
背景技术:
2.氘是氢的一种稳定的、非放射性同位素,它仅比氢原子多一个中子。但多出 的这个中子导致它们在化学性质方面存在一些差别:d相比于h,有着更小的摩 尔体积,并且脂溶性稍差于h。但最重要的是,c-d键比c-h键短,于是在很 多氧化反应里,c-d键有更好的稳定性。并且2017年第一个氘代药物—氘代丁 苯那嗪上市以来,氘代作为药物结构改造的一种方法逐步引起重视。最早的氘代 化合物可以追溯到19世纪60年代,在对氘代吗啡的研究中发现,对吗啡的n
‑ꢀ
甲基进行氘代后,不仅会导致吗啡的生物效力降低,还会减弱n-去甲基化的反 应速率,并且明显削弱吗啡与酶活性中心的结合。氘代吗啡与未氘代形式相比, 减慢了其在体内的代谢。目前的氘代药物还是以针对药物原型进行改造为主,这 种改造一般会减慢药物在体内的代谢。例如氘代形式的左旋多巴,左旋多巴在体 内经过脱羧作用形成多巴胺,α位的氘代能减弱单胺氧化酶的活性,从而减少了 二羟基苯乙酸的生成。而β位的氘代降低了多巴胺β羟化酶的活性,使得去甲肾 上腺素的生成减少。氘代后的左旋多巴相比于未氘代形式对于啮齿动物的帕金森 病的运动障碍模型有更好的治疗作用。目前该药正处于ⅰ期临床。
[0003][0004]
一般来说,实现精准氘代有两个途径:一是传统的化学合成,通常以经济易 得的小分子氘代化合物为起始材料,通过这种方法进行氘代能够保证非常好的区 域选择性和化学选择性,效率几乎达到100%。但存在步骤多,收率低的缺点; 另一种是同位素交换,这种方法以氘水或者氘气作为氘原子供体,对目标分子或 反应的最后一个中间体进行氘代,这种方法步骤简便,但存在区域选择性差和易 脱氘的问题。
[0005]
手性苯丙氨酸骨架普遍存在于药物分子中,例如抗帕金森药物左旋多巴 (levodopa)、用于治疗甲状腺功能减退症的左旋甲状腺素(levothyroxine)以 及用于治疗多发性骨髓瘤的马法兰(mephalan)。除此之外,美国亚利桑那大学 njardarson研究团队发
布的2020年全球销售额top200药物排行榜中,直接包含 苯丙氨酸结构的有用于治疗多发性骨髓瘤的硼替佐米(bortizomib,商品名 velcade,top 121)和左旋甲状腺素(levothyroxine,商品名synthroid,top193), 间接包含苯丙氨酸结构单元主要是一些多肽类药物,例如奥曲肽(octreotide, 商品名sandostatin,top118)、卡非佐米(carfilzomib,商品名kyprolis,top146) 以及血管加压素(vasopressin,商品名vasostrict,top189)。
[0006][0007]
目前,在药物中引入手性苯丙氨酸骨架一般采用不对称氢化的方法。此方法 来源于美国化学家william knowles。knowles在测试(d,l)-3,4-二羟基苯基 丙氨酸不同构型的对映体磷酸化的过程中,生产出一种催化剂,这种催化剂能在 氢化反应结束时生产出几乎100%纯度的左旋多巴,knowles也因为不对称氢化 反应的开发荣获2001年的诺贝尔化学奖。在knowles等人研究成果的基础上, 左旋多巴的商业化生产进程得以顺利进行:
[0008][0009]
但一般情况下,需要采用相对昂贵的rh、ru、ir等金属作为催化剂,贵金 属催化剂的高成本和高毒性阻碍了该技术在更大范围和更大规模上的应用。与贵 金属相比,第一类稀土过渡金属锰、铁、钴、镍和铜在不对称氢化反应中也表现 出了较高的效率,具有较低的成本和较低的毒性,为手性化合物的工业合成提供 了更可持续的前景。近年来,也开发出了co、ni等相对廉价金属催化的不对称 氢化方法。具体如2020年paul j chirik课题组开发的通过h2均裂实现钴催化α, β-不饱和羧酸的不对称氢化以及2019年南方科技大学张绪穆课题组开发的镍催 化的环己二酮的不对称氢化反应。
[0010][0011]
但遗憾的是,近年来发展的不对称氢化反应均以操作危险的氢气作为氢源, 以氢气以外的物质为氢源的方法还未见报道。因此需要开发一种相对廉价金属催 化且氢源安全易得的不对称氢化方法,而将氢源替换为相应的氘源即可做到不对 称氘化。基于此,本课题拟采用氘代醋酸作为氘源,以co作为催化金属开发一 种简便易行且普适性高的不对称氘化方法。
技术实现要素:
[0012]
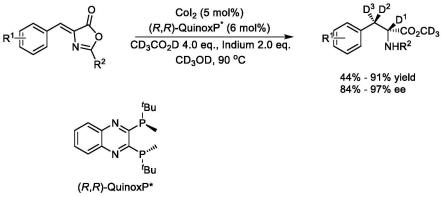
为了解决上述技术问题,本发明提供了一种(r)-氘代苯丙氨酸衍生物的制 备方法,在氩气条件下,将氘代甲醇、氘代醋酸、铟粉、不同取代基的噁唑啉酮 衍生物混合,加热回流,再加入催化体系,继续加热回流,检测反应情况,反应 结束后分离纯化,得到(r)-氘代苯丙氨酸衍生物,反应通式如下:
[0013][0014]
式中r1为h,4-甲基,4-甲氧基,4-硫甲基,4-异丙基,4-叔丁基,4-甲氧 酰基,4-氟,4-三氟甲基,4-氯,4-苯基,3-甲基,3-甲氧基,3-硫甲基,3-异丙 基,3-叔丁基,3-甲氧酰基,3-氟,3-三氟甲基,3-氯,3-苯基,2-甲基,2-甲氧 基,2-硫甲基,2-异丙基,2-叔丁基,2-甲氧酰基,2-氟,2-三氟甲基,2-氯,2
‑ꢀ
苯基,3,4-二甲基,3,4-二甲氧基,3,4-二硫甲基,3,4-二异丙基,3,4-二叔丁基, 3,4-二甲氧酰基,3,4-二氟,3,4-二三氟甲基,3,4-二氯,3,4-二苯基,3-氟-4-甲氧 基,3,5-二甲基,3,5-二甲氧基,3,5-二硫甲基,3,5-二异丙基,3,5-二叔丁基,3,5
‑ꢀ
二甲氧酰基,3,5-二氟,3,5-二三氟甲基,3,5-二氯噻吩,3,5-二苯基,2,
3-二甲基, 2,3-二甲氧基,2,3-二硫甲基,2,3-二异丙基,2,3-二叔丁基,2,3-二甲氧酰基,2,3
‑ꢀ
二氟,2,3-二三氟甲基,2,3-二氯,2,3-二苯基,2-噻吩,2-呋喃,1-萘,2-萘,环 己基,异丁基,苯丙基,苯乙基;r2为特戊酰基,苯甲酰基,乙酰基,丙酰基, 正丁酰基。
[0015]
优选地,所述(r)-氘代苯丙氨酸衍生物以(r,r)-(-)-2,3-双(叔丁基甲基膦 基)喹喔啉为配体引入的手性中心为r构型,以(s,s)-(+)-2,3-双(叔丁基甲基膦 基)喹喔啉引入的手性中心为s构型。
[0016]
优选地,氘代甲醇、氘代醋酸、铟粉、不同取代基的噁唑啉酮衍生物之间的 摩尔比为0.02-0.03:0.7-0.9:0.15-0.25:0.1-0.3,优选0.025:0.8:0.2:0.2。
[0017]
优选地,所述铟粉在反应过程中共添加了两次,且两次的添加量相等。
[0018]
优选地,所述加热回流的条件为:在80-100℃下回流11-13小时,优选在 90℃下回流12小时。
[0019]
优选地,所述催化体系包括碘化钴、(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹 喔啉、铟粉,其中,碘化钴、(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉、铟粉 之间的摩尔比为:0.05-0.15:0.01-0.014:0.15-0.25,优选0.01:0.012:0.2。
[0020]
优选地,所述继续加热回流的条件为:在80-100℃下回流20-28小时,优选 在90℃下继续回流24小时。
[0021]
优选地,所述检测反应情况的方法为薄层色谱法。
[0022]
优选地,所述分离纯化方法为:先通过硅胶柱层析纯化粗产物,再用洗脱剂 洗脱,其中,洗脱剂由正己烷与丙酮按照5:1的体积比混合得到。
[0023]
优选地,采用所述(r)-氘代苯丙氨酸衍生物的制备方法制备得到的(r)
ꢀ‑
氘代苯丙氨酸衍生物。
[0024]
与现有技术相比,本发明的有益效果为:
[0025]
本发明的(r)-氘代苯丙氨酸衍生物的制备方法中以一种全新且廉价易得、 操作简便的氘代醋酸作为氘源,以相对廉价的过渡金属钴催化,通过手性配体 (r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉构建一种简便高效且普适性良好的不 对称氘化方法;进一步地,本发明(r)-氘代苯丙氨酸衍生物的制备方法的目标 产物的产率、氘代率高、对映选择性好(对映体过量值最高可达97%)。
附图说明
[0026]
图1是本发明的(r)-氘代苯丙氨酸衍生物的制备反应示意图。
具体实施方式
[0027]
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地 描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例, 基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获 得的所有其他实施例,都属于本发明保护的范围。
[0028]
实施例1:(r)-特戊酰基苯丙氨酸甲酯-d5i-1的制备:
[0029]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及无取代叔丁基噁唑啉酮衍生物ii-1(0.2mmol, 1equiv),
90℃下回流反应12小时后,氩气条件加入催化体系:碘化钴(0.01mmol, 0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol,0.06equiv) 以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流24小时,tlc(薄 层色谱法)检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙 酮(5:1)洗脱,得到42.4mg白色固体,产率为79%。所得产物化学结构如下:
[0030][0031]1h nmr(400mhz,cdcl3):δ=7.31-7.22(m,3h),7.09-7.07(m,2h),6.03(s, 1h),3.18-3.15(m,0.10h),3.10-3.08(m,1h),1.15(s,9h)。
[0032]
13
c nmr(101mhz,cdcl3):δ=178.0,172.5,136.1,129.4,128.6,127.3, 52.7(t,j
c-d
=22.7hz),51.7-51.2(m),38.8,37.6(t,j
c-d
=20.0hz),27.5。
[0033]2h nmr(61mhz,cdcl3):δ=4.83,3.72,3.19。
[0034]
hrms(esi):c
15h16
d5kno3[m+k]
+
计算出的精确分子量307.1467,实测值 307.1467。
[0035]
hplc(daicelchiralcelod-h,正己烷/异丙醇=90/10,流速1.0ml/min, λ=210nm,t=30℃):tr(minor)=6.526min,tr(major)=5.616min,ee=89%。
[0036][0037]
实施例2:(r)-2-甲基-特戊酰基苯丙氨酸甲酯-d5i-2的制备:
[0038]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及2-甲基-叔丁基噁唑啉酮衍生物ii-2 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流48小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到27.9mg黄色固体,产率为49%。所得产物化学结构如下:
[0039][0040]1h nmr(400mhz,cdcl3):δ=7.17-7.08(m,3h),7.02-7.01(m,1h),6.04(s, 1h),3.17-3.13(m,0.13h),3.04-3.01(m,0.95h),2.34(s,3h),1.13(s,9h)。
[0041]
13
c nmr(101mhz,cdcl3):δ=178.1,173.0,136.8,134.4,130.7,130.0, 127.3,126.0,52.0-51.8(m),51.6-51.4(m),38.7,35.6(t,j
c-d
=20.1hz),27.5, 19.5。
[0042]2h nmr(61mhz,cdcl3):δ=4.81,3.67,3.18。
[0043]
hrms(esi):c
16h18
d5nnao3[m+na]
+
计算出的精确分子量305.1884,实测值305.1882。
[0044]
hplc(daicelchiralcelia,正己烷/异丙醇=95/5,流速0.5ml/min,λ=210nm, t=30℃):tr(minor)=14.336min,tr(major)=13.447min,ee=96%。
[0045][0046]
实施例3:(r)-2-氟-特戊酰基苯丙氨酸甲酯-d5i-3的制备:
[0047]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及2-氟-叔丁基噁唑啉酮衍生物ii-3(0.2mmol, 1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘化钴(0.02mmol, 0.1equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.024mmol,0.12equiv) 以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流24小时,tlc检测 反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1)洗脱, 得到49.8mg浅黄色固体,产率为91%。所得产物化学结构如下:
[0048][0049]1h nmr(400mhz,cdcl3):δ=7.25-7.20(m,1h),7.14-7.10(m,1h),7.08-7.06(m, 1h),7.04-7.00(m,1h),6.14(s,1h),3.22-3.19(m,0.16h),3.14-3.11(m,0.75h), 1.14(s,9h)。
[0050]
13
c nmr(101mhz,cdcl3):δ=178.1,172.3,161.5(d,j
c-f
=245.7hz),131.9(d, j
c-f
=4.5hz),129.1(d,j
c-f
=8.3hz),124.3(d,j
c-f
=3.5hz),123.2(dj
c-f
=16.2hz), 115.4(d,j
c-f
=22.4hz),52.3-52.0(m),51.9-51.6(m),38.8,31.1(t,j
c-d
=20.2hz), 27.4。
[0051]
19
f nmr(377mhz,cdcl3):δ=-117.7。
[0052]2h nmr(61mhz,cdcl3):δ=4.84,3.72,3.20。
[0053]
hrms(esi):c
15h15
d5fkno3[m+k]
+
计算出的精确分子量325.1373,实测值 325.1373。
[0054]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=210nm, t=30℃):tr(minor)=8.599min,tr(major)=6.969min,ee=84%。
[0055][0056]
实施例4:(r)-2-三氟甲基-特戊酰基苯丙氨酸甲酯-d5i-4的制备:
[0057]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及2-三氟甲基-叔丁基噁唑啉酮衍生物ii-4 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流48小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到47.4mg浅黄色固体,产率为71%。所得产物化学结构如下:
[0058][0059]1h nmr(400mhz,cdcl3):δ=7.63-7.61(d,j=8.0hz,1h),7.48(ψt,j=7.6hz, 1h),7.42(d,j=7.6hz,1h),7.33(ψt,j=7.6hz,1h),6.12(s,1h),3.33-3.29(m, 0.05h),3.15-3.11(m,0.91h),1.08(s,9h)。
[0060]
13
c nmr(101mhz,cdcl3):δ=178.2,172.4,135.3,132.0,131.7,129.2(q, j
c-f
=27.6hz),129.2,127.2,126.2(q,j
c-f
=5.2hz),126.1(q,j
c-f
=5.8hz),124.6(q, j
c-f
=274.7hz),52.7(t,j
c-d
=22.0hz),52.2-51.3(m),38.7,34.4(t,j
c-d
=20.1hz), 27.3。
[0061]
19
f nmr(377mhz,cdcl3):δ=-58.6。
[0062]2h nmr(61mhz,cdcl3):δ=4.91,3.67,3.30。
[0063]
hrms(esi):c
16h16
d5f3no3[m+h]
+
计算出的精确分子量337.1782,实测值 337.1782。
[0064]
hplc(daicelchiralcelad-h,正己烷/异丙醇=95/5,流速0.5ml/min,λ=205nm, t=30℃):tr(minor)=13.876min,tr(major)=16.312min,ee=97%。
[0065][0066]
实施例5:(r)-3-甲基-特戊酰基苯丙氨酸甲酯-d5i-5的制备:
[0067]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及3-甲基-叔丁基噁唑啉酮衍生物ii-5 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流48小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到39.4mg浅黄色固体,产率为70%。所得产物化学结构如下:
[0068][0069]1h nmr(400mhz,cdcl3):δ=7.17(ψt,j=7.6hz,1h),7.05(d,j=7.6hz,1h), 6.89-6.86(m,2h),6.03(s,1h),3.14-3.10(m,0.12h),3.06-3.03(m,0.86h),2.31(s, 3h),1.15(s,9h)。
[0070]
13
c nmr(101mhz,cdcl3):δ=178.0,172.5,138.2,135.9,130.3,128.5, 127.9,126.4,52.7(t,j
c-d
=22.2hz),52.0-51.1(m),38.8,37.4(t,j
c-d
=20.3hz), 27.5,21.4。
[0071]2h nmr(61mhz,cdcl3):δ=4.92,3.80,3.22。
[0072]
hrms(esi):c
16h18
d5kno3[m+k]
+
计算出的精确分子量321.1623,实测值 321.1624。
[0073]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=205nm, t=30℃):tr(minor)=8.239min,tr(major)=7.081min,ee=88%。
[0074][0075]
实施例6:(r)-3-氟-特戊酰基苯丙氨酸甲酯-d5i-6的制备:
[0076]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及3-氟-叔丁基噁唑啉酮衍生物ii-6(0.2mmol, 1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘化钴(0.02mmol, 0.1equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.024mmol,0.12equiv) 以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流24小时,tlc检测 反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1)洗脱, 得到51.2mg浅黄色固体,产率为89%。所得产物化学结构如下:
[0077][0078]1h nmr(400mhz,cdcl3):δ=7.27-7.22(m,1h),6.96-6.92(m,1h),6.86(d, j=7.6hz,1h),6.80-6.77(m,1h),6.07(s,1h),3.20-3.16(m,0.11h),3.10-3.07(m, 0.90h),1.16(s,9h)。
[0079]
13
c nmr(101mhz,cdcl3):δ=178.1,172.2,163.0(d,j
c-f
=247.1hz),138.7(d, j
c-f
=7.1hz),130.1(d,j
c-f
=8.3hz),125.1(d,j
c-f
=2.9hz),116.4(d,j
c-f
=21.3hz), 114.2(d,j
c-f
=21.0hz),52.8-52.4(m),52.0-51.6(m),38.8,37.3(t,j
c-d
=20.9hz), 27.5。
[0080]
19
f nmr(377mhz,cdcl3):δ=-113.2。
[0081]2h nmr(61mhz,cdcl3):δ=4.87,3.73,3.16。
[0082]
hrms(esi):c
15h15
d5fnnao3[m+na]
+
计算出的精确分子量309.1633,实测 值309.1631。
[0083]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=210nm, t=30℃):tr(minor)=8.851min,tr(major)=7.513min,ee=91%。
[0084][0085]
实施例7:(r)-3-甲氧基-特戊酰基苯丙氨酸甲酯-d5i-7的制备:
[0086]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及3-甲氧基-叔丁基噁唑啉酮衍生物ii-7 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.02mmol,0.1equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.024mmol, 0.12equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流24小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到51.6mg淡黄色固体,产率为87%。所得产物化学结构如下:
[0087][0088]1h nmr(400mhz,cdcl3):δ=7.19(ψt,j=8.0hz,1h),6.78(dd,j=8.4hz, 2.0hz,1h),6.66(d,j=7.6hz,1h),6.63-6.62(m,1h),6.05(s,1h),3.77(s, 3h),3.14-3.11(m,0.10h),3.10-3.05(m,0.88h),1.15(s,9h)。
[0089]
13
c nmr(101mhz,cdcl3):δ=178.0,172.4,159.9,137.6,129.7,121.7, 115.1,112.7,55.3,52.6(t,j
c-d
=21.9hz),52.1-51.4(m),38.8,37.6(t,j
c-d
=20.3hz), 27.5。
[0090]2h nmr(61mhz,cdcl3):δ=4.84,3.72,3.13。
[0091]
hrms(esi):c
16h18
d5kno4[m+k]
+
计算出的精确分子量337.1573,实测值 337.1572。
[0092]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=205nm, t=30℃):tr(minor)=10.658min,tr(major)=8.812min,ee=91%。
[0093][0094]
实施例8:(r)-4-甲基-特戊酰基苯丙氨酸甲酯-d5i-8的制备:
[0095]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及4-甲基-叔丁基噁唑啉酮衍生物ii-8 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流36小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到39.0mg白色固体,产率为69%。所得产物化学结构如下:
[0096][0097]1h nmr(400mhz,cdcl3):δ=7.09(d,j=8.0hz,2h),6.96(d,j=8.0hz,2h), 3.13-3.09(m,0.12h),3.07-3.04(m,0.93h),2.31(s,3h),1.15(s,9h)。
[0098]
13
c nmr(101mhz,cdcl3):δ=178.0,172.5,136.8,132.8,129.3,129.2, 52.9-52.5(m),51.8-51.4(m),38.8,37.1(t,j
c-d
=20.0hz),27.5,21.2。
[0099]2h nmr(61mhz,cdcl3):δ=4.85,3.72,3.09。
[0100]
hrms(esi):c
16h18
d5kno3[m+k]
+
计算出的精确分子量321.1623,实测值 321.1622。
[0101]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=205nm, t=30℃):tr(minor)=8.088min,tr(major)=6.799min,ee=91%。
[0102][0103]
实施例9:(r)-4-氟-特戊酰基苯丙氨酸甲酯-d5i-9的制备:
[0104]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及4-氟-叔丁基噁唑啉酮衍生物ii-9(0.2mmol, 1equiv),90
125.5(q,j
c-f
=3.7hz),124.3(q,j
c-f
=272.9hz),52.8-52.3(m),52.1-51.6(m),38.9, 37.4(t,j
c-d
=20.1hz),27.5。
[0118]
19
f nmr(377mhz,cdcl3):δ=-62.5。
[0119]2h nmr(61mhz,cdcl3):δ=4.87,3.73,3.25。
[0120]
hrms(esi):c
16h15
d5f3kno3[m+k]
+
计算出的精确分子量375.1341,实测值 375.1341。
[0121]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=205nm, t=30℃):tr(minor)=10.279min,tr(major)=8.430min,ee=86%。
[0122][0123]
实施例11:(r)-4-甲氧基-特戊酰基苯丙氨酸甲酯-d5i-11的制备:
[0124]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及4-甲氧基-叔丁基噁唑啉酮衍生物ii-11 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流24小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到45.7mg黄色固体,产率为77%。所得产物化学结构如下:
[0125][0126]1h nmr(400mhz,cdcl3):δ=7.00-6.97(m,2h),6.83-6.80(m,2h),6.03(s, 1h),3.78(s,3h),3.11-3.08(m,0.09h),3.05-3.02(m,0.91h),1.15(s,9h)。
[0127]
13
c nmr(101mhz,cdcl3):δ=178.0,172.5,158.9,130.4,128.0,114.1, 55.4,52.8(t,j
c-d
=22.0hz),52.1-51.6(m),38.8,36.7(t,j
c-d
=20.0hz),27.5。
[0128]2h nmr(61mhz,cdcl3):δ=4.76,3.66,3.12。
[0129]
hrms(esi):c
16h19
d5no4[m+h]
+
计算出的精确分子量299.2014,实测值 299.2010。
[0130]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=205nm, t=30℃):tr(minor)=9.868min,tr(major)=8.999min,ee=95%。
[0131][0132]
实施例12:(r)-4-氯-特戊酰基苯丙氨酸甲酯-d5i-12的制备:
[0133]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及4-氯-叔丁基噁唑啉酮衍生物ii-12(0.2mmol, 1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘化钴(0.01mmol, 0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol,0.06equiv) 以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流48小时,tlc检测 反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1)洗脱, 得到37.3mg白色固体,产率为62%。所得产物化学
结构如下:
[0134][0135]1h nmr(400mhz,cdcl3):δ=7.27-7.25(m,2h),7.03-7.01(m,2h),6.07(s, 1h),3.17-3.13(m,0.08h),3.07-3.04(m,0.84h),1.16(s,9h)。
[0136]
13
c nmr(101mhz,cdcl3):δ=178.0,172.2,134.6,133.1,130.7,128.7, 52.6(t,j
c-d
=22.0hz),52.2-51.3(m),38.8,36.9(t,j
c-d
=20.1hz),27.5。
[0137]2h nmr(61mhz,cdcl3):δ=4.84,3.71,3.15。
[0138]
hrms(esi):c
15h15
d5clkno3[m+k]
+
计算出的精确分子量341.1077,实测值 341.1076。
[0139]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=220nm, t=30℃):tr(minor)=10.266min,tr(major)=8.471min,ee=88%。
[0140][0141]
实施例13:(r)-4-异丙基-特戊酰基苯丙氨酸甲酯-d5i-13的制备:
[0142]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及4-异丙基-叔丁基噁唑啉酮衍生物ii-13 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流48小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到31.4mg黄色油状液体,产率为51%。所得产物化学结构如下:
[0143][0144]1h nmr(400mhz,cdcl3):δ=7.14(d,j=8.0hz,2h),6.99(d,j=8.4hz,2h), 6.02(s,1h),3.14-3.11(m,0.08h),3.06-3.03(m,0.85h),2.90-2.83(m,1h),1.23(s, 3h),1.21(s,3h),1.14(s,9h)。
[0145]
13
c nmr(101mhz,cdcl3):δ=178.0,172.6,147.8,133.2,129.3,126.7, 52.6(t,j
c-d
=22.0hz),52.1-51.2(m),38.8,37.1(t,j
c-d
=20.1hz),33.8,27.5,24.1。
[0146]2h nmr(61mhz,cdcl3):δ=4.84,3.72,3.13。
[0147]
hrms(esi):c
18h22
d5nnao3[m+na]
+
计算出的精确分子量333.2197,实测值 333.2197。
[0148]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速0.5ml/min,λ=205nm, t=30℃):tr(minor)=13.918min,tr(major)=12.167min,ee=89%。
[0149][0150]
实施例14:(r)-4-叔丁基-特戊酰基苯丙氨酸甲酯-d5i-14的制备:
[0151]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及4-叔丁基-叔丁基噁唑啉酮衍生物ii-14 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流48小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到28.5mg黄色油状液体,产率为44%。所得产物化学结构如下:
[0152][0153]1h nmr(400mhz,cdcl3):δ=7.31-7.28(m,2h),7.02-6.99(m,2h),6.01(s, 1h),3.15-3.11(m,0.08h),3.06-3.03(m,0.87h),1.29(s,9h),1.14(s,9h)。
[0154]
13
c nmr(101mhz,cdcl3):δ=178.0,172.6,150.1,132.9,129.1,125.6, 52.6(t,j
c-d
=21.7hz),52.0-51.2(m),38.8,37.0(t,j
c-d
=20.1hz),34.6,31.4,27.5。
[0155]2h nmr(61mhz,cdcl3):δ=4.84,3.72,3.16。
[0156]
hrms(esi):c
19h25
d5no3[m+h]
+
计算出的精确分子量325.2534,实测值 325.2534。
[0157]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速0.5ml/min,λ=205nm, t=30℃):tr(minor)=13.575min,tr(major)=11.981min,ee=92%。
[0158][0159]
实施例15:(r)-4-n,n-二甲基-特戊酰基苯丙氨酸甲酯-d5i-15的制备:
[0160]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及4-n,n-二甲基-叔丁基噁唑啉酮衍生物 ii-15(0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系: 碘化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉 (0.012mmol,0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继 续回流48小时,tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用 正己烷/丙酮(5:1)洗脱,得到36.9mg黄色油状液体,产率为59%。所得产物 化学结构如下:
[0161][0162]1h nmr(400mhz,cdcl3):δ=6.93(d,j=8.4hz,2h),6.65(d,j=8.8hz,2h), 6.03(s,1h),3.06-3.02(m,0.10h),3.01-3.00(m,0.98h),2.92(s,6h),1.16(s, 9h)。
[0163]
13
c nmr(101mhz,cdcl3):δ=178.0,172.6,150.0,130.0,123.5,112.9, 52.9(t,jc-d
=21.8hz),52.0-51.1(m),40.7,38.8,36.5(t,j
c-d
=20.0hz),27.5。
[0164]2h nmr(61mhz,cdcl3):δ=4.78,3.72,3.05。
[0165]
hrms(esi):c
17h21
d5n2nao3[m+na]
+
计算出的精确分子量334.2149,实测值 334.2149。
[0166]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=205nm, t=30℃):tr(minor)=11.861min,tr(major)=9.365min,ee=94%。
[0167][0168]
实施例16:(r)-3,4-二甲基-特戊酰基苯丙氨酸甲酯-d5i-16的制备:
[0169]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及3,4-二甲基-叔丁基噁唑啉酮衍生物ii-16 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol,0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流36小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到50.8mg白色固体,产率为86%。所得产物化学结构如下:
[0170][0171]1h nmr(400mhz,cdcl3):δ=7.03(d,j=7.6hz,1h),6.84(s,1h),6.79(d, j=7.6hz,1h),6.03(s,1h),3.10-3.06(m,0.09h),3.04-3.01(m,0.87h),2.21(s, 6h),1.16(s,9h)。
[0172]
13
c nmr(101mhz,cdcl3):δ=177.9,172.5,136.7,135.4,133.3,130.8, 129.9,126.7,52.8(t,j
c-d
=22.1hz),52.0-51.1(m),38.8,37.0(t,j
c-d
=20.1hz), 27.5,19.8,19.4。
[0173]2h nmr(61mhz,cdcl3):δ=4.79,3.72,3.08。
[0174]
hrms(esi):c
17h21
d5no3[m+h]
+
计算出的精确分子量297.2221,实测值 297.2222。
[0175]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=205nm, t=30℃):tr(minor)=8.253min,tr(major)=7.336min,ee=91%。
[0176][0177]
实施例17:(r)-3,4-二氟-特戊酰基苯丙氨酸甲酯-d5i-17的制备:
[0178]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及3,4-二氟-叔丁基噁唑啉酮衍生物ii-17 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流48小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到52.0mg白色固体,产率为85%。所
得产物化学结构如下:
[0179][0180]1h nmr(400mhz,cdcl3):δ=7.10-7.03(m,1h),6.92-6.87(m,1h),6.82-6.78(m, 1h),6.10(s,1h),3.17-3.13(m,0.14h),3.05-3.02(m,0.87h),1.17(s,9h)。
[0181]
13
c nmr(101mhz,cdcl3):δ=178.1,172.1,150.3(dd,j
c-f
=249.5hz,12.7hz), 149.7(dd,j
c-f
=248.6hz,12.7hz),133.2(dd,j
c-f
=5.4hz,4.3hz),125.4(dd,j
c-f
=6.2hz, 3.6hz),118.3(d,j
c-f
=17.2hz),117.4(d,j
c-f
=17.2hz),52.7(t,j
c-d
=22.1hz), 52.2-51.5(m),38.8,36.8(t,j
c-d
=20.3hz),27.5。
[0182]
19
f nmr(377mhz,cdcl3):δ=-137.7(d,j=21.1hz),-140.1(d,j=21.5hz)。
[0183]2h nmr(61mhz,cdcl3):δ=4.81,3.73,3.16。
[0184]
hrms(esi):c
15h15
d5f2no3[m+h]
+
计算出的精确分子量305.1720,实测值 305.1721。
[0185]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=210nm, t=30℃):tr(minor)=10.871min,tr(major)=8.864min,ee=90%。
[0186][0187]
实施例18:(r)-3-氟4-甲氧基-特戊酰基苯丙氨酸甲酯-d5i-18的制备:
[0188]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及3-氟4-甲氧基-叔丁基噁唑啉酮衍生物ii-18 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流48小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到39.6mg浅黄色油状液体,产率为63%。所得产物化学结构如下:
[0189][0190]1h nmr(400mhz,cdcl3):δ=6.89-6.85(m,1h),6.82-6.77(m,2h),6.07(s, 1h),3.86(s,3h),3.12-3.08(m,0.10h),3.03-3.00(m,0.95h),1.17(s,9h)。
[0191]
13
c nmr(101mhz,cdcl3):δ=178.0,172.3,152.3(d,j
c-f
=247.0hz),146.9(d, j
c-f
=10.7hz),129.0(d,j
c-f
=6.2hz),125.1(d,j
c-f
=3.5hz),117.1(d,j
c-f
=18.3hz), 113.6(d,j
c-f
=2.1hz),56.4,52.7(t,j
c-d
=22.0hz),52.2-51.3(m),38.8,36.6(t, j
c-d
=20.0hz),27.5。
[0192]
19
f nmr(377mhz,cdcl3):δ=-135.1。
[0193]2h nmr(61mhz,cdcl3):δ=4.79,3.73,3.10。
[0194]
hrms(esi):c
16h17
d5fnnao4[m+na]
+
计算出的精确分子量339.1739,实测 值339.1739。
[0195]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=205nm, t=30℃):tr(minor)=12.222min,tr(major)=10.835min,ee=94%。
[0196][0197]
实施例19:(r)-2,3-二甲氧基-特戊酰基苯丙氨酸甲酯-d5i-19的制备:
[0198]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及2,3-二甲氧基-叔丁基噁唑啉酮衍生物 ii-19(0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系: 碘化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉 (0.012mmol,0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继 续回流36小时,tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用 正己烷/丙酮(5:1)洗脱,得到45.4mg无色油状液体,产率为69%。所得产物 化学结构如下:
[0199][0200]1h nmr(400mhz,cdcl3):δ=6.98(ψt,j=8.0hz,1h),6.82(dd,j=8.0hz, 1.2hz,1h),6.71(dd,j=7.6hz,1.2hz,1h),3.84(s,6h),3.14-3.11(m,0.03h), 3.07-3.04(m,0.98h),1.11(s,9h)。
[0201]
13
c nmr(101mhz,cdcl3):δ=178.6,172.5,152.8,147.3,130.2,124.3, 122.9,111.9,60.6,55.9,53.5(t,j
c-d
=22.4hz),51.9-51.0(m),38.5,31.7(t, j
c-d
=19.9hz),27.4。
[0202]2h nmr(61mhz,cdcl3):δ=4.57,3.67,3.04。
[0203]
hrms(esi):c
17h21
d5no5[m+h]
+
计算出的精确分子量329.2119,实测值 329.2118。
[0204]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=205nm, t=30℃):tr(minor)=33.046min,tr(major)=12.705min,ee=85%。
[0205][0206]
实施例20:(r)-1-萘基-特戊酰基苯丙氨酸甲酯-d5i-20的制备:
[0207]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及1-萘基-叔丁基噁唑啉酮衍生物ii-20 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.02mmol,0.1equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.024mmol, 0.12equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流24小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到55.8mg黄色油状液体,产率为88%。所得产物化学结构如下:
[0208][0209]1h nmr(400mhz,cdcl3):δ=8.11(d,j=8.4hz,1h),7.86-7.84(m,1h),7.76(d, j=8.4hz,1h),7.56-7.46(m,2h),7.40-7.36(m,1h),7.24(d,j=6.4hz,1h), 6.11(s,1h),3.57(s,0.04h),3.55(m,0.99h),1.09(s,9h)。
[0210]
13
c nmr(101mhz,cdcl3):δ=178.1,172.7,134.0,132.6,132.4,128.9, 128.0,127.5,126.5,125.9,125.3,123.8,52.8(t,j
c-d
=22.2hz),52.0-51.1(m), 38.7,34.8(t,j
c-d
=20.1hz),27.4。
[0211]2h nmr(61mhz,cdcl3):δ=4.98,3.61。
[0212]
hrms(esi):c
19h18
d5kno3[m+k]
+
计算出的精确分子量357.1623,实测值357.1622。
[0213]
hplc(daicelchiralcelod-h,正己烷/异丙醇=95/5,流速1.0ml/min,λ=220nm, t=30℃):tr(minor)=15.288min,tr(major)=9.946min,ee=90%。
[0214][0215]
实施例21:(r)-1-噻吩-特戊酰基苯丙氨酸甲酯-d5i-21的制备:
[0216]
氩气条件下向封管中加入氘代甲醇(1.0ml),氘代乙酸(0.8mmol,4equiv), 一半量的铟粉(0.2mmol,1equiv)以及1-噻吩-叔丁基噁唑啉酮衍生物ii-21 (0.2mmol,1equiv),90℃下回流反应12小时后,氩气条件加入催化体系:碘 化钴(0.01mmol,0.05equiv),(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉(0.012mmol, 0.06equiv)以及剩余量的铟粉(0.2mmol,1equiv),90℃下继续回流24小时, tlc检测反应情况。反应完后通过硅胶柱层析纯化粗产物,用正己烷/丙酮(5:1) 洗脱,得到42.8mg浅黄色固体,产率为78%。所得产物化学结构如下:
[0217][0218]1h nmr(400mhz,cdcl3):δ=7.15(d,j=5.2hz,1h),6.93-6.91(m,1h),6.74(d, j=3.2hz,1h),6.25(s,1h),3.37(s,0.05h),3.35(s,0.78h),1.19(s,9h)。
[0219]
13
c nmr(101mhz,cdcl3):δ=178.1,171.8,137.4,127.1,126.8,124.9, 52.6(t,j
c-d
=22.0hz),52.2-51.4(m),38.8,31.8(t,j
c-d
=20.6hz),27.5。
[0220]2h nmr(61mhz,cdcl3):δ=4.83,3.73,3.37。
[0221]
hrms(esi):c
13h15
d5no3s[m+h]
+
计算出的精确分子量275.1472,实测值 275.1473。
[0222]
hplc(daicelchiralcelia,正己烷/异丙醇=95/5,流速0.5ml/min,λ=230nm, t=30℃):tr(minor)=17.068min,tr(major)=15.768min,ee=90%。
[0223][0224]
对比实施例:对比产物外消旋体iii-1~iii-21的制备:
[0225]
制备方法参照实施例1,将其中的手性配体(r,r)-(-)-2,3-双(叔丁基甲基膦 基)
喹喔啉替换为(r,r)-(-)-2,3-双(叔丁基甲基膦基)喹喔啉与(s,s)-(+)-2,3-双(叔 丁基甲基膦基)喹喔啉一比一的混合物,分别催化相应的实施例1~21的反应物ii-1~ii-21得外消旋体的产物iii-1~iii-21。
[0226]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言, 可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变 化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1