用于CRISPR级联核酸检测系统的核酸分子及应用的制作方法
本发明涉及生物检测领域,特别是涉及用于crispr级联核酸检测系统的核酸分子及应用。
背景技术:
1、核酸体外扩增技术在分子生物和生物分析等领域是一项重要的技术,可用于定性、定量地分析和检测微量核酸,其在临床医学、检验医学、分子生物学、基因组学及食品安全等相关的各个领域发挥着重要的作用,是生命科学发展不可或缺的一种重要检验方法。随着生物技术在临床和现场检测方面要求的不断提升,越来越多的研究人员开始把目光专注于核酸体外扩增新技术的研究。聚合酶链式反应(polymerase chain reaction,pcr)由于其特异性强,灵敏度高等优点,是目前应用最为广泛的核酸体外扩增技术。基于pcr反应进一步发展出的各种各样的荧光定量pcr方法,正是使用荧光探针整合到扩增反应中,通过荧光的强度或者时间分辨来实时或者最终反映体系中核酸的产量,是目前应用最广和最稳定、工业化程度最高的核酸检测手段。
2、虽然pcr技术已经应用于分子生物学等各个领域,但是该技术需要通过循环多次的温度升降变化才能实现核酸扩增,因此,热循环仪是不可或缺的设备。然而,由于热循环仪对升降温速度要求高、体积大、价格较高、维护较精细等,使其在需要迅速出结果的基层的推广和现场检测中受到了明显的限制。因此,陆续出现了不同的等温和低温扩增技术,这些技术反应温度单一,不受热循环仪的制约,正逐渐弥补pcr无法覆盖的现场应用场景。
3、无论是pcr还是等温扩增技术,都是基于核酸双链碱基配对的酶促核酸复制技术,在复制的同时其特异性由引物碱基配对原则来保证。由于其特异性和灵敏度高的特点,在分子检验工业化中充当着中流砥柱的作用。然而随着应用的扩大,其方法学上的缺陷也渐渐限制了其进一步的市场扩大。由于核酸复制产物的稳定性和复制方法学的灵敏度极高,逐步累积的特异性dna复制产物会显著地影响检验的稳定性。为了稳定地获得检测结果,业内建立了各种各样的方法,目前最有效的包括掺入尿嘧啶脱氧核糖核苷酸使复制产物可以被尿嘧啶糖基化酶降解;对实验室建设和运行进行严格分区和气流控制,并指定严格的操作流程,防止复制产物气溶胶的扩散和回流污染;另外还有把复制反应封装到密闭的反应仓中等进行统一处理,但复制产物积累的问题并未得到彻底解决。
4、自crispr系统中反式剪切活性的发现,触发了基于crispr的快速现场检测方法的发展和迭代。然而目前的crispr检测系统由于其需要一定的模板浓度触发反应,仍然依赖于在进行crispr检测前各种各样的等温扩增方法获取足够的产物数量,同时行业内报道的大部分基于等温扩增-crispr的检测系统仍然无法解决扩增系统和crispr系统互相干扰的问题,需要进行扩增后产物转移到后续的检测系统中。虽然有部分报道能优化到一定的程度,但其稳定性还是受到比较大的挑战。这样无论从使用的便捷性和对上述的污染角度来说,目前都限制了该方法的广范应用。
技术实现思路
1、针对上述技术问题,本发明提供一种用于crispr级联核酸检测系统的核酸分子,该核酸分子呈高度稳定的结构化,采用该核酸分子构建的crispr级联核酸检测系统能够实现两级循环放大反应,能够在不联用核酸模板链式扩增方法的前提下,提高crispr报告系统的报告速度、报告强度和报告灵敏度,既不会导致核酸复制产物的积累,也能单独作为核酸检验的手段使用。
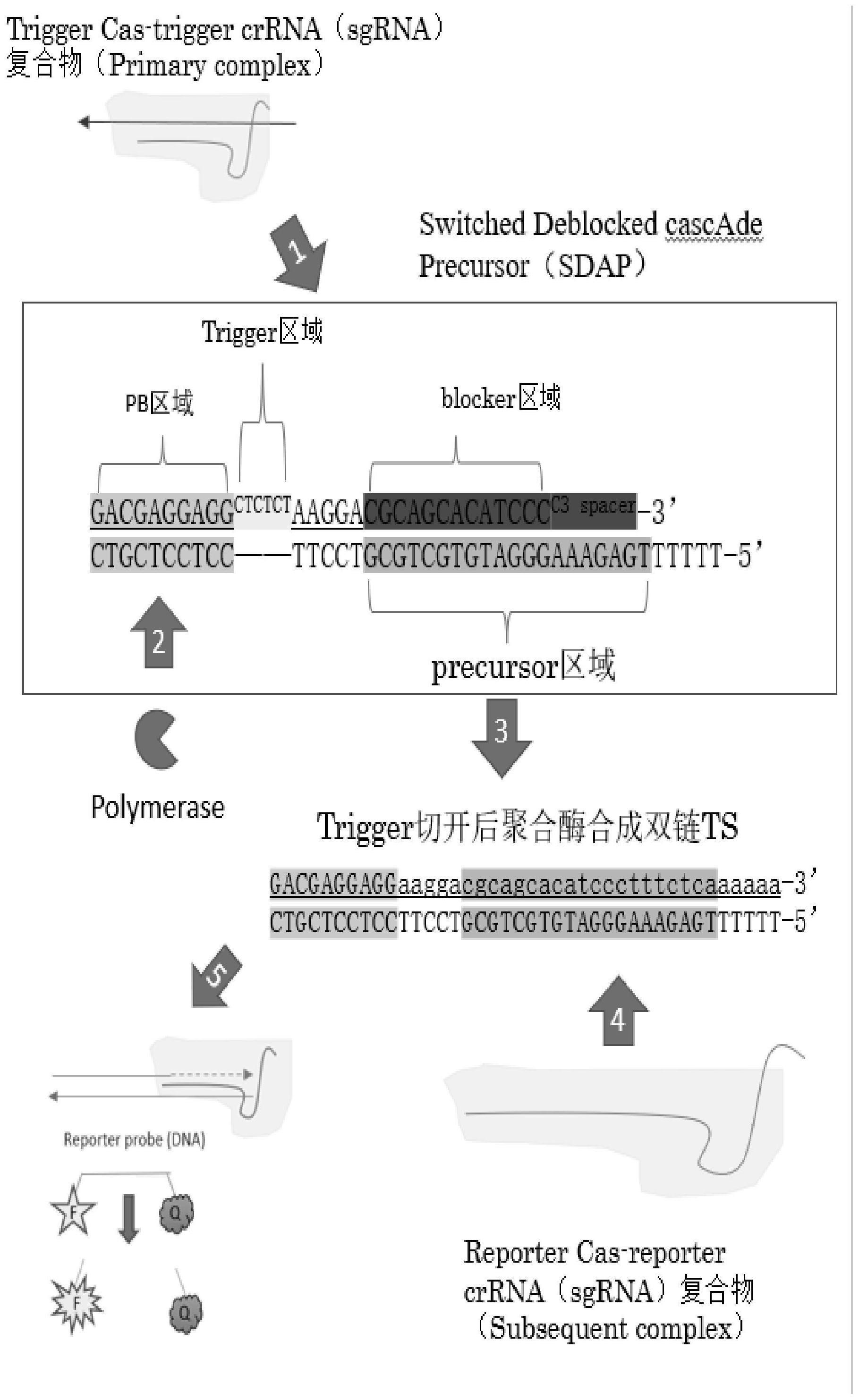
2、本发明提供了一种用于crispr级联核酸检测系统的核酸分子,该核酸分子包括聚合酶结合前导区、触发核酸酶切割区和外切聚合封闭区;
3、所述聚合酶结合前导区具有dna聚合酶结合位点,所述触发核酸酶切割区为具有反式核酸内切酶结合切割位点的单链核酸序列,所述外切聚合封闭区的3’端被修饰以避免发生非特异性外切聚合反应;
4、所述触发核酸酶切割区被切割后,所述聚合酶结合前导区和所述外切聚合封闭区连接,结合于所述聚合酶结合前导区的dna聚合酶可使外切聚合封闭区由5’端向3’端延伸,合成可被crispr报告系统的报告sgrna识别的靶序列。
5、本发明人在研究过程中发现,能用于现场快速检测的crispr系统,是利用crispr的顺式识别和反式切割作用,当crispr-sgrna复合体识别到与sgrna靶标同源的序列时,激活反式切割活性进行信号报告。其本身的反应不涉及核酸模板的扩增,但具有sgrna的特异性和反式切割活性的高反应能力,是理想的能替代核酸扩增的信号识别和报告系统。但如果只依赖反式切割活性进行报告,以目前报导的cas酶家族形成顺式切割复合物的情况下激活的反式切割反应效率基本上在10个荧光探针分子/秒左右,在107以下的模板,其达到信号报告水平的时间会超过10个小时。
6、因此,本发明人构建上述核酸分子,该核酸分子中的聚合酶结合前导区供dna聚合酶结合,在反式核酸内切酶切开触发核酸酶切割区的情况下,dna聚合酶能够沿5’-3’方向发生延伸反应,合成靶序列,该靶序列可被crispr报告系统的报告sgrna识别;该核酸分子中的触发核酸酶切割区具有供反式核酸内切酶作用的位点,能够供cas12或cas13被待测靶标核酸激活的情况下作用;该核酸分子中的外切聚合封闭区,在dna聚合酶不发生延伸的情况下,该外切聚合封闭区没有完整或正确的供crispr报告系统的报告sgrna识别的靶序列,使报告cas酶的反式切割活性不会被激活。
7、在其中一个实施例中,所述触发核酸酶切割区可被crispr触发系统的cas酶切割,所述crispr触发系统中的触发sgrna的靶向结构域与待测靶标核酸互补。
8、在其中一个实施例中,所述聚合酶结合前导区选自以下序列:
9、cctcctcgtcgacgaggagg(seq id no:18)
10、gcaaacaccgcggtgtttgc(seq id no:19)
11、aatcccaatcccatgggattgggatt(seq id no:20)。
12、在其中一个实施例中,所述触发核酸酶切割区选自以下序列:ttttttt,ttttttttt,gactttttttttgtt(seq id no:21),或cgttagggttagggttaggg(seq id no:22)。
13、采用上述聚合酶结合前导区、触发核酸酶切割区配合,构建得到的核酸分子具有较好的级联放大效应。
14、在其中一个实施例中,所述触发核酸酶切割区为ttttttt时,由5’端向3’端的第4位碱基t被修饰为du;
15、所述触发核酸酶切割区为ttttttttt时,由5’端向3’端的第3位碱基t被修饰为du;
16、所述触发核酸酶切割区为gactttttttttgtt(seq id no:21)时,由5’端向3’端的第6位碱基t被修饰为du。
17、在其中一个实施例中,所述触发核酸酶切割区为gactttttttttgtt(seq id no:21),由5’端向3’端的第6位碱基t被修饰为du,所述聚合酶结合前导区为gcaaacaccgcggtgtttgc(seq id no:19)。
18、采用上述特定的聚合酶结合前导区、触发核酸酶切割区配合,构建得到的核酸分子具有更优的级联放大效应。
19、在其中一个实施例中,所述外切聚合封闭区的序列长度≤15nt。
20、采用上述长度的外切聚合封闭区,能够不产生背景荧光。
21、在其中一个实施例中,所述外切聚合封闭区选自以下序列:
22、cgcagcacatccc(seq id no:6)
23、cgcagcacatccctt(seq id no:7)。
24、在其中一个实施例中,所述外切聚合封闭区的3’端具有以下修饰:ddntp修饰,invert-dt修饰,或c3-spacer修饰。
25、采用上述修饰,能够是外切聚合封闭区的3’端封闭聚合活性。
26、在其中一个实施例中,所述外切聚合封闭区的5’端还包括linker区,所述linker区用于使所述靶序列和所述dna聚合酶结合位点之间具有预定距离。
27、上述linker区使报告sgrna能与靶序列结合,而不会被空间位阻阻拦。
28、在其中一个实施例中,所述linker区的长度为5±2bp。
29、在其中一个实施例中,所述linker区选自以下序列:aagga,gtagga,或ttag。在其中一个实施例中,所述核酸分子还包括模板前体序列,所述模板前体序列包括第一区域序列与第二区域序列,所述第一区域序列与所述外切聚合封闭区互补,所述第二区域序列为所述外切聚合封闭区延伸的模板。
30、当crispr级联核酸检测系统中的dna聚合酶为模板依赖的聚合酶时,上述模板前体序列为dna聚合酶提供模板,使dna聚合酶延伸生成互补链后,形成可被crispr报告系统的报告sgrna识别的靶序列。
31、在其中一个实施例中,所述模板前体区序列的第二区域序列核酸具有硫代修饰。
32、采用上述修饰,能够避免被激活的触发sgrna切掉。
33、本发明还提供了一种crispr级联核酸检测系统,包括:触发sgrna,触发cas酶,dna聚合酶,报告sgrna,报告cas酶,报告探针,和所述核酸分子;所述触发sgrna的靶向结构域与待测靶标核酸互补,所述报告探针具有被所述报告cas酶切割的位点。
34、上述检测系统,通过改造crispr报告系统,使用与cas酶共享一个待测靶标核酸的特异性核酸酶,级联另一个反应常数相近的报告系统,从而对顺式或反式切割活性进行下一级级放大,提高整个系统的反应速度接近核酸扩增的信号报告速度,使其在免于核酸模板复制的前提下通过简单的温度达到应用类似于生化和免疫类检测反应的装置或者平台进行检测的目标,成为一种低成本、易操作、高灵敏度的检测方法。
35、在其中一个实施例中,当所述dna聚合酶为非模板依赖聚合酶,所述核酸分子选自上述不包括模板前体序列的核酸分子;当所述dna聚合酶为模板依赖聚合酶,所述核酸分子选自上述包括模板前体序列的核酸分子。
36、当dna聚合酶为非模板依赖聚合酶时,上述核酸分子不需要模板前体区序列;当dna聚合酶为模板依赖聚合酶时,上述核酸分子需要模板前体区序列。
37、在其中一个实施例中,所述dna聚合酶包括以下酶中的至少1种:t4 dna聚合酶,bca dna聚合酶,t7 dna聚合酶,i型dna聚合酶,phi29 dna聚合酶,或末端转移酶。
38、上述dna聚合酶具有3’-5’外切活性和链置换活性。
39、在其中一个实施例中,所述dna聚合酶包括klenow fragment。
40、上述klenow fragment为i型dna聚合酶的大片段。
41、在其中一个实施例中,所述dna聚合酶选自:t4 dna聚合酶,bca dna聚合酶,t7dna聚合酶,i型dna聚合酶,phi29 dna聚合酶,则所述聚合酶结合前导区为双链;所述dna聚合酶选自:末端转移酶,则所述聚合酶结合前导区为单链。
42、在其中一个实施例中,所述dna聚合酶为t4 dna聚合酶和bca dna聚合酶的组合,或i型dna聚合酶。
43、上述dna聚合酶的组合或单酶,具有较优的3’-5’外切活性和链置换活性。
44、在其中一个实施例中,所述触发cas酶选自cas12酶或cas13酶,所述报告cas酶选自cas12酶或cas13酶。
45、在其中一个实施例中,所述触发cas酶、所述报告cas酶均为cas12b。
46、本发明还提供了一种crispr级联核酸检测方法,该检测方法通过所述crispr级联核酸检测系统实现,所述检测方法包括以下步骤:
47、第一级循环放大:触发sgrna识别到待测靶标核酸后,触发cas酶的反式切割活性激活,将所述触发核酸酶切割区切割,使结合于所述聚合酶结合前导区的dna聚合酶活性激活,所述外切聚合封闭区在dna聚合酶作用下延伸,合成可被crispr报告系统的报告sgrna识别的靶序列;
48、第二级循环放大:将所述报告sgrna和所述报告cas酶与上述合成的靶序列进行反应,报告cas酶的反式切割活性激活,对报告探针进行反式切割,收集报告探针产生的信号,得到检测结果。
49、待测靶标核酸被触发sgrna识别后,通过第一级循环放大步骤,上述核酸分子合成可被crispr报告系统的报告sgrna识别的靶序列,该靶序列可以通过第一级循环放大步骤不断生成,反应速度依赖于触发cas酶的反式切割速度和dna聚合酶的合成速度;然后在第二级循环放大步骤中,靶序列与报告sgrna和报告cas酶形成cas次级放大的复合物,对报告探针进行反式切割,而靶序列与报告sgrna和报告cas酶形成cas次级放大的复合物后,靶序列并不会消解,而是与报告sgrna和报告cas酶持续性产生对报告探针切割的活性,形成第二级循环放大。
50、在其中一个实施例中,所述可被crispr报告系统的报告sgrna识别的靶序列为cas-grna顺式识别的双链结构。
51、与现有技术相比,本发明具有以下有益效果:
52、本发明的用于crispr级联核酸检测系统的核酸分子及其应用,该核酸分子中的聚合酶结合前导区供dna聚合酶结合,在反式核酸内切酶切开触发核酸酶切割区的情况下,dna聚合酶能够沿5’-3’方向发生延伸反应,合成靶序列,该靶序列可被crispr报告系统的报告sgrna识别;该核酸分子中的触发核酸酶切割区具有供反式核酸内切酶作用的位点,能够供cas12或cas13被待测靶标核酸激活的情况下作用;该核酸分子中的外切聚合封闭区,在dna聚合酶不发生延伸的情况下,该外切聚合封闭区没有完整或正确的供crispr报告系统的报告sgrna识别的靶序列,使报告cas酶的反式切割活性不会被激活。采用该核酸分子构建的crispr级联核酸检测系统能够实现两级循环放大反应,能够在不联用核酸模板链式扩增方法的前提下,提高crispr报告系统的报告速度、报告强度和报告灵敏度,既不会导致核酸复制产物的积累,也能单独作为核酸检验的手段使用。
- 还没有人留言评论。精彩留言会获得点赞!