小鼠腹水致敏物及其应用的制作方法
1.本发明属于抗体制备技术领域,特别涉及一种小鼠腹水致敏物及其应用。
背景技术:
2.利用杂交瘤细胞大量制备单克隆抗体目前主要有两种方法,一种是体外培养法,另外一种是动物体内生产法。
3.体外培养法:体外培养可以采用单层细胞培养的形式,也可以采用悬浮培养的形式。细胞体外培养一定时间后,收集培养上清液,离心去除细胞及其碎片,即可获得所需要的单克隆抗体。抗体相较于免疫动物生产单克隆抗体的方法,体外培养不需要对得到的抗体进行纯化,但该法的产量较低且费用昂贵。
4.动物体内生产单抗的方法:鉴于绝大多数动物用杂交瘤均由balb/c小鼠的骨髓瘤细胞与同品系的脾细胞融合而得,因此使用的动物首选balb/c小鼠。将杂交瘤细胞接种于小鼠腹腔内,在小鼠腹腔内生长杂交瘤,并产生腹水,可得到大量的腹水单抗。该法操作简便、经济且抗体浓度很高。但是,腹水中常混有小鼠的各种杂蛋白(包括ig),因此得到的腹水抗体要提纯后才能使用。
5.本发明大规模生产制备单克隆抗体,综合考虑经济成本、人力成本及抗体产量等因素,最终选择动物体内生产法。通常附加值较高的抗体采用balb/c小鼠进行生产,而附加值相对较低的抗体(如阻断剂项目等)采用f1小鼠(balb/c小鼠与昆明鼠或icr小鼠杂交第一代)进行生产。
6.常规的小鼠腹水制备单克隆抗体方法:小鼠品系:balb/c小鼠,f1小鼠;小鼠性别:雄性,雌性(注意分笼,通常雄鼠腹水产量较雌鼠高一些);小鼠周龄:8-10周;
7.常规的实验步骤:
8.1、致敏小鼠,提前3天将弗式不完全佐剂或提前7天将石蜡油注射到小鼠腹腔内,每只小鼠注射0.5ml;
9.2、3天(弗式不完全佐剂致敏)或7天(石蜡油致敏)后,将需要生产的杂交瘤细胞注射入小鼠腹腔中,每只小鼠注射1*106个细胞,0.5ml;
10.3、7-10天后,观察小鼠腹部是否有明显隆起,以此判断是否需要采集腹水;
11.4、根据不同的抗体制定不同的纯化方案:
①
硫酸铵沉淀法
②
辛酸硫酸铵沉淀法
③
亲和纯化(过proteina/g柱)。
12.公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
13.本发明的目的在于提供一种小鼠腹水致敏物,从而克服上述现有技术中腹水产量降低,小鼠死亡率升高,同时出现血性腹水的缺陷。
14.为实现上述目的,本发明提供了一种小鼠腹水致敏物,致敏物的有效成分为:降植
烷(pristane,中文别名老鲛烷,分子式c
19h40
,casno.1921-70-6)、石蜡油(paraffinoil,casno.8012-95-1)、矿物油(mineraloil,casno.8020-83-5)、二缩甘露醇一油酸(mannidemonooleate,分子式c
24h4406
,casno.25339-93-9);按照容积比计:
15.降植烷10-15%,
16.石蜡油50-60%,
17.矿物油20-30%,
18.二缩甘露醇一油酸10-15%。
19.优选地,上述技术方案中,有效成分按照每毫升计算为:0.1ml-0.15ml降植烷,0.5ml-0.6ml石蜡油,0.2ml-0.3ml矿物油,0.1ml-0.15ml二缩甘露醇一油酸。
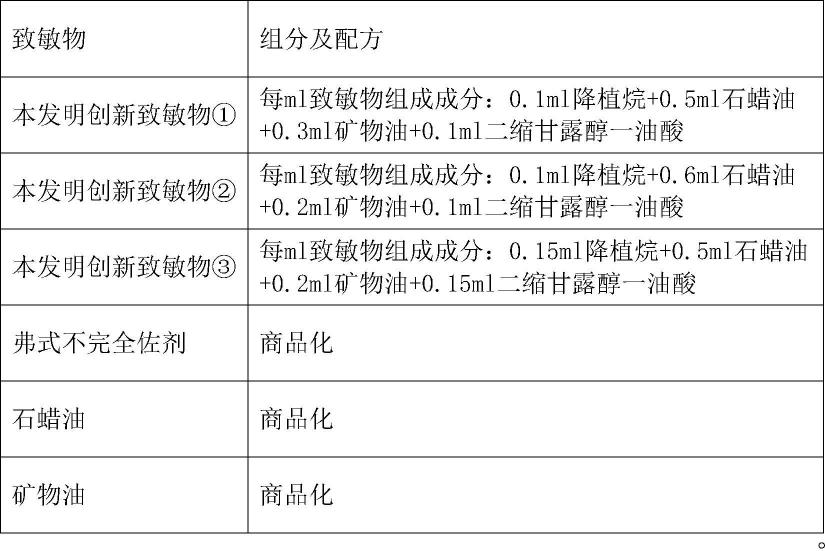
20.优选地,上述技术方案中,小鼠腹水致敏物为权利要求1或者权利要求2提供的组分组成。
21.优选地,上述技术方案中,小鼠周龄为8-10周。
22.与现有技术相比,本发明具有如下有益效果:
23.1.使用本发明公开的致敏物致敏小鼠后,在注射杂交瘤细胞进入小鼠腹腔,可以诱导产生更多的腹水量;
24.2.利用腹水传代的方法,针对部分杂交瘤细胞株易致瘤,易致死,腹水产量少,出现血清腹水的特性进行优化,优化后被注射细胞的小鼠腹腔内瘤细胞明显减少,死亡率降低,同时腹水产有了一定的提高,血性腹水情况得到了一定的改善。
附图说明
25.图1为表格3中实验组1-实验组3的腹水示意图;
26.图2为表格3中对照组1-对照组3的腹水示意图;
27.图3为表格4中实验组和对照组的腹水示意图。
具体实施方式:
28.下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
29.除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
30.实验准备
31.小鼠品系:f1小鼠;小鼠性别:雄性;小鼠周龄:8-10周;
32.注射的细胞株:s-1hbr1杂交瘤细胞株(该细胞株按照常规方法制备抗体,极易引起小鼠腹腔内产生大量实体瘤,腹水产量降低,小鼠状态不佳甚至部分死亡,且伴随较为严重的血性腹水现象)。
33.致敏物,如表1所示:
34.表1
[0035][0036]
备注:降植烷成本太高,不适合大规模生产中单独作为致敏物,这里不予考虑。
[0037]
实验步骤
[0038]
1.致敏小鼠:按照表2所示提前致敏好小鼠,为下一步注射细胞做准备:
[0039]
表2
[0040][0041][0042]
2.注射细胞:准备好s-1hbr1杂交瘤细胞株,每只f1小鼠注射1*106个细胞,0.5ml。
[0043]
3.腹水采集:第7天起,每天观察小鼠腹腔状况,待腹腔隆起明显,即开始采集小鼠腹水,做好记录,如表3所示:
[0044]
表3
[0045][0046]
4.腹水传代:取实验组采集的小鼠腹水,将其再次注射入提前致敏好的f1小鼠(用本发明创新致敏物
①
提前3天致敏好的f1小鼠,每只0.5ml)腹腔中,每只0.5ml。
[0047]
5.腹水采集:第7天起,每天观察小鼠腹腔状况,待腹腔隆起明显,即开始采集小鼠腹水,做好记录,如表4所示:
[0048]
表4
[0049][0050]
6.实验结果分析:
[0051]
比较表3各组别
[0052]
小鼠死亡数量:对照组2>对照组3>对照组1>实验组3>实验组1=实验组2;
[0053]
实体瘤严重情况:对照组2=对照组3>对照组1>实验组1=实验组2>实验组3;
[0054]
血性腹水严重程度:对照组2=对照组3>对照组1>实验组1=实验组2=实验组3;
[0055]
腹水采集总量:实验组1>实验组2>实验组3>对照组1>对照组3>对照组2;
[0056]
综合以上数据,得出结论,使用本发明创新致敏物
①
致敏的小鼠效果最优。
[0057]
比较表4各组别
[0058]
小鼠死亡数量:对照组>实验组;
[0059]
实体瘤严重情况:对照组>实验组;
[0060]
血性腹水严重程度:对照组>实验组;
[0061]
腹水采集总量:实验组>对照组;
[0062]
得出结论,经腹水传代后,小鼠腹腔实体瘤减少,血性腹水情况得到优化,腹水产量相应提高。
[0063]
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1