脲(甲基)丙烯酸化物的一锅合成的制作方法
1.本发明涉及可聚合的且无环的脲(甲基)丙烯酸化物((meth)acrylate)的一锅合成,所述脲(甲基)丙烯酸化物优选单(甲基)丙烯酸化物,所述一锅合成经由脲醇或胺的原位合成和随后与(甲基)丙烯酸酯反应性稀释剂的直接反应实现。
背景技术:
2.在大量可聚合官能团中,(甲基)丙烯酸化物结构部分是特别令人感兴趣的,因为它们可以被任意修饰、额外官能化、表现出有益的安全性状况并且通常是液体或低熔点物质。
3.在(甲基)丙烯酸化物中,带有脲结构部分的可聚合分子是特别令人感兴趣的,因为可聚合单元最终能够实现将脲结构部分并入到聚合物材料中。由此,这些聚合物材料被配有极性、亲水性和氢键接性质,它们可在粘合剂、涂料和医药/生物应用中被利用。
4.漆工业中使用术语“湿粘附性”来描述漆在湿润或高湿度条件下保持其粘接于基材的能力。尽管已知油基体系在湿润或潮湿条件下保持它们的粘合性能,但许多水基涂料(即胶乳)在湿润时倾向于丧失它们的粘合性能的倾向限制了这样的涂料的可用性。乳胶漆的湿粘附性不足也使得涂装有这样的漆的表面的耐擦洗性低于涂装有基于有机溶剂的漆的那些表面。
5.由于使用水基乳液聚合物体系作为许多类型表面的保护和装饰涂层已变得普遍,这样的体系被个人在家庭中和在工业中使用,因此非常需要它们改进的湿粘附性。近年来,本领域已经认识到在乳胶漆中粘合性能丧失的问题,并且已经有人提出了各种各样的对这样的胶乳体系的改良方案以改进湿粘附性。已有报道将胺、酰胺和乙酰乙酸酯官能团化学并入到胶乳聚合物中以改进乳胶漆的湿粘附性能。例如,已知许多环状脲基化合物赋予了湿粘附性能。
6.一个主要的且工业上最相关的实例是n-(2-甲基丙烯酰氧基乙基)亚乙基脲(meeu),其中环状脲结构部分经由c2单元连接于甲基丙烯酸酯。它可应用于在本体、悬浮液、乳液和溶液中的聚合和/或共聚过程中,导致形成用于塑料、漆、皮革、纸张和纺织工业中的材料。对于许多应用,它用于改进乳液聚合物的湿粘附性和内聚性质以及某些产品的耐湿擦洗性。在其配混物中,它还对防腐蚀做出贡献。
7.对n-(2-甲基丙烯酰氧基乙基)亚乙基脲稍加改进得到的是n-(2-甲基丙烯酰氨基乙基)亚乙基脲(n-meeu),它只是甲基丙烯酰胺而非酯。它也被用作乳胶漆的湿粘附性单体,并在包括工业、维护、汽车和建筑的许多应用中促进聚合物树脂对金属、玻璃、混凝土和其它无机基材的粘附性。它在多种胶乳体系中改进了湿粘附性效果和耐溶剂性。它为聚合物体系提供高的粘合力、增强的机械性能和改进的耐化学性和耐水性。
8.尽管meeu或n-meeu在几十年前就已被开发出来,但这两种单体仍然是最先进的,并且在当前的研究活动和发明中发挥着至关重要的作用。对于涂料和粘合剂,可以参考例如us2020017725(a1)、ep3643729(a1)、ep2935485(b1)、us10421872 b1或us2020392381
(a1)。
9.然而,这两种分子以及它们的制备方法都具有重大缺点。首先,起始材料“2-羟基乙基亚乙基脲”以及“2-氨基乙基亚乙基脲”的通用合成过程很难修改,并且实际上几乎仅限于五元环状脲(咪唑啉-2-酮)以及在该咪唑啉-2-酮结构部分的一个氮原子处的氨基/羟基乙基取代基。因此,含脲基团的(甲基)丙烯酸化物的范围在某种程度上仅限于两种上述分子,它们例如被称为meeu(evonik)或wam ii(solvay)。此外,两种起始材料“2-羟乙基亚乙基脲”以及“2-氨基乙基亚乙基脲”都必须在单独的合成步骤中制备。其次,这两种产物通常作为水溶液或在有机溶剂或反应性稀释剂中的溶液获得(和商业分销),这阻碍了在非水性介质中的后续工艺(例如3d打印)和不需要溶剂或反应性稀释剂的应用。第三,n-(2-甲基丙烯酰氨基乙基)亚乙基脲通常由2-氨基乙基亚乙基脲和活化的甲基丙烯酸衍生物(例如甲基丙烯酸酐、甲基丙烯酰氯)制成,导致形成通常不需要并且难以除去的副产物(例如甲基丙烯酸,盐酸),它们必须费力地与产物分离。因此,解决这些缺点是一项值得的挑战,并且仍然需要通往无水(没有水)且易于纯化的脲(甲基)丙烯酸化物的合成途径。
10.此外,已知的亚乙基脲乙基(甲基)丙烯酸酯/(甲基)丙烯酰胺的结构衍生物是特别理想的,它们可能最终导致具有例如以下性能的聚合物材料:改进的(湿)粘附性和内聚性、改进的抗腐蚀性能或改进的耐擦洗性。这可通过脲(甲基)丙烯酸化物的化学裁剪来实现,并且取决于目标改进可以设想各种合成路线。
技术实现要素:
11.根据上述内容,本发明的目的是提供一种用于制备新的基于(甲基)丙烯酸化物的单体的新方法,所述单体是应用于涂料或粘合剂中的(水性)乳液聚合物的单体。
12.发明概述
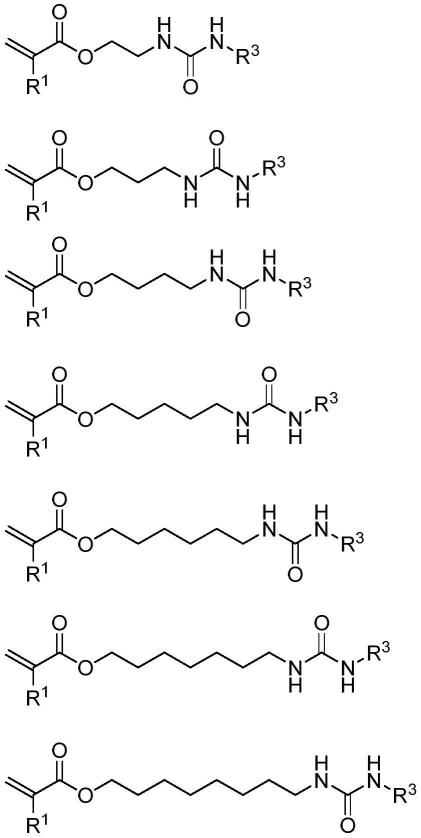
13.结果,本发明的发明人已经出人意料地发现meeu的各种各样的且极性更小的替代分子是可获得的,并且一种可能的但几乎没有被采用的用于合成脲官能化的(甲基)丙烯酸酯或(甲基)丙烯酰胺的替代方案是在于合成带有脲基团的(长链)醇或胺,和随后经由与(甲基)丙烯酸酯反应性稀释剂的直接反应(例如酯交换)进行后续的(甲基)丙烯酸化。不幸的是,必须费力地合成因此所需的带有脲基团的(长链)醇或胺,这使得带有脲基团的(长链)(甲基)丙烯酸化物的合成是一个昂贵的多步骤过程。本发明的发明人已经出人意料地发现,在作为反应性稀释剂的(甲基)丙烯酸烷基酯中原位合成所述带有脲基团的(长链)醇或胺是可能的,其允许进行随后的酯交换以在一锅过程中获得带有脲基团的(长链)(甲基)丙烯酸化物。通过通式(v)的氨基醇或二胺与通式(vi)的异氰酸酯在通式(iii)的(甲基)丙烯酸酯反应性稀释剂中的反应以非常高的纯度和收率原位形成中间体(ii),因此使其能够立即进行后续转化,从而以直接的方式以高收率和纯度获得(i)。
14.更具体地,本发明涉及用于制备通式(i)的(甲基)丙烯酸化物的一锅方法
15.16.其中
17.r1选自-h或-me;
18.r2选自-h或c
1-c
20
直链、支化或环状的烷基或芳基基团;
19.r2'是-h;
20.r3选自h或c
1-c
20
直链、支化或环状的烷基或芳基基团,以及苯磺酰基、甲苯磺酰基、对氯苯基、金刚烷基、2,6-二甲基苯基、3,5-二甲基苯基和2,6-二丙基苯基;
21.r2和r3是相同或不同的;
22.x选自-o-或-nh-;和
23.l选自c
2-c
20
直链、支化或环状的亚烷基或亚芳基基团,其中任选地,在碳链中的一个或多个碳原子被一个或多个-o-、-nh-或-s-杂原子替代,
24.其中
25.在通式(iii)的反应性稀释剂的存在下,由通式(v)的氨基醇或二胺和通式(vi)的异氰酸酯的反应原位形成通式(ii)的中间体化合物
[0026][0027]
其中x、r2、r2'、r3、l如上定义
[0028][0029]
其中x、r2、l如上定义
[0030][0031]
其中r3如上定义
[0032][0033]
其中r4是c1至c4烷基;
[0034]
r1选自-h或-me。
[0035]
其中中间体化合物(ii)立即与反应性稀释剂(iii)反应,从而形成产物化合物(i)。
[0036]
发明详述
[0037]
在本发明的上下文中,术语“(甲基)丙烯酸酯”包括“丙烯酸酯”(即丙烯酸的酯)和“甲基丙烯酸酯”(即甲基丙烯酸的酯),以及丙烯酸酯和甲基丙烯酸酯的混合物。
[0038]
如本文中使用的术语“芳基”包括取代的芳基基团,并且特别是烷基芳基基团,例
如ph-ch
2-ch
2-。其中碳链中的碳原子被o杂原子替代的直链烷基基团的实例是-ch2ch
2-o-ch2ch
2-;其中碳链中的碳原子被n杂原子替代的直链烷基基团的实例是-ch2ch
2-nh-ch2ch
2-。
[0039]
优选地,通式(i)的(甲基)丙烯酸化物是脲单(甲基)丙烯酸化物(与交联性的二-、三-或四(甲基)丙烯酸化物相对照)。
[0040]
在通式(i)的(甲基)丙烯酸化物中,r1优选是甲基,和r2优选选自氢和c1至c8直链或支化烷基。r2特别优选是氢。r3优选选自甲基、乙基、丙基、异丙基、丁基、乙基己基、环己基和苯基。r3特别优选是环己基或苯基。x优选为氧;并且l优选选自亚乙基、亚丙基、亚丁基、亚戊基、亚己基、亚庚基、亚辛基和乙氧基亚乙基。
[0041]
因此,通式(i)的(甲基)丙烯酸化物的实例是:
[0042][0043]
合适的无环烷基脲(甲基)丙烯酸化物,其中例如一个碳原子被杂原子(例如o、nh)取代,具有连接基,例如l=c5(c4+杂原子);r1=h、me;r2=h,例如是:
[0044][0045]
合适的无环烷基和芳基脲(甲基)丙烯酸化物,具有连接基,例如l=c4和c6;r1=h、
me;r2=h,例如是:
[0046][0047]
如上所述的,例如通过氨基醇或二胺和异氰酸酯在所述(甲基)丙烯酸酯类物质(其选自通式(iii)的(甲基)丙烯酸烷基酯)中的反应可原位获得中间体“含脲基团的醇和胺”,所述异氰酸酯例如c
1-c
30
单异氰酸酯化合物,例如苯磺酰基异氰酸酯、甲苯磺酰基异氰酸酯、甲基异氰酸酯、乙基异氰酸酯、丙基异氰酸酯、异丙基异氰酸酯、苯基异氰酸酯、对氯苯基异氰酸酯,丁基异氰酸酯、己基异氰酸酯、叔丁基异氰酸酯、环己基异氰酸酯、辛基异氰酸酯、2-乙基己基异氰酸酯、十二烷基异氰酸酯、金刚烷基异氰酸酯、2,6-二甲基苯基异氰酸酯、3,5-二甲基苯基异氰酸酯和2,6-二丙基苯基异氰酸酯。
[0048]
根据本发明的方法因此使得不需要使用在单独步骤中合成的官能化的(甲基)丙烯酸化物前体,例如(甲基)丙烯酸异氰酸根合乙酯,以及含脲基团的醇或胺。
[0049]
如上所述的与(甲基)丙烯酸酯反应性稀释剂的反应优选在至少一种催化剂的存在下进行。
[0050]
合适的催化剂的实例是乙酰丙酮锆和另外的锆或钙的1,3-二酮合物。这些催化剂公开在例如de 28 05 702 a1中。
[0051]
合适的催化剂的另外的实例是碱金属氰酸盐或碱金属硫氰酸盐与碱金属卤化物(例如licl)的混合物;锌化合物;碱土金属氧化物或碱土金属氢氧化物(例如cao、ca(oh)2、mgo、mg(oh)2或上述化合物的混合物);碱金属氢氧化物;碱金属醇盐与氯化锂和/或氢氧化锂的混合物;氧化二烷基锡(例如氧化二辛基锡(doto)),二月桂酸二丁基锡(dbtl),碱金属碳酸盐;碱金属碳酸盐连同季铵盐(例如四丁基氢氧化铵或十六烷基三甲基溴化铵);二有机锡氧化物和有机锡卤化物的混合催化剂;酸性离子交换剂;磷钼杂多酸;钛的醇盐,例如异丙醇钛;金属钛、锆、铁或锌与1,3-二羰基化合物的螯合化合物;铅化合物(如氧化铅、氢氧化铅、铅的醇盐、碳酸铅或羧酸的铅盐),第一主族金属的氨基化物(例如氨基化锂);或上述催化剂的混合物。
[0052]
此外,酸或碱可用于催化所述酯交换,其中示例性的反应条件在出版物de 34 23 443和ep-a-0 534 666中列出。
[0053]
用于根据本发明的方法的特别优选的催化剂是钛酸四烷基酯,例如异丙醇钛,以及碱土金属氧化物和氢氧化物,例如氧化钙和氢氧化钙,它们可以与碱金属盐(例如氢氧化锂或氯化锂)组合。
[0054]
据此,根据本发明的方法有利地在至少一种催化剂的存在下进行,所述催化剂选自zr(acac)2、lioh、cao、氧化二辛基锡(doto)、月桂酸二丁基锡(dbtl)、异丙醇钛和它们的组合。优选地,所述催化剂是异丙醇钛或cao/lioh或cao/licl或doto或dbtl。
[0055]
所述催化剂的存在量可以是基于化合物(v)的量计的0.01至5重量%之间,或0.1
至3重量%之间,优选0.3至2重量%之间。
[0056]
在初始反应阶段中的反应温度可保持在0℃至80℃之间,或在0℃至50℃之间,优选在0℃至30℃之间,而在第二反应阶段(酯交换阶段)中的反应温度可以保持在30℃至180℃之间,或在50℃至150℃之间,非常优选在80℃至130℃之间。在该阶段中,有利地将反应混合物加热至沸腾并且将分裂出的醇r4oh与酯一起以其共沸物形式连续蒸馏出。取决于反应温度、催化剂和催化剂量,反应时间在大约2至15小时范围内。也可以在惰性溶剂(例如甲苯或环己烷)的存在下进行反应,但这通常不是必要的。所述反应可以在标准压力、更大压力或在部分真空下进行。
[0057]
所述反应性稀释剂是(甲基)丙烯酸烷基酯,其选自(甲基)丙烯酸丙酯、(甲基)丙烯酸乙酯、(甲基)丙烯酸异丙酯、(甲基)丙烯酸异丁酯、(甲基)丙烯酸正丁酯和(甲基)丙烯酸甲酯。优选地,所述反应性稀释剂是(甲基)丙烯酸甲酯。
[0058]
根据上述方程式,等摩尔量的反应参与物(ii)和(iii)发生反应从而形成希望的最终产物。然而,在实践中,已经证明在反应过程中始终保持所述反应性稀释剂(即起始酯(iii))过量是实用的。反应性稀释剂的用量可以是每摩尔化合物(v)1至50,或2至20,优选3至10摩尔。
[0059]
异氰酸酯(vi)的量可以是每当量化合物(v)0.80至1.20当量,或0.90至1.10当量,优选0.95至1.05当量。
[0060]
有利地,根据本发明的方法在至少一种聚合抑制剂的存在下进行。在本发明的上下文中,术语“(聚合)抑制剂”和“稳定剂”同义使用。
[0061]
所述至少一种聚合抑制剂可选自对苯二酚,对苯二酚醚,例如对苯二酚单甲醚,或二叔丁基邻苯二酚,吩噻嗪,n,n'-(二苯基)-对苯二胺,4-羟基-2,2,6,6-四甲基哌啶-1-氧基,对苯二胺,亚甲基蓝或空间位阻酚,它们是本领域中公知的。对于更进一步的细节,参见常用的专业文献,特别是c.,schacker,o.和m.(2015).antioxidants(抗氧化剂),在ullmann's encyclopedia of industrial chemistry(乌尔曼工业化学大全)中(编者)。
[0062]
优选地,所述聚合抑制剂选自对苯二酚单甲醚、2,4-二甲基-6-叔丁基苯酚、2,6-二叔丁基-4-甲基-苯酚、3-(3,5-二叔丁基-4-羟基苯基)-丙酸十八烷基酯、4-羟基-2,2,6,6-四甲基哌啶-1-氧基和它们的混合物。特别优选对苯二酚单甲醚。
[0063]
可以将在反应开始时聚合抑制剂的量调节为基于在完全转化时的理论预期产物的量计的0至5000ppm之间,优选100ppm至3000ppm之间。可以添加额外的抑制剂,优选其中将在反应开始时额外添加的稳定剂的量调节为基于在完全转化时理论预期产物的量计的0至1000ppm之间,并且最优选其中将在反应开始时额外添加的稳定剂的量调节为基于在完全转化时理论预期产物的量计的100至1000ppm之间。
[0064]
所述反应可优选在搅拌下进行,搅拌速度特别优选在50至2000rpm范围内,非常特别优选在100至500rpm范围内。
[0065]
所述反应可连续、半连续或分批进行。所述连续工艺优选在具有多个反应器的设备中进行,在此尤其是反应温度变化,并且可以将由低沸点(甲基)丙烯酸酯释放的醇或水从反应体系中分离出来。
[0066]
特别感兴趣的是半间歇法,其中最初加料部分反应混合物。在另外的步骤中或连
续地,在反应开始之后,可以将低沸点的(甲基)丙烯酸的酯添加到所述反应混合物中。
[0067]
所述反应优选在含有至多20重量%,优选至多10重量%,特别优选至多3重量%的氧气的气氛下进行。以此方式,在实施过程中可以避免复杂的安全措施,从而实现很多的成本优点。
[0068]
在所述反应完成后,过量的反应性稀释剂(iii)可通过将其蒸馏出而被完全或部分移除。分散的催化剂通常通过过滤移除,并且有利的是,在蒸馏出大部分过量存在的反应性稀释剂(iii)之前这样操作。然而,也可以仅在部分或完全去除过量的反应性稀释剂(iii)之后才将其移除。当将所述催化剂以过滤形式回收时,所述催化剂可然后用于其它醇解批次,必要时在干燥后使用。
[0069]
因此获得的式(i)的方法产物可被直接使用,即无需昂贵的和定性上繁重的去除步骤—例如作为在丙烯酸酯或甲基丙烯酸酯中的溶液—用作共聚单体,特别是在分散聚合产物的制备中使用。采用上述方法,式(i)的化合物也可以根据本发明方法制备为纯液体或固体,例如通过从溶液中蒸发或通过从溶剂中结晶。优选地,通式(i)的(甲基)丙烯酸化物通过将反应性稀释剂蒸发获得。或者,通式(i)的(甲基)丙烯酸化物可以在将反应混合物冷却时(在过滤后,在非均相混合物的情况下)或通过当加入反溶剂(例如己烷、庚烷、石油醚等)时沉淀而作为固体获得。所述聚合抑制剂可与通式(i)的产物(甲基)丙烯酸化物一起共沉淀,效果是可以避免在最终产物中的自发聚合。
[0070]
通过本发明的方法获得的单体可更特别用于制备或用于改性聚合物,该聚合物可例如在粘结剂组合物中应用。所述聚合可通过任何已知的方式进行。
[0071]
这样的方式更尤其包括自由基、阳离子或阴离子加成聚合,也可以使用这些加成聚合方法的变型方案,例如atrp(原子转移自由基聚合)、nmp方法(氮氧化物介导的聚合)或raft(可逆加成-断裂链转移)。
具体实施方式
[0072]
实施例
[0073]
单体的通用合成程序
[0074]
所有反应和产物操作均在正常条件下在普通实验室玻璃器皿中进行。(甲基)丙烯酸甲酯、催化剂和溶剂得自商业/工业供应商并且未经进一步纯化直接使用。
[0075]
nmr波谱是在bruker avance 300或400波谱仪上在300k下记录的(除非另有说明)并且内参比于残留溶剂共振(1h nmr:thf-d8:1.72ppm,c6d6:7.16ppm,甲苯-d8(tol-d8):2.08ppm;cdcl3:7.26ppm。
13
c{1h}nmr:thf-d8:25.31ppm,c6d6:128.06ppm,cdcl3:77.16ppm)。化学位移δ参比于四甲基硅烷外标以ppm计给出(1h,
13
c{1h})。1h和
13
c nmr信号部分基于2d nmr波谱(1h,1h-cosy;1h,
13
c-hsqc;1h,
13
c-hmqc)归属。
[0076]
合成中间体(ii)的通用程序——概念的验证:
[0077]
将通式(vi)的异氰酸酯(1当量)与通式(iii)的反应性稀释剂(例如甲基丙烯酸甲酯)混合,优选冷却至0-20℃并搅拌。任选地,添加聚合抑制剂(例如mehq)。将通式(v)的氨基醇或二胺(1当量)要么作为纯物质,要么作为在通式(iii)的反应性稀释剂中的溶液加入,使得反应混合物的温度不超过约30℃。
[0078]
或者,将通式(v)的氨基醇或二胺(1当量)要么作为纯物质,要么作为在通式(iii)
的反应性稀释剂中的溶液称重加到反应容器中,优选将其冷却到0-20℃并搅拌。任选地,添加聚合抑制剂(例如mehq)。将通式(vi)的异氰酸酯(1当量)要么作为纯物质,要么作为在通式(iii)的反应性稀释剂中的溶液加入,使得反应混合物的温度不超过约30℃。
[0079]
在将所有组分完全添加和混合后,将所得的均相或非均相混合物再搅拌30-60分钟并使其达到环境温度。
[0080]
通过在真空下除去反应性稀释剂(iii),或者通过过滤所形成的固体并随后干燥,获得中间体(ii),其为无色固体或油状物。产率:》90%。
[0081]
实施例1:1-(2-羟基乙基)-3-苯基脲(hepu)
[0082][0083]1h nmr(dmso-d6,400.13mhz):δ[ppm]=3.15(dt,3j=5.7hz,3j=5.4hz,2h,ch2),3.44(dt,3j=5.5hz,3j=5.2hz,2h,ch2),4.71(t,3j=5.2hz,1h,oh),6.15(t,3j=5.4hz,1h,nh),6.89(tt,3j=7.4hz,4j=1.1hz,1h,ch),7.14-7.24(m,2h,ch),7.32-7.41(m,2h,ch),8.51(s,1h,nh)。
[0084]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=41.8(ch2),60.4(ch2),117.6(ch),120.9(ch),128.6(ch),140.5(cq),155.3(co)。
[0085]
实施例2:1-(1-羟基-2-甲基丙-2-基)-3-苯基脲
[0086][0087]1h nmr(dmso-d6,400.13mhz):δ[ppm]=1.22(s,6h,2x ch3),3.38(d,3j=5.6hz,2h,ch2),4.96(d,3j=5.6hz,1h,oh),5.90(bs,1h,nh),6.85(tt,3j=7.4hz,4j=1.1hz,1h,ch),7.16-7.24(m,2h,ch),7.31-7.36(m,2h,ch),8.44(s,1h,nh)。
[0088]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=23.9(ch3),53.2(c(ch3)2),68.2(och2),117.4(ch),120.8(cch2),128.6(ch),140.6(cq),154.8(co)。
[0089]
实施例3:1-(2-(2-羟基乙氧基)乙基)-3-苯基脲
[0090][0091]1h nmr(dmso-d6,400.13mhz):δ[ppm]=3.23-3.29(m,2h,ch2),3.43-3.49(m,4h,ch2),3.50-3.56(m,2h,ch2),4.58(bs,1h,oh),6.16(t,3j=5.6hz,1h,nh),6.88(tt,3j=7.3hz,4j=1.2hz,1h,ch),7.16-7.25(m,2h,ch),7.35-7.41(m,2h,ch),8.51(s,1h,nh)。
[0092]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=39.1(ch2),60.3(ch2),69.7(ch2),72.1(ch2),117.6(ch),121.0(ch),128.6(ch),140.5(cq),155.2(co)。
[0093]
实施例4:1-环己基-3-(2-(2-羟基乙氧基)乙基)脲
[0094][0095]1h nmr(dmso-d6,400.13mhz):δ[ppm]=0.98-1.32(m,5h,ch2),1.45-1.54(m,1h,
ch2),1.56-1.66(m,2h,ch2),1.67-1.78(m,2h,ch2),3.08-3.16(m,2h,nhch2),3.32-3.44(m,5h,nhch和ch2),3.45-3.52(m,2h,ch2),4.54(t,3j=5.5hz,1h,oh),5.72(t,3j=5.6hz,1h,nh),5.81(d,3j=8.2hz,1h,nh)。
[0096]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=24.4(ch2),25.3(ch2),33.3(ch2),39.2(nhch2),47.7(nhch),60.2(ch2oh),70.1(och2),72.1(och2),157.3(co)。
[0097]
实施例5:1-(6-羟基己基)-3-苯基脲
[0098][0099]1h nmr(dmso-d6,400.13mhz):δ[ppm]=1.23-1.34(m,4h,ch2),1.36-1.48(m,4h,ch2),3.06(dt,3j=6.7hz,3j=5.7hz,2h,ch2),3.39(dt,3j=6.4hz,3j=5.3hz,2h,ch2),4.31(t,3j=5.3hz,1h,oh),6.07(t,3j=5.7hz,1h,nh),6.87(tt,3j=7.3hz,4j=1.1hz,1h,ch),7.17-7.23(m,2h,ch),7.33-7.40(m,2h,ch),8.33(s,1h,nh)。
[0100]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=25.3(ch2),26.3(ch2),29.8(ch2),32.5(ch2),39.0(ch2),60.6(ch2),117.5(ch),120.8(ch),128.6(ch),140.6(cq),155.2(co)。
[0101]
实施例6:1-环己基-3-(6-羟基己基)脲
[0102][0103]1h nmr(dmso-d6,400.13mhz):δ[ppm]=0.96-1.17(m,3h,ch2),1.28-1.45(m,10h,ch2),1.46-1.55(m,1h,ch2),1.56-1.67(m,2h,ch2),1.67-1.77(m,2h,ch2),2.94(dt,3j=6.7hz,3j=6.3hz,2h,ch2),3.25-3.41(m,3h,重叠的ch和ch2),4.30(bs,1h,oh),5.58-5.66(m,2h,nh)。
[0104]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=24.4(ch2),25.2(ch2),25.3(ch2),26.3(ch2),30.0(ch2),32.5(ch2),33.3(ch2),39.1(ch2),47.6(ch),60.6(ch2),157.4(co)。
[0105]
合成单体(i)的通用程序:
[0106]
将通式(vi)的异氰酸酯(1当量)与通式(iii)的反应性稀释剂(例如甲基丙烯酸甲酯)混合,优选冷却至0-20℃并搅拌。任选地,添加聚合抑制剂(例如mehq)。将通式(v)的氨基醇或二胺(1当量)要么作为纯物质,要么作为在通式(iii)的反应性稀释剂中的溶液加入,使得反应混合物的温度不超过约30℃。
[0107]
或者,将通式(v)的氨基醇或二胺(1当量)要么作为纯物质,要么作为在通式(iii)的反应性稀释剂中的溶液称重加到反应容器中,优选将其冷却到0-20℃并搅拌。任选地,添加聚合抑制剂(例如mehq)。将通式(vi)的异氰酸酯(1当量)要么作为纯物质,要么作为在通式(iii)的反应性稀释剂中的溶液加入,使得反应混合物的温度不超过约30℃。
[0108]
在将所有组分完全添加和混合后,将所得的均相或非均相混合物再搅拌30-60分钟并使其达到环境温度。可以添加额外的抑制剂。
[0109]
在具有设置在其上的机械搅拌、空气供应、底液槽温度显示、填充元件柱,以及带有回流和馏出物冷却器的自动控制柱头的反应器中,将混合物然后加热至沸腾,并且对于
反应性稀释剂(iii)=甲基丙烯酸甲酯,首先蒸馏出甲基丙烯酸甲酯-水共沸物,直到不再观察到共沸物馏出物,而是观察到纯甲基丙烯酸甲酯馏出物(如果使用无水起始材料,就不需要这个经由共沸蒸馏除去水的步骤)。将批料冷却约10-20℃,并添加催化剂(例如异丙醇钛(ipt)(相对于中间体“含脲基团的醇或胺(ii)”为1%)以及甲基丙烯酸甲酯,其量相当于失去的共沸馏出物的质量。
[0110]
再次将混合物加热至沸腾,并将所得的甲基丙烯酸甲酯-甲醇共沸物以2:1的回流比蒸馏出,最高至70℃的最高顶部温度,并然后以10:1的回流比蒸馏出,直至达到98-101℃的恒定柱头温度。反应通常在2小时-16小时内终止。将批料冷却至80℃。当将钛的醇盐用作催化剂时,添加稀硫酸,然后添加碳酸钠。任选添加tonsil或celatom或celite。将批料通过压滤(eks压力过滤器)进行过滤。任选作为在甲基丙烯酸甲酯中的溶液的形式获得澄清的滤液或将其在真空下浓缩(室温至125℃,环境压力或最高至1毫巴)直至获得产物,该产物为无色油状物或固体。任选地,所述产物可当将溶液冷却时作为结晶材料获得。任选地,所述产物可以从合适的常用有机溶剂中重结晶,所述有机溶剂例如乙酸乙酯、甲醇、乙醇和丙酮。任选地,所述产物可以用合适的有机溶剂洗涤,所述有机溶剂例如戊烷、己烷、庚烷、乙醚或甲苯。
[0111]
实施例1:甲基丙烯酸2-(3-苯基脲基)乙酯的合成
[0112][0113]
将苯基异氰酸酯(49.3g,0.414mol,1.00当量)溶解在甲基丙烯酸甲酯(331g,3.31mol,8.00当量)中。添加mehq(44mg,基于产物计200ppm)。将混合物的温度保持在20℃以下,并在15分钟内滴加乙醇胺(25.53g,0.418mol,1.01当量)。用甲基丙烯酸甲酯(84.6g,0.84mol,2.00当量)进一步稀释非均相混合物,使其达到室温并加热至100℃以除去任何水(作为水-甲基丙烯酸甲酯共沸物)。将混合物冷却至80℃,并添加催化剂(例如ipt(基于脲醇计1%)或zr(acac)2(基于脲醇计1%)或lioh(基于脲醇计1%)。将混合物加热至120℃并逐渐共沸除去甲醇-甲基丙烯酸甲酯(采用调节的回流比)直到6小时后获得完全转化。任选地,在将反应混合物冷却时可以获得作为结晶固体形式的纯产物。通常,所述催化剂要么通过反应溶液的过滤(例如通过celite、celatome、arbocell)直接移除,要么在ipt的情况下,首先用稀硫酸沉淀,和然后通过将反应溶液过滤(例如通过celite、celatome、arbocell)移除。
[0114]1h nmr(dmso-d6,400.13mhz):δ[ppm]=1.89(dd,4j=1.5hz,4j=1.0hz,3h,ch3),3.39(dt,3j=5.5hz,3j=5.8hz,2h,ch2),4.14(t,3j=5.5hz,2h,ch2),5.68(dq,4j=1.5hz,4j=1.1hz,1h,ch2),6.08(bs,1h,ch2),6.26(t,3j=5.8hz,1h,nh),6.89(tt,3j=7.4hz,4j=1.1hz,1h,ch),7.18-7.24(m,2h,ch),7.35-7.42(m,2h,ch),8.52(s,1h,nh)。
[0115]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=17.9(ch3),38.14(ch2),63.9(ch2),117.7(ch),121.1(ch),125.8(ch2),128.6(ch),135.8(cq),140.3(cq),155.2(co),166.5(co)。
[0116]
实施例2:甲基丙烯酸2-甲基-2-(3-苯基脲基)丙酯
[0117][0118]1h nmr(dmso-d6,400.13mhz):δ[ppm]=1.30(s,6h,2x ch3),1.90(s,3h,ch3),4.20(s,2h,ch2),5.68(dq,4j=1.5hz,2j=1.1hz,1h,ch),6.08(bs,2h,nh和ch重叠),6.88(tt,3j=7.4hz,4j=1.1hz,1h,ch),7.16-7.24(m,2h,ch),7.30-7.35(m,2h,ch),8.31(s,1h,nh)。
[0119]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=17.9(ch3),24.4(ch3),51.5(c(ch3)2),68.8(och2),117.5(ch),120.9(cch2),125.7(ch),128.6(ch),135.8(cch2),140.3(cq),154.4(co),166.3(co)。
[0120]
实施例3:甲基丙烯酸3-(3-苯基脲基)丙酯
[0121][0122]1h nmr(dmso-d6,400.13mhz):δ[ppm]=1.78(q,3j=6.7hz,2h,ch2),1.89(bs,3h,ch3),3.18(表观(apparent)q,3j=6.6hz,2h,ch2),4.14(表观t,3j=6.4hz,2h,ch2),5.65(dq,4j=1.5hz,4j=1.1hz,1h,ch2),6.05(bs,1h,ch2),6.18(t,3j=5.7hz,1h,nh),6.88(tt,3j=7.4hz,4j=1.1hz,1h,ch),7.15-7.24(m,2h,ch),7.34-7.42(m,2h,ch),8.40(s,1h,nh)。
[0123]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=17.9(ch3),28.9(ch2),35.9(ch2),62.1(ch2),117.7(ch),121.0(ch),125.6(ch2),128.6(ch),135.9(cq),140.5(cq),155.2(co),166.6(co)。
[0124]
实施例4:甲基丙烯酸2-(2-(3-苯基脲基)乙氧基)乙酯
[0125][0126]1h nmr(dmso-d6,400.13mhz):δ[ppm]=1.88(dd,4j=1.5hz,4j=1.0hz,3h,ch3),3.25(dt,3j=5.7hz,3j=5.5hz,2h,ch2),3.50(t,3j=5.5hz,2h,ch2),3.65-3.69(m,2h,ch2),4.21-4.26(m,2h,ch2),5.65(dq,4j=1.5hz,4j=1.5hz,1h,ch2),6.02-6.06(m,1h,ch2),6.17(t,3j=5.7hz,1h,nh),6.88(tt,3j=7.4hz,4j=1.1hz,1h,ch),7.17-7.24(m,2h,ch),7.34-7.40(m,2h,ch),8.49(s,1h,nh)。
[0127]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=17.9(ch3),38.9(ch2),63.7(ch2),68.0(ch2),69.8(ch2),117.6(ch),120.9(ch),125.8(ch2),128.6(ch),135.8(cq),140.5(cq),155.2(co),166.5(co)。
[0128]
实施例5:甲基丙烯酸6-(3-苯基脲基)己酯
[0129][0130]1h nmr(dmso-d6,400.13mhz):δ[ppm]=1.24-1.36(m,6h,ch2),1.56-1.68(m,2h,
ch2),1.87(bs,3h,ch3),3.07(dt,3j=6.7hz,3j=5.7hz,2h,ch2),4.08(t,3j=6.4hz,2h,ch2),5.62-5.65(m,1h,ch2),6.01(bs,1h,ch2),6.10(t,3j=5.5hz,1h,nh),6.86(tt,3j=7.2hz,4j=1.1hz,1h,ch),7.16-7.24(m,2h,ch),7.35-7.42(m,2h,ch),8.37(s,1h,nh)。
[0131]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=17.9(ch3),25.2(ch2),26.0(ch2),28.1(ch2),29.6(ch2),38.9(ch2),64.2(ch2),117.6(ch),120.8(ch),125.4(ch),128.6(ch),136.0(cq),140.6(cq),155.2(co),166.6(co)。
[0132]
实施例6:甲基丙烯酸6-(3-环己基脲基)己酯
[0133][0134]
将6-氨基己醇(0.40mol,1.00当量)、甲基丙烯酸甲酯(602g,6.02mol,15当量)和mehq(0.02g,相对于产物200ppm)称重加到反应器中,所述反应器具有设置在其上的机械搅拌、空气供应、底液槽温度显示、填充元件柱,以及带有回流和馏出物冷却器的自动控制柱头。将混合物冷却至9℃并在20分钟内添加环己基异氰酸酯(49.76g,0.398mol,0.99当量,在甲基丙烯酸甲酯中50重量%),使得温度不超过20℃。在添加完成后,将混合物再搅拌30分钟,从而达到室温,并然后将其加热至100℃以除去任何水(作为水-甲基丙烯酸甲酯共沸物)。将混合物冷却至80℃,添加催化剂ipt(0.96g,基于中间体醇计1%)和甲基丙烯酸甲酯(35g,共沸物损失)。再次将混合物加热至沸腾,并将所得的甲基丙烯酸甲酯-甲醇共沸物以2:1的回流比蒸馏出,最高至75℃的最高顶部温度,并然后以10:1的回流比蒸馏出,直至达到98-101℃的恒定柱头温度。将混合物冷却至80℃,并添加稀硫酸(3.84g),然后添加碳酸钠(5.76g)。将混合物过滤,并当将母液冷却时获得产物,其为无色沉淀物,将其过滤出并干燥。产量:115.7g(94%)。
[0135]1h nmr(dmso-d6,400.13mhz):δ[ppm]=0.96-1.17(m,3h,ch2),1.18-1.40(m,8h,ch2),1.45-1.55(m,1h,ch2),1.56-1.67(m,4h,ch2),1.67-1.77(m,2h,ch2),1.87(s,3h,ch3),2.95(dt,3j=6.7hz,3j=6.3hz,2h,ch2),3.26-3.40(m,1h,ch),4.07(t,3j=6.8hz,2h,ch2),5.56-5.70(m,3h,cch2和nh),6.00(s,1h,nh)。
[0136]
13
c{1h}nmr(dmso-d6,100.61mhz):δ[ppm]=17.9(ch3),24.4(ch2),25.2(ch2),25.3(ch2),26.0(ch2),28.0(ch2),29.9(ch2),33.3(ch2),39.0(ch2nh),47.6(ch),64.1(ch2o),125.3(ch2),135.9(cch2),157.3(co),166.5(co)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1