一种植物纯化组分、制备方法、皮肤修复活性及用于制备皮肤修复化妆品的用途与流程
1.本发明属于植物化学领域,具体涉及一种植物纯化组分、制备方法、皮肤修复活性及用于制备皮肤修复化妆品的用途。
背景技术:
2.皮肤屏障功能通过防止水分、营养物质等的丢失,来保持皮肤生理功能的正常运行,同时也保证机体内器官组织免受外界有害物质的侵袭,对机体内环境稳态的维持起着重要作用。广义的皮肤屏障功能指与皮肤各层结构相关的屏障;狭义的皮肤屏障功能主要指以角质层结构为主的屏障,其中还与表皮的各种蛋白质、脂质、水、无机盐及各种代谢产物密切相关,这些物质的产生和代谢异常都会影响皮肤的屏障功能,不同程度地参与到皮肤病的病理生理过程中。皮肤屏障功能损伤是一大类皮肤病的病理基础,如银屑病、湿疹、特应性皮炎、痤疮、激素依赖性皮炎、黄褐斑、光老化等,都有角质层结构异常,皮肤含水量下降,经皮水分丢失(transepidermal water loss,tewl)增加等相关表现。
3.荷青花(hylomecon japonica(thunb.)prantl&k
ü
ndig)为荷青花属的多年生草本植物,主要分布在中国东北、华北等海拔300-1800米地区。荷青花药用部位多为根茎,全年可采,具有祛风湿,散瘀消肿,止血止痛等作用。荷青花全草富含生物碱类、酚类、萜类、黄酮类、皂苷类及其它生物活性成分,有抗菌、抗炎、抗癌等药用价值。
4.曾有研究报道荷青花的根茎提取物具有治疗皮炎的活性,并认为该活性可能与其活性成分黄酮、皂苷以及生物碱有关。尚未见荷青花其它部位提取物在皮肤修复方面的报道。
技术实现要素:
5.本发明的目的是为了提供一种植物纯化组分、制备方法,以及该植物纯化组分的皮肤修复活性和用于制备皮肤修复化妆品的用途。
6.技术方案如下:
7.一种植物纯化组分,为一种纯化多糖,通过如下步骤制备得到:
8.收集荷青花盛开的花瓣,阴干后粉碎,先用95%乙醇脱脂,再用纯净水加热提取,提取液离心,收集上清液;上清液先减压浓缩,然后加入乙醇调节乙醇体积百分浓度为80%,再于常温条件下静置过夜,收集沉淀,用纯净水复溶,透析,最后冻干得到荷青花粗多糖;其中,95%乙醇为体积百分浓度;
9.取适量荷青花粗多糖溶解在纯净水中,离心,收集上清液,上样于内径3cm、柱床高度35cm的deae-52纤维素阴离子交换柱,依次使用纯净水和0.1、0.3m nacl溶液冲洗,流速为1ml/min,各冲洗150ml,收集0.3m nacl溶液洗脱部分;
10.0.3m nacl溶液洗脱部分浓缩后用内径1.5cm、柱床高度50cm的葡聚糖凝胶sephadex g-100柱进一步纯化,使用纯净水冲洗,流速为0.5ml/min,每管收集10ml,使用硫
酸-苯酚法测吸光度,绘制洗脱曲线,根据洗脱曲线合并富含多糖的洗脱液,透析,冻干,即得。
11.优选地,脱脂步骤的料液比为1kg:10l,85℃加热提取3h。
12.优选地,脱脂后用纯净水加热提取的温度为85℃,提取时间为3h,料液比为1kg:10l。
13.优选地,纯净水提取液离心步骤的离心参数为3500r/min离心20min。
14.优选地,deae-52纤维素阴离子交换柱上样前离心参数为3500r/min离心10min。
15.上述任一植物纯化组分用于制备修复皮肤屏障损伤的化妆品的用途。
16.技术效果如下:
17.本发明提供了一种荷青花纯化多糖,该多糖均一性高,相对平均分子量是3.225
×
105da。活性试验表明,该多糖对皮肤屏障损伤具有良好的修复活性。因此,该多糖可以进一步用于开发制备成皮肤屏障损伤修复的化妆品。
附图说明
18.图1为deae-52纤维素阴离子交换柱洗脱曲线;
19.图2为葡聚糖凝胶sephadex g-100洗脱曲线;
20.图3为荷青花纯化多糖的红外波谱图;
21.图4为各组小鼠表皮tewl值,其中a为正常对照组,b为模型组,c为低剂量多糖修复组,d为高剂量多糖修复组;
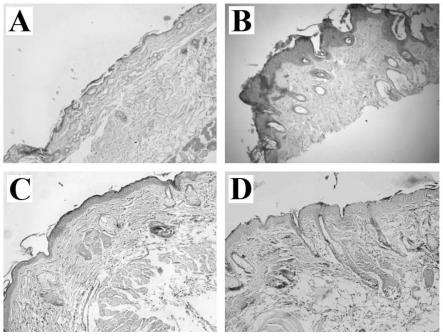
22.图5为各组小鼠皮肤he染色,其中a为正常对照组,b为模型组,c为低剂量多糖修复组,d为高剂量多糖修复组;
23.图6为各组小鼠皮肤中lor、inv和flg蛋白表达水平,其中a为正常对照组,b为模型组,c为高剂量多糖修复组,d为低剂量多糖修复组。
具体实施方式
24.实施例1:荷青花多糖的制备
25.一、材料和试剂
26.deae-52纤维素阴离子交换柱填料(进口分装)购自北京康瑞纳生物科技有限公司
27.葡聚糖凝胶sephadex g-100填料购自上海远慕生物科技有限公司。
28.收集荷青花盛开的花瓣,洗净,于阴凉处干燥后粉碎备用。
29.95%乙醇即市售95乙醇,购自上海阿拉丁生化科技股份有限公司。
30.纯净水为娃哈哈桶装纯净水。
31.氯化钠,分析纯,购自上海阿拉丁生化科技股份有限公司。
32.二、方法和结果
33.1、多糖提取和分离纯化
34.收集荷青花盛开的花瓣,阴干后粉碎,先用95%乙醇脱脂(体积百分浓度,料液比1kg:10l,85℃加热提取3h),再用纯净水85℃加热提取3h,料液比1kg:10l,提取液3500r/min离心20min,收集上清液。上清液先减压浓缩,然后加入乙醇调节乙醇体积百分浓度为80%,再于常温条件下静置过夜,收集沉淀,用纯净水复溶,透析(截留分子量mw=1000),最
后冻干得到荷青花粗多糖。
35.取适量荷青花粗多糖溶解在纯净水中,3500r/min离心10min,收集上清液,上样于deae-52纤维素阴离子交换柱(3cm
×
35cm),依次使用纯净水和0.1、0.3、0.5m nacl溶液冲洗,流速为1ml/min,每管收集10ml,每种洗脱剂收集15管,使用硫酸-苯酚法测吸光度,绘制洗脱曲线,收集多糖组分。洗脱曲线如图1所示,根据洗脱曲线可知0.3m nacl溶液洗脱部分的多糖含量较高,故以此多糖组分为研究目标。
36.0.3m nacl溶液洗脱部分浓缩后用葡聚糖凝胶sephadex g-100柱(1.5cm
×
50cm)进一步纯化,使用纯净水冲洗,流速为0.5ml/min,每管收集10ml,使用硫酸-苯酚法测吸光度,绘制洗脱曲线,根据洗脱曲线合并富含多糖的洗脱液,透析(截留分子量mw=1000),冻干得到荷青花纯化多糖。洗脱曲线如图2所示,根据曲线合并5~11管洗脱液即为富含纯化多糖的洗脱液。根据曲线形态,该纯化多糖的均一性较高。
37.2、含量测定和分子质量测定
38.硫酸-苯酚法测定目标多糖组分的含量,结果为(98.2
±
0.6)%,纯度高。
39.配置1mg/ml的葡聚糖标准品,以纯净水作为流动相进行检测,采用tsk g4000pwxl色谱柱(300mm
×
7.8mm,10μm),流速为1ml/min,柱温为30℃,进样体积20μl,检测器采用视差折光检测器。根据葡聚糖的标准品的保留时间建立标准曲线及公式,配置1mg/ml的多糖样品溶液进行检测,计算目标多糖的分子质量,结果该目标多糖组分的相对平均分子量是3.225
×
105da。
40.3、红外分析
41.使用傅立叶变换红外光谱测定目标多糖的红外波谱特征。采用溴化钾压片法,压片厚度1mm,扫描范围400~4000cm-1
。红外波谱图如图3所示,828.23cm-1
处吸收峰表明该纯化多糖含有α型糖苷键。
42.实施例2:皮肤屏障修复活性
43.一、材料
44.6-8周雄性c57bl/6小鼠(spf级),体重20-25g,购自常州卡文斯实验动物有限公司。
45.荷青花纯化多糖为实施例1制备,4℃干燥保存备用。
46.vapometer测量仪购自芬兰delfin。
47.lor、inv、flg、gapdh一抗购自北京百奥莱博科技有限公司。
48.二、方法
49.1、动物饲养
50.6-8周雄性c57bl/6小鼠(spf级),体重20-25g。保证自由进食进水,使用粮食、饮用水及垫料均经灭菌。饲养温度20-24℃,湿度45%-65%,12小时白昼和12小时黑夜交替维持实验动物生物节律。适应性饲养一周后开展实验。
51.2、分组、造模和给药处理
52.将小鼠根据体质量分层随机分为4组,每组5只,分别为正常对照组、模型组、低剂量多糖修复组和高剂量多糖修复组。以胶带法复制皮肤机械屏障损伤模型。各组于造模前1d,剃去小鼠颈背部被毛。造模当天开始,对模型组、低剂量多糖修复组和高剂量多糖修复组小鼠用强力胶带反复粘贴剃去被毛处皮肤,每日2遍,中间间隔12h,每遍反复粘贴3次,连
续造模5d,即获得皮肤屏障损伤模型。
53.造模同时,于低剂量多糖修复组和高剂量多糖修复组小鼠受损皮肤处均匀滴加实施例1制备的荷青花纯化多糖水溶液0.5ml,低剂量多糖修复组多糖浓度为5mg/ml,高剂量多糖修复组多糖浓度为10mg/ml。滴加时间为每日第2遍粘贴处理后2h。连续5d。正常对照组、模型组小鼠均匀滴加0.5ml纯净水。
54.3、表皮tewl值测定
55.最后1次给药次日,于室内无阳光直射处将小鼠水平放置于笼盖上并用vapometer测量仪测定小鼠颈背部皮肤。温度(22
±
2)℃,湿度(55
±
5)%。测量前保持皮肤处于自然状态20min。确保测量仪垂直接触于皮肤。重复测量3次。
56.4、皮肤病理测定
57.表皮tewl值测定后处死小鼠,小心剪取颈背部皮肤,用打耳器将剪下的皮肤打成皮肤圆片,面积0.5cm2,置于10%中性甲醛中固定48h,脱水、包埋,进行he染色。生物显微镜下观察各组小鼠皮肤组织病理学改变。
58.5、皮肤屏障功能标志蛋白表达水平测定
59.各组小鼠颈背部皮肤测定病理的剩余部分,用试剂盒提取总蛋白,并用bca试剂盒测定蛋白浓度。取40μg总蛋白行sds-page电泳,转膜,5%脱脂牛奶封闭,pbst洗膜,加入稀释的lor、inv、flg、gapdh一抗4℃孵育过夜,次日洗膜,加入稀释的二抗溶液常温孵育1h,ecl化学发光试剂盒检测蛋白质表达水平。
60.5、统计分析
61.统计分析采用spss 17.0软件,结果用均数
±
标准差表示,两组间比较采用t检验,p《0.05为差异有显著性。
62.三、结果
63.1、表皮tewl值
64.tewl表示真皮深层的水分通过表皮的蒸发散失,是描述皮肤屏障的重要参数,其与皮肤角质层含水量密切相关。tewl值越高,表明经皮肤散失的水分越多,角质层的屏障功能较差。结果见表1和图4。与正常对照组相比,模型组小鼠tewl值显著升高(p《0.05);与模型组相比,低剂量多糖修复组和高剂量多糖修复组小鼠tewl值均显著降低(p《0.05)。
65.表1各组小鼠表皮tewl值
[0066] tewl值(g/m2·
h)正常对照组12.57
±
4.08模型组44.29
±
7.52低剂量多糖修复组31.05
±
6.86高剂量多糖修复组19.83
±
7.90
[0067]
2、皮肤病理
[0068]
结果见图5。与正常对照组相比,模型组小鼠皮肤表皮明显增厚,角质层增厚并出现脱落缺失状况,真皮层有明显的炎症细胞浸润,腺上皮细胞增大增多,呈现明显的病理改变。与模型组相比,低剂量多糖修复组和高剂量多糖修复组小鼠皮肤表皮增厚量减少,角质层状况改善,炎症明显缓解,病理缓解显著。
[0069]
3、皮肤屏障功能标志蛋白表达水平
[0070]
兜甲蛋白(loricrin,lor)和内披蛋白(involucrin,inv)是2种重要的终末分化蛋白,两者皆参与角质化套膜的组成,在维持皮肤屏障功能中发挥着重要作用。和丝聚合蛋白(filaggrin,flg)是表皮角质层内的一种亲水性蛋白对保持皮肤的水合作用和皮肤屏障至关重要。结果见图6。与正常对照组相比,模型组小鼠皮肤中lor、inv和flg蛋白表达水平显著降低;与模型组相比,低剂量多糖修复组和高剂量多糖修复组小鼠皮肤中lor、inv和flg蛋白表达水平显著升高。
[0071]
通过上述试验,本发明提供了一种荷青花纯化多糖,该多糖均一性高,相对平均分子量是3.225
×
105da。该多糖对皮肤屏障损伤具有良好的修复活性。因此,该多糖可以进一步用于开发制备成皮肤屏障损伤修复的化妆品。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1