菊酯类农药降解菌、降解菌组合物、降解菌菌剂及其应用的制作方法
1.本发明涉及微生物技术领域,具体涉及一种菊酯类农药降解菌、降解菌组合物、降解菌菌剂及其应用。
背景技术:
2.农药污染已成为现在广泛关注的重大农业生态环境问题之一,对现代农业和社会经济的可持续发展、农业生态环境安全和农产品质量构成了严重威胁。菊酯类农药作为国内外农业中主要的杀虫剂,杀虫迅速、高效,使用成本低,在现代农业,尤其在设施蔬菜栽培上大量使用,成为农药残留超标的主体。农药残留是一种面源污染,浓度低、范围广,采用传统的物理化学处理方法难度大、成本高,并且还有二次污染。利用微生物治理农药残留是消除和解毒高浓度的农药残留的最安全、有效且廉价的方法。
3.设施蔬菜自上世纪80年代中期以来,得到迅速发展。由于常年种植与连作,养分失调,病虫害发生严重,化肥和农药频繁且超量使用,土壤环境日益恶化(如土壤次生盐渍化、酸化、养分失调),多种农药长期残留,微生物生态失衡。
4.目前菊酯类农药在人居环境消杀蚊蝇使用广泛,并且为达到较好的杀灭蚊蝇使用效果过量过频使用无可避免,因此在环境中残留的菊酯类农药的累积对环境及人类健康亦产生了不可忽视的影响。
技术实现要素:
5.本发明的目的是提供一种菊酯类农药降解菌、降解菌组合物、降解菌菌剂及其应用,通过生物修复的方式对农药残留土壤进行有效修复,降解菊酯类农药。
6.为了达到上述目的,本发明所采用的技术方案为:
7.菊酯类农药降解菌,所述菊酯类农药降解菌为爪哇正青霉(eupenicillium javanicum)dgd-4,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏日期为2022年2月14日,保藏编号为:cgmcc n0.40076。
8.另一方面,提供如所述的菊酯类农药降解菌在降解菊酯类农药中的应用。
9.菊酯类农药降解菌组合物,所述组合物包括权利要求1所述的爪哇正青霉(eupenicillium javanicum)dgd-4和米曲霉(aspergillus oryzae)ty197-08。
10.另一方面,提供如所述的菊酯类农药降解菌组合物在降解菊酯类农药中的应用。
11.菊酯类农药降解菌菌剂的制备方法,所述方法包括:
12.制备爪哇正青霉(eupenicillium javanicum)dgd-4种子液;
13.制备青霉固体发酵培养基;
14.将爪哇正青霉(eupenicillium javanicum)dgd-4种子液与青霉固体发酵培养基混合,发酵,得到固体青霉发酵物;
15.制备米曲霉(aspergillus oryzae)ty197-08种子液;
16.制备曲霉固体发酵培养基;
17.将米曲霉(aspergillus oryzae)ty197-08种子液与曲霉固体发酵培养基混合,发酵,得到固体曲霉发酵物;
18.将固体青霉发酵物与固体曲霉发酵物干燥、低温粉碎、过筛,得到混合发酵物粉;
19.将硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾与混合发酵物粉混合均匀,得到复合微生物可湿性粉剂,即菊酯类农药降解菌菌剂。
20.进一步地,青霉固体发酵培养基的配方为:
21.麸皮150-200克,谷壳50-100克,糖蜜5-10克,玉米粉4-10克,蛋白胨0.5-1.5克,加水100-150克。
22.进一步地,曲霉固体发酵培养基的配方为:
23.麸皮150-200克,谷壳50-100克,糙米10-50克,玉米粉4-10克,蛋白胨0.5-1.5克,磷酸二氢钾0.5-1克,加水100-150克。
24.进一步地,固体青霉发酵物与固体曲霉发酵物的混合比例为1:1。
25.进一步地,硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合比例为(81-88):(10-15):(0.3-0.6):(0.1-0.2):(1-2):(0.5-1);
26.硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合物与混合发酵物粉的混合比例为(10-20):1。
27.另一方面,提供如所述的菊酯类农药降解菌菌剂在降解菊酯类农药中的应用。
28.与现有技术相比,本发明的有益效果如下:
29.本发明提供了一种菊酯类农药降解菌、降解菌组合物、降解菌菌剂及其应用,利用微生物的方法降解化学农药残留,适用于现代农业生产中绿色无公害农产品的生产与加工。其中,所提供的的降解菌菌剂为菊酯类农药降解微生物复合可湿性粉剂,能对农药残留土壤进行有效修复,降解菊酯类农药。
30.本发明是一种高效、经济的环境友好型农残处理技术,操作简单、修复效果好、成本费用低、不影响农业生产的土壤修复技术,相比其他方法具有处理成本低、施工简单、无二次污染、对环境影响小等优点。
附图说明
31.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他实施例的附图。
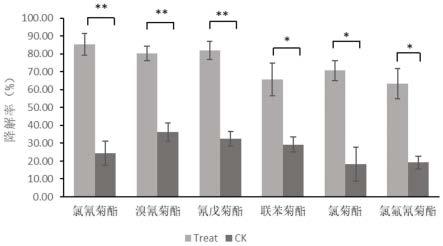
32.图1是降解菌菌剂对棚内土壤中各种菊酯类农药的降解效果对比图。
33.图2是爪哇正青霉(eupenicillium javanicum)dgd-4的菌落形态鉴定图。图中,a为dgd-4在ma平板上的形态,b为dgd-4在cya平板上的形态,c为dgd-4在100倍显微镜下菌丝形态,d为dgd-4在400倍显微镜下孢囊及孢子形态。
34.图3是爪哇正青霉(eupenicillium javanicum)dgd-4的18s序列建树图。
具体实施方式
35.为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中
给出了本发明的较佳实施方式。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明的公开内容理解的更加透彻全面。
36.本专利的描述中,需要理解的是,使用的所有技术以及科学术语具有与本专利所属领域普通技术人员通常理解的相同的含义。当存在矛盾时,以本说明书中的定义为准。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,实施例中所用的试剂为市售商品,实施例中采用的装置为现有装置,对手段、试剂或装置的限定不能理解为对本专利的限制,同类型解决相同技术问题的手段、试剂或装置均在本专利的保护范围之内。
37.在本专利的描述中,需要理解的是,当量、浓度、或者其它值或参数以范围、优选范围、或一系列上限优选值和下限优选值限定的范围表示时,这应当被理解为具体公开了由任何范围上限或优选值与任何范围下限或优选值的任一配对所形成的所有范围,而不论该范围是否单独公开了。当数值范围在本文中被描述时,除非另外说明,否则该范围意图包括其端值和在该范围内的所有整数和分数。
38.在本专利的描述中,需要理解的是,在描述方法的过程中涉及了多个步骤,不应理解为对方法步骤顺序的限制,在解决相同技术问题时仅通过改变步骤顺序获得的技术方案也在本专利的保护范围之内。
39.本发明提供了一种菊酯类农药降解菌,所述菊酯类农药降解菌为爪哇正青霉(eupenicillium javanicum)dgd-4,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏日期为2022年2月14日,保藏编号为:cgmcc n0.40076,genbank数据库登录号为on306759。该菊酯类农药降解菌可应用于降解菊酯类农药。
40.本发明还提供了一种菊酯类农药降解菌组合物,所述组合物包括青霉菌株和曲霉菌株,分别为上述爪哇正青霉(eupenicillium javanicum)dgd-4和米曲霉(aspergillus oryzae)ty197-08。米曲霉(aspergillus oryzae)ty197-08购自陕西省微生物研究所秦岭天然产物工程中心,购买日期为2021年1月22日,其genbank数据库登录号为mt093254。该菊酯类农药降解菌组合物可应用于降解菊酯类农药。
41.利用爪哇正青霉(eupenicillium javanicum)dgd-4和米曲霉(aspergillus oryzae)ty197-08可制备菊酯类农药降解菌菌剂,具体包括以下步骤:
42.步骤一:制备爪哇正青霉(eupenicillium javanicum)dgd-4种子液,具体包括:
43.1.1青霉斜面孢子制备:制备固体pda培养基,并进行常规无菌处理。将爪哇正青霉(eupenicillium javanicum)dgd-4在pda平板上活化三次,无菌操作转接至pda斜面培养基,温度28-32℃,持续培养96-120小时,待斜面孢子充分生成;
44.1.2青霉种子液培养:制备pda液体培养基,并进行常规无菌处理,将将步骤1.1的斜面孢子刮取至新无菌容器,用无菌生理盐水调节孢子浓度为5
×
10
6-8
×
106个/毫升,以1-2%的比例接种至液体pda培养基中,温度28-32℃,120-150rpm震荡培养48-72小时,待菌丝球形成,制备成青霉种子液。
45.步骤二:制备青霉固体发酵培养基,进行121℃灭菌2小时。青霉固体发酵培养基的配方为:麸皮150-200克,谷壳50-100克,糖蜜5-10克,玉米粉4-10克,蛋白胨0.5-1.5克,加水100-150克。
46.步骤三:将爪哇正青霉(eupenicillium javanicum)dgd-4种子液按1-10%比例与青霉固体发酵培养基混合,恒定温度28
±
5℃,固体水分含量35-55%,持续发酵96-100小时,显微镜血球计数板孢子计数1-1.5
×
109时终止发酵;得到固体青霉发酵物。
47.步骤四:制备米曲霉(aspergillus oryzae)ty197-08种子液。具体包括:
48.4.1曲霉斜面孢子制备:制备固体斜面pda培养基,并进行常规无菌处理,将米曲霉(aspergillus oryzae)ty197-08在pda平板上活化三次,无菌操作转接至pda斜面培养基,温度28-35℃,持续培养72-144小时,待斜面孢子充分生成。
49.4.2曲霉种子液培养:制备pda液体培养基,并进行常规无菌处理,将步骤4.1的斜面孢子刮取至新无菌容器,用无菌生理盐水调节孢子浓度为5
×
10
6-1
×
107个/毫升,以2-4%的比例接种至液体pda培养基中,温度30-35℃,120-150rpm震荡培养48-60小时,待菌丝球形成,制备成曲霉种子液。
50.步骤五:制备曲霉固体发酵培养基,进行121℃灭菌2小时。曲霉固体发酵培养基的配方为:麸皮150-200克,谷壳50-100克,糙米10-50克,玉米粉4-10克,蛋白胨0.5-1.5克,磷酸二氢钾0.5-1克,加水100-150克。
51.步骤六:将米曲霉(aspergillus oryzae)ty197-08种子液按1-5%比例与曲霉固体发酵培养基混合,恒定温度28
±
5℃,固体水分含量35-55%,持续发酵96-120小时,显微镜血球计数板孢子计数1-2
×
109时终止发酵,得到固体曲霉发酵物。
52.步骤七:将固体青霉发酵物与固体曲霉发酵物分别平铺于长方形浅盘内,厚度约为5-10cm,置于发酵间的恒温35-40℃金属层架上,通风干燥,干燥大约24-48小时。期间每2-3小时取样一次,检测发酵物含水量,待其含水量为8-15%时停止干燥。收集干燥物1:1混合,于气流粉碎机中按照按照工作5-10分钟、停止2-4分钟间歇模式进行粉碎至150目-200目大小。
53.步骤八:将硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾粉碎,过200目筛。将硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾与混合发酵物粉混合均匀,得到复合微生物可湿性粉剂,即菊酯类农药降解菌菌剂。硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合比例为(81-88):(10-15):(0.3-0.6):(0.1-0.2):(1-2):(0.5-1),含水量控制在5%以下。硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合物与混合发酵物粉的混合比例为(10-20):1,均以重量计。
54.该复合微生物可湿性粉剂的有效成分为活体爪哇正青霉分生孢子及米曲霉分生孢子,孢子数量≥1
×
108cfu/g,可通过生物修复的方式对土壤中残留的菊酯类农药进行降解,达到土壤修复的目的。所述菊酯类农药具体指氯氰菊酯、溴氰菊酯、氰戊菊酯、联苯菊酯、氯菊酯、氯氟氰菊酯。
55.为了更好地理解本发明,下面用具体实例来详细说明本发明的技术方案,但是本发明并不局限于此。
56.实施例1:
57.爪哇正青霉(eupenicillium javanicum)dgd-4的分离、纯化及鉴定,具体包括:
58.1、菊酯降解菌种富集:
59.在陕西省境内棚室、果园及秦岭等地,共收集土壤样本70余份。
60.在摇瓶中加入100ml无机盐液体培养基灭菌冷却后,分别加入氯氰菊酯或氯菊酯
(终浓度500mg/l)。分别加入收集土样5g,28℃180rpm富集培养7天后取1ml菌液转接至新无机盐液体培养基(含氯氰菊酯或氯菊酯(终浓度500mg/l)),连续转接3次。
61.2、菊酯降解菌种分离与纯化:
62.将富集3次后的培养液进行梯度稀释,涂布于含氯氰菊酯或氯菊酯(500mg/l)的无机盐固体培养基平板上,28℃培养7天。选取菌落进行划线纯化,选择单菌落,pda斜面培养,待长出孢子后,取孢子液甘油-80℃低温保藏。
63.无机盐培养基:kh2po
4 0.5g,mgso
4 0.5g,(nh4)2so
4 0.4g,nacl 0.5g,nh4no
3 1.2g,k2hpo
4 1.5g,酵母提取物0.05g,ph 7.0,至1,000ml。120℃灭菌20min。
64.pda培养基:去皮马铃薯200g,切块加沸水煮30min,滤去固体后,20g葡萄糖,加水至1,000ml,105℃灭菌20min。
65.固体培养基是以上培养基中再加入2%的琼脂粉。
66.3、菊酯降解菌的形态鉴定:
67.取菌株dgd-4在pda插片平板上接种,28℃培养48h,待菌丝长至盖玻片上后镜检观察。分别在ma及cya平板上接种观察其菌落形态。
68.菌落在ca上25℃培养5天,直径35-50mm,较薄,放射状皱纹较少;质地绒状兼絮状和颗粒状,分生孢子呈灰绿色。菌落在cay上25℃培养5天,直径5-10mm,,较薄,质地绒状兼絮状和颗粒状。
69.插片镜检观察分生孢子结构通常稀少,分生孢子梗发生于气生菌丝,帚状枝典型单轮生,瓶梗每轮2-6个,梗颈明显,分生孢子呈现球形,分生孢子链疏松而叉开,不产生可溶性色素。
70.cya培养基:蔗糖30g,nahco
3 3g,k2hpo
4 1g,mgso
4 0.5g,kcl 0.5g,feso
4 0.01g,酵母提取物0.1g,加水至1,000ml,120℃灭菌20mi n。
71.(ma)马丁氏:葡萄糖10g,蛋白胨5g,kh2po
4 0.1g,kcl 0.5g,加水至1,000ml,105℃灭菌20min。
72.其菌落及显微镜镜检显示其形态与爪哇正青霉(eupenicillium javanicum)最为接近。
73.4、菊酯降解菌的its rdna序列鉴定:
74.取dgd-4斜面孢子,接种至摇瓶,28℃,180r/min培养24h待生成菌丝球后取菌丝发酵液2ml离心,提取dgd-4菌株的基因。its序列扩增采用ns1序列引物(gtagtcatatgcttgtctc)及ns8序列引物(tccgcaggttcacctacgga),pcr扩增送测序。测序结果利用blast软件在genbank数据库中进行比对,用系统发育树软件clustalx及mega5.1构建分类系统发育树。结果表明在进化树中,gdg-4与爪哇正青霉(eupenicillium javanicum)序列最为接近。最终鉴定其为爪哇正青霉(eupenicillium javanicum)。
75.实施例2:
76.步骤一:制备爪哇正青霉(eupenicillium javanicum)dgd-4种子液,具体包括:
77.1.1青霉斜面孢子制备:制备固体pda培养基,并进行常规无菌处理。将爪哇正青霉(eupenicillium javanicum)dgd-4在pda平板上活化三次,无菌操作转接至pda斜面培养基,温度30℃,持续培养108小时,待斜面孢子充分生成;
78.1.2青霉种子液培养:制备pda液体培养基,并进行常规无菌处理,将将步骤1.1的
斜面孢子刮取至新无菌容器,用无菌生理盐水调节孢子浓度为6
×
106个/毫升,以1%的比例接种至液体pda培养基中,温度30℃,135rpm震荡培养60小时,待菌丝球形成,制备成青霉种子液。
79.步骤二:制备青霉固体发酵培养基,进行121℃灭菌2小时。青霉固体发酵培养基的配方为:麸皮175克,谷壳75克,糖蜜7克,玉米粉7克,蛋白胨1克,加水125克。
80.步骤三:将爪哇正青霉(eupenicillium javanicum)dgd-4种子液按5%比例与青霉固体发酵培养基混合,恒定温度28℃,固体水分含量45%,持续发酵98小时,显微镜血球计数板孢子计数1
×
109时终止发酵;得到固体青霉发酵物。
81.步骤四:制备米曲霉(aspergillus oryzae)ty197-08种子液。具体包括:
82.4.1曲霉斜面孢子制备:制备固体斜面pda培养基,并进行常规无菌处理,将米曲霉(aspergillus oryzae)ty197-08在pda平板上活化三次,无菌操作转接至pda斜面培养基,温度31℃,持续培养108小时,待斜面孢子充分生成。
83.4.2曲霉种子液培养:制备pda液体培养基,并进行常规无菌处理,将步骤4.1的斜面孢子刮取至新无菌容器,用无菌生理盐水调节孢子浓度为7
×
106个/毫升,以3%的比例接种至液体pda培养基中,温度32℃,135rpm震荡培养54小时,待菌丝球形成,制备成曲霉种子液。
84.步骤五:制备曲霉固体发酵培养基,进行121℃灭菌2小时。曲霉固体发酵培养基的配方为:麸皮175克,谷壳75克,糙米30克,玉米粉7克,蛋白胨1克,磷酸二氢钾0.7克,加水125克。
85.步骤六:将米曲霉(aspergillus oryzae)ty197-08种子液按3%比例与曲霉固体发酵培养基混合,恒定温度28℃,固体水分含量45%,持续发酵108小时,显微镜血球计数板孢子计数1
×
109时终止发酵,得到固体曲霉发酵物。
86.步骤七:将固体青霉发酵物与固体曲霉发酵物分别平铺于长方形浅盘内,厚度约为7cm,置于发酵间的恒温37℃金属层架上,通风干燥,干燥大约36小时。期间每2小时取样一次,检测发酵物含水量,待其含水量为12%时停止干燥。收集干燥物1:1混合,于气流粉碎机中按照按照工作7分钟、停止3分钟间歇模式进行粉碎至1700目大小。
87.步骤八:将硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾粉碎,过200目筛。将硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾与混合发酵物粉混合均匀,得到复合微生物可湿性粉剂,即菊酯类农药降解菌菌剂。硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合比例为84:12:0.4:0.1:1:0.7,含水量控制在5%以下。硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合物与混合发酵物粉的混合比例为15:1,均以重量计。该复合微生物可湿性粉剂有效成分为活体爪哇正青霉分生孢子及米曲霉分生孢子,孢子数量≥1
×
108cfu/g。
88.实施例3:
89.步骤一:制备爪哇正青霉(eupenicillium javanicum)dgd-4种子液,具体包括:
90.1.1青霉斜面孢子制备:制备固体pda培养基,并进行常规无菌处理。将爪哇正青霉(eupenicillium javanicum)dgd-4在pda平板上活化三次,无菌操作转接至pda斜面培养基,温度28℃,持续培养96小时,待斜面孢子充分生成;
91.1.2青霉种子液培养:制备pda液体培养基,并进行常规无菌处理,将将步骤1.1的
斜面孢子刮取至新无菌容器,用无菌生理盐水调节孢子浓度为5
×
106个/毫升,以1%的比例接种至液体pda培养基中,温度28℃,120rpm震荡培养48小时,待菌丝球形成,制备成青霉种子液。
92.步骤二:制备青霉固体发酵培养基,进行121℃灭菌2小时。青霉固体发酵培养基的配方为:麸皮150克,谷壳50克,糖蜜5克,玉米粉4克,蛋白胨0.5克,加水100克。
93.步骤三:将爪哇正青霉(eupenicillium javanicum)dgd-4种子液按1%比例与青霉固体发酵培养基混合,恒定温度23℃,固体水分含量35%,持续发酵96小时,显微镜血球计数板孢子计数1
×
109时终止发酵;得到固体青霉发酵物。
94.步骤四:制备米曲霉(aspergillus oryzae)ty197-08种子液。具体包括:
95.4.1曲霉斜面孢子制备:制备固体斜面pda培养基,并进行常规无菌处理,将米曲霉(aspergillus oryzae)ty197-08在pda平板上活化三次,无菌操作转接至pda斜面培养基,温度28℃,持续培养72小时,待斜面孢子充分生成。
96.4.2曲霉种子液培养:制备pda液体培养基,并进行常规无菌处理,将步骤4.1的斜面孢子刮取至新无菌容器,用无菌生理盐水调节孢子浓度为5
×
106个/毫升,以2%的比例接种至液体pda培养基中,温度30℃,120rpm震荡培养48小时,待菌丝球形成,制备成曲霉种子液。
97.步骤五:制备曲霉固体发酵培养基,进行121℃灭菌2小时。曲霉固体发酵培养基的配方为:麸皮150克,谷壳50克,糙米10克,玉米粉4克,蛋白胨0.5克,磷酸二氢钾0.5克,加水100克。
98.步骤六:将米曲霉(aspergillus oryzae)ty197-08种子液按1%比例与曲霉固体发酵培养基混合,恒定温度23℃,固体水分含量35%,持续发酵96小时,显微镜血球计数板孢子计数1
×
109时终止发酵,得到固体曲霉发酵物。
99.步骤七:将固体青霉发酵物与固体曲霉发酵物分别平铺于长方形浅盘内,厚度约为5cm,置于发酵间的恒温35℃金属层架上,通风干燥,干燥大约24小时。期间每2小时取样一次,检测发酵物含水量,待其含水量为8%时停止干燥。收集干燥物1:1混合,于气流粉碎机中按照按照工作5分钟、停止2分钟间歇模式进行粉碎至150目大小。
100.步骤八:将硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾粉碎,过200目筛。将硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾与混合发酵物粉混合均匀,得到复合微生物可湿性粉剂,即菊酯类农药降解菌菌剂。硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合比例为81:10:0.3:0.1:1:0.5,含水量控制在5%以下。硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合物与混合发酵物粉的混合比例为10:1,均以重量计。该复合微生物可湿性粉剂有效成分为活体爪哇正青霉分生孢子及米曲霉分生孢子,孢子数量≥1
×
108cfu/g。
101.实施例4:
102.步骤一:制备爪哇正青霉(eupenicillium javanicum)dgd-4种子液,具体包括:
103.1.1青霉斜面孢子制备:制备固体pda培养基,并进行常规无菌处理。将爪哇正青霉(eupenicillium javanicum)dgd-4在pda平板上活化三次,无菌操作转接至pda斜面培养基,温度32℃,持续培养120小时,待斜面孢子充分生成;
104.1.2青霉种子液培养:制备pda液体培养基,并进行常规无菌处理,将将步骤1.1的
斜面孢子刮取至新无菌容器,用无菌生理盐水调节孢子浓度为-8
×
106个/毫升,以2%的比例接种至液体pda培养基中,温度32℃,150rpm震荡培养72小时,待菌丝球形成,制备成青霉种子液。
105.步骤二:制备青霉固体发酵培养基,进行121℃灭菌2小时。青霉固体发酵培养基的配方为:麸皮200克,谷壳100克,糖蜜10克,玉米粉10克,蛋白胨1.5克,加水150克。
106.步骤三:将爪哇正青霉(eupenicillium javanicum)dgd-4种子液按10%比例与青霉固体发酵培养基混合,恒定温度33℃,固体水分含量55%,持续发酵100小时,显微镜血球计数板孢子计数1.5
×
109时终止发酵;得到固体青霉发酵物。
107.步骤四:制备米曲霉(aspergillus oryzae)ty197-08种子液。具体包括:
108.4.1曲霉斜面孢子制备:制备固体斜面pda培养基,并进行常规无菌处理,将米曲霉(aspergillus oryzae)ty197-08在pda平板上活化三次,无菌操作转接至pda斜面培养基,温度35℃,持续培养144小时,待斜面孢子充分生成。
109.4.2曲霉种子液培养:制备pda液体培养基,并进行常规无菌处理,将步骤4.1的斜面孢子刮取至新无菌容器,用无菌生理盐水调节孢子浓度为1
×
107个/毫升,以4%的比例接种至液体pda培养基中,温度35℃,150rpm震荡培养60小时,待菌丝球形成,制备成曲霉种子液。
110.步骤五:制备曲霉固体发酵培养基,进行121℃灭菌2小时。曲霉固体发酵培养基的配方为:麸皮200克,谷壳100克,糙米50克,玉米粉10克,蛋白胨1.5克,磷酸二氢钾1克,加水150克。
111.步骤六:将米曲霉(aspergillus oryzae)ty197-08种子液按5%比例与曲霉固体发酵培养基混合,恒定温度33℃,固体水分含量55%,持续发酵120小时,显微镜血球计数板孢子计数2
×
109时终止发酵,得到固体曲霉发酵物。
112.步骤七:将固体青霉发酵物与固体曲霉发酵物分别平铺于长方形浅盘内,厚度约为10cm,置于发酵间的恒温40℃金属层架上,通风干燥,干燥大约48小时。期间每3小时取样一次,检测发酵物含水量,待其含水量为15%时停止干燥。收集干燥物1:1混合,于气流粉碎机中按照按照工作10分钟、停止4分钟间歇模式进行粉碎至200目大小。
113.步骤八:将硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾粉碎,过200目筛。将硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾与混合发酵物粉混合均匀,得到复合微生物可湿性粉剂,即菊酯类农药降解菌菌剂。硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合比例为88:15:0.6:0.2:2:1,含水量控制在5%以下。硅藻土、滑石粉、黄原胶、维生素c、羧甲基纤维素钠、黄腐酸钾的混合物与混合发酵物粉的混合比例为20:1,均以重量计。该复合微生物可湿性粉剂有效成分为活体爪哇正青霉分生孢子及米曲霉分生孢子,孢子数量≥1
×
108cfu/g。
114.以下为本发明提供的菊酯类农药降解菌组合物在液体摇瓶条件对菊酯类农药的降解试验:
115.所述组合物包括青霉菌株和曲霉菌株,分别为上述爪哇正青霉(eupenicillium javanicum)dgd-4和米曲霉(aspergillus oryzae)ty197-08。
116.步骤一:将保存的青霉与曲霉菌种分别划线pda平板培养基三次活化,转接至琼脂pda斜面,28℃培养3天,待产生大量孢子。刮取斜面上的孢子使用无菌生理盐水调节其浓度
为1
×
106个/毫升,接种1毫升至100毫升pda液体培养基中,28℃120rpm培养48小时,待其长成菌丝球。
117.步骤二:按100mg/l的浓度含量分别将氯氰菊酯,溴氰菊酯,氰戊菊酯,联苯菊酯,氯菊酯,氯氟氰菊酯六种农药加入到灭菌后的装有40毫升pda液体培养基的250ml三角瓶中,分别接种各菌株菌丝球10毫升。
118.步骤三:以加入10毫升无菌pda液体培养基的处理为对照。每处理重复3次,置于28℃,120rpm培养10天,取样,并利用乙酸乙酯萃取-hplc法检测菊酯类农药残留量,结果如表1所示,在摇瓶培养的过程中爪哇正青霉与米曲霉均可有效的降解摇瓶中的菊酯类农药(是指氯氰菊酯,溴氰菊酯,氰戊菊酯,联苯菊酯,氯菊酯,氯氟氰菊酯其中之一种),其降解作用显著优于不含菌的空白对照。
119.表1微生物菌株在液体摇瓶条件下对菊酯类农药的降解作用
[0120][0121]
以下为本发明提供的复合微生物菌可湿性粉剂对土壤中菊酯类农药的降解试验:
[0122]
步骤一:取设施棚室土壤,109℃灭菌2小时,冷却后分成等重12组,每2组按100mg/kg的终浓度添加一种菊酯类农药(是指氯氰菊酯,溴氰菊酯,氰戊菊酯,联苯菊酯,氯菊酯,氯氟氰菊酯其中之一种),混拌均匀并吸附24h;
[0123]
步骤二:将用农药处理过的土壤,装30cm
×
45cm
×
20cm塑料试验盒内,每盒装土壤2kg,每种菊酯类农药无菌土壤准备6盒。
[0124]
步骤三:将步骤二中的处理,按2%的量加入,按每种农药无菌土壤3盒来加入实施例1中制得的复合微生物可湿性粉剂40g,混合均匀,以不加复合微生物可湿性粉剂的处理作为对照;每处理设3盆重复;
[0125]
步骤四:将处理组和对照组摆放至室内,保持温度20-24℃,喷施补充水分保持湿度40%-60%条件,20天后测定土壤氯氰菊酯残留量。采用乙酸乙酯萃取-hplc的方法,取土样测定菊酯类农药的残留量。结果如表2所示,土壤中残留菊酯类农药平均下降了约40%。
[0126]
表2复合微生物可湿性粉剂对无菌土壤中菊酯类农药的降解作用
[0127][0128]
以下为本发明提供的复合微生物菌可湿性粉剂对棚室内土壤的修复作用试验:
[0129]
步骤一:在设施大棚将地块分自西向东均分成14等区间,将2、4、6、8、10、12区间作为处理,3、5、7、9、11、13作为对照;
[0130]
按照翻耕25公分深度,人工添加农药使终浓度分别达到50mg/kg,其中区间2、3施用氯氰菊酯,区间4、5施用溴氰菊酯,区间6、7施用氰戊菊酯,区间8、9联苯菊酯,区间10、11施用氯菊酯,区间12、13施用氯氟氰菊酯。
[0131]
步骤二:对棚室土壤施用农药后翻耕均匀,待农药吸附24hr后做后续处理。
[0132]
步骤三:处理区间2、4、6、8、10、12贴近地面位置喷施实施例1中制得的本发明复合微生物菌可湿性粉剂(5kg/亩);对照区间3、5、7、9、11、13不施本发明复合微生物可湿性粉剂。
[0133]
步骤三:每隔一段时间浇水一次,保持棚室土壤水分在45-55%左右。30天后棚内各区间5点取样,测定土壤中残留的农药水平,结果如图1所示,菌剂施用后菊酯类农药(是指氯氰菊酯,溴氰菊酯,氰戊菊酯,联苯菊酯,氯菊酯,氯氟氰菊酯其中之一种)的降解水平都显著优于空白对照组。该菌剂在棚室土壤中也可发挥降解菊酯类(是指氯氰菊酯,溴氰菊酯,氰戊菊酯,联苯菊酯,氯菊酯,氯氟氰菊酯其中之一种)农药的作用。
[0134]
本发明提供了一种高效、经济、环境友好的农残处理策略,所提及的爪哇正青霉及米曲霉,对设施农业及土壤环境有更好的适应性,研发的复合微生物菌剂产品更利于应用和推广,处理成本低、施工简单、无二次污染、对环境影响小,能有效解决在农业生产及环境蚊蝇消杀过程中,由于过量使用菊酯类农药导致农产品及土壤农药高残留的问题,适用于现代农业生产中绿色无公害农产品的生产与加工。
[0135]
以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1