一种高纯千金藤素的分离方法与流程
1.本发明属于分离纯化技术领域,具体是一种高纯千金藤素的分离方法。
背景技术:
2.千金藤素(cepharanthine),白细胞增生药,能促进骨髓组织增生,从而升高白细胞。用于白细胞减少症。可使外周血白细胞增多,动物实验发现,可明显预防丝裂霉素引起的白细胞减少,但不抑制丝裂霉素的抗癌作用。其作用机制是促进骨髓组织增生,从而产生升高白细胞作用。用于因肿瘤化疗、放疗引起的粒细胞缺乏症和其他原因引起的白细胞减少症。现有技术中,千金藤素主的分离纯化方法工艺复杂,不易于工业化生产的自动化。
技术实现要素:
3.本发明针对以上问题,提供了一种高纯千金藤素的分离方法,其特征在于,以山乌龟片、地不容或含有千金藤素的防己科中药材为原料,用提取剂提取,提取液过硅胶柱层析、洗脱,制备液相色谱分离,得到纯化千金藤素;
4.所述层析材料装填在吸附柱中,层析材料为有机烃类键合硅胶或含有极性有机官能团的有机烃类键合硅胶;吸附柱材料为两种以上键合硅胶的物理混合或两种以上有机烃类键合硅胶;
5.所述极性有机官能团选自酯基、氨基、酰胺基、脲基。
6.优选的,包括以下步骤:
7.a、将中药材山乌龟片用研钵捣碎至粉末,加入提取剂超声提取后减压旋蒸浓缩除去提取剂;
8.b、将步骤a中得到的提取液过硅胶柱进行层析,经洗脱后得到千金藤素粗品;
9.c、将千金藤素粗品过滤后,经制备液相色谱进行纯化;
10.d、将步骤c中得到的馏分经减压旋蒸除去甲醇,冷冻干燥,得白色固体,即纯化千金藤素。
11.优选的,提取剂为甲醇、乙醇、正丙醇或异丙醇的一种或一种以上的混合液。
12.优选的,所述层析材料的粒径为5-100um,孔径为
13.优选的,所述步骤b中,洗脱流速为5-30倍柱体积/小时。
14.优选的,所述步骤b中,洗脱液选自有机溶剂甲醇、乙腈、丙酮、四氢呋喃、乙醇、异丙醇、二氧六环的任意一种,或一种以上有机溶剂的混合液与水混合,或一种以上有机溶剂的混合液与添加改性剂的水溶液混合。
15.优选的,所述洗脱液中水或水溶液粘的比例为10%-60%。
16.优选的,所述改性剂为甲酸、乙酸、三氟乙酸、三氯乙酸、磷酸、碳酸氢铵、氨水、三乙胺、二乙胺、乙酸铵或甲酸铵中的一种或一种以上的混合。
17.本发明的有益效果在于:
18.本发明公开了一种高纯千金藤素的分离方法,包括千金藤素的提取,色谱分离,收
集和色谱纯度检测。取山乌龟、地不容或含有千金藤素的防己科中药材,捣碎,经甲醇提取后,过键合硅胶层析柱,所得馏分浓缩后,结晶,可得纯度达到98%的千金藤素纯品。采用本发明所述的方法,千金藤素纯度高,分离工艺简单可控,非常易于工业化生产的自动化。
附图说明
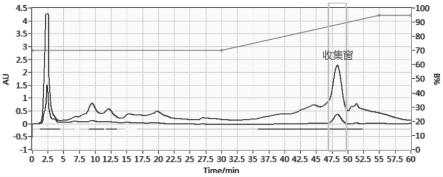
19.图1为典型千金藤素提取液层析分离在线检测图;
20.图2为千金藤素提取液质联用检测图;
21.图3为纯化千金藤素液质联用检测图。
具体实施方式
22.为让本发明的上述特征和优点能更明显易懂,下文特举实施例,并配合附图,作详细说明如下,但本发明并不限于此。
23.在本发明的说明书中,提及“一个实施例”时均意指在该实施例中描述的具体特征、结构或者参数、步骤等至少包含在根据本发明的一个实施例中。因而,在本发明的说明书中,若采用了诸如“根据本发明的一个实施例”、“在一个实施例中”等用语并不用于特指在同一个实施例中,若采用了诸如“在另外的实施例中”、“根据本发明的不同实施例”、“根据本发明另外的实施例”等用语,也并不用于特指提及的特征只能包含在特定的不同的实施例中。本领域的技术人员应该理解,在本发明说明书的一个或者多个实施例中公开的各具体特征、结构或者参数、步骤等可以以任何合适的方式组合。
24.实施例1
25.a、将中药材山乌龟片用研钵捣碎至粉末,用研钵捣碎至粉末,称取50g于具塞锥形瓶中,加入1000ml甲醇,超声提取20min后,静置冷却减压旋蒸浓缩除去提取剂;
26.b、将步骤a中得到的提取液过键合硅胶柱进行层析,经洗脱后得到千金藤素粗品;
27.其中,层析材料为十八烷基键合硅胶(有机烷烃键合硅胶)装填在吸附柱中;洗脱液为甲醇;
28.c、将千金藤素粗品过0.45μm的膜后,经制备液相色谱进行纯化;
29.其中填料:bioseps-flashc18,20-45μm,
30.填装规格:30倍柱体积/小时;
31.进样体积:500ml
32.洗脱液:1)甲醇:水=85:15(v/v)保持30min,2)25min内,比例线性调整为甲醇:水=95:5(v/v);3)保持步骤2)的比例5min.
33.洗脱流速:6倍柱体积/小时;
34.收集方式:紫外检测282nm;
35.d、将步骤c中得到的馏分经减压旋蒸除去甲醇,冷冻干燥,得37.5mg白色固体,即纯化千金藤素。
36.色谱分析:将提取液用甲醇稀释2倍后,过0.45um膜,进液质联用仪进行色谱分析,色谱条件如下:
37.色谱柱:biosepsaqc18,2.1*100mm,3um,
38.流动相:甲醇:0.1%tea=80:20(v/v)
39.检测波长:282nm
40.流速:0.3ml/min;
41.柱温:35℃
42.进样量:1ul
43.质谱电压:3000v,扫描范围150~1500m/z,pos-tic模式
44.纯化检测,经lcms检测,纯化千金藤素样品纯度为98.5%。
45.纯化千金藤素采用液相色谱质谱联用检测,液相色谱柱为十八烷基键合硅胶基质,2.1
×
100mm,孔径为粒径为3μm,流动相为甲醇与0.1磷酸三乙胺水溶液以70:30体积比的混合液,检测波长为282nm,质谱采用正模式全扫描方式下检测到607.7的准分子离子峰对应的峰即为千金藤素。
46.实施例2
47.a、将中药材山乌龟片用研钵捣碎至粉末,用研钵捣碎至粉末,称取50g于具塞锥形瓶中,加入1000ml甲醇,超声提取20min后,静置冷却减压旋蒸浓缩除去提取剂;
48.b、将步骤a中得到的提取液过键合硅胶柱进行层析,经洗脱后得到千金藤素粗品;
49.其中,层析材料为辛烷基键合硅胶装填在吸附柱中;洗脱液为甲醇;
50.c、将千金藤素粗品过0.45μm的膜后,经制备液相色谱进行纯化;
51.其中填料:bioseps-flashc8,20-45μm,
52.填装规格:50
×
250mm;
53.进样体积:500ml
54.洗脱液:四氢呋喃:水=78:22(v/v)
55.洗脱流速:10倍柱体积/小时;
56.收集方式:紫外检测282nm;
57.d、将步骤c中得到的馏分经减压旋蒸除去甲醇,冷冻干燥,得37.4mg白色固体,即纯化千金藤素。
58.纯化检测,经lcms检测,纯化千金藤素样品纯度为98.3%。
59.实施例3
60.a、将中药材山乌龟片用研钵捣碎至粉末,用研钵捣碎至粉末,称取50g于具塞锥形瓶中,加入1000ml甲醇,超声提取20min后,静置冷却减压旋蒸浓缩除去提取剂;
61.b、将步骤a中得到的提取液过键合硅胶柱进行层析,经洗脱后得到千金藤素粗品;
62.其中,层析材料为有nh
2-修饰的十八烷基键合硅胶装填在吸附柱中;洗脱液为甲醇;
63.c、将千金藤素粗品过0.45μm的膜后,经制备液相色谱进行纯化;
64.其中填料:bioseps-flashc18-n,20-45μm,
65.填装规格:50
×
250mm;
66.进样体积:500ml
67.洗脱液:乙腈:水=85:15(v/v)
68.洗脱流速:15倍柱体积/小时;
69.收集方式:紫外检测282nm;
70.d、将步骤c中得到的馏分经减压旋蒸除去甲醇,冷冻干燥,得37.5mg白色固体,即纯化千金藤素。
71.纯化检测,经lcms检测,纯化千金藤素样品纯度为97.1%。
72.实施例4
73.a、将中药材山乌龟片用研钵捣碎至粉末,用研钵捣碎至粉末,称取50g于具塞锥形瓶中,加入1000ml提取剂(体积比为20:80的丙酮/甲醇混合液),超声提取20min后,静置冷却减压旋蒸浓缩除去提取剂;
74.b、将步骤a中得到的提取液过键合硅胶柱进行层析,经洗脱后得到千金藤素粗品;
75.其中,层析材料为有酰胺基修饰的十八烷基键合硅胶装填在吸附柱中;洗脱液为体积比为20:80的丙酮/甲醇混合液;
76.c、将千金藤素粗品过0.45μm的膜后,经制备液相色谱进行纯化;
77.其中填料:bioseps-flashc18-nc,20-45μm,
78.填装规格:50
×
250mm;
79.进样体积:500ml
80.洗脱液:丙酮:甲醇:水(含0.05%三氟乙酸和0.01%三乙胺)=10:50:40(v/v)
81.洗脱流速:25倍柱体积/小时;
82.收集方式:紫外检测282nm;
83.d、将步骤c中得到的馏分经减压旋蒸除去甲醇,冷冻干燥,得37.2mg白色固体,即纯化千金藤素。
84.纯化检测,经lcms检测,纯化千金藤素样品纯度为97.8%。
85.实施例5
86.a、将中药材山乌龟片用研钵捣碎至粉末,用研钵捣碎至粉末,称取50g于具塞锥形瓶中,加入1000ml甲醇,超声提取20min后,静置冷却减压旋蒸浓缩除去提取剂;
87.b、将步骤a中得到的提取液过键合硅胶柱进行层析,经洗脱后得到千金藤素粗品;
88.其中,层析材料为有nh
2-修饰的十八烷基键合硅胶装填在吸附柱中;洗脱液为甲醇:水=85:15(v/v)
89.c、将千金藤素粗品过0.45μm的膜后,经制备液相色谱进行纯化;
90.其中填料:bioseps-flashc18-n,20-45μm,
91.填装规格:50
×
250mm;
92.进样体积:500ml
93.洗脱液:甲醇:乙醇:水(含0.1%甲酸)=68:17:15(v/v)
94.洗脱流速:5倍柱体积/小时;
95.收集方式:紫外检测282nm;
96.d、将步骤c中得到的馏分经减压旋蒸除去甲醇,冷冻干燥,得37.3mg白色固体,即纯化千金藤素。
97.纯化检测,经lcms检测,纯化千金藤素样品纯度为98.1%。
98.实施例6
99.a、将中药材山乌龟片用研钵捣碎至粉末,用研钵捣碎至粉末,称取50g于具塞锥形瓶中,加入1000ml甲醇,超声提取20min后,静置冷却减压旋蒸浓缩除去提取剂;
100.b、将步骤a中得到的提取液过硅胶柱进行层析,经洗脱后得到千金藤素粗品;
101.其中,层析材料为有丙酯基修饰的十八烷基键合硅胶装填在吸附柱中;洗脱液为甲醇和添加甲酸的水溶液,其中添加甲酸的水溶液占的体积比例为10%。
102.c、将千金藤素粗品过0.45μm的膜后,经制备液相色谱进行纯化;
103.其中填料:bioseps-flashc18,20-45μm,
104.填装规格:50
×
250mm;
105.进样体积:500ml
106.洗脱液:甲醇:水=85:15(v/v)
107.洗脱流速:20倍柱体积/小时;
108.收集方式:紫外检测282nm;
109.d、将步骤c中得到的馏分经减压旋蒸除去甲醇,冷冻干燥,得37.4mg白色固体,即纯化千金藤素。
110.纯化检测,经lcms检测,纯化千金藤素样品纯度为98.5%。
111.综上所述,本发明分离的千金藤素纯度高,分离工艺简单可控,非常易于工业化生产的自动化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1