一种澄清处理的方法与流程
1.本发明一般涉及澄清处理的方法;具体地,涉及一种使用连续流离心机的澄清处理方法。
背景技术:
2.近年来,由于生物工程制药细胞培养相关技术的快速发展,生物反应器单位体积表达量逐步提高。单位体积表达量提高主要是通过提升单细胞表达量和提升细胞密度来实现的。高的细胞密度会导致发酵液固含量和浊度上升,这对于现有的固-液的分离技术是一个巨大的挑战,并会导致产品(例如,细胞表达的蛋白质)回收量的降低。如何提高细胞培养物澄清方法的产品回收量成为了当前的关注点。
3.目前常见的澄清处理方式是联用连续流离心与深层过滤,或者采用两级深层过滤来去除细胞及细胞碎片。对于常规的细胞培养液而言,这两种操作方式均能达到下游工艺对于澄清的要求。对于连续流离心与深层过滤联用的操作方式而言,一般先利用连续流离心去除细胞及大的细胞碎片,再利用深层过滤去除小的细胞碎片及部分可溶杂质。对于两级深层过滤的操作方式而言,一般先用大孔径的一级深层过滤器去除细胞及大的细胞碎片,再用与之串联的较小孔径的二级深层过滤器去除小细胞碎片,从而达到澄清的目的。两者相比,连续流离心与深层过滤联用的生产成本低于后者,成为进行生物大分子商业化生产的首选。
4.发现在对具有高固含量的待澄清物料(例如,细胞培养物)进行连续流离心澄清处理的过程中会造成较大产品损失。需要一种改进的处理待澄清物料的方法,其能够进一步提高制备纯化过程中的产品(例如,蛋白质产品)回收量。
技术实现要素:
5.发明人发现并提出了一种澄清处理的方法。采用本发明所述的方法,能够在对细胞培养物进行连续流离心澄清处理的过程中得到提高的产品(例如,蛋白质产品)回收量。
6.一方面,本文提供一种澄清处理待澄清物料的方法,其包括在使用连续流离心机对待澄清物料进行澄清处理的过程中,重复步骤(a)至(c):
7.(a)排渣前,将馈入物料从待澄清物料切换为清洗介质;
8.(b)排渣;和
9.(c)排渣后,将馈入物料从清洗介质切换为待澄清物料;
10.其中,步骤(a)至(c)重复至少两次。
11.另一方面,本文提供一种对细胞培养物进行分离纯化的方法,其包括:
12.(i)使用本文所述的澄清处理待澄清物料的方法对细胞培养物进行澄清处理,获得经澄清的细胞培养上清液;和
13.(ii)对步骤(i)获得的经澄清的细胞培养上清液进行进一步分离纯化。
14.另一方面,本文提供一种澄清处理待澄清物料的系统,其包括:
15.(a)连续流离心机,其具有:
16.待澄清物料馈入接口,其与待澄清物料储存容器流体连通;
17.一个或多个清洗介质馈入接口,其各自与清洗介质储存容器流体连通;
18.(b)一个或多个处理器;和
19.(c)存储器,其上存储有能被所述一个或多个处理器执行的指令;
20.其中,所述能被所述一个或多个处理器执行的指令配置为执行以下操作:重复步骤(i)至(iii):
21.(i)排渣前,停止待澄清物料的馈入,并由清洗介质储存容器向连续流离心机馈入清洗介质,由此将馈入物料从待澄清物料切换为清洗介质;
22.(ii)排渣;和
23.(iii)排渣后,停止清洗介质的馈入,并由待澄清物料储存容器向连续流离心机馈入待澄清物料,由此将馈入物料从清洗介质切换为待澄清物料;
24.其中,在澄清处理待澄清物料的过程中,步骤(i)至(iii)重复至少两次。
25.另一方面,本文提供一种计算机可读介质,其中存储有能被处理器执行以在连续流离心机上执行本文所述的澄清处理待澄清物质的方法的指令。
附图说明
26.下面结合附图对本发明作进一步说明,其中这些显示仅为了图示说明本发明的实施方案,而不是为了局限本发明的范围。
27.图1为根据本文所述方法的一个实施方式的示意性流程图。
28.图2为根据实施例2的深层过滤趋势图。
29.图3为根据实施例2的深层过滤趋势图。
30.图4为根据实施例3的深层过滤趋势图。
31.图5为根据实施例3的深层过滤趋势图。
32.图6为实施例1-3的排渣前3分钟淋洗实验组的回收量图表。
具体实施方式
33.本技术中科技术语的含意与本领域技术人员的普遍理解一致,除非另做说明。本技术中,“一”或其与各种量词的组合既包括单数含意也包括复数含意,除非特别说明。本技术中,对于同一参数或变量,当给出多个数值、数值范围、或其组合予以说明时,相当于具体揭示了这些数值、范围端值以及由它们任意组合而成的数值范围。本技术中,任一数值不论是否带有“约”之类的修饰词,一律涵盖本领域技术人员能够理解的约略范围,例如正负10%、5%等。本文中,每一“实施方式”均同等地指代且涵盖了本技术各项方法和各项系统的实施方式。本技术中,任意实施方式中一项或多项技术特征可以与任何一个或多个其他实施方式中的一项或多项技术特征自由组合,由此得到的实施方式同样属于本技术公开的内容。
34.分离机械是生物制品生产领域中使用的主要工序设备。连续流离心机(例如,碟片式连续流离心机)因其离心效率高,分离效果好,被广泛应用于大批量生物制品生产工艺流程中。它主要可以将固态颗粒物杂质从液体中有效且连续地分离出来,以得到所需的物质
成分。
35.碟片式连续流离心机能够快速连续地对固液和液液物料进行分离,是立式离心机的一种。碟片式连续流离心机具有安装在立轴上端的转鼓,通过传动装置由电动机驱动而高速旋转。转鼓内有一组互相套叠在一起的碟形零件——碟片。碟片与碟片之间留有很小的间隙。悬浮液(或乳浊液)由位于转鼓中心的进料管加入转鼓。当悬浮液(或乳浊液)流过碟片之间的间隙时,固体颗粒(或液滴)能够在离心机作用下沉降到碟片上,形成沉渣(或液层)。沉渣沿碟片表面滑动而脱离碟片并积聚在转鼓内直径最大的部位,分离后的液体从出液口排出转鼓。碟片的作用是缩短固体颗粒(或液滴)的沉降距离、扩大转鼓的沉降面积,转鼓中由于安装了碟片而大大提高了分离机的生产能力。积聚在转鼓内的固体可通过排渣装置在不停机的情况下以一定时间间隔从转鼓中排出。
36.发明人经长期研究发现,在碟片式连续流离心机运行中,排渣的频率与待澄清物料,例如,细胞培养物(例如,细胞收获液)的固含量正相关。细胞培养物的固含量越高,单位时间内排渣次数也越多。每一次排渣除细胞和细胞碎片等固体杂质被排出外,部分目标生物制品(例如,目标蛋白质)也会随之被排出,造成产品的损失。细胞培养物的固含量越高,产品的损失越多。
37.本文中,术语待澄清物料(例如,细胞培养物)的“固含量”指的是待澄清物料(例如,细胞培养物)中的固体占待澄清物料(例如,细胞培养物)的体积百分比。
38.为提高生物制品的制备纯化过程中的产品回收量,发明人经反复研究实践,提出一种改进的澄清处理的方法,其能够减低或避免连续流离心过程中因排渣造成的产品损失,提高产品回收量,并降低每克产品生产成本。
39.一方面,本文提供一种澄清处理的方法,其包括在使用连续流离心机对待澄清物料进行澄清处理的过程中,重复步骤(a)至(c):
40.(a)排渣前,将馈入物料从待澄清物料切换为清洗介质;
41.(b)排渣;和
42.(c)排渣后,将馈入物料从清洗介质切换为待澄清物料;
43.其中,步骤(a)至(c)重复至少两次。
44.本文中,所用术语“待澄清物料”通常指的是期望且适合通过连续流离心机进行固-液分离操作的物料。待澄清物料通常为固液混合物,其中,期望收集的物质优势存在于(例如,溶解于)液体部分中。换言之,预期期望收获的物质通过收集固-液分离后的液体部分而获得。
45.在一些实施方式中,待澄清物料是细胞培养物。本文中,所用术语“细胞培养物”指的是包含培养的细胞株的培养悬浮液。在一些情况中,希望分离纯化细胞培养物上清液中所含的生物制品(例如,细胞分泌蛋白质)。
46.在一些实施方式中,所述细胞培养物为选自下组的细胞的培养悬浮液:真核细胞、原核细胞,及其任意组合。在一些实施方式中,所述细胞培养物为选自下组的细胞的培养悬浮液:动物细胞、植物细胞、微生物细胞,及其任意组合。适宜的动物细胞可包括哺乳动物细胞(例如,人、非人灵长类动物、马、牛、绵羊、狗、猫和啮齿动物(例如,仓鼠)、禽细胞(例如,鸡、鸭和鹅)或昆虫细胞。适宜的哺乳动物细胞可包括cho细胞、hek293细胞、淋巴细胞或骨髓瘤细胞(例如,ns0细胞)。适宜的微生物细胞包括细菌细胞或真菌细胞(例如,酵母)。适宜
的酵母包括甲醇毕赤酵母、巴斯德毕赤酵母、酿酒酵母或普通面包酵母。适宜的昆虫细胞包括果蝇schnieder s2细胞和sf9细胞。在一些示例性实施方式中,所述细胞培养物可以是选自以下的细胞的培养悬浮液:cho细胞,ns0细胞,人源细胞(例如,原代人细胞),昆虫细胞,以及其它动物或微生物细胞。
47.本文中,所用术语“澄清操作”或“澄清处理”通常指的是液-固分离操作。
48.在一些实施方式中,澄清处理的离心力在4000g至20000g范围内,例如,在4000g至13000g、5000g至12000g、6000g至11000g或7000g至10000g范围内。
49.在一些实施方式中,澄清处理的离心转速在4000rpm至13000rpm,例如,5000rpm至10000rpm范围内。
50.在一些实施方式中,连续流离心机是碟片式连续流离心机。
51.本文中,所用术语“重复步骤(a)至(c)”指的是在整个澄清处理过程中(例如,从澄清处理开始至澄清处理完成以得到所需量的产物的过程中),进行至少两次步骤(a)至(c)的操作。应理解,前次步骤(a)至(c)操作的结束之后并非紧接后次步骤(a)至(c)操作的开始。前次步骤(c)与后次步骤(a)之间至少包括一段时间的澄清操作。在一些实施方式中,前次步骤(c)与后次步骤(a)之间所包括的一段时间的澄清操作自前次步骤(c)结束时开始,至积聚在转鼓内的沉渣达到需排出的量时结束,之后可按需执行后次步骤(a)至(c)操作或仅执行排渣操作。
52.在一些实施方式中,步骤(a)至(c)按以下顺序进行:(a)
→
(b)
→
(c)。
53.本文中,所用术语“排渣”指的是将连续流离心机的转鼓渣腔的内容物(例如沉渣)排出。在连续流离心机的运行过程中,待澄清物料(例如,细胞培养物)通过进料口流入转鼓,在碟片组中得到澄清。由于碟片组由大量相互叠加的锥形碟片组成,液体通过很窄的碟片间隔腔,被分成薄薄的液层,使得沉降位移降低到最小。经澄清的液体挤向转鼓中央,然后流向夹持器腔并经其排出。固体颗粒将得到加速而朝碟片下侧运动,向外流入渣腔。为了避免渣腔被完全充满,转鼓需要定期向外排渣。所分离的固体物料定期通过固体物料排出口向外排出。在排渣过程中,物料的进料可中断或不中断。
54.在一些实施方式中,步骤(a)中,于排渣前至少10秒的时刻,例如,于排渣前至少20秒、至少30秒、至少45秒、至少1分钟、至少1.5分钟、至少2分钟、至少3分钟、至少4分钟、至少5分钟、至少6分钟、至少7分钟或至少8分钟的时刻,将馈入物料从待澄清物料切换为清洗介质。在一些实施方式中,步骤(a)中,于排渣前10秒至10分钟的时刻,例如,于排渣前10秒、20秒、30秒、45秒、1分钟、1.5分钟、2分钟或3分钟,至5分钟、8分钟或10分钟的时刻,例如,于排渣前10秒至8分钟、10秒至5分钟、10秒至3分钟、10秒至2分钟、10秒至1分钟、20秒至8分钟、20秒至5分钟、20秒至3分钟、20秒至2分钟、20秒至1分钟、30秒至8分钟、30秒至5分钟、30秒至3分钟、30秒至2分钟、30秒至1.5分钟、30秒至1分钟、45秒至8分钟、45秒至5分钟、45秒至3分钟、45秒至2分钟、15秒至1分钟、1分钟至8分钟、1分钟至5分钟、1分钟至3分钟或1分钟至1.5分钟的时刻,将馈入物料从待澄清物料切换为清洗介质。
55.在一些实施方式中,步骤(a)中,于排渣前将馈入物料从待澄清物料切换为清洗介质,从而利用清洗介质对沉渣进行淋洗。在一些实施方式中,淋洗持续至少10秒、至少20秒、至少30秒、至少45秒、至少1分钟、至少1.5分钟、至少2分钟、至少3分钟、至少4分钟、至少5分钟、至少6分钟、至少7分钟或至少8分钟的时间长度。在一些实施方式中,淋洗持续10秒、20
秒、30秒、45秒、1分钟、1.5分钟、2分钟或3分钟,至5分钟、8分钟或10分钟的时间长度,例如,淋洗持续10秒至8分钟、10秒至5分钟、10秒至3分钟、10秒至2分钟、10秒至1分钟、20秒至8分钟、20秒至5分钟、20秒至3分钟、20秒至2分钟、20秒至1分钟、30秒至8分钟、30秒至5分钟、30秒至3分钟、30秒至2分钟、30秒至1.5分钟、30秒至1分钟、45秒至8分钟、45秒至5分钟、45秒至3分钟、45秒至2分钟、15秒至1分钟、1分钟至8分钟、1分钟至5分钟、1分钟至3分钟或1分钟至1.5分钟的时间长度。
56.在一些实施方式中,在积聚于转鼓内的沉渣达到需排出的量时进行(b)排渣。对于具体的待澄清物料,在一些实施方式中,可按需设定积聚于转鼓内的沉渣的“需排出的量”,和/或,可按需设定排渣周期的时间长度,以针对具体的待澄清物料进一步优化本文所述方法的淋洗效果。
57.在一些实施方式中,在(b)排渣完成时进行步骤(c),即,将馈入物料从清洗介质切换为待澄清物料。
58.在一些实施方式中,步骤(a)至(c)重复至少两次,例如,至少三次、至少四次、至少五次、至少六次、至少七次、至少八次、至少九次或至少十次。在一些实施方式中,步骤(a)至(c)重复直至所需的澄清处理完成。在一些实施方式中,步骤(a)至(c)自澄清处理起始时即开始重复,也即,澄清处理过程中的首次排渣即进行步骤(a)至(c)的操作。在一些实施方式中,步骤(a)至(c)重复在整个澄清处理过程中持续,也即,在澄清处理过程中的每次排渣时均进行步骤(a)至(c)的操作。在一些实施方式中,可按需设置步骤(a)至(c)重复在整个澄清处理过程中的一个或多个开始时刻和一个或多个结束时刻,也即,可按需在澄清处理过程中的两次或更多次排渣时进行步骤(a)至(c)的操作。
59.在一些实施方式中,清洗介质可选自下组:水(例如,蒸馏水、纯化水、注射用水等)、细胞培养基(例如,新鲜培养基或用过的培养基)、缓冲液(例如,pbs),及其任意组合。
60.在一些实施方式中,物料的馈入速度在10至12000l/h范围内,例如,20至10000l/h、30至8000l/h、40至5000l/h、50至2000l/h、50至1000l/h、50至200l/h、60至180l/h、70至150l/h、80至120l/h或90至120l/h范围内。
61.在待澄清物料为细胞培养物的一些实施方式中,细胞培养物中所含活细胞密度在5
×
105至1
×
108个细胞/ml范围内,例如,在1
×
106至2.5
×
107个细胞/ml或1
×
106至2
×
107个细胞/ml范围内。
62.在待澄清物料为细胞培养物的一些实施方式中,细胞培养物中所含细胞活率在5%至95%范围内,例如,在5%至90%,5%至80%,5%至70%,5%至60%,5%至50%,5%至40%或5%至30%范围内,以细胞培养物中所含全部细胞数量为100%计。
63.在待澄清物料为细胞培养物的一些实施方式中,细胞培养物的浊度大于1000ntu,例如,大于1200ntu,大于1500ntu,大于1800ntu,大于2000ntu,大于2500ntu,大于3000ntu,大于3500ntu,大于4000ntu,大于5000ntu,大于6000ntu,大于7000ntu,大于8000ntu,大于9000ntu,大于10000ntu,大于12000ntu,大于14000ntu,大于16000ntu,大于18000ntu,或大于20000ntu。
64.在一些实施方式中,重复步骤(a)至(c)的操作手动或自动化进行。例如,可通过改进连续流离心机设备(如添加清洗介质馈入接口)与操作系统(如设置按需重复执行步骤(a)至(c)的指令的程序)来实现操作自动化。
65.在一些实施方式中,重复步骤(a)至(c)的操作可手动进行。
66.本文提供的处理待澄清物料(例如,细胞培养物)的方法能够显著降低或避免排渣(尤其是因固含量高而频繁排渣)造成的产品损失,提高产品回收量,并降低每克产品的生产成本。
67.另一方面,本文提供一种对细胞培养物进行分离纯化的方法,其包括:
68.(i)使用本文所述的澄清处理待澄清物料的方法对细胞培养物进行澄清处理,获得经澄清的细胞培养上清液;和
69.(ii)对步骤(i)获得的经澄清的细胞培养上清液进行进一步分离纯化。
70.在一些实施方式中,所述进一步分离纯化包括对经澄清的细胞培养上清液进行一次或多次深层过滤。
71.本文中,所用术语“深层过滤”指的是利用多孔介质从流动相中截留杂质颗粒(而不是表面截留)的操作。深层过滤一般应用介质层较厚的滤床类(如沙层、硅藻土等)作为过滤介质。尺寸小于介质孔道直径的杂质颗粒不能在过滤介质表面形成滤饼,这些杂质颗粒可以进入介质内部,借惯性和扩散作用趋近孔道壁面,并在静电和表面力的作用下沉积下来,从而与流体分离。
72.另一方面,本文提供一种用于澄清处理待澄清物料的连续流离心机,其包括:
73.待澄清物料馈入接口,其与待澄清物料储存容器流体连通;和
74.一个或多个清洗介质馈入接口,其各自与清洗介质储存容器流体连通。
75.在一些实施方式中,本文所述的连续流离心机用于本文所述的澄清处理的方法。
76.另一方面,本文提供一种澄清处理待澄清物料的系统,其包括:
77.(a)连续流离心机,其具有:
78.待澄清物料馈入接口,其与待澄清物料储存容器流体连通;
79.一个或多个清洗介质馈入接口,其各自与清洗介质储存容器流体连通;
80.(b)一个或多个处理器;和
81.(c)存储器,其上存储有能被所述一个或多个处理器执行的指令;
82.其中,所述能被所述一个或多个处理器执行的指令配置为执行以下操作:重复步骤(i)至(iii):
83.(i)排渣前,停止待澄清物料的馈入,并由清洗介质储存容器向连续流离心机馈入清洗介质,由此将馈入物料从待澄清物料切换为清洗介质;
84.(ii)排渣;和
85.(iii)排渣后,停止清洗介质的馈入,并由待澄清物料储存容器向连续流离心机馈入待澄清物料,由此将馈入物料从清洗介质切换为待澄清物料;
86.其中,在澄清处理待澄清物料的过程中,步骤(i)至(iii)重复至少两次。
87.在一些实施方式中,待澄清物料是固液混合物。
88.在一些实施方式中,待澄清物料是细胞培养物。
89.在一些实施方式中,所述细胞培养物为选自下组的细胞的培养悬浮液:真核细胞、原核细胞,及其任意组合。在一些实施方式中,所述细胞培养物为选自下组的细胞的培养悬浮液:动物细胞、植物细胞、微生物细胞,及其任意组合。适宜的动物细胞可包括哺乳动物细胞(例如,人、非人灵长类动物、马、牛、绵羊、狗、猫和啮齿动物(例如,仓鼠)、禽细胞(例如,
鸡、鸭和鹅)或昆虫细胞。适宜的哺乳动物细胞可包括cho细胞、hek293细胞、淋巴细胞或骨髓瘤细胞(例如,ns0细胞)。适宜的微生物细胞包括细菌细胞或真菌细胞(例如,酵母)。适宜的酵母包括甲醇毕赤酵母、巴斯德毕赤酵母、酿酒酵母或普通面包酵母。适宜的昆虫细胞包括果蝇schnieder s2细胞和sf9细胞。在一些示例性实施方式中,所述细胞培养物可以是选自以下的细胞的培养悬浮液:cho细胞,ns0细胞,人源细胞(例如,原代人细胞),昆虫细胞,以及其它动物或微生物细胞。
90.在一些实施方式中,澄清处理的离心力在4000g至20000g范围内,例如,在4000g至13000g、5000g至12000g、6000g至11000g或7000g至10000g范围内。
91.在一些实施方式中,澄清处理的离心转速在4000rpm至13000rpm,例如,5000rpm至10000rpm范围内。
92.在一些实施方式中,连续流离心机是碟片式连续流离心机。
93.本文中,所用术语“重复步骤(i)至(iii)”指的是在整个澄清处理过程中(例如,从澄清处理开始至澄清处理完成以得到所需量的产物的过程中),进行至少两次步骤(i)至(iii)的操作。应理解,前次步骤(i)至(iii)操作的结束之后并非紧接后次步骤(i)至(iii)操作的开始。前次步骤(iii)与后次步骤(i)之间至少包括一段时间的澄清操作。在一些实施方式中,前次步骤(iii)与后次步骤(i)之间所包括的一段时间的澄清操作自前次步骤(iii)结束时开始,至积聚在转鼓内的沉渣达到需排出的量时结束,之后可按需执行后次步骤(i)至(iii)操作或仅执行排渣操作。
94.在一些实施方式中,步骤(i)至(iii)按以下顺序进行:(i)
→
(ii)
→
(iii)。
95.在一些实施方式中,步骤(i)中,于排渣前至少10秒的时刻,例如,于排渣前至少20秒、至少30秒、至少45秒、至少1分钟、至少1.5分钟、至少2分钟、至少3分钟、至少4分钟、至少5分钟、至少6分钟、至少7分钟或至少8分钟的时刻,将馈入物料从待澄清物料切换为清洗介质。在一些实施方式中,步骤(i)中,于排渣前10秒至10分钟的时刻,例如,于排渣前10秒、20秒、30秒、45秒、1分钟、1.5分钟、2分钟或3分钟,至5分钟、8分钟或10分钟的时刻,例如,于排渣前10秒至8分钟、10秒至5分钟、10秒至3分钟、10秒至2分钟、10秒至1分钟、20秒至8分钟、20秒至5分钟、20秒至3分钟、20秒至2分钟、20秒至1分钟、30秒至8分钟、30秒至5分钟、30秒至3分钟、30秒至2分钟、30秒至1.5分钟、30秒至1分钟、45秒至8分钟、45秒至5分钟、45秒至3分钟、45秒至2分钟、15秒至1分钟、1分钟至8分钟、1分钟至5分钟、1分钟至3分钟或1分钟至1.5分钟的,将馈入物料从待澄清物料切换为清洗介质。
96.在一些实施方式中,步骤(i)中,于排渣前将馈入物料从待澄清物料切换为清洗介质,从而利用清洗介质对沉渣进行淋洗。在一些实施方式中,淋洗持续至少10秒、至少20秒、至少30秒、至少45秒、至少1分钟、至少1.5分钟、至少2分钟、至少3分钟、至少4分钟、至少5分钟、至少6分钟、至少7分钟或至少8分钟的时间长度。在一些实施方式中,淋洗持续10秒、20秒、30秒、45秒、1分钟、1.5分钟、2分钟或3分钟,至5分钟、8分钟或10分钟的时间长度,例如,淋洗持续10秒至8分钟、10秒至5分钟、10秒至3分钟、10秒至2分钟、10秒至1分钟、20秒至8分钟、20秒至5分钟、20秒至3分钟、20秒至2分钟、20秒至1分钟、30秒至8分钟、30秒至5分钟、30秒至3分钟、30秒至2分钟、30秒至1.5分钟、30秒至1分钟、45秒至8分钟、45秒至5分钟、45秒至3分钟、45秒至2分钟、15秒至1分钟、1分钟至8分钟、1分钟至5分钟、1分钟至3分钟或1分钟至1.5分钟的时间长度。
laval公司。
110.实施例1
111.本实施例采用的连续流离心参数是:进料速度90l/h,离心力设定为9500g。使用的料液是cho细胞的培养液,活细胞密度是14.01
×
106个细胞/ml,细胞活率是73.3%,固含量是7.9%,浊度是2940ntu。目标蛋白质的细胞培养物表达量为1.022g/l。
112.取三份等体积细胞培养物,一份作为对照实验,剩余两份在连续流离心排渣前进行馈入物料的切换操作(参见图1)。具体操作为:关闭清洗介质管道上的管夹,开启发酵液储液罐上连接的管夹,经过离心一段时间后,关闭发酵液储液罐上连接的管夹,开启清洗介质(缓冲液)管道上的管夹,使清洗介质经过连续流离心内。第一份排渣前淋洗3分钟,第二份排渣前淋洗8分钟。
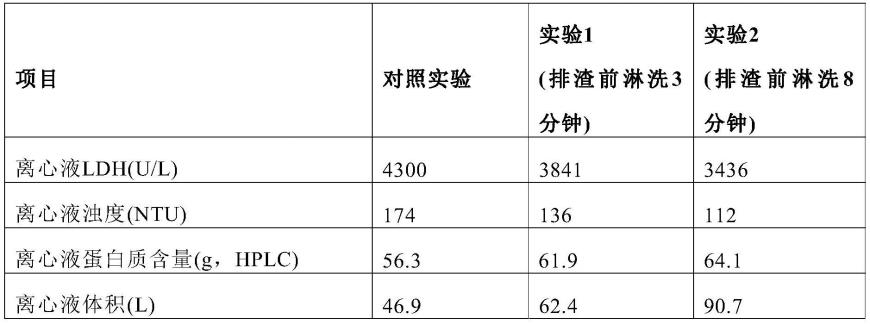
113.分别测定连续流离心后的产品浊度,乳酸脱氢酶(ldh)以及蛋白质的量。结果见表1。与对照相比,相同上样条件的情况下,收集到的蛋白质的量从56.3g分别增加至61.9g(3分钟,与对照回收量比,提高了9.95%)和64.1g(8分钟,与对照回收量比,提高了13.85%)。系统误差为约3%。
114.采用本文所述的处理细胞培养物的方法提高了离心液的蛋白质回收量。由于该方法适量增加了离心液体积,使得离心液浊度和ldh浓度有所降低。
115.表1.实施例1处理产品检测结果
[0116][0117]
实施例2
[0118]
本实施例采用的连续流离心参数是:进料速度120l/h,离心力设定为9000g。使用的料液是cho细胞的培养液,活细胞密度是1.35
×
106个细胞/ml,细胞活率是3.5%,固含量是12.5%,浊度是1508ntu。目标蛋白质的细胞培养物表达量为1.14g/l。
[0119]
取三份等体积细胞培养物,一份作为对照实验,剩余两份在连续流离心排渣前进行馈入物料的切换操作。具体操作为:关闭清洗介质管道上的管夹,开启发酵液储液罐上连接的管夹,经过离心一段时间后,关闭发酵液储液罐上连接的管夹,开启清洗介质(缓冲液)管道上的管夹,使清洗介质经过连续流离心内。第一份排渣前淋洗3分钟,第二份排渣前淋洗5分钟。
[0120]
分别测定连续流离心后的产品浊度,ldh以及蛋白质的量。具体数据见表2。与对照相比,相同上样条件的情况下,收集到的蛋白质的量从14.7g分别增加至19.4g(3分钟,与对照回收量比,提高了31.97%)和18.7g(5分钟,与对照回收量比,提高了27.21%)。系统误差为约3%。
[0121]
采用本文所述的处理细胞培养物的方法提高了离心液的蛋白质回收量。由于该方法适量增加了离心液体积,使得离心液浊度和ldh浓度有所降低。
[0122]
此外对本文所述的处理细胞培养物的方法对后续深层过滤的影响也进行了考察,结果见图2和图3。结果显示本文所述的处理细胞培养物的方法对深层过滤的载量没有负面影响。
[0123]
表2.实施例2处理产品检测结果
[0124][0125]
实施例3
[0126]
本实施例采用的连续流离心参数是:进料速度100l/h,离心力设定为9500g。采用的是cho细胞的培养液,活细胞密度是19.21
×
106个细胞/ml,细胞活率是37.7%,固含量是30%,浊度是183750ntu。目标蛋白质的细胞培养物表达量为0.239g/l。
[0127]
取三份等体积细胞培养物,一份作为对照实验,剩余三份在连续流离心排渣前进行馈入物料的切换操作。具体操作为:关闭清洗介质管道上的管夹,开启发酵液储液罐上连接的管夹,经过离心一段时间后,关闭发酵液储液罐上连接的管夹,开启清洗介质(缓冲液)管道上的管夹,使清洗介质经过连续流离心内。第一份排渣前淋洗1分钟,第二份排渣前淋洗2分钟,第三份排渣前淋洗3分钟。
[0128]
分别测定连续流离心后的产品浊度,ldh以及蛋白质的量。具体数据见表3。与对照相比,相同上样条件的情况下,收集到的蛋白质的量从0.86g分别增加至1.30g(1分钟,与对照回收量比,提高了51.16%),1.30g(2分钟,与对照回收量比,提高了51.16%)和1.38g(3分钟,与对照回收量比,提高了60.47%)。系统误差为约3%。
[0129]
采用本文所述的处理细胞培养物的方法提高了离心液的蛋白质回收量。由于该方法适量增加了离心液体积,使得离心液浊度和ldh浓度有所降低。
[0130]
此外对本文所述的处理细胞培养物的方法对后续深层过滤的影响也进行了考察,结果见图4和图5。结果显示本文所述的处理细胞培养物的方法对深层过滤的载量没有负面影响。
[0131]
表3.实施例3处理产品检测结果
[0132][0133]
由上述实施例可见,采用本文所述的处理细胞培养物的方法能够显著降低或避免排渣(尤其是因固含量高而频繁排渣)造成的产品损失,提高了蛋白质回收量,并且降低了每克产品的生产成本。并且,采用本文所述的处理细胞培养物的方法对后续深层过滤质量载量没有负面影响。
[0134]
进一步地,采用本文所述的方法处理的细胞培养物固含量越高,能够获得回收量提高的幅度越大。如图6所示,在排渣前3分钟处理情况中,相比实施例1(固含量7.9%)获得的回收量,相对于对照提高了9.95%的回收量,实施例2(固含量12.5%)获得的回收量,相对于对照提高了31.97%的回收量,而实施例3(固含量30%)获得的回收量,相对于对照提高了60.47%的回收量。
[0135]
对排渣前淋洗时长的研究结果显示,实施例1在排渣前淋洗约时间从3增至8分钟时,实施例2在排渣前淋洗约时间从3增至5分钟时,实施例3在排渣前淋洗约时间从1增至3分钟时,回收量没有显著提高,表明1分钟淋洗时间基本足够,并可能能够进一步降低,例如降低至半分钟或15秒淋洗时间。
[0136]
上述各实施例仅为本发明的较佳示例性实施例而已,并不用以限定本发明的保护范围。凡在本发明的精神和原则之内,所做的任何修改,等同替换、改进等,皆应包含在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1