一种细胞电转染缓冲液及制备方法、使用方法与流程
1.本方案属于生物技术领域,具体为基因输送技术转染介质及其制备方法,详细涉及一种细胞电转染缓冲液及其制备方法、使用方法。
背景技术:
2.电转染或电穿孔是微生物学技术,其中将电场施加到细胞以增加细胞膜的渗透性,从而允许化学品,药物或dna被引入细胞。在ipsc细胞电转过程中,由于购买的试剂盒较昂贵,且研发人员在实验过程中发现购买的电转的细胞数量与阳性率可进一步提高,针对上述问题,本技术人研制出一种电转buffer。
3.本方案中缓冲液使用了由kcl、mgcl2、nah2po4/na2hpo4等构成进行电转,可以达到同等甚至更高的电转效率甚,细胞活率增加,同时也减少了电转实验的成本。在本方案的设计中,通过母液中nah2po4/na2hpo4与其他试剂组分的浓度设置,使其nah2po4/na2hpo4的终浓度为0.075-0.095mol/l,从而使细胞处于渗透压在240mosm-270mosm的环境中。在细胞内外液之间保持着一个平衡状态,而一方出现异常,将会打破内环境的稳态,对测试结果就会产生不利影响。渗透压是调节细胞内外体液环境稳定的重要因素,其高低变化可以直接影响机体的生理功能和代谢活动,因此对于试剂技术人员来说,配液过程中及时考虑每个试剂本身对渗透压的影响。及其通过母液中pluronic f-68的添加使得ipsc细胞的电转后的活量与阳性表达相对于现有技术效果更好。
技术实现要素:
4.本发明中的nah2po4与na2hpo4可以相互替换,琥珀酸钠与nacl可以相互替换。为了实现上述中的渗透压维持在240-270mosm之间,使用如下技术方案:
5.一种细胞电转染缓冲液,所述缓冲液包括如下成分:所述缓冲液由如下浓度的母液配制而成:0.2-0.25mol/l海藻糖、0.2-0.4mol/l琥珀酸钠或是nacl、0.04-0.05mol/l kcl、0.1-0.15mol/l mgcl2、1.4-1.5mol/l nah2po4,以及质量分数为10%的pluronic f-68,其余为蒸馏水加至10ml。
6.进一步改进在于,添加1ml的海藻糖、1ml的琥珀酸钠或是nacl、1ml的kcl、1ml的mgcl
2、
0.5ml的nah2po4,及其0.01ml-0.05ml的10%的pluronic f-68母液,补充蒸馏水至10ml。使其最后终浓度为0.02-0.025mol/l海藻糖、0.02-0.04mol/l琥珀酸钠或是nacl、0.004-0.005mol/l kcl、0.01-0.015mol/l mgcl2、0.07-0.075mol/l nah2po4,以及质量分数为0.01%-0.05%的pluronic f-68,其余为蒸馏水。
7.本方案的进一步改进在于,所述细胞处于渗透浓度在240-270mosm的环境中,更优选在250-260mosm。
8.本方案还公开了一种缓冲液的制备方法,其特征在于,包括以下步骤:
9.1)配制母液;
10.2)体积用量:取1ml的海藻糖、1ml的琥珀酸钠或是nacl、1ml的kcl、1ml的mgcl
2、
0.5ml的nah2po4母液加入至ep管内,添加0.01ml-0.05ml的10%的pluronic f-68母液;
11.3)使用hcl或naoh微调ph值,使其达到7.30-7.35,优选的为7.31。
12.4)补充蒸馏水至10ml,混匀。
13.本方案的进一步改进在于,所述缓冲液适用于人多能干细胞,包括人ipsc细胞和人esc细胞的电转染。
14.本方案还公开一种缓冲液的使用方法,所述缓冲液用于电转人ipsc或人esc时,质粒量(单位:微克)和细胞数(单位:百万)的比值为1:1,使用的电转程序为lonza b-106。
15.使用时,保证所述细胞设置为细胞悬液,先将缓冲液吸入至质粒管中,二者混匀后转移至细胞细胞悬液内,三者混匀。
16.本发明相对于现有技术具有如下的优点在于:
17.其一.使用本方案中的电转液在电转后的细胞活率较高,其细胞的活量均比买购买的电转buffer要高,并且做了多次平行实验,都能实现较高细胞活量的技术效果;
18.其二.通过本方案的电转buffer其阳性表达在70%在添加了质量分数为10%的pluronic f-68后期阳性表达可达80%左右,并且相同多组实施例中的阳性表达均是高于对比例2中的阳性表达,说明本发明中的电转液是优于现有技术。
19.其三.购买的ipsc细胞电转液的金额约在200左右,本方案中配制的电转液试剂成本约在20左右,可节省大量成本,并且在技术效果方案较稳定,可同时提高细胞的存活量与阳性电转率。
附图说明
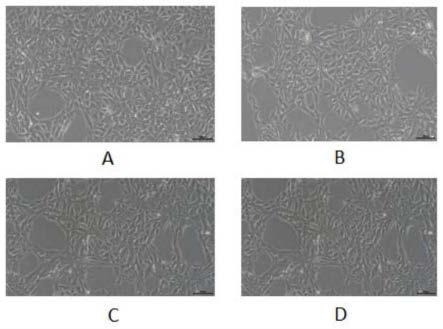
20.附图1为本发明缓冲液与对比液在电转完day1细胞形态图;其中,图a为本发明实施例1中的缓冲液电转后的细胞形态图;图b为本发明实施例2中的缓冲液电转后的细胞形态图;图c为本发明实施例3中的缓冲液电转后的细胞形态图;图d为(对比例2)购买的kit电转后的细胞形态图;
21.附图2为本发明缓冲液与对比液在电转完day2细胞形态图;其中,图a为本发明实施例1中的缓冲液电转后的细胞形态图;图b为本发明实施例2中的缓冲液电转后的细胞形态图;图c为本发明实施例3中的缓冲液电转后的细胞形态图;图d为(对比例2)购买的kit电转后的细胞形态图;
22.附图3分别为本发明缓冲液与对比例在电转完day1、day2的活细胞数(m)比较;
23.附图4为本发明缓冲液与对比液在电转完day2流式图;图a为本发明实施例1中的流式细胞术检测瞬时转染gfp阳性标记的流式图;图b为本发明实施例2中的流式细胞术检测瞬时转染gfp阳性标记的流式图;图c为本发明实施例3中的流式细胞术检测瞬时转染gfp阳性标记的流式图;其中,图d为购买的kit流式细胞术检测瞬时转染gfp阳性标记的流式图;
24.附图5为day2天后的阳性标记流式图(%);其中图a为实施例1-1的流式图、图b为实施例2-1的流式图;
25.附图6为的day1和day2的实施例1-1、2-1活细胞数的细胞形态图;图a为实施例为day1的实施例1-1的形态图,图b为day1的实施例2-1的形态图;图c为实施例day2的实施例1-1形态图,图d为day2的实施例2-1形态图。
具体实施方式
26.在阅读了该描述之后,对于本领域技术人员而言,如何实现多种替代实施方式和替代应用将变得显而易见。然而,本文未描述所有实施方式。将被理解的是,在此呈现的实施方式仅是示例性的,而非限制性的。因此,对多种替代实施方式的详细描述不应被理解为对本文公开内容的范围或广度的限制。将被理解的是,以下描述的方面不限于特定的组合物,制备这样的组合物的方法或其用途,因为这些当然是可变的。
27.如本领域技术人员还将理解的,所有语言,例如“至多”、“至少”、“大于”、“小于”等,均包括所列举的数字,并且指代可随后被细分为上文所讨论的子范围的范围。最后,如本领域技术人员将理解的,所述范围包括每个单独的成分。还将被理解的是,尽管并没有总是被明确指出,本文所述的试剂仅是示例性的,并且其等同物是本领域已知的。
[0028]“任选的”或“任选地”意为随后描述的事件或情况能或不能发生,并且该描述包括所述事件或情况发生的实例以及所述事件或情况没有发生的实例。
[0029]
实施例
[0030]
对比液指的是购买的lonza电转试剂盒里的kit电转缓冲液,本发明中的电转缓冲液与对比液采用相同方法与条件下进行电转验证。每一组实验中,初始铺板ipsc细胞数量均为2million。
[0031]
实施例1
[0032]
本方案中的电转缓冲液设3组平行实验,并设立阴性对照组与购买的试剂盒中的缓冲液的两组数据作为对比实验。所述细胞处于渗透压240-270mosm的环境中,更优选在250-260mosm。所述缓冲液的ph值为7.30-7.35,优选7.31。
[0033]
在生物安全柜内,每一组进行依次实验,每个试验组依次进行电转,不可同时进行。具体如下:
[0034]
称取1ml的海藻糖、1ml的琥珀酸钠或是nacl、1ml的kcl、1ml的mgcl2、0.5ml的nah2po4或是na2hpo4,其余为蒸馏水加至10ml。其中,母液中各个组分的浓度分别是0.2mol/l海藻糖、0.2mol/l琥珀酸钠或是nacl、0.04mol/l kcl、0.1mol/l mgcl2、1.4mol/l nah2po4或na2hpo4。
[0035]
电转质粒的制备:取无菌ep管,向管中分别加入2μg gfp,记为实验组1。收集ipsc细胞:培养箱中取出细胞,在生物安全柜中将细胞消化,300g,离心5分钟,弃上清,加入1ml dpbs,轻轻吹打混匀10次,将细胞团块打散,获得单细胞悬液,通过dpbs稀释和台盼蓝染色后手动计数,配制所需的细胞悬液。向管中分别加入细胞悬液,离心5秒钟,弃上清,备用。
[0036]
将ipsc细胞、质粒和缓冲液组合混匀:将管中的100μl电转缓冲液吸至质粒管中,吹打3-5次混匀后全部转移至细胞管的底部,电转。生物安全柜内,每一组进行依次实验,每个试验组依次进行电转,不可同时进行。
[0037]
在电转24及48小时后,离心收集细胞,检测活细胞数,结果见图1-3;电转48h小时后,采用流式细胞术检测瞬时转染gfp阳性标记,结果见图4。
[0038]
实施例2
[0039]
取1ml的海藻糖、1ml的琥珀酸钠或是nacl、1ml的kcl、1ml的mgcl2、0.5ml的nah2po4或是na2hpo4,其余为蒸馏水加至10ml。其中,母液中各个组分的浓度分别是0.22mol/l海藻糖、0.3mol/l琥珀酸钠或是nacl、0.045mol/l kcl、0.12mol/l mgcl2、1.45mol/l nah2po4或
na2hpo4。
[0040]
电转质粒的制备:取无菌ep管,向管中分别加入2μg gfp,记为实验组2。收集ipsc细胞:培养箱中取出细胞,在生物安全柜中将细胞消化,300g,离心5分钟,弃上清,加入1ml dpbs,轻轻吹打混匀10次,将细胞团块打散,获得单细胞悬液,通过dpbs稀释和台盼蓝染色后手动计数,配制所需的细胞悬液。向管中分别加入细胞悬液,离心5秒钟,弃上清,备用。
[0041]
将ipsc细胞、质粒和缓冲液组合混匀:将管中的100μl电转缓冲液吸至质粒管中,吹打3-5次混匀后全部转移至细胞管的底部,电转。生物安全柜内,每一组进行依次实验,每个试验组依次进行电转,不可同时进行。
[0042]
在电转24及48小时后,离心收集细胞,检测活细胞数,结果见图1-3;电转48h小时后,采用流式细胞术检测瞬时转染gfp阳性标记,结果见图4。
[0043]
实施例3
[0044]
取1ml的海藻糖、1ml的琥珀酸钠或是nacl、1ml的kcl、1ml的mgcl2、0.5ml的nah2po4或是na2hpo4,其余为蒸馏水加至10ml。其中,母液中各个组分的浓度分别是0.25mol/l海藻糖、0.4mol/l琥珀酸钠或是nacl、0.05mol/l kcl、0.15mol/l mgcl2、1.5mol/l nah2po4或na2hpo4。
[0045]
电转质粒的制备:取无菌ep管,向管中分别加入2μggfp,记为实验组3。收集ipsc细胞:培养箱中取出细胞,在生物安全柜中将细胞消化,300g,离心5分钟,弃上清,加入1ml dpbs,轻轻吹打混匀10次,将细胞团块打散,获得单细胞悬液,通过dpbs稀释和台盼蓝染色后手动计数,配制所需的细胞悬液。向管中分别加入细胞悬液,离心5秒钟,弃上清,备用。
[0046]
将ipsc细胞、质粒和缓冲液组合混匀:将管中的100μl电转缓冲液吸至质粒管中,吹打3-5次混匀后全部转移至细胞管的底部,电转。
[0047]
在电转24及48h后,离心收集细胞,检测活细胞数,结果见图1-3;电转48h后,采用流式细胞术检测瞬时转染gfp阳性标记,结果见图4。
[0048]
对比例
[0049]
使用的商业购买品牌为lonza的kit细胞转染试剂盒里的电转液(后面简称为kit)。电转质粒的制备:取无菌ep管,向管中分别加入2μg gfp,记为对照组2。收集ipsc细胞:培养箱中取出细胞,在生物安全柜中将细胞消化,300g,离心5分钟,弃上清,加入1ml dpbs,轻轻吹打混匀10次,将细胞团块打散,获得单细胞悬液,通过dpbs稀释和台盼蓝染色后手动计数,配制所需的细胞悬液。向管中分别加入细胞悬液,离心5秒钟,弃上清,备用。
[0050]
将人ipsc细胞、质粒和kit组合混匀:将管中的100μl电转缓冲液吸至质粒管中,吹打3-5次混匀后全部转移至细胞管的底部,电转。
[0051]
在电转24及48h后,离心收集细胞,检测活细胞数,结果见图1-3;电转48h后,采用流式细胞术检测瞬时转染gfp阳性标记,结果见图4。
[0052]
本方案在实验阶段还设阴性对照组,即采用实施例1中的电转缓冲液的组分及浓度,区别是阴性对照组不加电转质粒gfp。其他条件均不变,电转48h后,采用流式细胞术检测瞬时转染gfp阳性标记,不表达。
[0053]
实施例1-1
[0054]
与实施例1条件设置相同,仅是在实施1的母液中添加0.01ml的质量分数为10%的pluronic f-68。即:称取1ml的海藻糖、1ml的琥珀酸钠或是nacl、1ml的kcl、1ml的mgcl2、
0.5ml的nah2po4或是na2hpo4、0.01ml的pluronic f-68母液,其余为蒸馏水加至10ml。其中,母液中各个组分的浓度分别是0.2mol/l海藻糖、0.2mol/l琥珀酸钠或是nacl、0.04mol/l kcl、0.1mol/l mgcl2、1.4mol/l nah2po4或na2hpo4,以及质量分数为10%的pluronic f-68。
[0055]
其他条件均不变,同样是检测在电转24及48小时后,离心收集细胞,检测活细胞数,结果见图6;电转48h小时后,采用流式细胞术检测瞬时转染gfp阳性标记,结果见图5。
[0056]
实施例2-1
[0057]
与实施例2相同设置,仅在实施2中添加0.03ml的质量分数为10%的pluronic f-68母液。即取1ml的海藻糖、1ml的琥珀酸钠或是nacl、1ml的kcl、1ml的mgcl2、0.5ml的nah2po4或是na2hpo4、0.05ml的pluronic f-68母液,其余为蒸馏水加至10ml。其中,母液中各个组分的浓度分别是0.22mol/l海藻糖、0.3mol/l琥珀酸钠或是nacl、0.045mol/l kcl、0.12mol/l mgcl2、1.45mol/l nah2po4或na2hpo4及其10%的pluronic f-68母液。
[0058]
其他条件均不变,检测在电转24及48小时后,离心收集细胞,检测活细胞数,结果见图6;电转48h小时后,采用流式细胞术检测瞬时转染gfp阳性标记,结果见图5。
[0059]
数据效果评价
[0060]
检测电转完day1、day2天后的细胞的存活数量(m)如表1。
[0061]
表1.细胞活量检测(m)
[0062][0063]
通过图1-3、表1的分析对比可知,按照本发明中的电转缓冲液可实现电转完day1天的ipsc细胞电转的数量在1.48m以上,最优可达到1.87m,而使用购买的实施例中的电转液在相同条件下活细胞数在1.18m左右,相对于对比例2中的活细胞数量高出了1.6倍左右。
[0064]
进一步通过分析可知,在缓冲液中添加了质量分数为10%的pluronic f-68母液后数据分析可知,电转完day1后ipsc细胞电转的数量分别在同等条件下高出10%左右,即day1、day2中实施例1-1的细胞数量分别是实施例1的细胞数量又高出10%左右,同样检测可知,即day1、day2中实施例2-1的细胞数量分别是实施例2的细胞数量又高出10%左右。进而比对比例中的细胞数量更高的多。
[0065]
按照本发明中的电转缓冲液可实现电转完day2天的ipsc细胞电转的数量在4.06m以上,实施例1-3中最优可达到5.2m,而使用购买的对比例中的电转液在相同条件下活细胞数在3.2m左右,相对于对比例2中的活细胞数量高出了1.63倍左右。
[0066]
不论在电转完day1或者day2后,其使用本发明中的电转液的活细胞数均是高于对比例中的活细胞数。并且相对于购买的电转液在成本价格上也大大降低,节约成本。
[0067]
同样,进一步通过分析可知,电转完day2后在缓冲液中添加了质量分数为10%的pluronic f-68母液后数据分析可知,其ipsc细胞电转的数量分别在同等条件下高出8%左右。进而比对比例中的细胞数量高的多.
[0068]
并且通过分析附图3可知,day2的细胞数量高于day1的细胞数量。
[0069]
电转完day2天后的阳性标记图表(%),如下表2
[0070]
表2
[0071][0072]
按照本发明中的电转缓冲液可实现电转完day2天的ipsc天后的阳性标记在73.5%以上,最高可达到77.28%,相对于购买的电转buffer高出了41.6%左右。
[0073]
使用本方案中的电转液在电转后的细胞活率较高,其细胞的活量均比买购买的电转buffer要高,并且做了多次平行实验,都能实现较高细胞活量的技术效果;
[0074]
通过本方案的电转buffer其阳性表达在73.5%以上,并且相同实施例1-3组实施例中的阳性表达均是高于对比例中的阳性表达,说明本发明中的电转液是优于现有技术的。购买的ipsc细胞电转液相对于现有技术可节省大量成本的同时可提高细胞的存活量与阳性电转率。
[0075]
进一步通过分析可知,在缓冲液中添加了质量分数为10%的pluronic f-68母液后数据分析可知,其ipsc细胞电转的阳性表达分别在同等条件下高出8.5%左右。进而比对比例中的阳性表达更高。
[0076]
综上,虽然本发明公开了以上优选实施例,但上述优选实施例并不限制本发明的范围,本领域的技术人员在不脱离本发明的精神和范围内,所做的变动都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1