酱醪中微生物总DNA的提取方法与流程
酱醪中微生物总dna的提取方法
技术领域
1.本发明涉及生物学技术领域,特别涉及一种酱醪中微生物总dna的提取方法。
背景技术:
2.中国酱油酿造历史悠久,其中,高盐稀态工艺酿造酱油风味浓厚,味道鲜美,是未来酱油发展的主要方向。开放的制曲方式使得成曲和酱醪的微生物来源十分广泛,而微生物组成的不稳定性将会导致酱醪品质的波动,最终影响酱油产量与成品品质的稳定性。因此,明晰酱醪中微生物群落结构,对稳定和改善酱油品质、推进酱油酿造技术进步都显得尤为重要。
3.目前,对酱醪微生物的研究主要集中在通过可培养法对微生物组成进行研究分析。但传统的可培养法能培养的微生物种类十分有限,大部分的不可培养的微生物难以被发现,得到的微生物群不能准确地代表整个大曲的微生物群落组成。
4.应用分子生物学的方法,能有效地克服传统可培养技术的不足,通过扩增子测序能快速准确地得到酱醪微生物组成,在此基础上,利用宏基因组学还能进一步对群落中微生物的潜在功能进行预测。随着测序技术和组学技术的不断进步发展,人们对于酱醪中混菌发酵体系的研究有了必要的技术保障。无论哪种技术,都需要先从高盐稀态发酵酱醪中获得微生物总dna,微生物总dna的质量决定了最终结果的可靠性。
5.目前常用的dna提取方法主要有化学法和试剂盒法,其中:化学法主要有ctab法、sds法,以及基于这些方法的改良方法,如发明专利cn104560955a;试剂盒法在样品处理和dna提取阶段同样使用了化学法,区别主要在于其通常使用纯化柱吸附dna后洗脱纯化,如专利cn107418952a。
6.然而,高盐稀态发酵酱醪中复杂的成分对微生物总dna的提取造成一定的难度,采用目前常用的dna提取方法无法从高盐稀态发酵酱醪中提取到高质量的微生物总dna以满足基因测序的需求。
7.有鉴于此,特提出本发明。
技术实现要素:
8.本发明实施例的主要目的包括提供一种酱醪中微生物总dna的提取方法,采用该提取方法,能够从高盐稀态酱油发酵酱醪中提取到高质量的微生物总dna。
9.本发明的目的可以通过以下技术方案实现:
10.本发明实施例提供一种酱醪中微生物总dna的提取方法,其特征在于,所述提取方法包括如下步骤:
11.混合酱醪样品与吐温80水溶液,对所得混合物进行离心,收集酱醪沉淀;
12.于液氮条件下,混合所述酱醪沉淀和经活化处理的阳离子交换树脂并研磨,收集粉料;
13.混合所述粉料和溶菌酶缓冲液,孵育,制备孵育产物;
14.混合所述孵育产物和dna提取液进行dna提取,对所得提取产物进行离心,收集上清液;
15.混合所述上清液和乙醇进行dna沉淀,对所得沉淀产物进行离心,收集dna沉淀,清洗,获得微生物总dna。
16.在本发明的一些实施例中,所述阳离子交换树脂为氢型阳离子交换树脂或者钠型阳离子交换树脂。
17.在本发明的一些实施例中,活化处理的步骤包括:将所述阳离子交换树脂置于活化剂中浸泡,去除活化剂。
18.在本发明的一些实施例中,活化处理的步骤具有如下技术特征中的一个或者多个:
19.(1)所述活化剂为氯化钠含量为5%-15%(w/v)的氯化钠水溶液;
20.(2)浸泡的条件包括:温度为15℃-30℃,时间为0.5h-1.5h;
21.(3)去除活化剂的方法包括离心,离心的转速为8000rpm-12000rpm,离心的时间为4min-6min。
22.在本发明的一些实施例中,所述阳离子交换树脂的用量是所述酱醪样品质量的10wt%-50wt%。
23.在本发明的一些实施例中,所述阳离子交换树脂的平均颗粒直径为4nm-6nm。
24.在本发明的一些实施例中,所述吐温80水溶液中吐温80的含量为0.2%-0.8%(w/v)。
25.在本发明的一些实施例中,每1g所述酱醪样品对应的所述吐温80水溶液的用量为1ml-3ml。
26.在本发明的一些实施例中,离心所述混合物的条件包括:转速为10000rpm-14000rpm,时间为10min-20min。
27.在本发明的一些实施例中,孵育满足如下条件中的一个或者多个:
28.(1)每3g所述粉料对应的所述溶菌酶缓冲液的用量为15ml-25ml;
29.(2)孵育的温度为60℃-70℃,孵育的时间为25min-35min。
30.在本发明的一些实施例中,离心所述提取产物的条件包括:转速为10000rpm-14000rpm,时间为5min-15min。
31.在本发明的一些实施例中,离心所述沉淀产物的条件包括:转速为10000rpm-14000rpm,时间为5min-15min。
32.在本发明的一些实施例中,清洗所述dna沉淀采用的清洗剂为乙醇体积浓度为65%-75%的乙醇水溶液。
33.在本发明的一些实施例中,所述酱醪样品的含盐量为15wt%-25wt%。
34.在本发明的一些实施例中,所述酱醪样品为高盐稀态酱油发酵酱醪。
35.相对于传统技术,本发明具备如下有益效果:
36.本发明先采用吐温80水溶液对酱醪进行预处理,再于液氮条件下对预处理后的酱醪和经活化处理的阳离子交换树脂混合研磨,所得粉料经溶菌酶缓冲液孵育后经dna提取液提取、乙醇沉淀、清洗,从而实现酱醪中微生物总dna的提取。采用本发明的dna提取工艺,能够从盐分含量高、成分复杂的高盐稀态酱油发酵酱醪中提取出微生物总dna,且微生物总
dna质量高(包括纯度高、完整性好),能够满足测序要求。本发明的提取方法,简单,安全,能迅速操作。
附图说明
37.为了更清楚地说明本技术实施例中的技术方案、更完整地理解本技术及其有益效果,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对本领域技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
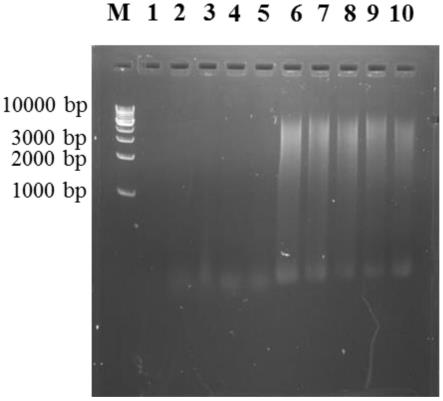
38.图1为实施例1和对比例1所得高盐稀态发酵酱油的发酵晚期酱醪样品的微生物总dna琼脂糖凝胶电泳图;图中,泳道1-5为对比例1提取的5个酱醪平行样品总dna,泳道6-10为实施例1提取的5个酱醪平行样品微生物总dna,m为1000bp ladder;
39.图2为实施例2和对比例1所得微生物总dna琼脂糖凝胶电泳图;图中,泳道1为实施例2所得的酱醪样品微生物总dna,泳道2为对比例1所得的酱醪样品微生物总dna,m为1000bp ladder;
40.图3为细菌16s rdna和真菌its pcr产物琼脂糖凝胶电泳图;图中,泳道1、2分别为实施例1和实施例2提取的酱醪样品16s rdna,泳道5、6分别为实施例1和实施例2提取的酱醪样品its,泳道3、4和7、8分别为对比例1提取的酱醪样品的16s rdna和its,m为500bp ladder。
具体实施方式
41.下面结合附图、实施方式和实施例,对本发明作进一步详细的说明。应理解,这些实施方式和实施例仅用于说明本发明而不用于限制本发明的范围,提供这些实施方式和实施例的目的是使对本发明公开内容理解更加透彻全面。还应理解,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式和实施例,本领域技术人员可以在不违背本发明内涵的情况下作各种改动或修改,得到的等价形式同样落于本技术的保护范围。此外,在下文的描述中,给出了大量具体的细节以便提供对本发明更为充分地理解,应理解,本发明可以无需一个或多个这些细节而得以实施。
42.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述实施方式和实施例的目的,不是旨在于限制本发明。
43.术语
44.除非另外说明或存在矛盾之处,本文中使用的术语或短语具有以下含义:
45.本文所使用的术语“和/或”、“或/和”、“及/或”的选择范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。需要说明的是,当用至少两个选自“和/或”、“或/和”、“及/或”的连词组合连接至少三个项目时,应当理解,在本技术中,该技术方案毫无疑问地包括均用“逻辑与”连接的技术方案,还毫无疑问地包括均用“逻辑或”连接的技术方案。比如,“a及/或b”包括a、b和a+b三种并列方案。又比如,“a,及/或,b,及/或,c,及/或,d”的技术方案,包括a、b、c、d中任一
项(也即均用“逻辑或”连接的技术方案),也包括a、b、c、d的任意的和所有的组合,也即包括a、b、c、d中任两项或任三项的组合,还包括a、b、c、d的四项组合(也即均用“逻辑与”连接的技术方案)。
46.本发明中涉及“多个”、“多种”、“多次”、“多元”等,如无特别限定,指在数量上大于2或等于2。例如,“一种或多种”表示一种或大于等于两种。
47.本文中所使用的“其组合”、“其任意组合”、“其任意组合方式”等中包括所列项目中任两个或任两个以上项目的所有合适的组合方式。
48.本文中,“合适的组合方式”、“合适的方式”、“任意合适的方式”等中所述“合适”,以能够实施本发明的技术方案、解决本发明的技术问题、实现本发明预期的技术效果为准。
49.本文中,“优选”、“更好”、“更佳”、“为宜”仅为描述效果更好的实施方式或实施例,应当理解,并不构成对本发明保护范围的限制。
50.本发明中,“进一步”、“更进一步”、“特别”等用于描述目的,表示内容上的差异,但并不应理解为对本发明保护范围的限制。
51.本发明中,“可选地”、“可选的”、“可选”,指可有可无,也即指选自“有”或“无”两种并列方案中的任一种。如果一个技术方案中出现多处“可选”,如无特别说明,且无矛盾之处或相互制约关系,则每项“可选”各自独立。
52.本发明中,“第一方面”、“第二方面”、“第三方面”、“第四方面”等中,术语“第一”、“第二”、“第三”、“第四”等仅用于描述目的,不能理解为指示或暗示相对重要性或数量,也不能理解为隐含指明所指示的技术特征的重要性或数量。而且“第一”、“第二”、“第三”、“第四”等仅起到非穷举式的列举描述目的,应当理解并不构成对数量的封闭式限定。
53.本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
54.本发明中,涉及到数值区间(也即数值范围),如无特别说明,可选的数值分布在上述数值区间内视为连续,且包括该数值范围的两个数值端点(即最小值及最大值),以及这两个数值端点之间的每一个数值。如无特别说明,当数值区间仅仅指向该数值区间内的整数时,包括该数值范围的两个端点整数,以及两个端点之间的每一个整数,在本文中,相当于直接列举了每一个整数,比如t为选自1~10的整数,表示t为选自由1、2、3、4、5、6、7、8、9和10构成的整数组的任一个整数。此外,当提供多个范围描述特征或特性时,可以合并这些范围。换言之,除非另有指明,否则本文中所公开之范围应理解为包括其中所归入的任何及所有的子范围。
55.本发明中的温度参数,如无特别限定,既允许为恒温处理,也允许在一定温度区间内存在变动。应当理解的是,所述的恒温处理允许温度在仪器控制的精度范围内进行波动。允许在如
±
5℃、
±
4℃、
±
3℃、
±
2℃、
±
1℃的范围内波动。
56.本发明中,%(w/w)与wt%均表示重量百分比,%(v/v)指体积百分比,%(w/v)指质量体积百分数。
57.在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。除非和本技术的发明目的和/或技术方案相冲突,否则,本发明涉及的引用文献以全部内容、全部目的被引用。本发明中涉及引用文献时,相关技术特征、术语、名词、短语等在引用文献中的定义也一并被引用。本发明中涉及引用文献时,被引用的相关技
术特征的举例、优选方式也可作为参考纳入本技术中,但以能够实施本发明为限。应当理解,当引用内容与本技术中的描述相冲突时,以本技术为准或者适应性地根据本技术的描述进行修正。
58.酱醪,指将成曲拌入多量盐水,使其呈浓稠的半流动状态的混合物。
59.目前,传统的dna的提取方法在高盐稀态发酵酱醪的微生物总dna提取中的应用效果不佳。传统的dna的提取方法例如:
60.中国发明专利申请cn113215146a记载的一种污泥中胞内外dna的分离方法及其携带耐药基因的检测方法,其核心在于利用酶解的手段使坚固的细胞壁软化,其不足之处主要有以下几点:1、酶处理过程耗时长、步骤繁琐;2、大量提取dna时酶的用量较大,成本高;3、不同酶的偏好性导致不同的微生物细胞壁酶解程度不同,酶解效果不好的细胞dna没有得到充分释放;4、酶的加入也引入了部分外源dna,对最终目标dna纯度造成影响。
61.中国发明专利cn105779442b记载的一种天然纤维素利用菌群的宏转录组rna的提取方法,其核心在于加入玻璃珠、陶瓷珠等刚性球状助研物,利用珠磨匀浆的方法对细胞进行破壁。由于该方法剪切力过大,在对酱醪样品的微生物dna提取过程中,混于其中的大量大豆、小麦等制曲原料的dna会被共同提取,严重影响微生物总dna的纯度。
62.中国发明专利申请cn107418952a记载了一种土壤微生物宏基因组提取方法,综合酶法、化学法、物理法以更好地裂解细胞,但在dna纯化过程中需要使用吸附柱,本质与试剂盒法相同,无法满足酱醪大培养体系抽提dna的需要,且总体实验步骤较繁琐。
63.中国发明专利申请cn111875665a记载了一种用于细胞破碎和/或回收生物分子的微粒的方法,“一种破坏细胞的方法,包括向生物流体中加入带负电荷的微粒,其中所述带负电荷微粒为磨碎的聚合的阳离子交换树脂”,但发明人发现,采用其技术方案也不能从高盐稀态发酵酱油酱醪中提取到高质量的微生物总dna。
64.然而,实际操作过程中,传统的dna提取方法在高盐稀态发酵酱醪的微生物总dna提取中应用效果不佳,原因主要有以下几点:
65.1、高盐稀态酱油发酵体系盐分含量高,高浓度的盐离子以及发酵过程中产生的多种次级代谢产物对化学试剂的效果造成影响,某些抑制物如(酚类化合物、重金属等)存在与dna共提取的现象;
66.2、高盐环境的微生物如耐盐酵母等耐高渗透压能力强,细胞结构牢固,能否有效破壁严重影响dna的提取质量;
67.3、酱醪中大豆、小麦等生产原料的基因组对目标微生物基因组的严重干扰,进而影响dna的后续使用。
68.基于上述问题,本发明的目的在于克服现有技术的不足之处而提供一种能够从高盐稀态酱油发酵酱醪中提取高质量的微生物总dna的方法。
69.为此,本发明主要先采用吐温80水溶液对酱醪进行预处理,再于液氮条件下对预处理后的酱醪和经活化处理的阳离子交换树脂混合研磨,所得粉料经溶菌酶缓冲液孵育后经dna提取液提取、乙醇沉淀、清洗,从而实现酱醪中微生物总dna的高质量(纯度高、完整性好)提取。
70.酱油发酵的酱醪中含有大量溶于水或者不溶于水的杂质(金属离子、多糖、酚类化合物、蛋白质及细胞壁残留等),吐温80水溶液能很好地溶解非水溶性的杂质和代谢产物,
然后通过离心去上清的方式去除这些杂质和代谢产物,减少后续提取过程中其对于dna提取效率的影响。
71.本发明通过加入阳离子交换树脂助研磨体,能够有效增加酱醪顽劣微生物的破壁效率,同时减少大豆、小麦等dna的干扰,提高微生物总dna的得率。本发明中阳离子交换树脂可以为氢型阳离子交换树脂或者钠型阳离子交换树脂,优选钠型强阳离子交换树脂,更加优选为钠型001*7阳离子交换树脂。氢型阳离子交换树脂的反应基为磺酸基,其交换能力不随ph变化而变化。高盐稀态酱油发酵酱醪ph≈4-5,可保证蛋白等杂质带正电荷,与阳离子交换树脂紧密结合,从而保证纯化效果。阳离子交换树脂加入量约为酱醪的1/10-5/10(w/w),研磨过程中应注意及时添加液氮,否则样品会吸收空气中水分而呈粘稠状,影响研磨效率。研杵应顺一个方向快速研磨,待样品中观察不到明显大颗粒物体即可快速转移到溶菌缓冲液中。研磨后酱醪和阳离子交换树脂同时成为粉状混合物,细胞破壁后的一些内容物能够被带有电荷的阳离子交换树脂吸附,孵育过程中应及时用移液枪枪头轻轻吹打混匀,以使反应更充分。
72.就研磨而言,本发明的发明人尝试过在液氮研磨过程中添加刚性玻璃珠以增加机械剪切力,但最终提取效果不佳,主要原因是商用玻璃珠规格统一,不同的大小对不同的微生物破壁效果有偏好性,且对于酱醪中大颗粒原料的破壁效果更明显。而阳离子交换树脂在研磨过程中逐渐破碎,混合物中存在不同大小的树脂,对不同的微生物的细胞壁都产生了剪切力。除此之外,相对于其他dna提取方法(如cn105779442b记载的方法)的惰性助研磨剂(如陶瓷珠、玻璃珠、硅珠等),阳离子交换树脂的加入有以下不可替代的优点:
73.1、研磨后呈粉料的阳离子交换树脂能更好地交换体系中的盐离子,减少其对dna提取的干扰;
74.2、由于阳离子交换树脂自身带有电荷,其对于酱醪体系中的多糖、蛋白、多酚等杂质有一定吸附作用,使提取的dna纯度更高;
75.3、阳离子交换树脂在酱醪微生物dna提取这种特定场景下提供了适当的剪切力,保证了微生物细胞与制曲原料的良好分离,而陶瓷珠、玻璃珠、硅珠等惰性助研磨剂具有较强的刚性,研磨过程中对制曲原料(大豆、小麦)的剪切力过大,导致其dna在后续过程被大量共提取,对目标微生物dna造成严重干扰。
76.进一步地,发明人还尝试将预处理后的酱醪直接在液氮下研磨(也可添加常规的助研磨剂提供剪切力),再将其置于研磨碎的阳离子交换树脂下反应。该方法中研磨碎的树脂仅作为dna提取过程中部分杂质的吸附剂发挥作用,制曲原料dna共提取严重的现象未得到解决,获得的dna质量不足以进行后续测序分析。
77.此外,发明人还尝试将研磨后粉料直接加入dna提取液进行抽提,不经过步骤3的溶菌缓冲液充分孵育,最终得到的洗脱液中仅含有微量dna。步骤3的主要目的是利用(十二烷基磺酸钠)sds等离子型表面活性剂溶解细胞膜和核膜蛋白,使细胞膜和核膜破裂,充分释放dna。
78.本发明实施例提供一种酱醪中微生物总dna的提取方法,所述提取方法包括如下步骤:
79.混合酱醪样品与吐温80水溶液,对所得混合物进行离心,收集酱醪沉淀;
80.于液氮条件下,混合所述酱醪沉淀和经活化处理的阳离子交换树脂并研磨,收集
粉料;
81.混合所述粉料和溶菌酶缓冲液,孵育,制备孵育产物;
82.混合所述孵育产物和dna提取液进行dna提取,对所得提取产物进行离心,收集上清液;
83.混合所述上清液和乙醇进行dna沉淀,对所得沉淀产物进行离心,收集dna沉淀,清洗,获得微生物总dna。
84.在一些实施例中,所述阳离子交换树脂为氢型阳离子交换树脂或者钠型阳离子交换树脂。
85.在一些实施例中,活化处理的步骤包括:将所述阳离子交换树脂置于活化剂中浸泡,去除活化剂。
86.在一些实施例中,活化处理的步骤具有如下技术特征中的一个或者多个:
87.(1)所述活化剂为氯化钠含量为5%-15%(w/v)的氯化钠水溶液;
88.(2)浸泡的条件包括:温度为15℃-30℃,时间为0.5h-1.5h;
89.(3)去除活化剂的方法包括离心,离心的转速为8000rpm-12000rpm,离心的时间为4min-6min。
90.所述活化剂中,氯化钠含量(%(w/v))例如为5、6、7、8、9、10、11、12、13、14、15。
91.浸泡的温度(℃)例如为15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30,浸泡的时间(h)例如为0.5、0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5。
92.去除活化剂的离心转速(rpm)例如为8000、8500、9000、9500、10000、10500、11000、11500、12500,离心的时间(min)例如为4、4.5、5、5.5、6、6.5。
93.在一些实施例中,所述阳离子交换树脂的用量是所述酱醪样品质量的10wt%-50wt%,例如为10wt%、15wt%、20wt%、25wt%、30wt%、35wt%、40wt%、45wt%、50wt%。
94.在本发明的一些实施例中,所述阳离子交换树脂的平均颗粒直径为4nm-6nm,例如为4nm、4.5nm、5nm、5.5nm、6nm。
95.在本发明的一些实施例中,所述吐温80水溶液中吐温80的含量为0.2%-0.8%(w/v),例如为0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%。
96.在本发明的一些实施例中,每1g所述酱醪样品对应的所述吐温80水溶液的用量为1ml-3ml,例如为1ml、1.2ml、1.4ml、1.6ml、1.8ml、2ml、2.2ml、2.4ml、2.6ml、2.8ml、3ml。
97.在本发明的一些实施例中,离心所述混合物的条件包括:转速为10000rpm-14000rpm,时间为10min-20min。离心的转速(rpm)例如为10000、10500、11000、11500、12000、12500、13000、13500、14000,离心的时间(min)例如为10、11、12、13、14、15、16、17、18、19、20。
98.在本发明的一些实施例中,孵育满足如下条件中的一个或者多个:
99.(1)每3g所述粉料对应的所述溶菌酶缓冲液的用量为15ml-25ml;和,
100.(2)孵育的温度为60℃-70℃,孵育的时间为25min-35min。
101.每3g所述粉料对应的所述溶菌酶缓冲液的用量(ml)例如为15、17、19、20、21、23、25。
102.孵育的温度(℃)例如为60、62、64、66、68、70,孵育的时间(min)例如为25、26、27、28、29、30、31、32、33、34、35。
103.在本发明的一些实施例中,离心所述提取产物的条件包括:转速为10000rpm-14000rpm,时间为5min-15min。离心的转速(rpm)例如为10000、10500、11000、11500、12000、12500、13000、13500、14000,离心的时间(min)例如为5、6、7、8、9、10、11、12、13、14、15。
104.在本发明的一些实施例中,离心所述沉淀产物的条件包括:转速为10000rpm-14000rpm,时间为5min-15min。离心的转速(rpm)例如为10000、10500、11000、11500、12000、12500、13000、13500、14000,离心的时间(min)例如为5、6、7、8、9、10、11、12、13、14、15。
105.在本发明的一些实施例中,清洗所述dna沉淀采用的清洗剂为乙醇体积浓度为65%-75%的乙醇水溶液,乙醇水溶液中乙醇体积浓度(%)例如为65、66、67、68、69、70、71、72、73、74、75。
106.在本发明的一些实施例中,所述酱醪样品的含盐量为15wt%-25wt%,例如为15wt%、16wt%、17wt%、18wt%、19wt%、20wt%、21wt%、22wt%、23wt%、24wt%、25wt%。
107.在本发明的一些实施例中,所述酱醪样品为高盐稀态酱油发酵酱醪。
108.具体实施例
109.下面将结合实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,优先参考本发明中给出的指引,还可以按照本领域的实验手册或常规条件,还可以按照制造厂商所建议的条件,或者参考本领域已知的实验方法。
110.下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
111.1、溶菌酶缓冲液:tris-hcl 50mm,edta 50mm,sds 3%,ph 8.0,高温高压灭菌后保存使用。
112.2、dna提取液:苯酚:氯仿:异戊醇(25:24:1),轻轻颠倒混匀(氯仿和异戊醇提前按比例配好)。
113.3、阳离子交换树脂需进行10%(w/v)氯化钠浸泡处理。
114.实施例1、高盐稀态酱油发酵酱醪微生物总dna提取方法
115.本发明中从高盐稀态酱油发酵酱醪中提取微生物总dna的方法的一种实施例,包括如下步骤:
116.a、酱醪样品前处理
117.1、称取10g盐分为18wt%的高盐稀态酱油发酵酱醪溶于20ml 0.5%(w/v)tween 80水溶液中,12000rpm离心15min后弃上清,收集沉淀。
118.b、阳离子交换树脂的活化
119.2、每克树脂加入10ml活化剂,活化剂为10%(w/v)nacl水溶液,于室温(15-30℃)下处理1h,活化后于10000rpm下离心5min,移除上清,得到活化后树脂。其中,树脂选用钠型001*7阳离子交换树脂,其平均颗粒直径为5nm。
120.c、研磨
121.3、将沉淀转移至液氮预冷的研钵中,加入1g经活化处理的阳离子交换树脂与沉淀混匀,用研杵将沉淀和经活化处理的阳离子交换树脂逐渐研磨成粉末,期间不断加入液氮保持低温,直至研磨产物呈淡黄色粉状。
122.d、总dna的提取
123.4、称取3g粉末,加入20ml经65℃预热的溶菌缓冲液。
124.5、于65℃孵育30min,每5min用去尖枪头轻轻混匀。
125.6、加入等体积dna提取液,于12000rpm下离心10min。
126.7、小心吸取上清液,转移到新的离心管中,重复步骤6一次。
127.e、dna沉淀的清洗
128.8、取10ml上清液,加入25ml经-20℃预冷的无水乙醇。
129.9、于-20℃下沉淀dna 30min,于12000rpm、4℃下离心10min,此时离心管底部出现dna沉淀。
130.10、弃去上清,加入20ml 70%(v/v)乙醇溶液,用枪头轻轻吹打沉淀,使其呈漂浮状态。
131.11、于12000rpm下离心8min,重复步骤10一次。
132.12、于12000rpm下离心8min,弃去上清。
133.f、dna的溶解
134.13、室温干燥沉淀5min,挥发残留的乙醇,加入0.5ml无菌水溶解沉淀。
135.应用本实施例的方法,得到高盐稀态酱油发酵过程中酱醪微生物的总dna,采用琼脂糖凝胶电泳法检测总dna质量。5个高盐稀态酱油发酵酱醪平行样品的电泳图参见图1中的泳道6-10,结果显示条带亮度较高,无蛋白质和酚污染。紫外分光光度计上测定a260/a280的吸光度比值为1.92,浓度为57.5μg/ml(以图1泳道6对应的高盐稀态酱油发酵酱醪平行样品的总dna为例),16s rdna和its的pcr产物电泳结果(参见图3泳道1、5)显示对应条带清晰可见,满足基因组测序的样品质量要求。
136.实施例2、高盐稀态酱油(盐分为15wt%)发酵酱醪微生物总dna提取方法
137.a、酱醪样品前处理
138.1、称取10g盐分为15wt%的高盐稀态酱油发酵酱醪溶于20ml0.5%(w/v)tween 80水溶液中,12000rpm离心15min后弃上清,收集沉淀。
139.b、阳离子交换树脂的活化
140.2、每克树脂加入10ml活化剂,活化剂为10%(w/v)nacl水溶液,于室温(15-30℃)下处理1h,活化后于10000rpm下离心5min,移除上清,得到活化后树脂。其中,树脂选用钠型001*7阳离子交换树脂,其平均颗粒直径为5nm。
141.c、研磨
142.3、将沉淀转移至液氮预冷的研钵中,加入1g经活化处理的阳离子交换树脂与沉淀混匀,用研杵将沉淀和经活化处理的阳离子交换树脂逐渐研磨成粉末,期间不断加入液氮保持低温,直至研磨产物呈淡黄色粉末状。
143.d、总dna的提取
144.4、称取3g粉末,加入20ml经65℃预热的溶菌缓冲液。
145.5、于65℃孵育30min,每5min用去尖枪头轻轻混匀。
146.6、加入等体积dna提取液,于12000rpm下离心10min。
147.7、小心吸取上清液,转移到新的离心管中,重复步骤(6)一次。
148.e、dna沉淀的清洗
149.8、取10ml上清液,加入25ml经-20℃预冷的无水乙醇。
150.9、于-20℃下沉淀dna 30min,于12000rpm、4℃下离心10min,此时离心管底部出现dna沉淀。
151.10、弃去上清,加入20ml 70%(v/v)乙醇溶液,用枪头轻轻吹打沉淀,使其呈漂浮状态。
152.11、于12000rpm下离心8min,重复步骤(10)一次。
153.12、于12000rpm下离心8min,弃去上清。
154.f、dna的溶解
155.13、室温干燥沉淀5min,挥发残留的乙醇,加入0.5ml无菌水溶解沉淀。
156.应用本实施例的方法,得到高盐稀态酱油发酵过程中酱醪微生物的总dna,采用琼脂糖凝胶电泳法检测总dna质量检测,参见图2,结果显示条带亮度较高,无蛋白质和酚污染。紫外分光光度计上测定a260/a280的吸光度比值为1.79,浓度为41.3μg/ml,16s rdna和its的pcr产物电泳结果(参见图3泳道2、6)显示对应条带清晰可见,满足基因组测序的样品质量要求。
157.实施例3、高盐稀态酱油发酵酱醪微生物总dna提取方法
158.a、酱醪样品前处理
159.1、称取10g盐分为15wt%的高盐稀态酱油发酵酱醪溶于30ml 0.2%(w/v)tween 80水溶液中,14000rpm离心10min后弃上清,收集沉淀。
160.b、阳离子交换树脂的活化
161.2、每克树脂加入10ml活化剂,活化剂为15%(w/v)nacl水溶液,于室温(15-30℃)下处理0.5h,活化后于8000rpm下离心4min,移除上清,得到活化后树脂。其中,树脂选用氢型阳离子交换树脂,其平均颗粒直径为4nm。
162.c、研磨
163.3、将沉淀转移至液氮预冷的研钵中,加入3g经活化处理的阳离子交换树脂与沉淀混匀,用研杵将沉淀和经活化处理的阳离子交换树脂逐渐研磨成粉末,期间不断加入液氮保持低温,直至研磨产物呈淡黄色粉状。
164.d、总dna的提取
165.4、称取3g粉末,加入15ml经60℃预热的溶菌缓冲液。
166.5、于60℃孵育25min,每5min用去尖枪头轻轻混匀。
167.6、加入等体积dna提取液,于10000rpm下离心15min。
168.7、小心吸取上清液,转移到新的离心管中,重复步骤6一次。
169.e、dna沉淀的清洗
170.8、取10ml上清液,加入25ml经-20℃预冷的无水乙醇。
171.9、于-20℃下沉淀dna 30min,于10000rpm、4℃下离心15min,此时离心管底部出现dna沉淀。
172.10、弃去上清,加入20ml 65%(v/v)乙醇溶液,用枪头轻轻吹打沉淀,使其呈漂浮状态。
173.11、于10000rpm下离心5min,重复1次步骤10的操作。
174.12、于10000rpm下离心5min,弃去上清。
175.f、dna的溶解
176.13、室温干燥沉淀5min,挥发残留的乙醇,加入0.5ml无菌水溶解沉淀。
177.应用本实施例的方法,得到高盐稀态酱油发酵过程中酱醪微生物的总dna,采用琼脂糖凝胶电泳法检测总dna质量检测,结果显示条带亮度较高,无蛋白质和酚污染。紫外分光光度计上测定a260/a280的吸光度比值为1.75,浓度为40.8μg/ml,16s rdna和its的pcr产物电泳结果显示对应条带清晰可见,满足基因组测序的样品质量要求。
178.实施例4、高盐稀态酱油发酵酱醪微生物总dna提取方法
179.本发明中从高盐稀态酱油发酵酱醪中提取微生物总dna的方法的一种实施例,包括如下步骤:
180.a、酱醪样品前处理
181.1、称取10g盐分为25wt%的高盐稀态酱油发酵酱醪溶于10ml 0.8%(w/v)tween 80水溶液中,10000rpm离心20min后弃上清,收集沉淀。
182.b、阳离子交换树脂的活化
183.2、每克树脂加入10ml活化剂,活化剂为5%(w/v)nacl水溶液,于室温(15-30℃)下处理1.5h,活化后于12000rpm下离心6min,移除上清,得到活化后树脂。其中,树脂选用氢型阳离子交换树脂,其平均颗粒直径为6nm。
184.c、研磨
185.3、将沉淀转移至液氮预冷的研钵中,加入5g经活化处理的阳离子交换树脂与沉淀混匀,用研杵将沉淀和经活化处理的阳离子交换树脂逐渐研磨成粉末,期间不断加入液氮保持低温,直至研磨产物呈淡黄色粉状。
186.d、总dna的提取
187.4、称取3g粉末,加入25ml经70℃预热的溶菌缓冲液。
188.5、于70℃孵育35min,每5min用去尖枪头轻轻混匀。
189.6、加入等体积dna提取液,于14000rpm下离心5min。
190.7、小心吸取上清液,转移到新的离心管中,重复步骤6一次。
191.e、dna沉淀的清洗
192.8、取10ml上清液,加入25ml经-20℃预冷的无水乙醇。
193.9、于-20℃下沉淀dna 30min,于14000rpm、4℃下离心5min,此时离心管底部出现dna沉淀。
194.10、弃去上清,加入20ml 75%(v/v)乙醇溶液,用枪头轻轻吹打沉淀,使其呈漂浮状态。
195.11、于14000rpm下离心5min,重复步骤10一次。
196.12、于14000rpm下离心5min,弃去上清。
197.f、dna的溶解
198.13、室温干燥沉淀5min,挥发残留的乙醇,加入0.5ml无菌水溶解沉淀。
199.应用本实施例的方法,得到高盐稀态酱油发酵过程中酱醪微生物的总dna,采用琼脂糖凝胶电泳法检测总dna质量检测,结果显示条带亮度较高,无蛋白质和酚污染。紫外分光光度计上测定a260/a280的吸光度比值为1.82,浓度为46.2μg/ml,16s rdna和its的pcr产物电泳结果显示对应条带清晰可见,满足基因组测序的样品质量要求。
200.对比例1、相对于实施例1不添加阳离子交换树脂的高盐稀态酱油发酵酱醪微生物总dna提取方法
201.a、酱醪样品前处理
202.1、称取10g盐分为18wt%的高盐稀态酱油发酵酱醪溶于20ml 0.5%tween 80水溶液中,12000rpm离心15min后弃上清,收集沉淀。
203.b、研磨
204.2、将沉淀转移至液氮预冷的研钵中,直接用研杵将沉淀研磨成粉末,期间不断加入液氮保持低温,直至沉淀呈淡黄色粉末状。
205.c、总dna的提取
206.3、取3g粉末加入20ml经65℃预热的溶菌缓冲液。
207.4、65℃孵育30min,每5min用去尖枪头轻轻混匀。
208.5、加入等体积dna提取液,于12000rpm下离心10min。
209.6、小心吸取上清液(勿吸中间层白色沉淀),重复步骤5中操作一次。
210.d、dna沉淀的清洗
211.7、取10ml上清液,加入25ml经-20℃预冷无水乙醇。
212.8、于-20℃下沉淀dna 30min,于12000rpm、4℃下离心10min,此时离心管底部出现dna沉淀。
213.9、弃去上清,加入20ml 70%(v/v)乙醇溶液,用枪头轻轻吹打沉淀,使其呈漂浮状态。
214.10、于12000rpm下离心8min,重复步骤9的操作一次。
215.11、于12000rpm下离心8min,弃去上清。
216.e、dna的溶解
217.12、室温干燥沉淀5min,挥发残留的乙醇,加入0.5ml无菌水溶解沉淀。
218.应用本对比例的方法,得到不添加阳离子交换树脂研磨的酱醪微生物总dna。本对比例实施过程中,由于研磨过程没有加入阳离子交换树脂,后续液氮研磨微生物破壁效果不佳,杂质去除不完全。经琼脂糖凝胶电泳法质量检测,结果(参见图2泳道2)显示对应的dna亮度较低,勉强能够看到弥散的总dna条带,紫外分光光度计测得的浓度为14.4μg/ml,紫外分光光度计上测定a260/a280的吸光度比值为2.27,表明rna残留量较高。此外,主要的亮带偏小,泳道最下方的条带亮度明显,表明dna降解较为严重。16s rdna电泳结果(参见图3泳道3、4)显示对应条带比较暗淡。需要特别指出的是,its电泳结果(参见图3泳道7、8)显示对应条带大小约为750bp,大于一般真菌its大小,表明该条带主要来源为大豆、小麦等原料。
219.可见,在不使用阳离子交换树脂研磨条件下,使用常规的液氮研磨结合sds法从高盐稀态酱油发酵酱醪这类复杂基质中提取总dna含量和质量都较低。
220.对比例2、相对于实施例1树脂未经活化处理的高盐稀态酱油发酵酱醪微生物总dna提取方法
221.a、酱醪样品前处理
222.1、称取10g盐分为18wt%的高盐稀态酱油发酵酱醪溶于20ml 0.5%(w/v)tween 80水溶液中,12000rpm离心15min后弃上清,收集沉淀。
223.b、研磨
224.2、将沉淀转移至液氮预冷的研钵中,加入1g未经活化处理的阳离子交换树脂与沉淀混匀,用研杵将沉淀和经活化处理的阳离子交换树脂逐渐研磨成粉末,期间不断加入液氮保持低温,直至研磨产物呈淡黄色粉状。
225.c、总dna的提取
226.3、称取3g粉末,加入20ml经65℃预热的溶菌缓冲液。
227.4、于65℃孵育30min,每5min用去尖枪头轻轻混匀。
228.5、加入等体积dna提取液,于12000rpm下离心10min。
229.6、小心吸取上清液,转移到新的离心管中,重复步骤5一次。
230.d、dna沉淀的清洗
231.7、取10ml上清液,加入25m l经-20℃预冷的无水乙醇。
232.8、于-20℃下沉淀dna 30min,于12000rpm、4℃下离心10min,此时离心管底部出现dna沉淀。
233.9、弃去上清,加入20ml 70%(v/v)乙醇溶液,用枪头轻轻吹打沉淀,使其呈漂浮状态。
234.10、于12000rpm下离心8min,重复一次步骤9的操作。
235.11、于12000rpm下离心8min,弃去上清。
236.e、dna的溶解
237.12、室温干燥沉淀5min,挥发残留的乙醇,加入0.5ml无菌水溶解沉淀。
238.应用本对比例的方法,得到树脂未经过活化处理的酱醪微生物总dna。实施过程中,由于新的阳离子交换树脂未经活化,其中含有少量未参与聚合反应的低聚合物,以及铁、铝、铜等无机杂质,影响dna提取,导致提取的dna纯度不足。紫外分光光度计测得的浓度为42.5μg/ml,紫外分光光度计上测定a260/a280的吸光度比值为2.33(正常值为1.8-2.0),表明dna纯度明显低于实施例。
239.对比例3、相对于实施例1使用吐温20代替吐温80的酱醪微生物总dna提取方法
240.a、酱醪样品前处理
241.1、称取10g盐分为18wt%的高盐稀态酱油发酵酱醪溶于20ml 0.5%(w/v)tween 20水溶液中,12000rpm离心15min后弃上清,收集沉淀。
242.b、阳离子交换树脂的活化
243.2、每克树脂加入10ml活化剂,活化剂为10%(w/v)nacl,于室温(15-30℃)下处理1h,活化后于10000rpm下离心5min,移除上清,得到活化后树脂。
244.c、研磨
245.3、将沉淀转移至液氮预冷的研钵中,加入1g经活化处理的阳离子交换树脂与沉淀混匀,用研杵将沉淀和经活化处理的阳离子交换树脂逐渐研磨成粉末,期间不断加入液氮保持低温,直至研磨产物呈淡黄色粉状。
246.d、总dna的提取
247.4、称取3g粉末,加入20ml经65℃预热的溶菌缓冲液。
248.5、于65℃孵育30min,每5min用去尖枪头轻轻混匀。
249.6、加入等体积dna提取液,于12000rpm下离心10min。
250.7、小心吸取上清液,转移到新的离心管中,重复步骤(6)一次。
251.e、dna沉淀的清洗
252.8、取10ml上清液,加入25ml经-20℃预冷的无水乙醇。
253.9、于-20℃下沉淀dna 30min,于12000rpm、4℃下离心10min,此时离心管底部出现dna沉淀。
254.10、弃去上清,加入20ml 70%(v/v)乙醇溶液,用枪头轻轻吹打沉淀,使其呈漂浮状态。
255.11、于12000rpm下离心8min,重复1次步骤(10)的操作。
256.12、于12000rpm下离心8min,弃去上清。
257.f、dna的溶解
258.13、室温干燥沉淀5min,挥发残留的乙醇,加入0.5ml无菌水溶解沉淀。
259.应用本对比例的方法,得到酱醪微生物总dna。吐温20与吐温80同为非离子型表面活性剂,区别在于吐温20更有利于亲水性物质的溶解,吐温80更有助于疏水性物质的溶解。而酱醪中含有的油脂和脂溶性的物质(脂溶性蛋白等)在吐温80的存在下能更好地溶解,并通过离心从体系中分离。经紫外分光光度计检测,其浓度为21.6μg/ml,显著低于实施例1与实施例2的结果,且a260/a280的吸光度比值为1.54(低于1.8-2.0的正常水平),表明蛋白类杂质残留量较高,其质量不利于后续基因测序。
260.对比例4、相对于实施例1不经溶菌缓冲液孵育的酱醪微生物总dna提取方法
261.a、酱醪样品前处理
262.1、称取10g盐分为18wt%的高盐稀态酱油发酵酱醪溶于20ml 0.5%(w/v)tween 80水溶液中,12000rpm离心15min后弃上清,收集沉淀。
263.b、阳离子交换树脂的活化
264.2、每克树脂加入10ml活化剂,活化剂为10%(w/v)nacl,于室温(15-30℃)下处理1h,活化后于10000rpm下离心5min,移除上清,得到活化后树脂。
265.c、研磨
266.3、将沉淀转移至液氮预冷的研钵中,加入1g经活化处理的阳离子交换树脂与沉淀混匀,用研杵将沉淀和经活化处理的阳离子交换树脂逐渐研磨成粉末,期间不断加入液氮保持低温,直至研磨产物呈淡黄色粉状。
267.d、总dna的提取
268.4、称取3g粉末,不经过溶菌缓冲液孵育,直接加入等体积dna提取液。于12000rpm下离心10min。
269.5、小心吸取上清液,转移到新的离心管中,加入等体积dna提取液,于12000rpm下离心10min。
270.e、dna沉淀的清洗
271.6、取10ml上清液,加入25ml经-20℃预冷的无水乙醇。
272.7、于-20℃下沉淀dna 30min,于12000rpm、4℃下离心10min,此时离心管底部出现dna沉淀。
273.8、弃去上清,加入20ml 70%(v/v)乙醇溶液,用枪头轻轻吹打沉淀,使其呈漂浮状态。
287.its4:5
’‑
tcctccgcttattgatatgc-3’288.pcr反应体系和反应条件见表2:
289.表2.pcr反应体系和反应条件
[0290][0291]
以上所述实施方式和实施例的各技术特征可以进行任意合适方式的组合,为使描述简洁,未对上述实施方式和实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为在本说明书记载的范围中。
[0292]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,得到的等价形式同样落于本技术的保护范围。还应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1