一种4-卤代-1-(二氟甲基)-1H-咪唑的制备方法与流程
一种4-卤代-1-(二氟甲基)-1h-咪唑的制备方法
技术领域
1.本发明涉及有机合成技术领域,特别是涉及一种4-卤代-1-(二氟甲基)-1h-咪唑的制备方法。
背景技术:
2.含氟化合物在现代医药、农药、材料领域具有非常普遍的应用,氟原子和c-f键的特殊性决定了在许多分子中引入氟元素可以较大程度的改变化合物的生物活性和物理特性。二氟甲基具有很好的代谢稳定性和亲酯性,通常可以改善化合物的溶解度或通透性,提高生物利用度和代谢稳定性。二氟甲基中的氢具有弱酸性,能够与其他物质形成氢键,有利于药物和受体的结合,从而提高药物活性。含有1-(二氟甲基)-1h-咪唑片段的化合物在药物化学领域的应用非常广泛,作为重要的分子砌块用于合成血凝素(ha)抑制剂、杂芳基syk抑制剂、治疗逆转录病毒科病毒感染的新型化合物等,在抗病毒、hiv感染、哮喘、copd、过敏性鼻炎、过敏性皮炎、类风湿性关节炎等众多疾病领域的药物开发中具有重要的应用价值。
3.现有已公开的4-取代-1-(二氟甲基)-1h-咪唑的制备方法中,咪唑的二氟甲基化反应选择性差、收率低,通常会生成摩尔比为1:1的同分异构体混合物,且目标产物和同分异构体的分离困难。且4-取代-1-(二氟甲基)-1h-咪唑的大规模生产通常使用氟利昂作为二氟甲基化试剂,环境危害大。
4.例如现有外文文献公开了使用氯二氟甲烷或二氟氯乙酸钠作为咪唑的氟代烷基化试剂,但是反应产物为4-取代-1-(二氟甲基)-1h咪唑和5-取代-1-(二氟甲基)-1h咪唑的同分异构体的混合物,目标产物分离后收率很低。
5.再如专利wo2015/140051a1公开了4-溴-1-(二氟甲基)咪唑的制备方法,该化合物用于合成sky抑制剂。该方法中使用氟利昂作为氟代烷基化试剂,最终收率仅为23%。
6.又如专利wo2018/145021a1公开了4-溴-1h-咪唑和二氟碘甲烷进行氟代烷基化反应,得到的产物也为溴取代位置不同的同分异构体的混合物,混合物后续分离难度大。
技术实现要素:
7.本发明所要解决的技术问题是针对现有技术的缺点和不足,提供一种4-卤代-1-(二氟甲基)-1h-咪唑的制备方法,该制备方法目标产物的选择性高,分离简单,目标产物的收率显著提高。
8.为解决以上技术问题,本发明采取如下技术方案:一种4-卤代-1-(二氟甲基)-1h-咪唑的制备方法,所述制备方法包括:使式ii所示
的化合物与脱卤试剂在有机溶剂中、惰性气体氛围下发生反应生成式iv所示的中间态,再使式iv所示的中间态在水存在下反应生成式i所示的化合物;所述脱卤试剂选自格氏试剂或有机锂试剂;所述格氏试剂为r-mg-br,所述有机锂试剂为r-li,其中r为c1-6烷基或苯基,所述式i和式ii中,x选自br或者i,所述式iv中,y选自mgbr或li;所述格氏试剂与所述式ii所示的化合物的摩尔比为2~4:1。
9.在一些优选实施方式中,所述脱卤试剂为格氏试剂。
10.在一些实施方式中,所述脱卤试剂与所述式ii所示的化合物的摩尔比为2~3:1。
11.在一些实施方式中,所述格氏试剂选自甲基溴化镁、乙基溴化镁和苯基溴化镁中的一种或多种的组合;所述有机锂试剂选自甲基锂、丁基锂、仲丁基锂、异丁基锂和叔丁基锂中的一种或多种的组合。
12.在一些实施方式中,所述式i和式ii中,x为br。
13.在一些实施方式中,所述有机溶剂选自四氢呋喃和乙醚中的一种或两种的组合。
14.在一些实施方式中,所述有机溶剂和式ii所示的化合物的体积质量比为5~15ml:1g。
15.在一些实施方式中,所述脱卤试剂为格氏试剂,所述生成式iv所示的中间态的反应的温度为-5~5℃,时间为1~5小时。
16.在一些实施方式中,所述脱卤试剂为有机锂试剂,所述生成式iv所示的中间态的反应的温度为-60~-30℃,时间为1~5小时。
17.本发明中反应的温度是指反应体系的外部控温装置测量到的温度,例如反应装置外的水浴或冷却设备中测量得到的温度。
18.在一些实施方式中,所述脱卤试剂为格氏试剂,惰性气体氛围下,将所述式ii所示的化合物溶解在所述有机溶剂中,将有机溶剂冷却至-5~5℃,将所述格氏试剂滴加至有机溶剂中,在-5~5℃反应1~5小时。
19.在一些实施方式中,所述脱卤试剂为有机锂试剂,惰性气体氛围下,将所述式ii所示的化合物溶解在所述有机溶剂中,将有机溶剂冷却至-60~-30℃,将所述有机锂试剂滴加至有机溶剂中,在-60~-30℃反应1~5小时。
20.在一些实施方式中,所述脱卤试剂为格氏试剂,所述生成式i所示的化合物的反应的温度为-5~5℃,时间为10-30分钟。
21.在一些实施方式中,所述脱卤试剂为有机锂试剂,所述生成式i所示的化合物的反应的温度为-60~-30℃,时间为10~30分钟。
22.在一些实施方式中,所述水相对于所述格氏试剂大大过量,水同时作为后处理溶剂。
23.在一些实施方式中,所述使式iv所示的中间态在水存在下反应生成式i所示的化合物具体为:再加入水进行反应和分层,得到有机相和水相,将有机相干燥、过滤、浓缩、柱层析得到所述式i所示的化合物。
24.本发明人经过研究发现,使用特定的脱卤试剂例如格氏试剂r-mg-br或者有机锂试剂r-li与式ii所示的化合物进行区域选择性交换,得到特定的如下结构所示的中间态,该中间态在加入水后,碳负离子和水中的质子结合,最终形成式i所示的化合物。并且通过控制脱卤试剂与式ii所示的化合物的摩尔比,可以实现式ii所示的化合物选择性取代特定位置的两个卤素取代基,生成式i所示的目标化合物,该反应选择性高,目标产物的收率高,且无目标产物的同分异构体产生,目标产物的分离工艺简单。
25.在一些实施方式中,所述制备方法还包括式iii所示的化合物 与氟代烷基化试剂在溶剂中,碱性条件下发生氟代烷基化反应生成式ii所示的化合物的步骤,所述式iii中,x选自br或者i,所述氟代烷基化试剂选自二氟溴乙酸乙酯和二氟氯乙酸钠中的一种或两种的组合。
26.在一些实施方式中,所述式iii中,x为br。
27.在一些实施方式中,所述溶剂选自四氢呋喃和乙腈中的一种或两种的组合。
28.在一些实施方式中,所述溶剂和式iii所示的化合物的体积质量比为5~10ml:1g。
29.在一些实施方式中,所述氟代烷基化反应的温度为35~70℃,时间为12~18小时。
30.在一些实施方式中,所述碱性条件通过加入选自氢氧化钠和碳酸钾中的一种或两种碱形成。
31.在一些实施方式中,所述碱和所述式iii所示的化合物的摩尔比为2~5:1。
32.在一些实施方式中,所述氟代烷基化试剂和式iii所示的化合物的摩尔比为1.2~3:1。
33.在一些实施方式中,所述生成式ii所示的化合物的步骤包括:将所述式iii所示的化合物溶解在溶剂中,加入碱,升温至35~70℃,加入所述氟代烷基化试剂进行氟代烷基化反应12~18小时。
34.在一些实施方式中,所述生成式ii所示的化合物的步骤还包括:在所述氟代烷基化反应结束后,降温、浓缩、加入冰水和乙酸乙酯进行分层,得到有机相和水相,对有机相洗涤、干燥、过滤、浓缩得到式ii所示的化合物的粗品,重结晶后得到式ii所示的化合物。
35.在一些实施方式中,所述4-卤代-1-(二氟甲基)-1h-咪唑的制备方法采用以下反应路线:。
36.本发明还提供一种4-卤代-1-(二氟甲基)-1h-咪唑的制备方法,所述制备方法包括以下步骤:惰性气体氛围下,将式ii所示的化合物溶解在有机溶剂中,将有机溶剂冷却至-5~5℃,将格氏试剂滴加至有机溶剂中,在-5~5℃反应1~5小时,之后加入水,体系分层,得到包含有式i所示的化合物的有机相和水相,之后,从有机相中分离得到式i所示的化合物;所述式i和式ii中,x选自br或者i,所述格氏试剂与所述式ii所示的化合物的摩尔比为2~4:1。
37.本发明还提供一种4-卤代-1-(二氟甲基)-1h-咪唑的制备方法,所述制备方法包
括以下步骤:惰性气体氛围下,将式ii所示的化合物溶解在有机溶剂中,将有机溶剂冷却至-60~-30℃,将有机锂试剂滴加至有机溶剂中,在-60~-30℃反应1~5小时,之后加入水,体系分层,得到包含有式i所示的化合物的有机相和水相,之后,从有机相中分离得到式i所示的化合物;所述式i和式ii中,x选自br或者i,所述有机锂试剂与所述式ii所示的化合物的摩尔比为2~4:1。
38.本发明还提供一种适用于制备4-卤代-1-(二氟甲基)-1h-咪唑的化合物,所述化合物具有下式ii或式iv所示的结构:;;其中x选自br或者i,y选自mgbr或li。
39.优选地,x为 br。
40.优选地,y为mgbr。
41.与现有技术相比,本发明具有如下技术优势:1、使用2,4,5-三卤代-1h-咪唑为底物进行二氟甲基化反应,不产生选择性问题,然后采用特定摩尔比的脱卤试剂与式ii所示的化合物进行反应,后续再加入水进行进一步的反应,可以高选择性高收率地得到目标化合物,且不会产生目标化合物的同分异构体,目标产物的分离简单。本发明可以实现目标化合物的收率为90%以上。
42.2、本发明避免使用氟利昂等具有环境危害的试剂,合成路线绿色环保。
43.3、采用本发明的制备方法,得到的目标化合物纯度高,可以高达97%,可用作药物合成中间体。
44.4、本发明的反应和纯化过程操作简单,反应条件温和可控,利于工业化生产。
附图说明
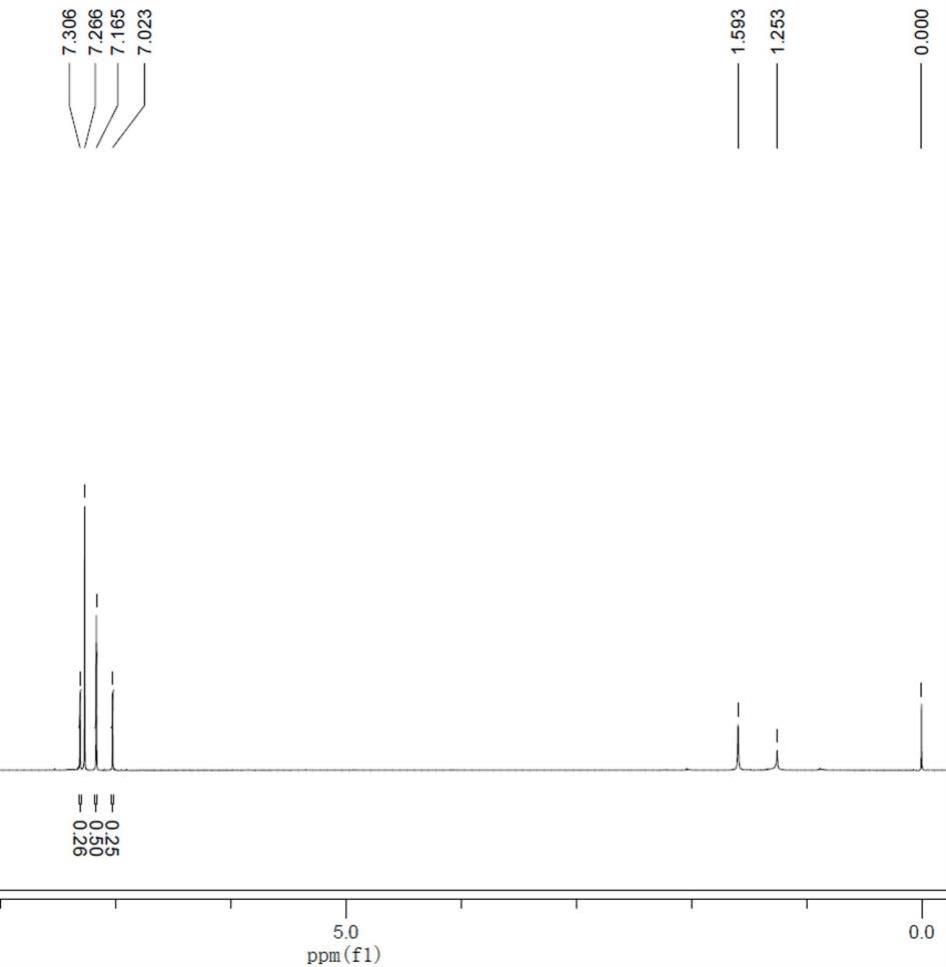
45.图1为实施例1中制备得到的2,4,5-三溴-1-(二氟甲基)-1h-咪唑的核磁谱图;
图2为实施例1中制备得到的4-溴-1-(二氟甲基)-1h-咪唑的核磁谱图;图3为实施例1中制备得到的4-溴-1-(二氟甲基)-1h-咪唑的质谱谱图。
具体实施方式
46.以下结合实施例对本发明做进一步的描述,但该实施例并非用于限制本发明的保护范围。
47.以下所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对下述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
48.以下所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
49.实施例1本实施例提供一种4-溴-1-(二氟甲基)-1h-咪唑的制备方法:步骤1:2,4,5-三溴-1-(二氟甲基)-1h-咪唑的制备将2,4,5-三溴-1h-咪唑(50 g,164.1 mmol)溶解在乙腈(300 ml)中,搅拌下加入碳酸钾(45.4 g,328.2 mmol)。将反应体系升温至50℃,将二氟溴乙酸乙酯(40.0 g,196.9 mmol)缓慢加入到反应体系,50℃搅拌过夜。tlc点板反应完全,将反应液降温至室温,浓缩除去溶剂。加入冰水(200 ml)和乙酸乙酯(300 ml),分层,有机相用水和饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩得到粗品,粗品重结晶得到2,4,5-三溴-1-(二氟甲基)-1h-咪唑57 g,其为白色固体,收率为98%。
50.2,4,5-三溴-1-(二氟甲基)-1h-咪唑的esi-ms (m/z)为354.65[m+h]
+
,其在cdcl3中的核磁共振氢谱如图1所示,具体数值如下:1h nmr (400 mhz, cdcl3):7.31 (s, 0.25h),7.16 (s, 0.5h),7.02 (s, 0.25h)。
[0051]
步骤2:4-溴-1-(二氟甲基)-1h-咪唑的制备氮气条件下,将2,4,5-三溴-1-(二氟甲基)-1h-咪唑(30 g,84.6 mmol)溶解在四氢呋喃(300 ml)中得到反应液。冷却到0℃,将甲基溴化镁(3 m,56.4 ml,169.2 mmol)缓慢滴加到反应液中,搅拌反应2小时。tlc点板反应完全。加入水(400 ml),0℃搅拌15分钟,体系分层,收集有机相。水层用乙酸乙酯萃取。有机相用无水硫酸钠干燥、过滤、浓缩得到粗品。粗品经柱层析纯化得到4-溴-1-(二氟甲基)-1h-咪唑15.9 g,其为无色油状,收率为95%,纯度为97%。
[0052]
4-溴-1-(二氟甲基)-1h-咪唑在cdcl3中的核磁共振氢谱如图2所示,具体数值如下:1h nmr (400 mhz, cdcl3):7.72 (s, 1h),7.22 (d, j = 1.2 hz, 1h),7.20 (s, 0.25h),7.04 (s, 0.51h),6.89 (s, 0.25h)。4-溴-1-(二氟甲基)-1h-咪唑的质谱谱图如图3所示,具体数值如下:esi-ms (m/z):196.90 [m+h]
+
。
[0053]
实施例2本实施例提供一种大规模生产4-溴-1-(二氟甲基)-1h-咪唑的方法:步骤1:2,4,5-三溴-1-(二氟甲基)-1h-咪唑的制备
将2,4,5-三溴-1h-咪唑(1.5 kg,4.9 mol)溶解在乙腈(7.5 l)中,搅拌下加入氢氧化钠(392 g,9.8 mol)。升温至50℃,将二氟溴乙酸乙酯(1.5 kg,7.4 mol)缓慢加入到反应体系中,50℃搅拌过夜。tlc点板反应完全,将反应液降温至室温,浓缩除去溶剂。加入冰水(8 l)和乙酸乙酯(8 l),分层,有机相用水和饱和食盐水洗涤,无水硫酸钠干燥,过滤,浓缩得到粗品。粗品重结晶得到2,4,5-三溴-1-(二氟甲基)-1h-咪唑1.69 kg,其为白色固体,收率为97%。
[0054]
步骤2:4-溴-1-(二氟甲基)-1h-咪唑的制备氮气条件下,将2,4,5-三溴-1-(二氟甲基)-1h-咪唑溶(1.6 kg,4.5 mol)溶解在无水四氢呋喃(12 l)溶液中,冷却到0℃。将甲基溴化镁(3 m,3.3 l,9.9 mol)缓慢滴加到反应液中,搅拌2.5小时。tlc点板反应完全。加入水(12 l),0℃搅拌30分钟,分层,收集有机相。水层用乙酸乙酯萃取。有机相用无水硫酸钠干燥,过滤,浓缩得到粗品。粗品经过减压蒸馏得到4-溴-1-(二氟甲基)-1h-咪唑859 g,其为无色油状物,收率为97%,纯度为97%。
[0055]
实施例3本实施例提供一种4-溴-1-(二氟甲基)-1h-咪唑的制备方法:步骤1同实施例1,步骤2基本同实施例1,区别仅在于:将甲基溴化镁的用量由169.2 mmol增加至253.8mmol。最终4-溴-1-(二氟甲基)-1h-咪唑的收率为95%,纯度为97%。
[0056]
实施例4本实施例提供一种4-溴-1-(二氟甲基)-1h-咪唑的制备方法:步骤1同实施例1,步骤2基本同实施例1,区别仅在于:将乙基溴化镁的用量由169.2 mmol增加至338.4mmol。最终4-溴-1-(二氟甲基)-1h-咪唑的收率为96%,纯度为96%。
[0057]
实施例5本实施例提供一种4-溴-1-(二氟甲基)-1h-咪唑的制备方法:步骤1同实施例1,步骤2基本同实施例1,区别仅在于:将甲基溴化镁替换为同摩尔量的乙基溴化镁。最终4-溴-1-(二氟甲基)-1h-咪唑的收率为93%,纯度为96%。
[0058]
实施例6本实施例提供一种4-溴-1-(二氟甲基)-1h-咪唑的制备方法:步骤2同实施例1,步骤1基本同实施例1,区别仅在于:将二氟溴乙酸乙酯替换为同摩尔量的二氟氯乙酸钠。最终4-溴-1-(二氟甲基)-1h-咪唑的收率为96%,纯度为95%。
[0059]
实施例7本实施例提供一种4-溴-1-(二氟甲基)-1h-咪唑的制备方法:步骤1同实施例1,步骤2如下:氮气条件下,将2,4,5-三溴-1-(二氟甲基)-1h-咪唑(30 g,84.6 mmol)溶解在四氢呋喃(300 ml)中得到反应液。冷却到-60℃,将叔丁基锂(1.3 m,130.2 ml,169.2 mmol)缓慢滴加到反应液中,搅拌反应2小时。tlc点板反应完全。加入水(400 ml),-60℃搅拌15分钟,体系分层,收集有机相。水层用乙酸乙酯萃取。有机相用无水硫酸钠干燥、过滤、浓缩得到粗品。粗品经柱层析纯化得到4-溴-1-(二氟甲基)-1h-咪唑15.3 g,其为无色油状,收率为92%,纯度为96%。
[0060]
核磁共振氢谱具体数值如下:1h nmr (400 mhz, cdcl3):7.72 (s, 1h),7.22 (d, j = 1.6 hz, 1h),7.18 (s, 0.23h),7.03 (s, 0.48h),6.88 (s, 0.24h)。
[0061]
实施例8本实施例提供一种4-溴-1-(二氟甲基)-1h-咪唑的制备方法:步骤1同实施例1,步骤2如下:氮气条件下,将2,4,5-三溴-1-(二氟甲基)-1h-咪唑(30 g,84.6 mmol)溶解在四氢呋喃(300 ml)中得到反应液。冷却到-60℃,将丁基锂(1.3 m,130.2 ml,169.2 mmol)缓慢滴加到反应液中,搅拌反应2小时。tlc点板反应完全。加入水(400 ml),-60℃搅拌15分钟,体系分层,收集有机相。水层用乙酸乙酯萃取。有机相用无水硫酸钠干燥、过滤、浓缩得到粗品。粗品经柱层析纯化得到4-溴-1-(二氟甲基)-1h-咪唑14.5 g,其为无色油状,收率为87%,纯度为96%。
[0062]
对比例1本对比例提供一种制备方法:步骤1同实施例1,步骤2基本同实施例1,区别仅在于:将乙基溴化镁的用量由169.2 mmol降低至84.6 mmol。结果发现,未制备得到4-溴-1-(二氟甲基)-1h-咪唑,得到的为4,5-二溴-1-(二氟甲基)-1h-咪唑。
[0063]
对比例2本对比例提供一种制备方法:步骤1同实施例1,步骤2基本同实施例1,区别仅在于:将乙基溴化镁替换为同摩尔量的亚硫酸钠。结果发现,反应收率低至50%,反应不完全且生成大量副产物。
[0064]
对比例3本对比例提供一种制备方法:步骤1同实施例1,步骤2基本同实施例1,区别仅在于:将乙基溴化镁替换为同摩尔量的硼氢化钠。结果发现,反应选择性差,产生同分异构体和不同溴取代的副产物,且副产物很难分离。
[0065]
可见,本发明通过先将格氏试剂或有机锂试剂与2,4,5-三卤代-1-(二氟甲基)-1h-咪唑进行反应,再加入水进行脱除反应,并通过控制格氏试剂或有机锂试剂与其的摩尔当量,可以实现2,4,5-三卤代-1-(二氟甲基)-1h-咪唑特定位置的卤素脱除,进而以高收率得到高纯度的目标产物。而对比例2-3中的试剂却无法用于本发明目标产物的合成。
[0066]
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1