抗新冠病毒纳米抗体、制备方法及其应用与流程
1.本发明属于生物医药技术领域,尤其涉及一种广谱抗新冠病毒纳米抗体、制备方法及其应用。
背景技术:
2.新型冠状病毒sars-cov-2一直不断的发生变异,目前出现的变异株包括alpha、beta、delta、omicron ba.1/ba.2/ba.1.12.1/ba.3/ba.4/5等,新的变异株不断的对现有的疫苗和治疗药物进行逃逸,严重危害人们的身体健康,为全球疫情带来严峻的挑战。
3.目前已上市的治疗新冠的大部分抗体药物对omicron变异株失效或中和能力极大减弱,仅有两个鸡尾酒抗体药物仍能对omicron变异株有较好的中和作用,我们之前已开发的抗新冠纳米抗体对omicron变异株的中和作用也有不同程度的降低。因此开发中和作用更好、更加广谱的抗体药物仍然是当前的首要任务之一。并且随着全球疫情逐渐常态化,人们急需一款可以预防新冠感染的药物,用于人群密集的场所。
4.目前已上市的抗体均为传统的抗体药物,生产成本高昂,且需要冷链保存,难以应用到常态化防疫中。纳米抗体作为一种新型抗体,具有分子量小、亲和力高、热稳定性强且生产成本低等优点,主要来源于鲨鱼和驼科。
5.综上所述,提供一种具备广谱的中和能力,生产成低本,耐热性好,可常温保存的抗新冠病毒纳米抗体,对于sars-cov-2防治领域具有重要意义。
技术实现要素:
6.本发明的目的在于提出一种抗新冠病毒纳米抗体、制备方法及其应用,具备广谱的结合能力,生产成低本,耐热性好,可常温保存,特异性高。
7.为达此目的,本发明采用以下技术方案:
8.本发明提供的抗新冠病毒纳米抗体,抗新冠病毒纳米抗体的互补决定区由cdr1和cdr3组成,cdr1为seq id no.1所示的氨基酸序列,cdr3为seq id no.3所示的氨基酸序列,或,cdr1为seq id no.2所示的氨基酸序列,cdr3为seq id no.4所示的氨基酸序列。
9.优选地,还包括高变区hv2和hv4,hv2为seq id no.5或seq id no.6所示的氨基酸序列,hv4为seq id no.7或seq id no.8所示的氨基酸序列。
10.优选地,还包括骨架区fr1、fr2和fr3,fr1为seq id no.9或seq id no.10所示的氨基酸序列,fr2为seq id no.11或seq id no.12所示的氨基酸序列,fr3为seq id no.13或seq id no.14所示的氨基酸序列。
11.优选地,抗新冠病毒纳米抗体的氨基酸序列如seq id no.15或seq id no.16所示。
12.seq id no.1:gssctlsd。
13.seq id no.2:dsscalas。
14.seq id no.3:eaysyycplygmgy。
15.seq id no.4:kaycpytagmtfssv。
16.seq id no.5:atkkanls。
17.seq id no.6:atneesls。
18.seq id no.7:ntask。
19.seq id no.8:nkask。
20.seq id no.9:veqtpttttkeagesltincvlk。
21.seq id no.10:leqtpttttkeagesltincvlr。
22.seq id no.11:tywyftkkgatkka。
23.seq id no.12:thwyftkkgatnee。
24.seq id no.13:nlstggrysdtkntasksfslrisdlrvedsgtyhc。
25.seq id no.14:slsnggryaetvnkasksfslrisdlrvedagtyhc。
26.seq id no.15:
27.maprveqtpttttkeagesltincvlkgssctlsdtywyftkkgatkkanlstggrysdtkntasksfslrisdlrvedsgtyhceaysyycplygmgyegggtivtvk。
28.seq id no.16:
29.maprleqtpttttkeagesltincvlrdsscalasthwyftkkgatneeslsnggryaetvnkasksfslrisdlrvedagtyhckaycpytagmtfssvggggttltvk。
30.本发明还提供核酸分子,核酸分子包括编码上述抗新冠病毒纳米抗体的核酸序列。
31.优选地,核酸分子包括seq id no.17或seq id no.18所示的核酸序列。
32.seq id no.17:
33.atggccccacgggttgaacaaacaccgacaacgacaacaaaggaggcaggcgaatcactgaccatcaattgcgtcctaaaaggttccagctgtacattgagtgacacgtactggtatttcacaaaaaagggcgcaacaaaaaaggcgaacttatcaactggcggacgatactcggacacaaagaatacggcatcaaagtccttttccttgcgaattagtgacctaagagttgaagacagtggtacatatcactgtgaagcgtatagttattactgtcccctctatgggatgggttatgaaggaggcggcaccattgtgactgtgaaa。
34.seq id no.18:
35.atggccccacggcttgaacaaacaccgacaacgacaacaaaggaggcaggcgaatcactgaccatcaattgcgtcctaagagattccagctgtgcattggctagcacgcactggtatttcacaaaaaagggcgcaacaaacgaggagagcttatcaaatggcggacgatacgcggaaacagtgaacaaggcatcaaagtccttttctttgcgaattagtgacctaagagttgaagacgctggtacatatcactgtaaagcgtattgcccgtatacagctgggatgacgttttccagtgtcggaggaggcggcaccactctgactgtgaaa。
36.本发明还提供重组载体,重组载体包括上述的核酸分子。
37.本发明还提供重组细胞,重组细胞包括上述的核酸分子或上述的重组载体。
38.本发明还提供上述的抗新冠病毒纳米抗体的制备方法,制备方法包括以下步骤:(1)使用sars-cov-2s1蛋白免疫条纹斑竹鲨,分离免疫后条纹斑竹鲨的外周血单核细胞并提取总rna,以所述rna为模板逆转录制备cdna,(2)以所述cdna为模板,pcr扩增纳米抗体可变区,构建噬菌体展示文库,(3)在所述噬菌体展示文库中筛选具有sars-cov-2抗原特异性的噬菌体抗体,并进行测序,获得抗体的核酸序列,(4)利用所述抗体的核酸序列构建表达
载体,并转入细胞进行表达及纯化,得到所述抗新冠病毒纳米抗体。
39.本发明还提供药物组合物,药物组合物包括上述的抗新冠病毒纳米抗体、上述的核酸分子、上述的重组载体、上述的重组细胞中的任意一种或至少两种的组合。
40.优选地,药物组合物还包括药学上可接受的载体,包括稀释剂、粘附剂或防腐剂中的任意一种或至少两种的组合。
41.本发明还提供如上述抗新冠病毒纳米抗体、上述的核酸分子、上述的重组载体、上述的重组细胞、上述的药物组合物在制备抗sars-cov-2药物中的应用。
42.本发明的有益效果为:
43.1、抗新冠病毒纳米抗体可有效解决新冠变异株逃逸的问题,具备广谱的中和能力,且可以在原核、真核系统中高效表达,生产成低本,耐热性好,可常温保存,特异性高,具备开发成鼻喷剂的潜力,在预防新冠病毒感染具有重要应用价值。
44.2、抗新冠病毒纳米抗体具备高亲和力,广谱结合乙型冠状病毒sarbecovirus亚属的病毒,包括不同sars-cov-2变异株,且可以在真核系统中高效表达,表达流程标准可控,可大大降低生产成本,同时,分子量小,理化性质稳定。
附图说明
45.图1是本发明抗新冠病毒纳米抗体(41a4-fc)纯化后蛋白电泳图。
46.图2是本发明抗新冠病毒纳米抗体(1c12-fc)纯化后蛋白电泳图。
47.图3-14为elisa检测本发明抗新冠病毒纳米抗体(41a4-fc)与不同突变sars-cov-2病毒rbd蛋白结合活性图。
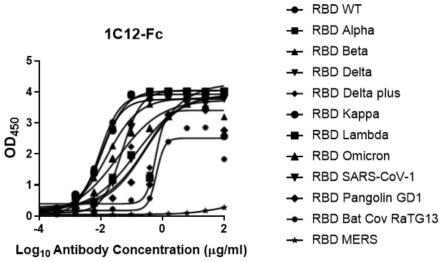
48.图15为elisa检测本发明抗新冠病毒纳米抗体(1c12-fc)与不同突变sars-cov-2病毒rbd蛋白结合活性图。
具体实施方式
49.现结合附图和具体实施方式对本发明进一步说明。
50.实施例一:
51.本实施例构建单链抗体噬菌体库,单链抗体噬菌体库的构建方法包括以下步骤:
52.(1)取100μg sars-cov-2s1蛋白(购自北京义翘神州)溶于250μl pbs中,并与等体积铝佐剂充分振荡乳化,皮下及肌肉多点注射免疫条纹斑竹鲨,共免疫6次,每次间隔2周;
53.(2)从第二次免疫开始,每次免疫一周后尾静脉采血1ml,将其中0.5ml经抗凝处理分离淋巴细胞,trizol裂解,-80℃保存备用;另外取0.5ml室温静置1小时,离心分离血清检测血清效价,最后一次免疫后尾静脉采血检测血清假病毒中和效价;
54.(3)取第3、4、5、6次免疫后的淋巴细胞裂解液,使用氯仿抽提总rna,采用bio-rad公司的逆转录试剂盒(bio-rad,cat:1708891)合成cdna;
55.(4)以上述cdna为模板,利用特异性引物;
56.上游引物:gcgaggaggaggcccagccggccatggccsmacggsttgaacaaacacc;
57.下游引物:ataagaatgcggccgcwttcacagtcasarkggtscc;
58.(参考文献,doi:10.1016/j.molimm.2006.07.299)扩增单链抗体可变区,pcr反应体系包括:
59.pcr扩增程序为:
60.98℃预变性30s;
61.98℃变性10s、61℃退火30s、72℃延伸30s,27个循环;
62.72℃延伸7min;
63.(5)使用1%琼脂糖凝胶电泳鉴定pcr产物,并进行回收纯化(magen dna凝胶回收试剂盒),得单链抗体可变区pcr产物,将单链抗体可变区pcr产物与pcantab5e噬菌粒载体分别进行noti和sfii双酶切,按载体150ng,片段50ng的比例于16℃连接过夜,连接产物经纯化后电转化入tg1感受态中,涂板,并同时做10倍倍比梯度稀释计算库容,37℃过夜培养,用涂布棒刮取平板上的菌落,重悬于培养基中,加入终浓度20%的甘油,-80℃保存备用,挑取96个克隆进行菌液pcr鉴定文库阳性转化率并测序验证抗体多样性,经鉴定,库容达2
×
108,阳性转化率100%,文库多样性大于90%。
64.实施例二:
65.本实施例进行sars-cov-2单链抗体筛选及表达,包括以下步骤:
66.(1)取100μl实施例一制备的单链抗体噬菌体库,接种于50ml含有氨苄抗生素和1%葡萄糖的2yt培养基中,37℃培养至对数期,加入20倍菌数的辅助噬菌体m13ko7,混匀后37℃静置20分钟,再振荡培养30分钟,离心,弃掉培养基,加入50ml2yt氨苄霉素卡那霉素培养基,30℃振荡培养过夜,第二天离心,收集上清,加入1/4体积的peg/nacl,4℃沉淀重组噬菌体2小时,离心收集噬菌体沉淀,使用5ml pbs溶解,重复沉淀1次,pbs溶解噬菌体,加入终浓度为15%的甘油,分装保存于-80℃备用,同时取10μl做10倍梯度稀释,感染对数期tg1,培养过夜,计算滴度。
67.(2)将omicron rbd或s抗原用cbs缓冲液稀释至10μg/ml,充分混匀后包被于96孔酶标板中,100μl/孔,4℃孵育12-16小时,丢弃上清,加入封闭液(5%脱脂牛奶溶解于pbst中),37℃封闭2小时,用0.05%pbst洗涤4次,2分钟/次,最后甩掉液体,备用。
68.(3)筛选:取100倍库容的重组噬菌体稀释于100μl封闭液中,加入包被了rbd或s抗原的酶标孔中,室温孵育2小时后,用0.1%pbst洗涤5-10次,2分钟/次,最后用100μl三乙胺洗脱结合在板上的噬菌体,并立即加入1m tris-hcl(ph 7.4)中和洗脱液,将其与3ml对数生长期tg1混合,静置30分钟,振荡培养30分钟,涂板,一部分用于梯度稀释计算库容,另一部分作为菌种库,37℃倒置培养过夜。
69.(4)重复2-4轮筛选,具体步骤如步骤(3)中所述,在步骤(3)基础上改变条件,增加洗涤次数15-30次,包被抗原量降低1-3倍,从最后一轮筛选获得的库中挑选单个克隆,进行phage elisa验证。
70.(5)phage elisa验证,挑取单个克隆于96孔板中,37℃振荡培养过夜,第二天接种于新的96孔板中(300μl培养基/孔),37℃振荡培养至对数期,加入20倍菌量的辅助噬菌体,37℃静置30分钟,再振荡培养30分钟,将培养基替换为2yt氨苄卡那培养基,30℃振荡培养过夜。取100μl上清于包被了rbd或s抗原(50ng/孔)的酶标板中,室温孵育2小时,同时用重组噬菌体库作为阳性对照,辅助噬菌体作为阴性对照,pbst洗板4次,加入hrp标记的抗m13抗体(购于成都阿帕克),100μl/孔,37℃孵育1小时,pbst洗板6次,加入tmb显色底物(购自millipore),100μl/孔,37℃避光孵育15分钟,加入50μl 1m h2so4终止,检测450nm吸光值。
71.(6)hek293表达:将phage elisa验证的阳性克隆进行测序,获得序列不同的抗体,
pcr扩增出不同的抗体序列构建至pcmv-igg1载体。将序列正确的质粒用pei转染至hek293细胞中表达3-7天,收集表达上清,离心过滤细胞碎片后进行protein a亲和纯化,最终获得如图1和图2所示的纯化后的抗新冠病毒纳米抗体:41a4-fc(seq id no.17)和1c12-fc(seq id no.18),纯度》93%。
72.实施例三:
73.本实施例检测实施例二制备的抗新冠病毒纳米抗体的结合能力,包括以下步骤:
74.(1)分别将rbd(332-527)蛋白(wh-hu-1、alpha、beta、delta、delta plus、kappa、lambda、omicron、sars-cov、pangolin gd1、bat cov ratg13)和mers rbd稀释于cbs缓冲液中,包被酶标板,50ng/100μl/孔,4℃孵育12小时,弃掉抗原,加入封闭液(5%脱脂牛奶溶解于pbst中),200μl/孔,37℃封闭2小时,洗板,0.05%pbst,200μl/孔,洗4次,2分钟/次,甩掉液体,拍干;
75.(2)分别将41a4-fc与1c12-fc抗体稀释于pbst中,从100μg/ml开始,做半对数稀释,共稀释12个梯度,100μl/孔加入酶标板中,37℃孵育2小时,pbst洗板4次,2分钟/次,加入hrp标记的抗his二抗,37℃孵育1小时,pbst洗板6次,2分钟/次,甩掉液体,拍干,加入tmb显色底物,100μl/孔,37℃避光孵育15分钟,加入50μl 1m h2so4终止,检测450nm吸光值,计算抗原抗体结合ec50,结果如图3和图15所示,41a4-fc和1c12-fc与sars-cov-2不同变异株的rbd、sars-cov、pangolin以及bat rbd均有很好的结合,对其他冠状病毒属的mers rbd则不结合,表明41a4-fc和1c12-fc具有广谱结合乙型冠状病毒sarbecovirus亚属的能力,并且特异性高。
76.以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解;其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1