一种内源性多肽的筛选方法及其筛选的多肽的应用与流程
1.本发明属于小分子多肽领域,具体涉及一种内源性多肽的筛选方法及其筛选的多肽的应用。
背景技术:
2.子宫内膜癌(ec)约占女性癌症总数的7%,是女性生殖道三大恶性肿瘤之一。近年来,我国子宫内膜癌发病率呈逐年上升和年轻化趋势。由于近30%子宫内膜癌患者呈恶性进展,发现时已为中晚期,即便穷尽现有综合治疗手段,其生存率仍无明显改善,且术后补充的放化疗本身亦存在一定毒副反应。基于此,临床迫切需要治疗子宫内膜癌的新靶标以制备天然低毒的生物靶向药物。目前,对子宫内膜癌发病、侵袭及转移相关恶性进展机制的了解仍然不够透彻。进一步剖析其发病机制,寻找新的靶点并开发新的生物治疗药物,成为当前妇科肿瘤防治研究领域的难点。
3.多肽(peptide)是一类α-氨基酸以肽键连接形成的化合物,以往被认为仅是大分子蛋白质的降解产物。近年来,随着多肽组学的不断发展,研究者逐渐认识到小分子多肽功能的多样性。基于多肽的分子量小,具有易被合成、低毒、高效以及靶向性强、易透过血脑屏障等等诸多优势,从多肽角度筛选、制备新型抗肿瘤生物药物具有天然优势。多肽极有可能成为治疗妇科恶性肿瘤尤其子宫内膜癌新的生物靶标。
4.内源性多肽主要来源于内源性蛋白的酶解或由非编码rna 编码,受益于质谱技术的快速发展,尤其是基于液相色谱-串联质谱技术(lc-ms/ms)的人体组织肽段分析为具有潜在生物学活性的内源性多肽的挖掘提供了可能。基于lc-ms/ms的多肽组学分析在子宫内膜癌组织中的应用尚处于不断尝试和完善中,深入挖掘子宫内膜癌组织分泌的内源性多肽分子表达特征,对于阐明子宫内膜癌的发生与恶性进展无疑具有重要的潜在科研价值,有望为制备子宫内膜癌生物靶点药物提供可能。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种内源性多肽的筛选方法及其筛选的多肽的应用。本发明筛选出一种在子宫内膜癌的恶性进展机理中发挥着重要作用的多肽,筛选得到的多肽制备治疗子宫内膜癌的药物提供新的选择。
6.为实现上述发明目的,本发明提供如下技术方案:一方面,本发明提供了一种内源性多肽的筛选方法,所述内源性多肽为pdaep-1,其氨基酸序列为iqgitkpair。
7.另一方面,本发明还提供了上述内源性多肽在制备子宫内膜癌的特异性靶点药物中的应用。
8.另一方面,本发明还提供了上述内源性多肽在制备预防或治疗子宫内膜癌药物中的应用。作为优选的,所述的子宫内膜癌为转移性子宫内膜癌。
9.另一方面,本发明还提供了一种内源性多肽的筛选方法,所述方法包括如下步骤:
(1)从已发生局部侵袭转移的子宫内膜癌患者癌组织标本提取多肽,并用超滤管进一步分离提纯,得到检测样本;(2)以液相色谱-串联质谱技术(lc-ms/ms)检测样本中内源性多肽的表达谱,得到在子宫内膜癌组织中差异性表达的多肽;(3)借助生物信息学预测方法获得具有潜在生物学活性的子宫内膜癌特异性内源性多肽。
10.优选的,步骤(1)中所述超滤管的分子量小于等于3kda。
11.步骤(2)中所述的差异性表达的p 《0.05。
12.步骤(3)中所述的生物信息学预测为将差异多肽前体蛋白与患者临床预后相关性进行评价。
13.步骤(3)中所述的内源性多肽来自前体蛋白histone h4。
14.与现有技术相比,本发明的有益效果是:本发明通过筛选获得一种来源于子宫内膜癌组织的内源性多肽,其以旁分泌的方式释放到病灶微环境中。本发明将分离提纯后的内源性多肽是否可能具备生物学活性功能置于优先考察的位置来进行筛选,并采用生物信息学分析工具筛选其前体蛋白表达水平与子宫内膜癌患者临床预后密切相关的多肽。经验证,筛选得到的pdaep-1多肽在子宫内膜癌的恶性进展机理中发挥着重要作用,可作为子宫内膜癌治疗靶点指标。以pdaep-1多肽为靶点,其可能成为治疗子宫内膜癌尤其侵袭转移患者的特异性靶点,应用在制备治疗子宫内膜癌的新型生物靶向药物的研发中;尤其针对已发生侵袭转移的子宫内膜癌患者的生物新药的研制具有重要的科研价值。
附图说明
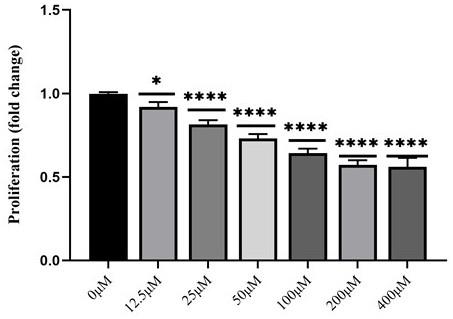
15.图1是不同浓度pdaep-1多肽对子宫内膜癌细胞hec-1-a增殖的影响图;图2 是pdaep-1多肽对子宫内膜癌细胞hec-1-a侵袭的影响图;图中,a为pdaep-1抑制hec-1-a侵袭的transwell典型图,b为transwell实验定量对比图;图3 是pdaep-1多肽对子宫内膜癌细胞hec-1-a迁移的影响图;图中,a为pdaep-1抑制hec-1-a迁徙的划痕实验典型图,b为划痕实验定量对比图;图4 是pdaep-1多肽体内对子宫内膜癌细胞hec-1-a侵袭转移的影响图。
具体实施方式
16.为了使本技术领域的人员更好地理解本技术方案,下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分的实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本技术保护的范围。
17.需要说明的是,本技术对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。下述实施例中所用的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
18.实施例1临床样本来源于南京市妇幼保健院;主要来自于接受手术治疗的女性患者,其术前没有接受包括放化疗在内的任何治疗且不合并有任何其他恶性肿瘤病史,术后均得到明确的病理学诊断。分别收集已发生局部侵袭转移的子宫内膜癌患者癌组织(年龄=57
±
5.5岁,实验组)以及同期年龄匹配的健康女性子宫内膜样本为对照样本(年龄=55
±
4.4岁,对照组)各3例,两组患者的年龄无统计学差异(p 》 0.05)。提取内源性多肽以供后续研究。
19.将提取获得的内源性多肽以3 kda分子量的超滤管进行多肽的进一步分离提纯。分离提纯后获得的多肽,运用lc-ms/ms方法检测多肽组分。结果显示共计有来自153种前体蛋白的383条多肽表达;其中12条多肽呈差异性表达。获得的多肽数量显著小于既往研究报道获得的差异多肽数量,大大简化了后期筛选的工作强度;且均位于其前体蛋白的功能区(变化倍数》1.5或《1/1.5,p 《 0.05)。表1是差异表达多肽信息。
20.表1. 差异表达多肽信息由表1及以上结果表明,与对照相比,癌组织分泌的多肽存在显著的差异性和特异性。
21.既往研究多采用先以亲脂性、等电点、不稳定性等理化性质进行考量后,即批量合成差异多肽行生物学功能检测,以此来筛选获得可能具备生物学活性功能的差异多肽。基于现有的多肽修饰发展水平,多肽的理化性质实际在后期可能通过包括化学方法在内的手段来进行一定程度的优化修饰。因此,本发明将多肽是否可能具备生物学活性功能置于优先考察的位置来首先进行筛选,为筛选到可能具有潜在生物学活性功能的目的差异多肽,采用生物信息学分析工具(the human protein atlas web server,https://
www.proteinatlas.org)筛选其前体蛋白表达水平与子宫内膜癌患者临床预后密切相关的多肽以进行下一步生物学活性功能验证研究。因内源性多肽的生物学活性功能往往与其前体蛋白相近或者相反,限定满足上述要求的多肽来自前体蛋白histone h4(https://www.proteinatlas.org/ensg00000278637-h4c1/pathology/endometrial+cancer,高表达患者5年生存率显著高于低表达患者,p 《 0.05),筛选后得到一个内源性多肽,将其命名为pdaep-1 (protein derived anti-ec peptide 1)。其氨基酸序列为iqgitkpair。对此序列进行下述功能验证。
22.实施例2:细胞活力检测实验(cck-8实验)以每孔4000个接种处于对数生长期的hec-1-a细胞于96孔板,置37℃ 5%co
2 细胞培养箱培养过夜,吸去培养基后加100μl含不同浓度(0μm、12.5μm、25μm、50μm、100μm、200μm、400μm)穿膜pdaep-1多肽的培养基(1%fbs),分别培养48h后,弃去培养基,各孔中加入含10μlcck-8检测溶液的新鲜培养基37℃下孵育 1~4 小时,酶标仪在 450nm 波长处检测每孔的吸光度。
23.图1是不同浓度pdaep-1多肽对子宫内膜癌细胞hec-1-a增殖的影响图;如图1所示,pdaep-1对ec细胞hec-1-a在≤400 400μm 浓度范围内均呈现出明显的增殖抑制作用(p<0.05,与0μm浓度组比较),且具有一定的浓度依赖性。
24.实施例3:细胞迁移侵袭实验1.transwell实验将小室放入24孔板中,下室加600μl完全培养基;消化、计数hec-1-a细胞后,上室加200μl基础培养基(含100μm pdaep-1多肽)制成的细胞悬液(1-10x104个细胞/孔)。将24孔板放入培养箱中培养48h后取出,弃去培养基,每孔加1ml 4%多聚甲醛4℃固定细胞30min。后上室加50μl、下室加300μl结晶紫染液染色30min,用棉签擦去孔膜上层的细胞,pbs清洗后拍摄膜底层细胞并测定、计算细胞量。(100x,4-6个视野;40x全图)。图2 是pdaep-1多肽对子宫内膜癌细胞hec-1-a侵袭的影响图;图中,a为pdaep-1抑制hec-1-a侵袭的transwell典型图,b为transwell实验定量对比图;control组意为未加pdaep-1多肽的对照组,peptide组为加了100μm pdaep-1的实验组;如图2所示,pdaep-1能够显著抑制hec-1-a细胞的侵袭转移能力。
25.2.划痕实验接种hec-1-a细胞于6孔板,培养细胞完全贴壁且铺满约70-80%,用10μl枪头在每孔板底部均匀笔直的划出约1mm细痕,pbs漂洗2-3次洗去划掉脱落细胞,以100μm 终浓度的pdaep-1多肽处理接种细胞,显微镜下观察在划痕后的0h、48h各组细胞的划痕愈合情况,并拍照记录,分析细胞迁移情况。图3 是pdaep-1多肽对子宫内膜癌细胞hec-1-a迁移的影响图;图中,a为pdaep-1抑制hec-1-a迁徙的划痕实验典型图,b为划痕实验定量对比图;control组意为未加pdaep-1多肽的对照组,peptide组为加了100μm pdaep-1的实验组;如图3所示,pdaep-1能够显著抑制hec-1-a细胞的迁移能力。由此可证实pdaep-1对的子宫内膜癌的侵袭迁移有着明显的影响,有望成为治疗转移性子宫内膜癌的新型靶点药物。
26.实验数据经graphpad prism软件计算,均以三次(或以上)实验的平均值
±
标准差表示,组间差异以student’s t-test检验(p 《 0.05具有显著差异;p 》 0.05无统计学差异)。
27.实施例4:动物实验实验遵循南京医科大学实验动物伦理要求,经尾静脉接种100μl重悬于培养液的hec-1-a细胞(密度5
×
107/ml)于雌性balb/c裸鼠(饲养于spf动物房)。2周后每周分别腹腔注射pdaep-1(20mmo l /l/kg)或等体积的生理盐水,连续6周。处死小鼠,将裸鼠的肺脏组织完整游离,石蜡包埋标本、切片后he染色,计数肺部转移瘤病灶数量。图4 是pdaep-1多肽在体内对子宫内膜癌细胞hec-1-a侵袭转移的影响图;如图4所示,pdaep-1能够显著抑制子宫内膜癌细胞hec-1-a在脏器(肺)内的转移。
28.对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1