一种三官能度交联剂及其制备方法和应用与流程
1.本技术涉及一种三官能度交联剂及其制备方法和应用,属于功能高分子材料领域。
背景技术:
2.柔性显示器具有轻、薄、不易碎的特点,且外观形态多样化,有无限的产品设计可能,是目前显示器的主要研究方向。与液晶显示器(lcd)相比,有机发光二极管(oled)显示器结构简单,更适合制作柔性显示器。oled显示器在2020年的市场规模已经到了160亿美元。oled具有高发光效率、高对比度,在手机、数码相机、导航仪、商业标识等方面可获得广泛的应用。
3.聚酰亚胺具有优异的透光率、热特性、机械特性,广泛应用于电学、电子学、车辆、飞机、半导体等领域。低温固化型的光敏性聚酰亚胺可涂覆于oled器件的玻璃基底上,刻画图案后,再低温热处理即可在基底表面新成一层聚酰亚胺薄膜,起到绝缘、隔水隔氧等钝化作用。由于oled器件的特殊要求,可用于oled器件的光敏聚酰亚胺涂层胶的性能要求也非常苛刻,如低固化温度、低介电常数、高耐热性等。
4.目前关于oled器件封装层用光敏聚酰亚胺涂层胶的研究主要有:专利cn 109153841 a中通过在耐碱性树脂上引入具有交联性基团的酚骨架和不具有交联性基团的酚骨架,制备出的树脂组合物可在低温固化的条件下获得优异的耐化学药品性、低应力、高伸长率性的固化膜。专利cn 108779251 a利用具有苯并噁唑前体结构及脂肪族基团的碱溶性树脂、热产酸剂及抗氧化剂制备出能够在低温热处理进行固化同时具有优异的耐热性、耐化学药品性及断裂伸长率的固化膜,可用于有机电致发光元件的绝缘层。此外还可制备出可溶性的聚酰亚胺或聚异酰亚胺来实现树脂的低温固化,但往往会溶解性不好,应用受限。专利cn 102047178b 中添加丸善石油化学株式会社制的商业化的热交联剂,来提高固化膜的拉伸伸长率,同时显示出良好的密合性和光刻性能,但由于这种交联剂为亚胺化的结构,会导致在一些低溶解性的溶剂如el、pgme中溶解度差,而这些低溶解性溶剂又是提高固化膜均匀性不可或缺的。此外丸善石油的交联剂只含有两个可聚合的双键,在提高膜性能上存在一定缺陷。
技术实现要素:
5.根据本技术的第一个方面,提供了一种三官能度交联剂,该交联剂的结构中含有可交联反应的双键或炔基,在组合物固化过程中可产生交联进而改善成膜性,提高玻璃化转变温度。同时该交联剂含有n杂环基团,n杂环基团中的氮原子可以结合氢离子形成络合物,因此可促进聚酰胺酸或聚酰胺酸酯的脱水环化反应,进而降低组合物的固化温度。该交联剂中含酰胺酸酯结构,与聚酰胺酸、聚酰胺酸酯等耐热树脂的相容性高,同时在溶剂中的溶解性优于酰亚胺结构的交联剂,尤其是γ-丁内酯、乳酸乙酯、丙二醇甲醚等溶剂中,除此之外该交联剂经过受热处理后可形成一个交联网络,大幅度提高固化膜的耐热性,同时交
联网络中n 杂原子的存在还可降低固化膜的介电常数,进而形成一种低介电、高耐热的低温固化型光敏聚酰亚胺组合物。
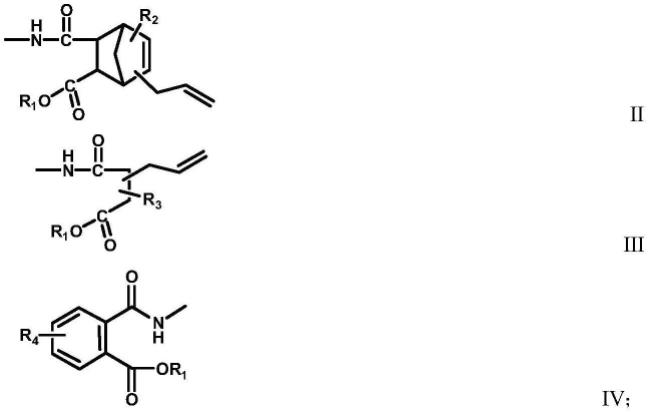
6.一种三官能度交联剂,所述三官能度交联剂具有通式ⅰ所示结构:
[0007][0008]
其中,w为含n杂环的有机基团;
[0009]
x1、x2、x3分别独立的选自通式ⅱ~ⅳ中任一所示结构;
[0010][0011][0012]
所述通式ⅱ~ⅳ中:
[0013]
r1为碳原子数1~20的烷基或烷氧基;
[0014]
r2、r3为氢原子或碳原子数1~6的有机基团;
[0015]
r4为含炔基的有机基团。
[0016]
可选地,r2、r3为氢原子或碳原子数1~3的烃基。
[0017]
可选地,x1、x2、x3为相同的结构。
[0018]
可选地,w为碳原子数2~40的有机基团;
[0019]
r4选自碳原子数2~20的含炔基有机基团;
[0020]
r4选自碳原子数2~10的烷基、碳原子数2~10的烷氧基、碳原子数2~20的苯基。
[0021]
可选地,n杂环选自三嗪、三唑、吡啶、咔唑、嘧啶、咪唑、苯并噻唑中的一种。
[0022]
可选地,r1选自甲基、乙基、丙基、正丁基、叔丁基、甲基丙烯酸羟乙基中的一种。
[0023]
可选地,r4选自中的一种。
[0024]
可选地,w选自以下结构式:
[0025][0026]
根据本技术的第二个方面,提供了一种三官能度交联剂的制备方法。
[0027]
一种三官能度交联剂的制备方法,包括以下步骤:
[0028]
s1、将含有酸酐、n杂环化合物、有机溶剂的混合物,反应ⅰ,得到前驱体液;
[0029]
s2、将酯化试剂加入前驱体液中,反应ⅱ,得到三官能度交联剂。
[0030]
可选地,步骤s1中,所述酸酐选自以下结构中任一种:
[0031][0032]
其中,r2、r3、r4同上述所述r2、r3、r4的范围。
[0033]
可选地,所述酸酐含双键或炔基。
[0034]
可选地,含双键的所述酸酐为5-烯丙基纳迪克酸酐、烯丙基丁二酸酐。
[0035]
可选地,含炔基的的所述酸酐为4-乙炔基苯酐、甲基乙炔基苯酐。
[0036]
可选地,步骤s1中,所述n杂环化合物选自以下结构所示的化合物:
[0037][0038]
可选地,步骤s1中,所述有机溶剂选自n-甲基吡咯烷酮、γ-丁内酯、四氢呋喃、二氧杂环己烷、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲基亚砜、乙酸乙酯、乙酸丁酯、乳酸乙酯、甲苯、二甲苯、二乙二醇二甲醚、二乙二醇二甲乙醚中的至少一种。
[0039]
可选地,步骤s1中,所述酸酐与所述n杂环化合物的摩尔比为3:0.9~1.1。
[0040]
可选地,所述酸酐与所述n杂环化合物的摩尔比为3:0.95~1.05。
[0041]
可选地,所述酸酐与所述n杂环化合物的摩尔比独立地选自3:0.90、3:0.92、3:0.95、3:0.97、3:1.00、3:1.02、3:1.05、 3:1.07、3:1.10中的任意值或任意两者之间的范围值。
[0042]
可选地,步骤s1中,所述酸酐与所述有机溶剂的质量比为5~50:100。
[0043]
可选地,步骤s1中,所述酸酐与所述有机溶剂的质量比独立地选自5:100、6:100、7:100、8:100、9:100、10:100、 15:100、20:100、25:100、30:100、35:100、40:100、45:100、50:100中的任意值或任意两者之间的范围值。
[0044]
可选地,步骤s1中,反应ⅰ的条件如下:
[0045]
温度为10℃~150℃;
[0046]
时间为3h~24h。
[0047]
可选地,温度独立地选自10℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃、100
℃、110℃、120℃、130℃、 140℃、150℃中的任意值或任意两者之间的范围值。
[0048]
可选地,时间独立地选自3h、4h、5h、6h、7h、8h、9h、10h、11h、12h、13h、14h、15h、16h、17h、18h、19h、20 h、21h、22h、23h、24h中的任意值或任意两者之间的范围值。
[0049]
可选地,步骤s2中,所述酯化试剂选自n,n-二甲基甲酰胺二甲基缩醛、n,n-二甲基甲酰胺二乙基缩醛、n,n-二甲基甲酰胺二丙基缩醛、n,n-二甲基甲酰胺二新戊基丁基缩醛、n,n-二甲基甲酰胺二叔丁基缩醛、1-甲基-3-对甲苯基三氮烯、1-乙基-3-对甲苯基三氮烯、1-丙基-3-对甲苯基三氮烯、4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉滃盐酸盐、甲基丙烯酸羟乙酯、4-硝基苄醇中的至少一种。
[0050]
可选地,步骤s2中所述酯化试剂的加入量与步骤s1中所述酸酐的加入量的摩尔比为1~5:1。
[0051]
可选地,步骤s2中所述酯化试剂的加入量与步骤s1中所述酸酐的加入量的摩尔比为1.2~3:1。
[0052]
可选地,步骤s2中所述酯化试剂的加入量与步骤s1中所述酸酐的加入量的摩尔比独立地选自1.0:1、1.2:1、1.4:1、1.6: 1、1.8:1、2.0:1、2.2:1、2.4:1、2.6:1、2.8:1、3.0:1、3.2:1、3.4:1、3.6:1、3.8:1、4.0:1、4.2:1、4.4:1、4.6:1、 4.8:1、5.0:1中的任意值或任意两者之间的范围值。
[0053]
可选地,步骤s2中,反应ⅱ的条件如下:
[0054]
温度为20℃~80℃;
[0055]
时间为2h~24h。
[0056]
可选地,温度独立地选自20℃、30℃、40℃、50℃、60℃、70℃、80℃中的任意值或任意两者之间的范围值。
[0057]
可选地,时间独立地选自3h、4h、5h、6h、7h、8h、9h、10h、11h、12h、13h、14h、15h、16h、17h、18h、19h、20 h、21h、22h、23h、24h中的任意值或任意两者之间的范围值。
[0058]
另一方面,本发明提供一种含n杂环的三官能度交联剂的制备方法,具体包括以下步骤:
[0059]
sp1:称取一定量的含n杂环三胺溶解到一定量的溶剂中。
[0060]
sp2:在sp1反应体系中加入一定量的含双键或炔基的酸酐,10℃~150℃条件下反应3h~24h。
[0061]
sp3:sp2反应结束后,在反应液中加入酯化试剂,20℃~80℃反应2h~24h。
[0062]
sp4:反应完成后,将反应液倒入去离子水中,析出得到交联剂沉淀。将交联剂沉淀过滤后用去离子水洗涤三次后,40℃~ 100℃真空条件下干燥36h~120h,得含n杂环的三官能度交联剂。
[0063]
进一步的,sp2的反应温度优选的为50℃~120℃,更优选的为70℃~90℃。
[0064]
进一步的,sp4的反应温度优选的为25℃~50℃,兼顾酯化效率及亚胺化副反应,更优选的为30℃~40℃。
[0065]
进一步的,含n杂环的三官能度交联剂中含有双键或炔基,可在一定温度条件下发生热交联反应,为提高交联效果或降低交联温度可配合催化剂使用。该交联剂除含可交联的官能团外,主体为含n杂环结构,n杂环上氮原子的存在可增强交联剂本身的功能性。此外该交联剂为酰胺酸酯类结构,稳定性较酰胺酸类结构的交联剂更好,溶解性较酰亚胺类的
更好,应用范围也更广。含 n杂环的三官能度交联剂可作为添加剂应用于聚酰胺酸、聚酰胺酸酯、聚酰亚胺、聚苯并噁唑前体、聚苯并噁唑、聚酰胺、聚苯并咪唑、聚苯并噻唑、酚醛树脂、聚丙烯酸酯等聚合物为主题结构的材料中,在不同聚合物材料中也会表现出不同的功能性特征,也可根据不同的应用领域及应用要求来调整添加量或者与其他不同类型的催化剂、添加剂复合使用。
[0066]
根据本技术的第三个方面,提供了一种感光树脂组合物。
[0067]
一种感光树脂组合物,包括以下组分:
[0068]
组分a:聚酰胺酸、聚酰胺酸酯中的至少一种;
[0069]
组分b:三官能度交联剂;
[0070]
组分c:感光剂;
[0071]
组分d:溶剂;
[0072]
组分e:硅烷偶联剂、流平剂、消泡剂中的至少一种;
[0073]
所述三官能度交联剂选自上述所述的三官能度交联剂。
[0074]
可选地,组分a与组分b的质量比为100:0.5~30。
[0075]
可选地,组分a与组分b的质量比为100:5~20。
[0076]
进一步地,感光树脂组合物制备方法是按以下步骤进行:
[0077]
将组分a、组分b、组分c、组分d按照一定比例混合均匀,再加入组分e混合均匀得到一定粘度的聚合物溶液,将聚合物溶液用0.1μm~5μm孔径大小的过滤器进行过滤,去除杂质即可得到感光组合物。
[0078]
进一步的,组分a为通式(8)所示聚酰亚胺酸、聚酰亚胺酸酯结构:
[0079][0080]
进一步的,所述通式(8)中,x1表示碳原子数4~40的4价的有机基团;y1表示碳原子数2~40的2价的有机基团;r5和 r6分别独立地表示氢原子或碳原子数1~10的饱和脂肪族基团、不饱和脂肪族基团;n表示2~200的整数。
[0081]
进一步的组分a由二酐单体、二胺单体及酯化试剂通过反应获得。
[0082]
进一步的,二酐单体可选自4,4'-氧双邻苯二甲酸酐、2,3,3’,4
’‑
二苯醚四甲酸二酐、3,3’,4,4
’‑
联苯四甲酸二酐、2,3’4,4
’‑
联苯四甲酸二酐、均苯四甲酸二酐、2,2’,3,3
’‑
二苯甲酮四甲酸二酐、2,2-双(2,3-二羧基苯基)丙烷二酐、双酚a型二醚二酐、1,1
‑ꢀ
双(2,3-二羧基苯基)乙烷二酐、2,2-双(3,4-二羧基苯基)六氟丙烷二酐、4,4'-(六氟异丙烯)二酞酸酐、9,9-双(3,4-二羧基苯基)芴二酸酐、3,3,4,4-二苯基砜四羧酸二酸酐。
[0083]
进一步的,二胺单体可选自:2,2
’‑
双(3-氨基-4羟基苯基)六氟丙烷、4,4
’‑
二氨基二苯醚、2,2
’‑
双(三氟甲基)-4,4
’‑
二氨基苯基醚、4,4'-二氨基-2,2'-二甲基联苯、联苯二胺、对苯二胺、3,3
’‑
二羟基联苯胺、2,2
’‑
二(3-氨基-4-羟基苯基)丙烷、2,2
’‑
二(3-氨基-4
‑ꢀ
羟基苯基)二苯砜、2,2-双[4-羟基-3-(3-氨基)苯甲酰胺基]六氟丙烷、2,2
’‑
二(三氟甲
基)-(1,1
’‑
二苯基)4,4
’‑
二胺、9,9-双(4-氨基苯基)芴、2,2-双(4-(4-氨基苯氧基苯基))丙烷、2,2-双(4-(4-氨基苯氧基)苯基)六氟丙烷、3,3
’‑
二(2,3,5,6-四氟-4-乙烯基苯氧基)
‑ꢀ
4,4
’‑
联苯二胺、2,2
’‑
二[4-(2,3,5,6-四氟-4-乙烯基苯氧基)-3-氨基苯基]六氟丙烷、2,2
’‑
二[4-(2,3,5,6-四氟-4-乙烯基苯氧基)-3-氨基苯基]丙烷、1,3-二(1-氨基-3-三氟甲基苯氧基)-5-(2,3,5,6-四氟-4-乙烯基苯氧基)苯和1,3-二氨基苯氧基-5-(2,3,5,6-四氟-4-乙烯基苯氧基)苯。
[0084]
进一步的,组分b为结构式ⅰ~ⅳ所示含n杂环的三官能度交联剂,组分a与组分b的质量比为100:0.5~30;
[0085]
优选的,组分a与组分b的质量比为100:5~20;
[0086]
进一步的,组分c为感光剂,感光剂c根据本发明的感光性树脂组合物的组分a的不同而异。
[0087]
首先以负型所期望的情况进行说明。这种情况下的使用光聚合引发剂作为c感光剂,优选为光自由基聚合物引发剂,例如可以使用苯乙酮系化合物、联咪唑系化合物、三嗪系化合物、肟系化合物或2种及以上的混合物。作为上述光聚合引发剂,可优选列举出1-(4-苯硫基-苯基)-辛-1,2-二酮-2-肟-0-苯甲酸酯、2-羟基-2-甲基-1-苯基丙烷-1-酮、1-羟基环己基苯基酮、二苯偶酰酮、 4-苯甲酰基-4
’‑
甲基二苯基酮、芴酮、2,2
’‑
二乙氧基苯乙酮、2-羟基-2-甲基苯丙酮、2-环氧乙基-2-{4-[2,4-双(三氯甲基)-均三嗪-6-基]苯硫基}乙酸酯,但不限定于这些。上述光聚合物引发剂种,特别是从感光度的方面考虑,更优选为肟酯类。
[0088]
接着对以正型为所期望的情况进行说明。这种情况下使用光产酸剂作为c感光剂,具体而言,可以使用重氮醌化合物、鎓盐、含卤素的化合物等,但从溶剂溶解性及保存稳定性的观点出发,优选为醌二叠氮的磺酸通过酯键键合到多羟基化合物上所得的酯类化合物,作为多羟基化合物,可以列举出:2,6-二甲氧基甲基-4-叔丁基苯酚、2,6-二甲氧基-对甲酚、2,6-二乙酰氧基甲基-对甲酚、四羟基二苯甲酮等,但不限定于此。商品化的醌二叠氮化合物是优选的对象,例如nt-300、4nt-350、4nt-300、hp-190(日本东洋合成工业(株)制造)。
[0089]
进一步的,组分a与组分c的质量比为100:0.1~30;
[0090]
优选的,组分a与组分c的质量比为100:2~25;
[0091]
进一步的,所述组分d溶剂为n-甲基-2-吡咯烷酮、γ-丁内酯、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲基亚砜、四氢呋喃、二氧杂环己烷、丙二醇单甲基醚、丙二醇单乙基醚、丙酮、甲基乙基酮、二异丁基酮、乙酸乙酯、乙酸丁酯、乙酸异丁酯、乙酸丙酯、丙二醇单甲基醚乙酸酯、乙酸3-甲基-3-甲氧基丁酯、乳酸乙酯、乳酸甲酯、二丙酮醇、3-甲基-3-甲氧基丁醇、甲苯、二甲苯等芳香族烃类等的一种或两种以上。
[0092]
进一步的,组分a与组分d的质量比为100:70~3000;
[0093]
优选的,组分a与组分d的质量比为100:150~1500。
[0094]
进一步地,组分e中硅烷偶联剂可举出γ-缩水甘油醚氧丙基三甲氧基硅烷、(8-环氧丙氧基辛基)三甲氧基硅烷、(3-环氧丙氧基丙基)三甲氧基硅烷、3-(三乙氧硅基硫代)丙基三甲氧基硅烷、3-(三甲氧基硅烷基)-1-丙硫醇、γ-硫丙基三乙氧基硅烷(南京轩浩新材料科技,kh-580)、3-脲基丙基三乙氧基硅烷、3-脲丙基三甲氧基硅烷、1-丙基-1-(三乙氧基
硅基)甲基脲等。
[0095]
进一步的,组分a与硅烷偶联剂的质量比为100:0.1~30;
[0096]
优选的,组分a与硅烷偶联剂的质量比为100:0.1~15;
[0097]
优选的,组分a与硅烷偶联剂的质量比为100:0.5~10;
[0098]
进一步的,流平剂可举出丙烯酸类流平剂、有机硅类流平剂、含氟类的流平剂等。
[0099]
进一步的,组分a与流平剂的质量比为100:0.1~10;
[0100]
进一步的,消泡剂可举出byk-a530、byk-a550、airex-920工业化产品。
[0101]
进一步的,组分a与消泡剂的质量比为100:0.1~10;
[0102]
进一步的,根据应用的需要感光树脂组合物中还可包含光引发剂、交联剂、阻聚剂等添加剂,添加剂可选自现有技术公布的类型。
[0103]
根据本技术的第四个方面,提供了一种oled器件。
[0104]
一种oled器件,包括钝化绝缘层;
[0105]
所述钝化绝缘层选自上述所述的感光树脂组合物。
[0106]
本技术能产生的有益效果包括:
[0107]
1)本技术所提供的一种三官能度交联剂,该三官能度交联剂含有酰胺酸酯结构,与聚酰胺酸、聚酰胺酸酯等耐热树脂具有很高的相容性,同时在溶剂中的溶解性优于酰亚胺结构的交联剂,尤其是γ-丁内酯、乳酸乙酯、丙二醇甲醚等溶剂中;该交联剂储存稳定性优于酰胺酸结构的交联剂。该交联剂具有低介电、高耐热性。
[0108]
2)本技术所提供的感光树脂组合物,可用于半导体芯片封装,可用于改善封装层的成膜性,提高封装层的玻璃化转变温度、机械强度,降低封装层的固化温度,使得芯片的可靠性和信赖性大大提升。
附图说明
[0109]
图1为本技术oled器件剖面图。
[0110]
图2为实施例13感光树脂组合物的不同固化温度下的红外光谱图。
[0111]
图3为不同固化温度的亚胺化率变化图。
[0112]
部件和附图标记列表:
[0113]
1-玻璃基板;2-氧化铟锡;3-钝化绝缘层;4-发光层;5-阴极;6-隔离柱。
具体实施方式
[0114]
下面结合实施例详述本技术,但本技术并不局限于这些实施例。
[0115]
如无特别说明,本技术的实施例中的原料均通过商业途径购买。
[0116]
本技术的实施例中分析方法如下:
[0117]
(1)红外光谱测试
[0118]
使用红外光谱仪(岛津,iraffinity-1s)采用kbr压片法测试合成的交联剂样品,以检测是否成功制备出本发明中的交联剂。
[0119]
(2)交联剂纯度测试
[0120]
使用液相色谱仪(岛津,lc-2030)测试合成得到的交联剂纯度。色谱柱:c18;波长:254nm;柱温箱:40℃;流动相:0.1%磷酸水溶液:乙腈=40:60;流速:1.0ml/min。
[0121]
(3)交联剂溶解度测试
[0122]
称取100g的γ-丁内酯(gbl)、乳酸乙酯(el)或丙二醇甲醚(pgme)于烧杯中,放入水浴锅中恒温至30℃,称取一定量的交联剂放入上述溶剂中,搅拌溶解,重新再加入一定量的交联剂,直至溶液达到饱和状态,计算溶解的交联剂的总重量m即为该交联剂的在该溶剂中的溶解度,单位记为g/100g。
[0123]
(4)成膜性
[0124]
将树脂组合物样品均匀的涂覆到硅晶片上,然后将其放在120℃的加热台(ht-300实验电热板,广州格丹纳仪器有限公司) 上进行3分钟软烘,得到膜厚为10um~20um的树脂膜。然后将该膜放置在真空无氧烤箱(molzk-32d1)中,氮气气氛保护下,在170℃下热处理30分钟后,再经过1h升温至250℃,并在250℃下处理1h,随后直接在烘箱中自然冷却至50℃以下,最终得到固化膜。将带有固化膜的硅片放于氢氟酸溶液中,对硅片进行腐蚀脱膜。用以下标准对成膜性进行评价。
[0125]“优”:树脂组合物可成膜,有韧性,对折不断裂;
[0126]“良”:树脂组合物可成膜,有韧性,对折断裂;
[0127]“差”:树脂组合物无法成膜,呈碎片状。
[0128]
成膜性为“优”时,则可进一步进行其它试验评价。
[0129]
(5)固化膜亚胺化率测试
[0130]
使用红外光谱仪(岛津,iraffinity-1s)采用atr法分别测试固化温度250℃和350℃固化膜的红外光谱图,记录1380cm-1
处c-n键的伸缩振动吸收峰的强度a和1500cm-1
处的苯环的吸收峰强度a。
[0131]
亚胺化程度α的计算公式如下所示:
[0132][0133]
(6)玻璃化转变温度测试
[0134]
将250℃所制得的固化膜约10g装在铝制标准容器中,使用士差扫描量热仪dsc-25(美国ta仪器沃特斯公司)进行玻璃化转变温度(tg)的测定。首先于80℃预干燥1小时,然后以20℃/min的升温速度进行测定。
[0135]
(7)拉伸强度测试
[0136]
将感光树脂组合物制备的固化膜切割成尺寸为长40毫米、宽5毫米的样品条,利用dma-850(美国ta仪器沃特斯公司) 对样条进行拉伸强度测试,温度150℃、拉力范围0-18n,速率3n/min。
[0137]
(8)介电常数测试
[0138]
25℃下,novocontrol宽频介电与阻抗谱仪(bds 40德国),采用电极直径2厘米,测试频率范围:0.1hz~100mhz。
[0139]
本技术所用略号如下所示:
[0140]
nmp:n-甲基吡咯烷酮
[0141]
gbl:γ丁内酯
[0142]
el:乳酸乙酯
[0143]
pgme:丙二醇甲醚
[0144]
odpa:4,4-氧双邻苯二甲酸酐
[0145][0146]
hfha:2,2-双[4-羟基-3-(3-氨基)苯甲酰胺基]六氟丙烷
[0147][0148]
bahf:2,2-双(3-氨基-4-羟基苯基)六氟丙烷
[0149]
oda:4,4
’‑
二氨基二苯基醚
[0150]
ad-1:5-烯丙基纳迪克酸酐
[0151][0152]
ad-2:烯丙基丁二酸酐
[0153][0154]
ad-3:4-乙炔基苯酐
[0155][0156]
ad-4:甲基乙炔基苯酐
[0157][0158]
im-1:2,4,6-三氨基嘧啶
[0159][0160]
im-2:1,3,5-三嗪-2,4,6-三胺
[0161][0162]
im-3:2,4,6-三(4-氨基苯基)-1,3,5-三嗪
[0163][0164]
im-4:9-(4-氨基苯基)-9h-咔唑-3,6-二胺
[0165][0166]
im-5:4-[双(4-氨基苯基)-4h-1,2,4-三唑-3-基]苯胺
[0167][0168]
im-6:
[0169][0170]
合成例1:
[0171]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、12.51g的im-1(0.1mol)搅拌溶解后,缓慢加入61.26g(0.3mol)的ad-1,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g
(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-1。
[0172][0173]
所得交联剂pm-1结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的— nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210 cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0174]
合成例2:
[0175]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、12.61g的im-2(0.1mol)搅拌溶解后,缓慢加入61.26g(0.3mol)的ad-1,待加料完成后80℃下反10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-2。
[0176][0177]
所得交联剂pm-2结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的— nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210 cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0178]
合成例3:
[0179]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g的im-3(0.1mol)搅拌溶解后,缓慢加入61.26g(0.3mol)的ad-1,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00gnmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-3。
[0180][0181]
所得交联剂pm-3结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的— nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210 cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0182]
合成例4:
[0183]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、28.84g的im-4(0.1mol)搅拌溶解后,缓慢加入61.26g(0.3mol)的ad-1,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-4。
[0184][0185]
所得交联剂pm-4结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的— nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210 cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0186]
合成例5:
[0187]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、34.24g的im-5(0.1mol)搅拌溶解后,缓慢加入61.26g(0.3mol)的ad-1,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-5。
[0188][0189]
所得交联剂pm-5结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的— nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0190]
合成例6:
[0191]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、12.51g(0.1mol)的im-1搅拌溶解后,缓慢加入42.04g(0.3mol)的ad-2,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-6。
[0192][0193]
所得交联剂pm-6结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的— nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210 cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0194]
合成例7:
[0195]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、12.61g(0.1mol)的im-2搅拌溶解后,缓慢加入42.04g(0.3mol)的ad-2,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm
‑ꢀ
7。
[0196][0197]
所得交联剂pm-7结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出
现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0198]
合成例8:
[0199]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g(0.1mol)的im-3搅拌溶解后,缓慢加入42.04g(0.3mol)的ad-2,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm
‑ꢀ
8。
[0200][0201]
所得交联剂pm-8结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的— nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0202]
合成例9:
[0203]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、28.84g(0.1mol)的im-4搅拌溶解后,缓慢加入42.04g(0.3mol)的ad-2,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00gnmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-9。
[0204][0205]
所得交联剂pm-9结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的— nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0206]
合成例10:
[0207]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、34.24g(0.1mol)的im-5搅拌溶解后,缓慢加入42.04g(0.3mol)的ad-2,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00gnmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-10。
[0208][0209]
所得交联剂pm-10结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0210]
合成例11:
[0211]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、
12.51g的im-1(0.1mol)搅拌溶解后,缓慢加入51.64g(0.3mol)的ad-3,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00gnmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-11。
[0212][0213]
所得交联剂pm-11结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0214]
合成例12:
[0215]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、12.61g的im-2(0.1mol)搅拌溶解后,缓慢加入51.64g(0.3mol)的ad-3,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-12。
[0216][0217]
所得交联剂pm-12结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消
失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0218]
合成例13:
[0219]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g的im-3(0.1mol)搅拌溶解后,缓慢加入51.64g(0.3mol)的ad-3,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-13。
[0220][0221]
所得交联剂pm-13结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0222]
合成例14:
[0223]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、28.84g的im-4(0.1mol)搅拌溶解后,缓慢加入51.64g(0.3mol)的ad-3,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00gnmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-14。
[0224][0225]
所得交联剂pm-14结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0226]
合成例15:
[0227]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、34.24g的im-5(0.1mol)搅拌溶解后,缓慢加入51.64g(0.3mol)的ad-3,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-15。
[0228][0229]
所得交联剂pm-15结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0230]
合成例16:
[0231]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、12.51g的im-1(0.1mol)搅拌溶解后,缓慢加入55.85g(0.3mol)的ad-4,待加料完成后80℃
下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-16。
[0232][0233]
所得交联剂pm-16结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0234]
合成例17:
[0235]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、12.61g的im-2(0.1mol)搅拌溶解后,缓慢加入55.85g(0.3mol)的ad-4,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00gnmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-17。
[0236][0237]
所得交联剂pm-17结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消
失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0238]
合成例18:
[0239]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g的im-3(0.1mol)搅拌溶解后,缓慢加入55.85g(0.3mol)的ad-4,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-18。
[0240][0241]
所得交联剂pm-18结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0242]
合成例19:
[0243]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、28.84g的im-4(0.1mol)搅拌溶解后,缓慢加入55.85g(0.3mol)的ad-4,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-19。
[0244][0245]
所得交联剂pm-19结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0246]
合成例20:
[0247]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、34.24g的im-5(0.1mol)搅拌溶解后,缓慢加入55.85g(0.3mol)的ad-4,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00g nmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-20。
[0248][0249]
所得交联剂pm-20结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0250]
合成例21
[0251]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、42.35g的im-6(0.1mol)搅拌溶解后,缓慢加入51.64g(0.3mol)的ad-3,待加料完成后80℃
下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00gnmp 稀释后的53.62g(0.45mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-21。
[0252][0253]
所得交联剂pm-21结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0254]
合成例22:
[0255]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g的im-3(0.1mol)搅拌溶解后,缓慢加入51.64g(0.3mol)的ad-3,待加料完成后80℃下反应10h,反应完成后将反应液冷却至35℃,滴入用50.00gnmp 稀释后的66.25g(0.45mol)的n,n-二甲基甲酰胺二乙基缩醛所得的溶液,滴加完成后35℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-22。
[0256][0257]
所得交联剂pm-22结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,1640cm-1
~1660cm-1
处出现—conh的c=o键的振动吸收峰,1540cm-1
~ 1550cm-1
处出现—conh的c—n键的振动吸收峰,1730cm-1
~1740cm-1
出现c-c(=o)-o的c=o键的伸缩振动吸收峰,1210cm-1
~1165cm-1
出现c-c(=o)-o的c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0258]
合成例23:
[0259]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g(0.1mol)的im-3搅拌溶解后,缓慢加入61.26g(0.3mol)的ad-1,待加料完成后80℃下反应10h,反应完成后将反应液冷却至25℃,然后向反应体系中加入47.46g(0.6mol)的吡啶,搅拌均匀后缓慢加入61.26g(0.6mol)的乙酸酐,25℃下反应20h。待反应完成,将反应液倒入3l的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-23。
[0260][0261]
所得交联剂pm-23结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,在1780cm-1
左右出现酰亚胺环c=o的反对称伸缩振动吸收峰,1380cm-1
附近出现酰亚胺环c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0262]
合成例24:
[0263]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、
35.44g(0.1mol)的im-3搅拌溶解后,缓慢加入42.04g(0.3mol)的ad-2,待加料完成后80℃下反应10h,反应完成后将反应液冷却至25℃,然后向反应体系中加入47.46g(0.6mol)的吡啶,搅拌均匀后缓慢加入61.26g(0.6mol)的乙酸酐,25℃下反应20h。待反应完成,将反应液倒入3l 的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-24。
[0264][0265]
所得交联剂pm-24结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,在1780cm-1
左右出现酰亚胺环c=o的反对称伸缩振动吸收峰,1380cm-1
附近出现酰亚胺环c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0266]
合成例25:
[0267]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g(0.1mol)的im-3搅拌溶解后,缓慢加入51.64g(0.3mol)的ad-3,待加料完成后80℃下反应10h,反应完成后将反应液冷却至25℃,然后向反应体系中加入47.46g(0.6mol)的吡啶,搅拌均匀后缓慢加入61.26g(0.6mol)的乙酸酐,25℃下反应20h。待反应完成,将反应液倒入3l 的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-25。
[0268][0269]
所得交联剂pm-25结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,在1780cm-1
左右出现酰亚胺环c=o的反对称伸缩振动吸收峰,1380cm-1
附近出现酰亚胺环c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0270]
合成例26:
[0271]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g(0.1mol)的im-3搅拌溶解后,缓慢加入55.85g(0.3mol)的ad-4,待加料完成后80℃下反应10h,反应完成后将反应液冷却至25℃,然后向反应体系中加入47.46g(0.6mol)的吡啶,搅拌均匀后缓慢加入61.26g(0.6mol)的乙酸酐,25℃下反应20h。待反应完成,将反应液倒入3l 的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-26。
[0272][0273]
所得交联剂pm-26结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,在1780cm-1
左右出现酰亚胺环c=o的反对称伸缩振动吸收峰,1380cm-1
附近出现酰亚胺环c-o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0274]
合成例27:
[0275]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g(0.1mol)的im-3搅拌溶解后,缓慢加入61.26g(0.3mol)的ad-1,待加料完成后80℃下反应10h,反应完成后将反应液冷却至25℃,将反应液倒入3l 的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-27。
[0276][0277]
所得交联剂pm-27结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,在1710cm-1
左右出现—cooh的c=o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0278]
合成例28:
[0279]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g(0.1mol)的im-3搅拌溶解后,缓慢加入42.04g(0.3mol)的ad-2,待加料完成后80℃下反应10h,反应完成后将反应液冷却至25℃,将反应液倒入3l 的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-28。
[0280][0281]
所得交联剂pm-28结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,在1710cm-1
左右出现—cooh的c=o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0282]
合成例29:
[0283]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、35.44g(0.1mol)的im-3搅拌溶解后,缓慢加入51.64g(0.3mol)的ad-3,待加料完成后80℃下反应10h,反应完成后将反应液冷却至25℃,将反应液倒入3l 的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-29。
[0284][0285]
所得交联剂pm-29结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,在1710cm-1
左右出现—cooh的c=o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂。
[0286]
合成例30:
[0287]
氮气保护下,向配有搅拌器和温度计的500ml三口烧瓶中依次加入120.00g的nmp、
35.44g(0.1mol)的im-3搅拌溶解后,缓慢加入55.85g(0.3mol)的ad-4,待加料完成后80℃下反应10h,反应完成后将反应液冷却至25℃,将反应液倒入3l 的去离子水中,析出得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到交联剂pm-30。
[0288][0289]
所得交联剂pm-30结构式如上所示,按照上述检测方法对交联剂进行红外光谱测试,谱图显示,3400cm-1
~3500cm-1
处的—nh2的不对称伸缩振动和对称伸缩振动吸收峰消失,在1710cm-1
左右出现—cooh的c=o键的伸缩振动吸收峰,以上信息可证明成功合成交联剂
[0290]
本发明中,将bani-m(丸善石油化学株式会社)与本发明中的交联剂进行对比,所述bani-m的结构如下所示:
[0291][0292]
按照前面所述的交联剂溶解度的测试方法对合成例合成的交联剂进行溶解度测试,具体结果见表1。
[0293]
从表1可看出合成例3、合成例8、合成例13和合成例18合成的具有酰胺酸酯结构的三官能度的含n杂环的交联剂在gbl、el和pgme中的溶解度远大于合成例22~23合成的具有酰亚胺类结构的交联剂,同时也大于丸善石油化学的交联剂bani-m。酰亚胺结构的交联剂在pgme中基本不溶,严重限制应用。
[0294]
从表1中还可看出合成例3、合成例8、合成例13和合成例18合成的具有酰胺酸酯结构的三官能度的含n杂环的交联剂的储存稳定性远高于合成例26~29合成的具有酰胺酸结构的交联剂,这是因为酰胺酸非常容易发生水解副反应,尤其是高温高湿环境中,不利于产品的应用和储存。
[0295]
以上结果可以看出本发明合成的酰胺酸酯类的含n杂环的三官能度的交联剂的性能最优的。可根据应用场景的不同,再选择不同结构的酰胺酸酯类的含n杂环的三官能度的交联剂及其合适的最佳用量。
[0296]
表1交联剂纯度及溶解度测试结果
[0297][0298]
感光树脂组合物的制备
[0299]
实施例1
[0300]
在氮气流下,向配有搅拌器、滴液漏斗和温度计的500ml三口烧瓶中依次加入31.02g (0.1mol)的odpa、100.00g的nmp,室温下搅拌溶解得二酐溶液。取另一配有搅拌器的三口烧瓶,依次加入54.41g(0.09mol)的hfha、100.00g的nmp搅拌溶解得到二胺溶液。将二胺溶液滴加到上述二酐溶液中,滴加完毕后常温反应1h,然后50℃反应2h。反应完成后滴入用45.00g nmp 稀释后的23.83g(0.2mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后50℃反应3h。待反应完成,将反应液倒入 3l的去离子水中,析出聚合物得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到聚酰胺酸酯p-1。
[0301]
在配有搅拌的三口烧瓶中,依次加入10.00g合成好的聚酰胺酸酯p-1、1.00g的交联剂pm-1、2.00g nt-300(日本东洋合成工业(株)制造)、1.00g的gbl、20.00g的el、70.00g的pgme搅拌溶解,待澄清后,再加入0.20gγ-缩水甘油醚氧丙基三甲氧基硅烷(南京帝蒙特,kh-560),0.15g流平剂byk-392,0.15g消泡剂byk-a530,继续搅拌均匀后用1微米pp滤膜
进行过滤得到感光树脂组合物。
[0302]
实施例2
[0303]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-2外,其他同实施例1。
[0304]
实施例3
[0305]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-3外,其他同实施例1。
[0306]
实施例4
[0307]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-4外,其他同实施例1。
[0308]
实施例5
[0309]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-5外,其他同实施例1。
[0310]
实施例6
[0311]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-6外,其他同实施例1。
[0312]
实施例7
[0313]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-7外,其他同实施例1。
[0314]
实施例8
[0315]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-8外,其他同实施例1。
[0316]
实施例9
[0317]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-9外,其他同实施例1。
[0318]
实施例10
[0319]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-10外,其他同实施例1。
[0320]
实施例11
[0321]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-11外,其他同实施例1。
[0322]
实施例12
[0323]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-12外,其他同实施例1。
[0324]
实施例13
[0325]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-13外,其他同实施例1。
[0326]
实施例14
[0327]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-14外,其他同实施例1。
[0328]
实施例15
[0329]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-15外,其他同实施例1。
[0330]
实施例16
[0331]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-16外,其他同实施例1。
[0332]
实施例17
[0333]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-17外,其他同实施例1。
[0334]
实施例18
[0335]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-18外,其他同实施例1。
[0336]
实施例19
[0337]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-19外,其他同实施例1。
[0338]
实施例20
[0339]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-20外,其他同实施例1。
[0340]
实施例21
[0341]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-21外,其他同实施例1。
[0342]
实施例22
[0343]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-22外,其他同实施例1。
[0344]
实施例23
[0345]
除将1.00g的交联剂pm-1替换为0.50g的交联剂pm-13外,其他同实施例1。
[0346]
实施例24
[0347]
除将1.00g的交联剂pm-1替换为2.00g的交联剂pm-13外,其他同实施例1。
[0348]
实施例25
[0349]
除将1.00g的交联剂pm-1替换为0.10g的交联剂pm-13外,其他同实施例1。
[0350]
实施例26
[0351]
除将1.00g的交联剂pm-1替换为4.00g的交联剂pm-13外,其他同实施例1。
[0352]
实施例27
[0353]
在氮气流下,向配有搅拌器、滴液漏斗和温度计的500ml三口烧瓶中依次加入31.02g(0.1mol)的odpa、100.00g的nmp,室温下搅拌溶解得二酐溶液。取另一配有搅拌器的三口烧瓶,依次加入32.96g(0.09mol)的2,2-双(3-氨基-4-羟基苯基)六氟丙烷(6fap)、100.00g的nmp搅拌溶解得到二胺溶液。将二胺溶液滴加到上述二酐溶液中,滴加完毕后常温反应1h,然后50℃反应2h。反应完成后滴入用45.00gnmp稀释后的23.83g(0.2mol)的n,n-二甲基甲酰胺二甲基缩醛所得的溶液,滴加完成后 50℃反应3h。待反应完成,将反应液倒入3l的去离子水中,析出聚合物得白色沉淀。过滤后用去离子水洗涤三次,放入真空烘箱中,80℃干燥72h得到聚酰胺酸酯p-2。
[0354]
在配有搅拌的三口烧瓶中,依次加入10.00g合成好的聚酰胺酸酯p-2、1.00g的交联剂pm-13、2.00g nt-300(日本东洋合成工业(株)制造)、1.00g的gbl、20.00g的el、70.00g的pgme搅拌溶解,待澄清后,再加入0.20g的kh-560,0.15g的byk
‑ꢀ
392,0.15g的byk-a530,继续搅拌均匀后用1微米pp滤膜进行过滤得到感光树脂组合物。
[0355]
实施例28
[0356]
除将1.00g的交联剂pm-13替换为1.00g的交联剂pm-18外,其他同实施例26。
[0357]
实施例29
[0358]
将31.02g(0.1mol)的odpa放入500ml的三口烧瓶中,加入26.03g(0.2mol)甲基丙烯酸羟乙酯(hema)和100.00g 的gbl,在10℃以下,边搅拌边滴入(0.2mol)15.82g吡啶,得到反应混合物,自然升至25℃后搅拌12h。
[0359]
接下来,在冰浴条件下,用40min边搅拌边将该反应混合物加入溶有41.25g(0.2mol)二环己基碳化二亚胺(dcc)的50.00 g的gbl溶液中,在氮气保护下,用60min加入溶有19.03g(0.095mol)4,4
’‑
二氨基二苯基醚(oda)的70.00g的gbl溶液,自然升至25℃,加入80.00ggbl,继续搅拌12h后加入乙醇6.00g并搅拌1h,过滤除去反应混合物中产生的沉淀物,得到反应液。
[0360]
将所得到的反应液加入到1l的乙醇中,析出聚合物,再用300ml四氢呋喃将析出的聚合物溶解,将所得到的聚合物溶液滴入5l超纯水中,析出聚合物沉淀,将所得到的沉淀物滤出后,在50℃下进行真空干燥72h,得到聚酰胺酸酯p-3。
[0361]
在配有搅拌的三口烧瓶中,将10.00g合成好的聚合物p-3溶解在20.00g nmp中,待完全溶解后,加入1.00g交联剂pm-13、 1.00g 3-(三乙氧硅基硫代)丙基三甲氧基硅烷(日本信越化学,x-12-1056es)、0.20gkh-560,继续搅拌至完全溶解,再依次加入0.30g光引发剂1-(4-苯硫基-苯基)-辛-1,2-二酮-2-肟-0-苯甲酸酯(oxe-1,basf)、1.50g交联剂三缩四乙二醇二甲基丙烯酸酯(tegdma)、0.10g阻聚剂对羟基苯甲醚(mehq),充分溶解后,利用1.0μm滤膜压滤,得到感光性树脂组合物。
[0362]
实施例30
[0363]
除将1.00g的交联剂pm-13替换为1.00g的交联剂pm-18外,其他同实施例28。
[0364]
对比例1
[0365]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-23外,其他同实施例1。
[0366]
对比例2
[0367]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-24外,其他同实施例1。
[0368]
对比例3
[0369]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-25外,其他同实施例1。
[0370]
对比例4
[0371]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-26外,其他同实施例1。
[0372]
对比例5
[0373]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-27外,其他同实施例1。
[0374]
对比例6
[0375]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-28外,其他同实施例1。
[0376]
对比例7
[0377]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-29外,其他同实施例1。
[0378]
对比例8
[0379]
除将1.00g的交联剂pm-1替换为1.00g的交联剂pm-30外,其他同实施例1。
[0380]
对比例9
[0381]
除将1.00g的交联剂pm-1替换为1.00g的交联剂bani-m外,其他同实施例1。
[0382]
对比例10
[0383]
除了将1.00g的交联剂pm-1替换为2,6-二甲氧基亚甲基-4-叔丁基苯酚(dmom-ptbp-mf,本州化学)外,其他同实施例1。
[0384]
对比例11
[0385]
除了在体系中不添加交联剂,其他同实施例1。
[0386]
按照前面所述的成膜性、亚胺化率、玻璃化转变温度、拉伸强度、介电常数的测试方法对实施例及对比例的感光树脂组合物进行性能表征,具体结果见表2。
[0387]
从表2可看出:实施例1~21和对比例9~11对比可看出,含发明中的n杂环的交联剂的固化膜表现出更高的亚胺化率,要明显优于丸善石油化学交联剂、其他类型交联剂或者不加交联剂。实施例3、8、13、18及对比例1~4对比可看出,具有酰胺酸酯结构的交联剂由于其于聚合物具有更好的相容性,同时在gbl、el、pgme中的溶解度更高,因此表现出较酰亚胺结构更好的提高亚胺化率、玻璃化转变温度及拉伸强度的效果,而酰亚胺结构的交联剂因溶解度差,导致在组合物体系中无法发挥作用,进而制备所得的固化膜性能也很差。实施
例1~21及对比例9~11对比可看出,相较于其他交联剂或不添加交联剂,本发明中的含n杂环的交联剂对固化膜的成膜性具有很大的促进作用,可在低温250℃固化温度下有优异的成膜性,说明交联剂中的n杂原子对亚胺化具有促进作用。实施例13、22~25对比可看出,当交联剂添加量过少时,固化膜的有益效果不明显,当交联剂添加过多时,虽然表现出很高的亚胺化率、玻璃化转变温度,但由于交联程度过高,膜比较脆,反而成膜性差,因此本发明的交联剂的添加量优选的占树脂质量数的5%~20%。实施例3、8、13、18及对比例5~8可看出,具有酰胺酸结构的交联剂虽然也表现出很好的膜性能,但由于其储存稳定性差,故也不作为优选。除此之外,从实施例1~21及对比例9~11可已看出,添加了本发明含n杂环交联剂的组合物固化莫表现出更低的介电常数,可以很好的应用于oled器件的钝化绝缘层。
[0388]
表2感光树脂组合物固化膜性能测试结果
[0389]
[0390][0391]
以上所述,仅是本技术的几个实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1