一种杂交瘤细胞株的筛选方法与流程
1.本发明涉及生物技术领域,尤其涉及一种杂交瘤细胞株的筛选方法。
背景技术:
2.杂交瘤技术是科研实验室和工业界运用最为广泛的单克隆抗体制备方法。其主要实验流程为:
①
免疫动物;
②
将动物免疫后的脾细胞与瘤细胞进行融合;
③
筛选能分泌抗原特异性抗体的单克隆杂交瘤细胞;
④
扩大培养可分泌抗体的单克隆杂交瘤细胞;
⑤
体外培养单克隆杂交瘤细胞或体内诱生法获得大量的单克隆抗体。其中,鉴定和分离出分泌针对目标抗原抗体的单克隆杂交瘤细胞株是该技术最为关键的步骤,耗时长。
3.杂交瘤细胞是通过细胞融合技术,将已知的永生细胞如小鼠骨髓瘤细胞与b淋巴细胞进行融合而成,该细胞获得了两种亲本细胞的遗传特性,是具有分泌抗原特异性抗体功能的永生化细胞。b淋巴细胞表面存在具有抗原特异性的bcr(b-cell receptor),因而杂交瘤细胞亦可能存在具有抗原特异性的分子标志物。本发明通过鉴定杂交瘤细胞表面稳定表达抗原特异性膜型igg,将膜型igg作为流式单细胞分选抗原特异性杂交瘤细胞的分子标志物,能够快速获得分泌具有抗原特异性抗体的单克隆杂交瘤细胞株,从而简化和缩短单克隆抗体的研发步骤和时间。
技术实现要素:
4.本发明的首要目的在于克服现有技术的缺点与不足,提供一种杂交瘤细胞株的筛选方法。该筛选方法可满足单抗开发等领域的研究应用需求。
5.本发明的目的通过下述技术方案实现:一种杂交瘤细胞株的筛选方法,包括以下步骤:确立杂交瘤表面分子标志物,采用流式分选的方法对经过抗原免疫的小鼠的脾细胞与骨髓瘤细胞融合后的杂交瘤细胞混合物进行筛选,筛选出能够分泌单克隆抗体的杂交瘤细胞;
6.所述流式分选采用的流式分选仪鞘液压力为20psi.,将具有双抗原阳性的细胞分选至含有200μl dmem、20%fbs、2ng/ml il6的孔板中,每个细胞孔分选一个细胞,在37℃、5%co2的恒温培养箱中培养10天,得到杂交瘤细胞。
7.所述流式分选在采用流式分选仪分选前对细胞进行以下处理:用2%fbs洗涤培养后的细胞,300g离心5min;用13%的密度梯度离心介质重悬细胞,4℃、800g离心20min,收集上层细胞;采用2%fbs洗涤细胞,300g离心5min;加入死细胞染色液,常温避光孵育15min,加入2%fbs,300g离心5min;加入fc封闭剂4℃孵育5min;加入杂交瘤表面分子标志物,避光孵育,fbs洗涤并重悬细胞,40μm细胞筛网过滤。
8.优选地,所述杂交瘤表面分子标志物为杂交瘤细胞膜型igg,包括抗原偶联荧光染料分子和抗鼠igg荧光抗体;更优选地,采用杂交瘤表面分子标志物筛选杂交瘤细胞的过程为:先采用抗原偶联荧光染料分子避光孵育1h,以2%fbs洗涤,再采用抗鼠igg荧光抗体避光孵育25min,以2%fbs洗涤,300g离心10min,用2%fbs重悬细胞,40μm细胞筛网过滤。
9.优选地,所述杂交瘤细胞混合物筛选前进行培养,方法为:将融合后的细胞悬液采用hat培养基37℃、5%co2恒温培养,第六天密度梯度离心去除细胞碎片,换ht-il6培养基培养2天。
10.优选地,所述恒温培养过程中,在第三天进行半换液。
11.上述筛选方法在禽流感病毒单克隆抗体制备中的应用。
12.上述筛选方法在冠状病毒广谱抗体制备中的应用。
13.优选地,所述所述杂交瘤表面分子标志物为杂交瘤细胞膜型igg,包括多个抗原偶联荧光染料分子和抗鼠igg荧光抗体;更优选地,所述多个抗原偶联荧光染料分子为两个不同的冠状病毒刺突蛋白。
14.与现有技术相比,本发明具有以下有益效果:
15.本发明通过对杂交瘤表面分子的筛查和鉴定,确立杂交瘤表面分子标志物(mig),在杂交瘤技术中引入流式单细胞分选技术,并且进行了单细胞分选条件的优化及单细胞培养条件的优化。本发明的方法针对杂交瘤技术筛选过程耗时长,效率低、难以保证获得的杂交瘤细胞株为单克隆细胞株等缺点进行改良,在细胞融合后的细胞培养早期即实现杂交瘤细胞的单细胞分选,在较短时间内获得特异性分泌抗体的杂交瘤细胞、保障获得的细胞系确为单克隆细胞株。本方法可在实验动物身上免疫不同抗原,以此筛选分泌广谱抗体的杂交瘤细胞。本方法在对骨髓瘤与脾细胞的融合细胞进行单细胞分选时即可筛选分泌结合广谱抗原抗体的杂交瘤细胞,提高获得分泌广谱抗体杂交瘤细胞的效率。本方法减少了细胞培养基和胎牛血清等试剂的使用,降低杂交瘤细胞制备成本。综上所述,本方法应用于广谱抗体开发的探索实验表现出较好的结果,可考虑将其应用于广谱抗体开发领域。
附图说明
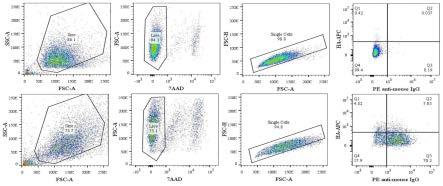
16.图1是细胞分选流式散点图;其中,第一行四张图的样品为sp2/0,第二行四张图的样品为融合后第8天的混合细胞样品;fsc为前向角散射,代表细胞的大小;ssc为侧向角散射,代表细胞的颗粒度;a是area的缩写,代细胞经过激光束时呈现的“拱形”曲线下面积;h是height的缩写,代表“拱形”高度;7aad是一种非渗透性核酸染料,与dna结合会发出强烈的荧光,即死细胞会发出强荧光。
17.图2是双抗原单细胞流式分选散点图;其中,第一行、第二行的样品为sp2/0,作为阴性对照,第三行、第四行的样品为融合后第8天的混合细胞样品;fsc为前向角散射,代表细胞的大小;ssc为侧向角散射,代表细胞的颗粒度;a是area的缩写,代细胞经过激光束时呈现的“拱形”曲线下面积;h是height的缩写,代表“拱形”高度;7aad是一种非渗透性核酸染料,与dna结合会发出强烈的荧光,即死细胞会发出强荧光。
18.图3是冠状病毒广谱抗体的广谱性分析结果图。
具体实施方式
19.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
20.实施例1对杂交瘤细胞表面分子标志物进行鉴定
21.为了验证杂交瘤细胞是否表达膜型igg/m,将6株针对h7n9禽流感ha的杂交瘤细胞株(包括2株分泌igg1亚类抗体、3株分泌ig2a亚类抗体以及1株分泌igm亚类抗体的杂交瘤细胞,采用实施例2中的h7n9禽流感病毒ha蛋白采用相同方法免疫小鼠、电融合后克隆化筛选杂交瘤细胞得到)为样品。
22.1、取上述6株杂交瘤细胞株,每个样品约1
×
106个细胞,用2%fbs洗1次,300g离心5min,弃上清,用100μl 2%fbs重悬细胞。
23.2、用100μl死细胞染色液常温孵育15min。
24.3、用2%fbs洗1次,300g离心5min,弃上清,用100μl 2%fbs重悬细胞。
25.4、加1μl fc block在4℃孵育5min。
26.5、加入0.5μl apc anti mouse igg(h+l)(invitrogen,a-21235)在4℃孵育30min。
27.6、用2%fbs洗1次,300g离心5min,弃上清。
28.7、加500μl 2%fbs重悬细胞。
29.8、用40μm的细胞筛网过滤细胞。
30.9、在流式细胞仪上调节荧光补偿,检测荧光强度。
31.表1杂交瘤mig的表达水平
32.名称/克隆号百分比平均荧光强度sp200%24.37c234.1%6258c965.8%105710b130.4%52311c1227%50612b1023%41713f768.1%957
33.为了验证migg/m在杂交瘤细胞膜上的表达,用流式细胞仪检测被可结合apc anti mouse igg(h+l)igg(h+l)标记的杂交瘤细胞。结果如表1所示,所有杂交瘤细胞样品均能被荧光抗体标记,且平均荧光强度远大于骨髓瘤细胞,说明migg/m确实在杂交瘤细胞膜上表达。
34.实施例2h7n9禽流感ha杂交瘤细胞的制备
35.(一)小鼠免疫
36.1、首次免疫(day0)时将50ugh7n9禽流感ha蛋白(sino biological,40103-v08h)溶于pbs中并与等体积弗氏完全佐剂(cfa,sigma)充分乳化;取乳化液背部皮下、双侧腹股沟、腋窝多点注射免疫6周龄雌性balb/c小鼠(来源于北京维通利华,生产许可证号scxk(京)2016-0006),350μl/只;阴性对照组小鼠仅注射弗氏完全佐剂+等量pbs;空白组小鼠不做任何处理。
37.2、第二次免疫在day14用弗氏不完全佐剂(ifa,sigma)与等体积ha蛋白充分乳化,并对小鼠再次进行皮下多点注射,同样350μl/只。
38.3、第三次免疫在day28,具体操作与第二次免疫相同。
39.4、在day39进行最后的加强免疫,此时不使用佐剂,只用100ug ha蛋白进行腹腔注射。
40.(二)细胞融合
41.参考yokoyam等发表于《current protocols in immunology》的文献“production of monoclonal antibodies”并略作改动:
42.1、脾细胞准备
43.1)在最后的加强免疫后3天分离小鼠脾脏
44.2)裂解红细胞
45.3)洗涤和细胞计数
46.2、电融合
47.将骨髓瘤细胞(sp2/0,ac338400)与小鼠脾脏细胞1:3混匀,在电融合仪(上海启文生物,btx)中进行细胞融合。
48.3、细胞培养
49.1)将融合得到的细胞悬液平分为2份,1份铺96孔板(100μl/孔),另外一份放在9cm平皿(hat培养基,10ml/平皿)中,均放于37℃、5%co2恒温培养箱中培养,将此时记为day0。
50.2)融合后细胞在day3、day6时进行半换液,9cm平皿吸走5ml并补入5ml hat培养基。在day6时对9cm平皿中细胞进行密度梯度离心去除细胞碎片,并换培养基(dmem加ht(gibco,11067030;原液为100
×
,使之终浓度为1
×
)+2ng/ml il6)培养2天。
51.实施例3分泌h7n9禽流感ha抗体的杂交瘤细胞的单细胞分选
52.1、用2%fbs洗涤实施例2培养2天后得到的杂交瘤细胞株2次,300g离心5min。
53.2、用密度梯度离心介质碘克沙醇(non-ionic iodixanol)配制13%的工作液,用工作液将细胞重悬,设置离心机为4℃,800g离心20min,收集上层细胞。
54.3、用2%fbs洗涤2次,300g离心5min。
55.4、加入死细胞染色液,常温避光孵育15min,加入1ml用2%fbs,300g离心5min。
56.5、加入fc block(bd pharmingen,553141)4℃孵育5min。
57.6、加入ha蛋白偶联af647染料(sigma,mx647s100),避光孵育1h,采用2%fbs洗涤1次,300g离心5min。
58.7、加入1μl anti-mouse igg(h+l)-pe antibody(invitrogen,p-852),4℃孵育25min。
59.8、用2%fbs洗涤细胞,300g离心10min。
60.9、用2%fbs重悬细胞,用40μm细胞筛网过滤。
61.10、在流式分选仪上设置鞘液压力为20psi.,对细胞混合物进行流式分选,将具有双抗原阳性的细胞分选至含有200μl dmem(20%fbs,2ng/ml il6)的96孔板中,每个细胞孔分选一个细胞。在37℃、5%co2的恒温培养箱中培养10天,最终获得17株h7n9禽流感ha杂交瘤细胞。
62.为了将抗原特异性b细胞从细胞混合物中分离(克隆化),发明人在脾细胞与骨髓瘤细胞(sp2/0)融合后第8天对细胞混合物进行流式分选,以sp2/0作为阴性对照,通过细胞颗粒度和大小先将细胞群体圈出,利用死细胞染料去除死细胞带来的非特异结合干扰,随后在fsc-a和fsc-h散点图中利用单个细胞群体应有相似的大小和高度分出单细胞(即去除
粘连细胞),最后在单细胞群体中分出migg+和ha+的细胞进行单细胞分选。抗原为aiv-h7n9的杂交瘤细胞分选结果如图1所示,在混合细胞样品中,表达migg且能与ha结合的细胞占7.03%。被分选下来的单细胞在96孔细胞板中培养,持续观察细胞状态,在第10天显微镜下可见明显细胞克隆,结果共有439株单克隆形成,即完成克隆化过程。
63.实施例4h7n9禽流感病毒单克隆抗体的纯化及亲和力测定
64.(一)抗体的亲和层析纯化
65.1、将实施例3流式分选得到的杂交瘤细胞培养5天,收集50ml杂交瘤上清。
66.2、把样品及所有试剂用0.22μm过滤器过滤除菌。
67.3、样品及所有试剂超声15min除去气泡。
68.4、用akta pure 25纯化仪及mabselecttm prisma纯化柱进行纯化,得到待测抗体样品。
69.(二)亲和力测定
70.1、样品准备:将待测抗体样品用缓冲液稀释至10μg/ml。
71.2、抗原准备:将h7n9-aiv的ha蛋白稀释至100、50、25、12.5nm。
72.3、对照:设置固化抗体但无分析物(ha为0浓度)的对照孔。
73.4、上机参数:
[0074][0075]
为了解制备的杂交瘤细胞分泌的单克隆抗体与h7n9禽流感病毒ha蛋白的亲和力,发明人利用生物层干涉技术(biolayer interferometry,bli)将纯化后的抗体进行抗原抗体亲和力实验,通过拟合动力学曲线计算出解离常数(dissociation constant)kd,kd可反映抗原抗体结合的亲和力大小,kd值越小,则亲和力越强,本次检测的5株单克隆抗体的kd值如表2。5株抗体的kd值均是小于10-8
m级,其中21f6的kd值最小达到nm级,表明其具有较优的抗原结合能力。
[0076]
表2
[0077][0078][0079]
实施例5冠状病毒s蛋白杂交瘤细胞的制备
[0080]
(一)小鼠免疫
[0081]
1、制备mers-cov s刺突蛋白及sars-cov-2s刺突蛋白(参照yali zhang等发表于《small methods》的文章“virus-free and live-cell visualizing sars-cov-2cell entry for studies of neutralizing antibodies and compound inhibitors”)。
[0082]
2、首次免疫day0:每只balb/c小鼠注射10μg mers-cov s蛋白(稀释在100μl pbs中),将蛋白与等体积利赛佐剂充分乳化,皮下多点注射(背部、双侧腹股沟、腋窝)。
[0083]
3、day14第二次免疫:每只小鼠注射10μg sars-cov-2s蛋白,具体操作与首次免疫相同。
[0084]
4、day28第三次免疫:mers-cov s蛋白和sars-cov-2s蛋白1:1混合,每只小鼠注射混合蛋白10μg,具体操作与首次免疫相同。
[0085]
5、day42最后加强免疫:mers-cov s蛋白和sars-cov-2s蛋白混合蛋白50μg,腹腔注射。
[0086]
6、day45解剖小鼠取脾脏。
[0087]
(二)细胞融合和培养
[0088]
同实施例1中细胞融合方法,融合后的杂交瘤细胞混合物放在9cm平皿(10ml/平皿)中,于37℃、5%co2恒温培养箱中培养,将此时记为day0。在day3、day6时进行半换液,9cm平皿吸走5ml并补入5ml hat。在day6时对9cm平皿中细胞进行密度梯度离心去除细胞碎片,并换ht-il6培养基培养2天。
[0089]
实施例6分泌冠状病毒s蛋白广谱抗体的杂交瘤细胞的单细胞分选
[0090]
1、用2%fbs洗涤实施例5中制备的细胞2次,300g离心5min。
[0091]
2、用13%的密度梯度离心介质重悬细胞,4℃,800g离心20min,收集上层细胞。
[0092]
3、采用2%fbs洗涤2次,300g离心5min。
[0093]
4、加入死细胞染色液,常温避光孵育15min,加入1ml2%fbs,300g离心5min。
[0094]
5、加入fc block(anti mouse cd16/32)4℃孵育5min。
[0095]
6、加入merscov-s1(sinobiological,40069-v08)偶联af647染料(sigma,mx647s100)与sars-cov-2-s1(sinobiological,40591-v08b1)偶联af488染料(sigma,mxs488100)或mers-cov-s2(sinobiological,40070-v08b)偶联af488染料与sars-cov-2-s2(acro,s2n-c52h5)偶联af647染料,避光孵育1h,采用2%fbs洗涤1次,300g离心5min。
[0096]
7、加入1μl anti-mouse igg(h+l)-pe antibody(invitrogen,p-852)孵育25min,采用2%fbs洗涤1次,300g离心5min。
[0097]
8、用2%pbs重悬细胞,用40μm细胞筛网过滤。
[0098]
9、在流式分选仪上设置鞘液压力为20psi.,对细胞混合物进行流式分选,将具有双抗原阳性的细胞分选至含有200μl dmem(20%fbs,2ng/ml il6)的96孔板中,每个细胞孔分选一个细胞。在37℃,5%co2恒温培养箱培养10天。
[0099]
为了获得同时结合mers-cov和sars-cov-2的杂交瘤细胞,发明人在脾细胞与骨髓瘤细胞(sp2/0)融合后的第8天进行流式分选,选用这两种冠状病毒s蛋白的两个亚基s1和s2分别选出同时结合两个病毒的s1蛋白的单克隆或结合两个病毒的s2的单克隆。以sp2/0作为阴性对照进行设门,并通过死细胞染料去除死细胞带来的非特异结合干扰,先在细胞混合物中区分出migg阳性细胞群体,再在migg阳性群体中区分出对sars-cov-2和mers-cov的s1蛋白有共同结合的细胞,将其分选至96孔板内进行培养;对另外的细胞样品同样分出migg阳性细胞群体,再在migg阳性群体中分出对sars-cov-2和mers-cov的s2蛋白有共同结合的细胞,也将其分选至96孔板内进行培养。
[0100]
结果显示(图2),在混合细胞样品中约有9.56%的细胞是migg+sars-cov-2-s1+mers-cov-s1+;约有11.3%的细胞是migg+sars-cov-2-s2+mers-cov-s2+。将这两个抗原阳性细胞群体分选成的单细胞在完全培养基中培养至形成细胞克隆,即筛选得到广谱冠状病毒抗体分泌型细胞。
[0101]
实施例7冠状病毒广谱抗体的广谱性分析
[0102]
发明人用elisa的方法对广谱单克隆抗体进行广谱性分析,检测在不同浓度下的抗体与抗原的结合情况。以用相同方法制备的h7n9单克隆抗体(实施例4纯化后的抗体)作为阴性对照,以商品化的单克隆抗体作为阳性对照,以抗体稀释液作为空白对照,以od450>0.1为抗原抗体结合阳性。
[0103]
1、包被:采用2μg/ml mers-cov s/sars-cov-2s蛋白100μl/孔加入酶标板,4℃包被过夜。
[0104]
2、封闭:用pbst洗板5次,拍干,加入300μl封闭液,4℃过夜。
[0105]
3、一抗孵育:拍干封闭液,将广谱冠状病毒抗体分泌型细胞分泌并纯化后的抗体用抗体稀释液配制为2μg/ml,并在96孔u型板上做倍比稀释,每个样品做3个重复,设置最后一孔浓度为0(样品浓度依次为2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml、0.125μg/ml、0.0625μg/ml、0.03125μg/ml以及0μg/ml)将稀释好的样品转移至酶标板,37℃孵育1h。
[0106]
4、二抗孵育:用pbst洗板5次,拍干,加入100μl二抗工作液,37℃孵育25min。
[0107]
5、显色:用pbst洗板5次,拍干,加入100μl tmb显色液,常温静置3min。
[0108]
6、终止:加入50μl终止液(1m hcl)
[0109]
7、用酶标仪读od450nm值。
[0110]
结果如图3所示,在抗体浓度为0-2ug/ml的范围内,od450值的总体趋势均是随着浓度的增加而增大,且在1ug/ml以后od450值的上升趋于平缓,可能已接近饱和浓度。样品中能与两种抗原均在较低浓度结合且很快达到饱和的抗体(即可能具有较高亲和力)。
[0111]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1