一种共培养微藻提高α-亚麻酸油脂产率的方法
一种共培养微藻提高
α-亚麻酸油脂产率的方法
技术领域
1.本发明属于微藻生物技术以及食品功能因子开发与应用领域,具体涉及一种共培养微藻提高α-亚麻酸油脂产率的方法。
背景技术:
2.微藻具有脂质含量高、生长周期短、不占用农用土地、可利用废水(如工农业废水、高盐度海水等)进行规模化培养等优势性能,且富含的多种不饱和脂肪酸脂质,在降血脂、抗肿瘤、增强免疫力等方面功效显著,因而在食品、药品及保健品等领域应用广泛,被认为是最具潜力的功能脂质资源之一(udayan a,et al.mass cultivation and harvesting of microalgal biomass:current trends and future perspectives.bioresource technology,2022,344:126406)。其中不饱和脂肪酸亚麻酸在促进大脑发育,防止老人大脑痴呆以及促进维生素、蛋白质、矿物质等营养物质的吸收,阻止癌细胞扩散,促进肿瘤萎缩等方面具有较好的生物学功能,并且亚麻酸是人体健康必需却又普遍缺乏且急需补充的一种必需营养素。然而,矛盾的是,诸多能合成亚麻酸的微藻,如褐藻、绿藻、硅藻、盐藻,其微藻细胞生长与亚麻酸合成呈负相关性,导致亚麻酸积累效率并不理想。因此,如何提高微藻亚麻酸产率一直是利用微藻产业化亚麻酸的一大难题。
3.目前,微藻培养多以单一藻株培养为主,存在脂质产率低、易受杂菌污染以及生长迟滞等弊端,并且诸多生物合成过程仅靠单藻株难以实现(arora d,et al.expanding the chemical diversity through microorganisms co-culture:current status and outlook.biotechnology advances,2020,40:107521)。而共培养微藻可通过微藻间有益相互作用(如群体感应)来进行信息交流和物质交换,以抵抗来自培养系统外部的压力(如杂菌污染等),从而提高培养体系稳定性,缩短生长周期,实现生物量增加和脂质富集。例如,长春理工大学吴佳铭将小球藻和栅藻共培养,发现共培养条件下各种抗氧化酶酶活性相较于单一藻株培养更高,证实共培养时产生更少的超氧阴离子和自由基,共培养细胞受到的氧化损伤较单一藻株培养更小,表明微藻共培养对外界环境的变化应对能力更强(吴佳铭.藻群协同作用对微藻油脂产量的影响与机制.吉林:长春理工大学,2020)。然而,尽管微藻共培养能有效提升总脂产率,但共培养对何种脂类富集更为有利以及如何有针对性地显著提高某种脂类产率尤为困难。本发明希望在解决微藻生物量和脂质产率负相关问题的前提下,尤其显著地提升α-亚麻酸油脂的产率,从而实现微藻α-亚麻酸油脂的产业化生产。
技术实现要素:
4.针对微藻细胞生长与亚麻酸合成呈负相关以及微藻α-亚麻酸油脂尚未实现产业化的问题,本发明提供一种共培养微藻提高α-亚麻酸油脂产率的方法,显著提高了α-亚麻酸油脂产率,解决了微藻单位体积藻细胞生物量与脂肪酸无法同步高效富集问题,实现微藻α-亚麻酸油脂的产业化生产,可辐射应用于生产医药、食品、化妆品等领域有益功能因子。
5.本发明的技术方案为:
6.一种共培养微藻提高α-亚麻酸油脂产率的方法,包括以下步骤:(1)先以基础培养基单独培养一株小球藻和一株胶球藻至对数末期,收集两株微藻种子液作为共培养接种种子液;(2)再优化两株微藻接种种子液接种体积比和共培养体系碳氮比,以获得的最大生物量产率为筛选指标,构建微藻共培养体系;(3)后以构建的最佳共培养条件发酵扩大化共培养两株微藻获得高产率α-亚麻酸油脂。
7.进一步地,所述的基础培养基具体为:按质量份数计,nano
3 1.2-1.3份、kh2po
4 1.2-1.3份、mgso4·
7h2o 0.95-1.05份、na2edta 0.4-0.6份、h3bo
3 0.10-0.12份、cacl
2 0.82-0.86份、feso4·
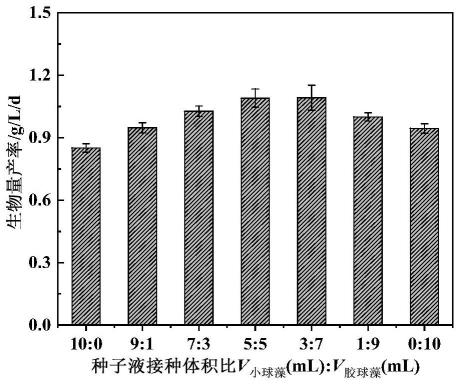
7h2o 0.04-0.06份、znso4·
7h2o 0.03-0.05份、mncl2·
4h2o 0.01-0.02份、na2moo4·
2h2o 0.01-0.02份、cuso4·
5h2o 0.01-0.03份、cono3·
6h2o 0.004-0.006份、glucose 8-12份、蒸馏水800-1200份,培养基ph 6.0-7.0;所述培养基的碳源和氮源分别为葡萄糖和硝酸钠。
8.进一步地,所述的小球藻为原始小球藻chlorella protothecoides,所述的胶球藻为极地胶球藻株coccomyxa subellipsoidea c-169。
9.进一步地,所述两株微藻接种种子液的制备为分别挑取小球藻和胶球藻平板单菌落接入基础培养基中,在光照强度50-55μmol/m2/s,摇床转速为120-160rpm,培养温度为28
±
1℃,在光照和黑暗周期变化的条件下(光照周期优选12h光照:12h黑暗)培养144-168h即得两株微藻接种种子液。
10.进一步地,两株微藻接种种子液接种体积比的优化方法具体为,将两株微藻接种种子液按照不同体积比10:0-0:10(v:v)同步接入基础培养基培养至对数末期,离心收集共培养藻液,蒸馏水洗涤藻泥,冷冻干燥获得藻粉,称重藻粉计算生物量产率,以最大生物量产率确定最佳接种体积比。
11.进一步地,共培养体系碳氮比的优化方法具体为,按上述得到的两株微藻接种种子液的最佳接种体积比同步接入碳氮比为20-80的基础培养基培养至对数末期,离心收集共培养藻液,蒸馏水洗涤藻泥,冷冻干燥获得藻粉,称重藻粉计算生物量产率,以最大生物量产率确定共培养体系的最佳碳氮比,最终以获得的最佳生物量产率的两株微藻接种种子液接种体积比和培养体系碳氮比为两株微藻共培养体系的最佳条件,以实现共培养体系的稳定高效。
12.进一步地,所述的共培养体系碳氮比为葡萄糖碳源中碳质量与硝酸钠氮源中氮质量之比。
13.进一步地,步骤(3)具体为,将两株微藻以最佳接种液体积比接入装有最佳碳氮比基础培养基的光生物反应器进行共培养,培养至对数末期离心收集共培养藻液,经冷冻干燥、有机溶剂抽提、皂化获得脂肪酸甲酯,以gc内标法测定α-亚麻酸油脂含量,再通过生物量产率计算α-亚麻酸油脂产率。
14.与现有技术相比,本发明的有益效果在于:
15.1)较单一微藻株培养相比,通过共培养微藻株间的有益相互作用进行信息交流和物质交换,可抵抗来自培养系统外部的杂菌污染等压力,从而提高共培养体系稳定性,另共培养藻株可通过高效快速地消耗体系营养物质大大缩短生长周期,并实现单位体积生物量和亚麻酸油脂产率的同步增加。
16.2)传统的利用添加大量化学药品诱导提高微藻脂肪酸产率的方法,其化学药品易转移至微藻细胞,尤其微藻用于食品或者饲料喂食动物时将直接影响动物衍生品品质和人类健康,并且存在微藻培养成本高弊端,本发明共培养微藻技术不仅规避了污染风险,而且有效降低了微藻培养成本,所得富含亚麻酸的微藻生物质可安全用于医药、食品、化妆品等领域,社会经济效益显著。
17.3)本发明共培养原始小球藻chlorella protothecoides和极地胶球藻株coccomyxa subellipsoidea c-169,不仅增加了生物量,还特别显著地提升了α-亚麻酸油脂产率;共培养原始小球藻chlorella protothecoides和极地胶球藻株coccomyxa subellipsoidea c-169达到对数生长末期时间相较于单一培养原始小球藻chlorella protothecoides和极地胶球藻株coccomyxa subellipsoidea c-169均缩短72h,其生物量增加至2.2-3.2倍,总脂产率提升至2.2-3.2倍,α-亚麻酸油脂产率提高到4.5-7.9倍。
附图说明
18.图1为原始小球藻和极地胶球藻共培养种子液接种体积比对共培养生物量产率影响图。
19.图2为原始小球藻和极地胶球藻共培养基体系碳氮比对共培养生物量产率影响图。
20.图3为原始小球藻和极地胶球藻单一和最佳共培养生长曲线图。
21.图4为原始小球藻和极地胶球藻单一和最佳共培养生物量产率和α-亚麻酸油脂产率图。
具体实施方式
22.为了使本发明的目的、技术方案及优点更加清楚明白,下面结合具体实施例对本发明做进一步说明,但本发明并不限于此。
23.实施例
24.1)原始小球藻和极地胶球藻接种种子液制备
25.小球藻藻种chlorella protothecoides和胶球藻藻种coccomyxa subellipsoidea c-169分别购于美国德州大学utex藻种库。分别将10μl小球藻藻液和胶球藻藻液均匀涂布于基础培养基(配方如下a所示)琼脂平板上,将涂布平板放入光照强度为50μmol/m2/s的培养箱中,在28
±
1℃下培养168h。后挑取小球藻和胶球藻单藻落分别接入液体基础培养基中(配方如a所示),将接种液体培养瓶放入转速160rpm的摇床中,设置温度为28
±
1℃,光照周期12h光照:12h黑暗培养144h即得小球藻和胶球藻接种种子液。
26.(a)基础培养基组成(按质量份数计):
27.glucose 10份、nano
3 1.25份、kh2po
4 1.25份、na2edta 0.5份、h3bo
3 0.11份、cacl
2 0.84份、mgso4·
7h2o 1份、fe2so4·
7h2o 0.05份、znso4·
7h2o 0.04份、mncl2·
4h2o 0.01份、na2moo4·
2h2o 0.01份、cuso4·
5h2o 0.02份、co(no3)2·
6h2o 0.005份、蒸馏水1000份,培养基ph 6.1。
28.2)原始小球藻和极地胶球藻共培养体系构建
29.分别取上述小球藻和胶球藻种子液以不同接种体积比(10:0、9:1、7:3、5:5、3:7、
ch3oh溶液(v:v=1:4),再75℃水浴15min,待冷却加入1ml饱和nacl溶液和2ml正己烷,涡旋1min混匀,在4000rpm下离心8min。取1ml上清过0.22μm滤膜。亚麻酸含量采用gc 7900气相色谱仪进行测定,db-1701色谱柱(30mm
×
0.25mm,0.25μm),配备fid氢离子火焰器。载气为高纯氮气,流速1.6ml/min,进样口温度250℃,分流比50:1,检测器温度300℃,进样量1μl。升温程序为:100℃保持1min,以40℃/min升至200℃,再以8℃/min升至280℃,保持2min。按照国家标准gb 28404-2012给出的计算方法,依据保留时间以及对应峰面积计算α-亚麻酸油脂含量(mg/g藻粉),并以式(4)计算α-亚麻酸油脂产率。
43.p
亚麻酸
(g/l/d)=p
biomass
(g/l/d)
×c亚麻酸
(mg/g藻粉)
ꢀꢀꢀ
(4)
44.式中,p
亚麻酸
—α-亚麻酸油脂产率(g/l/d);p
biomass
—生物量产率(g/l/d);c
亚麻酸
—亚麻酸油脂含量(mg/g藻粉)。
45.如图3和图4所示结果,将小球藻和胶球藻种子液接种体积比为3:7按照扩培比例接入碳氮比为32的共培养体系中,其共培养藻株生长至对数末期所需时间为96h,获得的最大生物量产率、总脂产率、α-亚麻酸油脂产率分别为1.69g/l/d、0.98g/l/d和0.63g/l/d。
46.为充分说明本发明的优越性,对比为小球藻藻种chlorella protothecoides单独培养结束后的生物量产率、总脂产率和α-亚麻酸产率,主要步骤为:将200ml小球藻种子液接入含有2l基础培养基(配方如a所示)的生物反应器中,在温度28
±
1℃、光照强度100μmol/m2/s、光照周期12h光照:12h黑暗、搅拌速度140rpm条件下培养168h达到对数末期。收集原始小球藻藻液,在8000rpm离心15min,以pbs缓冲液洗涤藻泥数次后放入-80℃超低温冰箱内冷冻10h,再放入冷冻干燥机内干燥48h获得藻粉。称量小球藻藻粉重量得生物量,以式(1)计算生物量产率。
47.准确称取0.02g(w1)冻干小球藻藻粉,加入3ml水/氯仿/甲醇(v/v/v=0.5:2:1)震荡20min充分混匀,8000rpm离心10min,收集氯仿层,萃取重复3-5次,收集氯仿层至已称重(w2)50ml离心管中,以0.5ml 1m氯化钾和1ml超纯水清洗萃取管,合并所有清洗液与氯仿层,真空干燥至恒重(w3),以式(2)和(3)计算总脂含量和产率。
48.准确称取10mg冻干小球藻藻粉,加入100μl十九酸内标液(1.0mg/ml)和2ml koh-ch3oh溶液(40g/l),75℃水浴加热15min,油珠完全溶解后取出,冷却至室温加入2ml bf
3-ch3oh溶液(v:v=1:4),再75℃水浴15min,待冷却加入1ml饱和nacl溶液和2ml正己烷,涡旋1min混匀,在4000rpm下离心8min。取1ml上清过0.22μm滤膜。亚麻酸含量采用gc 7900气相色谱仪进行测定,db-1701色谱柱(30mm
×
0.25mm,0.25μm),配备fid氢离子火焰器。载气为高纯氮气,流速1.6ml/min,进样口温度250℃,分流比50:1,检测器温度300℃,进样量1μl。升温程序为:100℃保持1min,以40℃/min升至200℃,再以8℃/min升至280℃,保持2min。按照国家标准gb 28404-2012给出的计算方法,依据保留时间以及对应峰面积计算α-亚麻酸油脂含量(mg/g藻粉),并以式(4)计算α-亚麻酸油脂产率。
49.如图3和图4所示结果,单一培养小球藻株生长至对数末期所需时间为168h,至培养结束时,单一培养小球藻获得的生物量产率、总脂产率和α-亚麻酸油脂产率分别为0.53g/l/d、0.31g/l/d和0.08g/l/d。
50.为充分说明本发明的优越性,对比为胶球藻株coccomyxa subellipsoidea c-169单独培养结束后的生物量产率、总脂产率和α-亚麻酸产率,主要步骤为:将200ml胶球藻种子液接入含有2l基础培养基(配方如a所示)的生物反应器中,在温度28
±
1℃、光照强度100
μmol/m2/s、光照周期12h/12h、搅拌速度140rpm条件下培养168h达到对数末期。收集胶球藻藻液,在8000rpm离心15min,以pbs缓冲液洗涤藻泥数次后放入-80℃超低温冰箱内冷冻10h,再放入冷冻干燥机内干燥48h获得藻粉。称量胶球藻藻粉重量得生物量,以式(1)计算生物量产率。
51.准确称取0.02g(w1)冻干胶球藻藻粉,加入3ml水/氯仿/甲醇(v/v/v=0.5:2:1)震荡20min充分混匀,8000rpm离心10min,收集氯仿层,萃取重复3-5次,收集氯仿层至已称重(w2)50ml离心管中,以0.5ml 1m氯化钾和1ml超纯水清洗萃取管,合并所有清洗液与氯仿层,真空干燥至恒重(w3),以式(2)和(3)计算总脂含量和产率。
52.准确称取10mg冻干胶球藻藻粉,加入100μl十九酸内标液(1.0mg/ml)和2ml koh-ch3oh溶液(40g/l),75℃水浴加热15min,油珠完全溶解后取出,冷却至室温加入2ml bf
3-ch3oh溶液(v:v=1:4),再75℃水浴15min,待冷却加入1ml饱和nacl溶液和2ml正己烷,涡旋1min混匀,在4000rpm下离心8min。取1ml上清过0.22μm滤膜。亚麻酸含量采用gc 7900气相色谱仪进行测定,db-1701色谱柱(30mm
×
0.25mm,0.25μm),配备fid氢离子火焰器。载气为高纯氮气,流速1.6ml/min,进样口温度250℃,分流比50:1,检测器温度300℃,进样量1μl。升温程序为:100℃保持1min,以40℃/min升至200℃,再以8℃/min升至280℃,保持2min。按照国家标准gb 28404-2012给出的计算方法,依据保留时间以及对应峰面积计算α-亚麻酸油脂含量(mg/g藻粉),并以式(3)计算α-亚麻酸油脂产率。
53.如图3和图4所示结果,单一培养胶球藻株生长至对数末期所需时间为168h,至培养结束时,单一培养胶球藻获得的生物量产率、总脂产率和α-亚麻酸产率分别为0.76g/l/d、0.44g/l/d和0.14g/l/d。
54.综合以上,本发明共培养原始小球藻chlorella protothecoides和极地胶球藻株coccomyxa subellipsoidea c-169达到对数生长末期时间相较于单一培养原始小球藻chlorella protothecoides和极地胶球藻株coccomyxa subellipsoidea c-169均缩短72h,生物量产率增加至2.2-3.2倍,总脂产率提高至2.2-3.2倍,α-亚麻酸油脂产率提高到4.5-7.9倍。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1