一种贝莱斯芽孢杆菌及其应用
1.本发明属于水产养殖益生菌替代抗生素技术领域,具体涉及一种贝莱斯芽孢杆菌及其应用。
背景技术:
2.大口黑鲈是一种优质淡水鱼类,具有适应性强、生长快、易起捕、养殖周期短等优点,加之肉质鲜美细嫩,无肌间刺,外形美观,深受养殖者和消费者喜爱。中国大口黑鲈的年产量一直保持在15万吨左右。近年来,由于众多主客观原因,大口黑鲈养殖过程中病害种类和程度越来越严重。为防治病害,大量的化学药品和抗生素被长期过量使用,这虽然对水产动物病害防治起到了一定作用,但也产生了不容忽视的毒副作用,如造成药物残留、耐药性、引起水产动物免疫力下降、环境污染及微生态失调等影响。为了满足目前绿色无公害水产养殖生产的需求,寻找抗生素替代品,筛选天然无公害的免疫增强剂,提高水产动物的免疫力,以增强其对疾病的抵抗能力成为科研工作者的重要研究内容之一。至今,科研人员和企业已经研究和开发出多种抗生素替代物,主要包括益生菌、益生元、酸化剂、酶制剂、中草药提取物等。
3.益生菌因其独特的生理功能,已被广泛应用于水产养殖中,在改善饲料风味和适口性、提高饲料转化率、促进水产动物生长、增强机体免疫力和抗病力、改善水质和拮抗致病菌等方面均取得了显著的研究效果,具有广阔的发展前景。根据fao/who的定义,益生菌(probiotics)是指一类在足量摄入后对宿主健康有益的活微生物。目前,水产养殖中常用的的益生菌制剂主要包括乳酸菌类、芽孢杆菌类、酵母菌类、光合细菌和丁酸梭菌等。其中,作为益生菌之一的贝莱斯芽孢杆菌被广泛的研究及应用。近些年的研究表明,贝莱斯芽孢杆菌可作为有效的微生态制剂应用于哺乳动物、畜禽类和水产动物等的养殖过程中,能够有效促进养殖动物的生长性能。实践表明在鱼类和虾类的饲料中添加贝莱斯芽孢杆菌可调节鱼虾肠道菌群的平衡,提高饲料利用率和鱼虾免疫力,促进鱼虾生长,减少疾病发生,降低养殖风险,提高养殖效益。
4.目前,水产养殖中使用的大多数贝莱斯芽孢杆菌都是从陆生动物和人类来源中分离出来的。然而,研究表明,鱼源益生菌比非鱼类来源的益生菌更有效,因为它们可以适应相同的环境。因此,从大口黑鲈体内筛选分离出的天然贝莱斯芽孢杆菌,并将其应用于大口黑鲈养殖中具有重要意义。
技术实现要素:
5.本发明的目的在于克服上述现有技术的不足,提供了一种贝莱斯芽孢杆菌及其应用,从大口黑鲈体内筛选分离出的天然贝莱斯芽孢杆菌,并将其应用于大口黑鲈养殖中用于替代抗生素产品。
6.本发明为实现上述目的采用如下技术方案,一种贝莱斯芽孢杆菌,其特征在于:其分类命名为贝莱斯芽孢杆菌bacillus velezensis,编号为flu-1,于2022年08月01日保藏
于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.25454,保藏单位的地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编100101。
7.进一步限定,所述贝莱斯芽孢杆菌从大口黑鲈肠道内容物中分离纯化获得,该贝莱斯芽孢杆菌的16s rrna的序列注册号为op326015,其耐高温、耐酸、耐胆盐且能够产蛋白酶、淀粉酶、纤维素酶和甘露聚糖酶,并且该贝莱斯芽孢杆菌对抗生素敏感,不具有溶血活性。
8.本发明所述贝莱斯芽孢杆菌的分离纯化方法,其特征在于具体过程为:从养殖池塘选取健康大口黑鲈,置于超净工作台中,表面用体积分数75%的乙醇消毒,在无菌条件下取出肠道,将肠道内容物按体积比1:9的比例加入到无菌生理盐水中,然后经梯度稀释,涂布于fwa固体培养基中,于28℃培养24h,从平板中挑取单菌落进行纯化,获得纯菌flu-1,菌落形态特征为近圆形表面粗糙有褶皱,边缘不规则,乳白色无光泽,不透明。菌体呈杆状,0.4~0.7μm
×
0.8~3μm,单个或成对排列,芽胞椭圆形,中生或近端生,革兰氏阳性,利用细菌通用引物27f/1492r对获得的菌株进行16s rrna序列测定,得到长度为1453bp的基因序列片段。
9.本发明所述贝莱斯芽孢杆菌应用于制备水产养殖中预防或/和治疗细菌性疾病的益生菌制剂。
10.进一步限定,所述细菌性疾病的病原菌包括维氏气单胞菌(aeromonas veronii)、嗜水气单胞菌(aeromonas hydrophila)、大肠杆菌(escherichia coli)和金黄色葡萄球菌(staphylococcus aureus)。
11.进一步限定,所述水产养殖中的鱼类为大口黑鲈。
12.与现有技术相比,本发明具有如下突出的优点和技术效果:
13.1.本发明所述的贝莱斯芽孢杆菌flu-1分离自大口黑鲈体内,相比于其它应用于水产养殖中的益生菌,该菌株为鱼源益生菌。
14.2.本发明所述的贝莱斯芽孢杆菌flu-1益生性能表现在具有耐高温、耐酸、耐胆盐以及产蛋白酶、淀粉酶、纤维素酶和甘露聚糖酶等特性。
15.3.本发明所述的贝莱斯芽孢杆菌flu-1在大口黑鲈养殖应用中具有安全性。所述安全性具体为对青霉素、诺氟沙星、红霉素、氨苄西林、丁胺卡那、氯霉素、复方新诺明、庆大霉素、环丙沙星和头孢唑林等抗生素敏感,不具有溶血活性。
16.4.本发明所述的贝莱斯芽孢杆菌flu-1对水产病原菌维氏气单胞菌和嗜水气单胞菌具有较强的抑制作用,是潜在的抗生素替代品,具有较好的生产应用前景。
附图说明
17.图1是贝莱斯芽孢杆菌flu-1在lb培养基形态、扫描电镜观察、革兰氏染色、芽孢染色结果,其中贝莱斯芽孢杆菌flu-1在lb培养基形态(a);扫描电子显微镜下细菌形态(b);普通光学显微镜下革兰氏染色(c);普通光学显微镜下芽胞染色(d)。
18.图2是贝莱斯芽孢杆菌flu-1及其相近种属16s rdna基因进化树。
19.图3是贝莱斯芽孢杆菌flu-1抗病原菌结果,其中贝莱斯芽孢杆菌flu-1抗嗜水气单胞菌(a);维氏气单胞菌(b);金黄色葡萄球菌(c);大肠杆菌(d)。
20.图4是贝莱斯芽孢杆菌flu-1产消化酶结果,其中贝莱斯芽孢杆菌flu-1产淀粉酶
(a);蛋白酶(b);β-甘露聚糖酶(c);纤维素酶(d)结果。
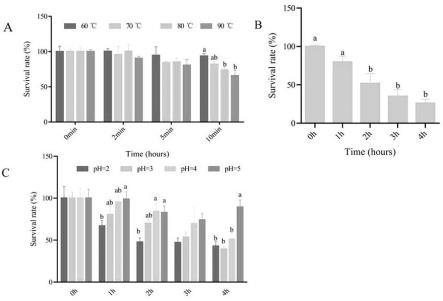
21.图5是贝莱斯芽孢杆菌flu-1耐受实验结果,其中贝莱斯芽孢杆菌flu-1耐温度(a);0.3%(v/v)胆盐(b);ph(c)结果。
22.图6是贝莱斯芽孢杆菌flu-1溶血实验结果。
具体实施方式
23.以下通过实施例对本发明的上述内容做进一步详细说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
24.实施例1
25.贝莱斯芽孢杆菌分离纯化及鉴定
26.从养殖池塘选取健康大口黑鲈,置于超净工作台中,表面用体积分数75%的乙醇消毒,无菌条件下取出肠道,将肠道内容物按体积比1:9的比例加入到无菌生理盐水中,然后经梯度稀释,涂布于fwa固体培养基中,于28℃培养24h。从平板中挑取单菌落进行纯化,获得纯菌并编号flu-1。菌落形态为近圆形表面粗糙有褶皱,边缘不规则,乳白色无光泽,不透明(图1)。菌体呈杆状,单个或成对排列,芽胞椭圆形,中生或近端生,革兰氏阳性(图1)。
27.利用细菌通用引物27f/1492r对该菌株进行16s rrna序列测定,得到长度为1453bp的基因序列片段,序列注册号为op326015。利用mega 7构建系统发育树(图2),结果表明其与贝莱斯芽孢杆菌聚在一枝。
28.实施例2
29.贝莱斯芽孢杆菌抗病原菌实验
30.利用牛津杯法评估分离菌株对金黄色葡萄球菌、大肠杆菌、维氏气单胞菌、嗜水气单胞菌抗病活性。当lb培养基灭菌后冷却至55℃时,以0.1%(v/v)的比例将病原菌(预培养过夜)添加到lb培养基中。然后,无菌培养皿中先放入牛津杯后再将混合物倒板,凝固后取出牛津杯,向孔中加入200μl过夜培养flu-1菌悬液进行静态吸附。最后,在28℃的培养箱中培养24小时后测定抑菌圈。如果牛津杯孔周围有一个透明圈,没有病原菌的生长,则表示该细菌对病原菌具有抗菌能力。抗菌能力的强弱以透明圈的直径来判断。结果发现贝莱斯芽孢杆菌flu-1对金黄色葡萄球菌、大肠杆菌、维氏气单胞菌、嗜水气单胞菌有较强的抗菌活性,如图3所示。
31.实施例3
32.贝莱斯芽孢杆菌产消化酶实验
33.表1消化酶验证培养基配方
[0034][0035]
利用产相应消化酶的验证培养基来检验(表1),淀粉酶验证培养基配制后倒于无菌培养皿中,待凝固后取过夜培养的贝莱斯芽孢杆菌flu-1菌悬液2μl点接于培养基,重复三次。于28℃培养24h后,在生长菌落的培养皿中滴加卢氏碘液染1min,观察菌落周围是否有透明圈形成,有则表示贝莱斯芽孢杆菌flu-1具有产淀粉酶能力,无透明圈则表示没有产此酶能力。蛋白酶验证培养基配制后倒于无菌培养皿中,待凝固后取过夜培养的贝莱斯芽孢杆菌flu-1菌悬液2μl点接于培养基,重复三次。于28℃培养24h后,观察菌落周围是否有透明圈形成,有则表示贝莱斯芽孢杆菌flu-1具有产蛋白酶能力,无透明圈则表示没有产此酶能力。β-甘露聚糖酶验证培养基配制后倒于无菌培养皿中,待凝固后取过夜培养的贝莱斯芽孢杆菌flu-1菌悬液2μl点接于培养基,重复三次。于28℃培养24h后,用1g/l刚果红溶液染15min,用0.9wt%nacl溶液冲洗后观察菌落周围是否有黄色透明圈形成,有则表示贝莱斯芽孢杆菌flu-1具有产β-甘露聚糖酶能力,无黄色透明圈则表示没有产此酶能力。纤维素酶验证培养基配制后倒于无菌培养皿中,待凝固后取过夜培养的贝莱斯芽孢杆菌flu-1菌悬液2μl点接于培养基,重复三次。于28℃培养24h后,用1g/l刚果红溶液染10min,用0.9wt%nacl溶液冲洗后观察菌落周围是否有黄色透明圈形成,有则表示贝莱斯芽孢杆菌flu-1具有产纤维素酶能力,无透明圈则表示没有产此酶能力。结果表明贝莱斯芽孢杆菌flu-1具有产上述四种消化酶的能力,如图4所示。
[0036]
实施例4
[0037]
贝莱斯芽孢杆菌益生性能评价(耐酸、耐胆盐、耐高温)
[0038]
菌株的耐酸性在不同ph条件下lb液体培养基中进行测定,1mol/l盐酸溶液调节至ph为2、3、4和5。以10%(v/v)的菌悬液接入,在100r/min的摇床上进行培养,分别于1、2、3、4小时取样进行稀释涂布,24小时后计数,并且以0小时计数的结果作为对照,结果发现ph为5的条件下存活率较高,暴露于ph为2、3、4的条件下4小时后存活率没有显著差异,暴露于ph为5的条件下4小时后存活率接近90%,结果表明贝莱斯芽孢杆菌flu-1具有耐酸性,如图5所示。
[0039]
菌株的胆盐耐受性在0.3%(v/v)胆盐含量条件下lb液体培养基中进行测定,以10%(v/v)的贝莱斯芽孢杆菌悬液接入,在100r/min的摇床上进行培养,分别于1、2、3、4小时取样进行稀释涂布,24小时后计数,并且以0小时计数的结果作为对照。结果发现菌株暴露于胆盐后2、3、4小时存活率没有显著差异具有耐胆盐能力,如图5所示。
[0040]
菌株的高温耐受性于不同温度下进行测定,将贝莱斯芽孢杆菌悬液置于不同温度(60℃、70℃、80℃、90℃)下,分别于2、5、10分钟取样进行稀释涂布,24小时后计数,并且室温下初始计数的结果作为对照。结果发现,60℃、70℃、80℃在前五分钟存活率没有显著差
异,即使在90℃高温下10min后存活率也高于50%,如图5所示。
[0041]
实施例5
[0042]
贝莱斯芽孢杆菌安全性能评价(抗生素敏感性、溶血性、生物致病能力)
[0043]
通过使用纸片扩散法测试抗生素敏感性。过夜培养的贝莱斯芽孢杆菌菌悬液取100ul在lb固体培养基用涂布棒涂布,后将含有不同抗生素的纸片贴于培养基表面,于24小时后观察抑菌圈情况并测量抑菌圈直径,存在抑菌圈则表明对该抗生素敏感。结果表明贝莱斯芽孢杆菌flu-1对青霉素、诺氟沙星、红霉素、氨苄西林、丁胺卡那、氯霉素、复方新诺明、庆大霉素、环丙沙星和头孢唑林等抗生素敏感,如表2所示。
[0044]
表2贝莱斯芽孢杆菌flu-1抗生素敏感试验结果
[0045][0046]
注:r耐药(直径《10.00mm);s:敏感(直径≥10.00mm)
[0047]
菌株溶血性通过血平板来判定。在含有羊血的基础血琼脂培养基上用移液枪取过夜培养的菌悬液5ul点接,于28℃下培养24小时,通过菌落周围的培养基变化判断溶血结果,分为α-溶血(菌落周围的绿色区域)、β-溶血(菌落周围的透明区域)或γ-溶血(菌落周围没有变化),同时以嗜水气单胞菌作为对照。结果发现贝莱斯芽孢杆菌flu-1为γ-溶血,如图6所示。
[0048]
生物致病能力的测定是通过对健康的活鱼进行细菌注射实验判定的。于28℃培养的菌悬液以1
×
108cfu/ml浓度通过腹腔注射200μl到大口黑鲈体内,两周内观察鱼体发病情况,并以腹腔注射生理盐水的鱼作为对照。结果表明贝莱斯芽孢杆菌flu-1对大口黑鲈是安全的。
[0049]
以上实施例描述了本发明的基本原理、主要特征及优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1