哌嗪类化合物及其制备方法和应用与流程
1.本发明涉及药物技术领域,特别是涉及一种哌嗪类化合物及其制备方法和应用。
背景技术:
2.bcl-2蛋白是b细胞淋巴瘤-2(b-cell lymphoma 2,bcl-2)家族的成员之一,也是人体内重要的抗凋亡因子。bcl-2家族在调控内源性细胞凋亡过程中起重要作用,根据功能活性可分为两大类:抗凋亡蛋白和促凋亡蛋白。抗凋亡蛋白均具有四个bh(bcl-2 homology)功能域,包括bcl-2、bcl-xl、bcl-w、mcl-1、bcl-2-related protein a1等。促凋亡蛋白根据其结构可进一步分为两类:多结构域促凋亡因子,包括bak、bax、bok等;以及仅含bh3结构域的促凋亡蛋白,包括bad、bid、bik、noxa、puma、bim等。抗凋亡蛋白和促凋亡蛋白之间的平衡和相互作用决定细胞是否进入凋亡程序。抗凋亡蛋白如bcl-2通过与促凋亡蛋白形成异源二聚体,抑制促凋亡蛋白形成活性状态,保护细胞不进入凋亡程序。当细胞接收到内源性凋亡信号后,仅含bh3结构域的促凋亡蛋白可以与抗凋亡蛋白bcl-2蛋白结合,解除bcl-2对多结构域促凋亡因子的抑制,并可以直接激活多结构域促凋亡因子,促使这些凋亡诱导因子在线粒体外膜形成寡聚体,导致线粒体外膜通透(momp),释放细胞色素c和其他促凋亡因子,激活胞质内的凋亡级联反应,引起细胞凋亡。
3.细胞凋亡在肿瘤的发生、发展以及产生耐药中发挥着重要作用。bcl-2蛋白的高表达在促进淋巴和血液系统恶性肿瘤存活中的作用已经得到了广泛证实:t(14;18)染色体易位是滤泡型淋巴瘤(fcl)患者中最常见的突变,同时也存在于大约30%的弥漫性大b细胞淋巴瘤(dlbcl)患者中,这一染色体易位突变导致了bcl-2蛋白的过量表达;bcl-2基因所在的18q21染色体区域的扩增导致了bcl-2蛋白的高表达也常见于慢性髓系白血病(cml)以及活化b细胞样弥漫性大b细胞淋巴瘤(abc-dlbcl)中,与较低的生存率和不良预后显著相关;bcl-2蛋白在超过80%的慢性淋巴细胞白血病(cll)患者中存在高表达,主要由于染色体13q14区域的缺失降低了抑制bcl-2蛋白表达的微小rna(mir-15a和mir16-1)的表达水平;bcl-2在急性髓性白血病(aml)和急性淋巴细胞白血病(all)患者中也存在高表达。除了淋巴和血液系统恶性肿瘤外,bcl-2在很多实体瘤中也存在高表达,包括80%的小细胞肺癌(sclc),20%的mycn扩增的神经母细胞瘤,85%的雌激素受体阳性的乳腺癌(er+ bc),黑色素瘤、前列腺癌、胃癌,胰腺癌等患者。此外,bcl-2的抗凋亡作用也是导致肿瘤对多种化疗药产生耐药性的因素之一,例如bcl-2的过量表达与胃癌对5-fu的抗性、卵巢癌对cisplatin的抗性、雌激素受体阳性的乳腺癌对紫杉醇的抗性等显著相关。
4.因此,bcl-2的抗凋亡作用使其成为肿瘤治疗领域热门的药物靶标。目前针对bcl-2蛋白抑制剂的开发是基于与其结合的促凋亡蛋白的bh3结构类似物,竞争抑制bcl-2结合抑制促凋亡蛋白的功能。navitoclax(abt-263)是首个具有口服活性、靶向bcl-2和bcl-xl蛋白的抑制剂,临床试验证实它对白血病和一些实体瘤有效,但也显示出剂量限制性毒性,主要是由其对bcl-xl蛋白的抑制导致了嗜中性白血球减少和血小板减少等。随后,新的bcl-2抑制剂venetoclax(abt-199、gdc-0199)被开发出来,对bcl-2蛋白具有更强的选择
性,降低了血小板减少毒副作用的产生。2016年venetoclax成为首个被fda批准上市的bcl-2抑制剂,用于治疗17p缺失突变以及接收过至少一种治疗的复发性慢性淋巴细胞白血病(cll)患者,后续拓展到全部慢性淋巴细胞白血病患者、小淋巴细胞性淋巴瘤(sll)患者以及作为联合用药治疗部分确诊初期的急性髓性白血病(aml)患者。venetoclax作为单药治疗,总缓解率(orr)高达79%。此外,venetoclax可增强多种肿瘤对化疗药物的敏感性,能够帮助克服对化疗药物的抗性,因此也在多种血液瘤或实体瘤患者中开展了与化疗药联用的临床实验。
5.虽然venetoclax在cll患者中展现了显著的疗效,但临床研究已经观察到了继发性耐药的产生,比如发生g101v位点突变。因此开发能够靶向抑制bcl-2蛋白的小分子药物具有重要的临床意义。
6.此外,小分子化合物选择性降解靶蛋白可以通过招募e3泛素化连接酶的方法来实现。小分子降解剂同时与靶蛋白和e3泛素化连接酶结合,使靶蛋白发生泛素化修饰,进而被蛋白酶体识别并降解。因此,进一步开发能够通过招募e3泛素化连接酶的方法降解bcl-2蛋白的小分子药物具有重要的临床意义。
技术实现要素:
7.基于此,本发明提供一种能够靶向调控bcl-2蛋白的哌嗪类化合物及其制备方法和应用。
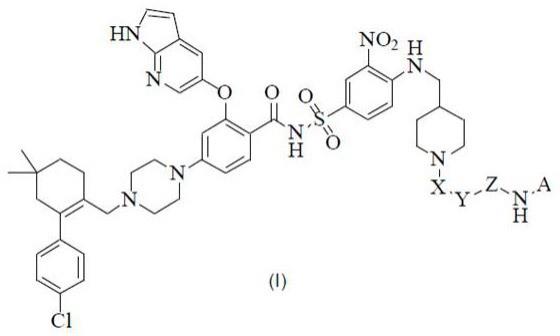
8.本发明的第一方面,提供一种哌嗪类化合物,具有如下式(i)所示结构:其中,a为;基团-x-y-具有如下特征:x为ch2,y为-c(o)nh-;z为-(ch2)
n-或-(ch2ch2o)
m-ch2ch
2-;n为2、3、4或5;m为1、2或4。
9.在其中一个实施例中,n为2、3或4。
10.在其中一个实施例中,m为2或4。
11.在其中一个实施例中,所述的哌嗪类化合物具有式(ii) 或(iii)所示结构:
。
12.在其中一个实施例中,所述的哌嗪类化合物选自如下化合物之一:、、、、、
和。
13.本发明还提供第一方面所述的哌嗪类化合物的制备方法,包括如下步骤:将化合物1和化合物2进行反应,使基团d和基团e反应生成基团-x-y-,制备所述哌嗪类化合物;其中,化合物1具有如下所示结构:;化合物2具有如下所示结构:;a、x、y和z的定义如第一方面所示。
14.在其中一个实施例中,所述制备方法包括如下步骤:将化合物i-9和化合物ii-1进行反应;其中,化合物i-9具有如下所示结构:;化合物ii-1具有如下所示结构:
。
15.在其中一个实施例中,反应在碱和缩合试剂存在的条件下进行,反应温度为室温。
16.在其中一个实施例中,化合物i-9的制备方法包括如下步骤:将化合物i-6与化合物i-7进行反应,制备化合物i-8;将化合物i-8进行脱除保护基反应,制备化合物i-9;其中,化合物i-6、化合物i-7、化合物i-8和化合物i-9具有如下所示结构:9具有如下所示结构:9具有如下所示结构:;其中,r1为烷基。
17.在其中一个实施例中,化合物i-6的制备方法包括如下步骤:将化合物i-1与化合物i-2进行反应,制备化合物i-3;将化合物i-3与化合物i-4进行反应,制备化合物i-5;将化合物i-5进行脱除保护基反应,制备化合物i-6;
其中,化合物i-1、化合物i-2、化合物i-3、化合物i-4、化合物i-5具有如下所示结构:构:;其中,m为保护基。
18.在其中一个实施例中,所述化合物ii-1的制备方法包括如下步骤:将化合物ii-2与化合物ii-3进行反应,制备化合物ii-4;将化合物ii-4进行脱除保护基反应,制备化合物ii-1;其中,化合物ii-2、化合物ii-3、化合物ii-4和化合物ii-1具有如下所示结构:
。
19.本发明的第三方面,提供一种药物,包括第一方面所述的哌嗪类化合物或其药学上可接受的盐,以及药学上可接受的载体。
20.本发明的第四方面,提供第一方面所述的哌嗪类化合物或其药学上可接受的盐在制备降解bcl-2蛋白的药物中的应用。
21.本发明的第五方面,提供第一方面所述的哌嗪类化合物或其药学上可接受的盐在制备治疗或预防肿瘤及其相关疾病的药物中的应用。
22.在其中一个实施例中,所述肿瘤及其相关疾病为急性淋巴细胞白血病、慢性淋巴细胞白血病、小淋巴细胞淋巴瘤、急性粒细胞白血病、慢性粒细胞白血病、套细胞淋巴瘤、多发性骨髓瘤、非霍奇金淋巴瘤、肺癌、食管癌、胃癌、肝癌、胰腺癌、黑色素瘤、前列腺癌、乳腺癌或卵巢癌。
23.经研究,上述的哌嗪类化合物能够靶向调控bcl-2蛋白,进而实现对肿瘤的治疗和预防,特别是对人急性淋巴细胞白血病具有较优的抑制活性。同时潜在地可以克服现有药物出现继发性耐药的问题。
24.进一步经研究发现,上述的哌嗪类化合物可以通过招募crbn e3连接酶的方法进而有效降解bcl-2,且同时还可以降解ikaros以及aiolos蛋白,通过对三种蛋白的降解,具有潜在的协同增效能力,有效抑制人急性淋巴细胞白血病细胞的生长和存活。
25.另外,上述哌嗪类化合物的生物利用度高,具有较好的成药性。
附图说明
26.图1为化合物cpd1、cpd2处理rs4;11细胞3天后的细胞活力结果图;图2为化合物cpd1和cpd2对抗凋亡蛋白bcl-2以及两个免疫转录因子ikaros和aiolos蛋白的降解的结果图;图3为化合物cpd3、cpd7和cpd6对抗凋亡蛋白bcl-2以及两个免疫转录因子ikaros和aiolos蛋白的降解的结果图。
具体实施方式
27.以下结合具体实施例对本发明的哌嗪类化合物及其制备方法和应用作进一步详细的说明。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明公开内容理解更加透彻全面。
28.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
29.本文中,术语“烷基”是指包含伯(正)碳原子、或仲碳原子、或叔碳原子、或季碳原
子、或其组合的饱和烃失去一个氢原子生成的一价残基。包含该术语的短语,例如,“c1~c3亚烷基”是指包含1~3个碳原子的烷基,每次出现时,可以互相独立地为c1烷基、c2烷基、c3烷基。“烷基”合适的实例包括但不限于:甲基(me、-ch3)、乙基(et、-ch2ch3)、1-丙基(n-pr、n-丙基、-ch2ch2ch3)、2-丙基(i-pr、i-丙基、-ch(ch3)2)、1-丁基(n-bu、n-丁基、-ch2ch2ch2ch3)、2-甲基-1-丙基(i-bu、i-丁基、-ch2ch(ch3)2)、2-丁基(s-bu、s-丁基、-ch(ch3)ch2ch3)、2-甲基-2-丙基(t-bu、t-丁基、-c(ch3)3)、1-戊基(n-戊基、-ch2ch2ch2ch2ch3)、2-戊基(-ch(ch3)ch2ch2ch3)、3-戊基(-ch(ch2ch3)2)、2-甲基-2-丁基(-c(ch3)2ch2ch3)、3-甲基-2-丁基(-ch(ch3)ch(ch3)2)、3-甲基-1-丁基(-ch2ch2ch(ch3)2)、2-甲基-1-丁基(-ch2ch(ch3)ch2ch3)、1-己基(-ch2ch2ch2ch2ch2ch3)、2-己基(-ch(ch3)ch2ch2ch2ch3)、3-己基(-ch(ch2ch3)(ch2ch2ch3))、2-甲基-2-戊基(-c(ch3)2ch2ch2ch3)、3-甲基-2-戊基(-ch(ch3)ch(ch3)ch2ch3)、4-甲基-2-戊基(-ch(ch3)ch2ch(ch3)2)、3-甲基-3-戊基(-c(ch3)(ch2ch3)2)、2-甲基-3-戊基(-ch(ch2ch3)ch(ch3)2)、2,3-二甲基-2-丁基(-c(ch3)2ch(ch3)2)、3,3-二甲基-2-丁基(-ch(ch3)c(ch3)3和辛基(-(ch2)7ch3)。可以理解地,术语“亚烷基”是指在“烷基”的基础上再失去一个氢原子的残基。
[0030]“药学上可接受的”指在合理医学判断范围内适于施用患者且与合理益处/风险比相称的那些配体、材料、组合物和/或剂型。
[0031]“药学上可接受的载体”指药学上可接受的材料、组合物或媒剂,例如液体或固体填充剂、稀释剂、赋形剂、溶剂或囊封材料。如本文所用,语言“药学上可接受的载体”包括与药物施用相容的缓冲剂、注射用无菌水、溶剂、分散介质、包衣、抗细菌剂及抗真菌剂、等渗剂及吸收延迟剂及诸如此类。在与配制物中其他成分兼容且对患者无害的意义上,每种载体必须为“药学上可接受的”。合适的实例包括但不限于:(1)糖,例如乳糖、葡萄糖及蔗糖;(2)淀粉,例如玉米淀粉、马铃薯淀粉及经取代或未经取代的β-环糊精;(3)纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素及乙酸纤维素;(4)粉状黄蓍胶;(5)麦芽;(6)明胶;(7)滑石;(8)赋形剂,例如可可脂及栓剂蜡;(9)油类,例如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油及大豆油;(10)二醇,例如丙二醇;(11)多元醇,例如甘油、山梨醇、甘露醇及聚乙二醇;(12)酯类,例如油酸乙酯及月桂酸乙酯;(13)琼脂;(14)缓冲剂,例如氢氧化镁及氢氧化铝;(15)海藻酸;(16)无热原水;(17)等渗盐水;(18)林格氏溶液;(19)乙醇;(20)磷酸盐缓冲液;及(21)药物配制物中所采用的其他无毒兼容物质。
[0032]“药学上可接受的盐”是指所示结构中的任一化合物与酸或碱所形成的适合用作药物的盐。药学上可接受的盐包括无机盐和有机盐。其中,一类盐是本发明化合物与酸形成的盐。适合形成盐的酸包括但并不限于:盐酸、氢溴酸、氢氟酸、硫酸、硝酸、磷酸等无机酸;甲酸、乙酸、三氟乙酸、丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苦味酸、苯甲酸、甲磺酸、乙磺酸、对甲苯磺酸、苯磺酸、萘磺酸等有机酸;以及脯氨酸、苯丙氨酸、天冬氨酸、谷氨酸等氨基酸。另一类盐是本发明化合物与碱形成的盐,适合形成盐的碱包括但并不限于:碱金属盐(例如钠盐或钾盐)、碱土金属盐(例如镁盐或钙盐)、铵盐(如低级的烷醇铵盐以及其它药学上可接受的胺盐),例如甲胺盐、乙胺盐、丙胺盐、二甲基胺盐、三甲基胺盐、二乙基胺盐、三乙基胺盐、叔丁基胺盐、乙二胺盐、羟乙胺盐、二羟乙胺盐、三羟乙胺盐,以及分别由吗啉、哌嗪、赖氨酸形成的胺盐。
[0033]
本发明的化合物或包含其的药物的剂型和施用方式没有特别限制。
[0034]
代表性的施用方式包括但并不限于:口服、瘤内、直肠、肠胃外(静脉内、肌肉内或皮下)注射、和局部给药。
[0035]
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i)润滑剂,例如,滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与上述赋形剂中的一种或多种形成微胶囊形式。
[0036]
用于口服给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,具体例如,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1 ,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物。除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。如悬浮液可包含悬浮剂,具体例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物。
[0037]
用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,以及用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水或非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
[0038]
用于局部给药的剂型包括软膏剂、散剂、贴剂、喷射剂和吸入剂。由活性成分在无菌条件下与药学上可接受的载体及任何防腐剂、缓冲剂,或必要时可能需要的推进剂一起混合而成。
[0039]
本发明中,“第一方面”、“第二方面”、“第三方面”、“第四方面”等仅用于描述目的,不能理解为指示或暗示相对重要性或数量,也不能理解为隐含指明所指示的技术特征的重要性或数量。而且“第一”、“第二”、“第三”、“第四”等仅起到非穷举式的列举描述目的,应当理解并不构成对数量的封闭式限定。
[0040]
本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
[0041]
本发明中,涉及到数值区间,如无特别说明,上述数值区间内视为连续,且包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值。进一步地,当范围是指整数时,包括该范围的最小值与最大值之间的每一个整数。此外,当提供多个范围描述特征或特性时,可以合并该范围。换言之,除非另有指明,否则本文中所公开之所有范围应理解为包括其中所归入的任何及所有的子范围。
[0042]
本发明中涉及的百分比含量,如无特别说明,对于固液混合和固相-固相混合均指
质量百分比,对于液相-液相混合指体积百分比。
[0043]
本发明中涉及的百分比浓度,如无特别说明,均指终浓度。所述终浓度,指添加成分在添加该成分后的体系中的占比。
[0044]
本发明中的温度参数,如无特别限定,既允许为恒温处理,也允许在一定温度区间内进行处理。所述的恒温处理允许温度在仪器控制的精度范围内进行波动。
[0045]
本发明中的室温一般指4℃~30℃,较佳地指20
±
5℃。
[0046]
本发明提供一种哌嗪类化合物,具有如下式(i)所示结构:其中,a为;基团-x-y-具有如下特征:x为ch2,y为-c(o)nh-;z为-(ch2)
n-或-(ch2ch2o)
m-ch
2-ch
2-;n为2、3、4或5;m为1、2或4。
[0047]
在其中一个示例中,z为-(ch2)
n-。
[0048]
在其中一个示例中,n为2、3或4。
[0049]
在其中一个示例中,m为2或4。
[0050]
在其中一个示例中,所述的哌嗪类化合物具有式(ii)或(iii)所示结构:。
[0051]
在其中一个示例中,所述的哌嗪类化合物选自如下化合物之一:
、、、、、和
。
[0052]
本发明还提供如上所述的哌嗪类化合物的制备方法,包括如下步骤:将化合物1和化合物2进行反应,使基团d和基团e反应生成基团-x-y-,制备所述哌嗪类化合物;其中,化合物1具有如下所示结构:;化合物2具有如下所示结构:;a、x、y和z的定义如上所示。可以理解地,d和e不作特别限制,依据基团-x-y-的结构进行设计即可。
[0053]
在其中一个示例中,所述制备方法包括如下步骤:s401:将化合物i-9和化合物ii-1进行反应;其中,化合物i-9具有如下所示结构:;化合物ii-1具有如下所示结构:。
[0054]
在其中一个示例中,步骤s401中,反应在碱和缩合试剂存在的条件下进行,反应温度为室温。进一步地,缩合试剂为edci和hoat的组合。反应采用的溶剂和碱的种类可以不作
特别限制,举例可如溶剂为dmso,碱为nmm。
[0055]
在其中一个示例中,化合物i-9的制备方法包括如下步骤:s104:将化合物i-6与化合物i-7进行反应,制备化合物i-8;s105:将化合物i-8进行脱除保护基反应,制备化合物i-9;其中,化合物i-6、化合物i-7、化合物i-8和化合物i-9具有如下所示结构:9具有如下所示结构:9具有如下所示结构:;其中,r1为烷基。不作限制地,r1可举例如叔丁基。
[0056]
在其中一个示例中,化合物i-6的制备方法包括如下步骤:s101:将化合物i-1与化合物i-2进行反应,制备化合物i-3;s102:将化合物i-3与化合物i-4进行反应,制备化合物i-5;s103:将化合物i-5进行脱除保护基反应,制备化合物i-6;其中,化合物i-1、化合物i-2、化合物i-3、化合物i-4、化合物i-5具有如下所示结构:
;其中,m为保护基。不作限制地,m可举例如boc。
[0057]
在其中一个示例中,步骤s101中,反应在碱存在的条件下进行,反应温度为66℃~76℃。应采用的溶剂和碱的种类可以不作特别限制,举例可如溶剂为四氢呋喃,碱为diea。
[0058]
在其中一个示例中,步骤s102中,反应在碱和缩合试剂存在的条件下进行,反应温度为室温。进一步地,缩合试剂为edci。反应采用的溶剂和碱的种类可以不作特别限制,举例可如溶剂为二氯甲烷,碱为三乙胺和/或dmap。
[0059]
在其中一个示例中,步骤s103中,反应在酸存在的条件下进行,反应温度为室温。应采用的溶剂和酸的种类可以不作特别限制,举例可如溶剂为二氯甲烷,酸为三氟乙酸。
[0060]
在其中一个示例中,步骤s104中,反应在碱存在的条件下进行,反应温度为室温。应采用的溶剂和碱的种类可以不作特别限制,举例可如溶剂为二甲基亚砜,碱为diea。
[0061]
在其中一个示例中,步骤s105中,反应在酸存在的条件下进行,反应温度为室温。应采用的溶剂和酸的种类可以不作特别限制,举例可如溶剂为二氯甲烷,酸为三氟乙酸。
[0062]
在其中一个示例中,所述化合物ii-1的制备方法包括如下步骤:s201:将化合物ii-2与化合物ii-3进行反应,制备化合物ii-4;s202:将化合物ii-4进行脱除保护基反应,制备化合物ii-1;其中,化合物ii-2、化合物ii-3、化合物ii-4和化合物ii-1具有如下所示结构:
。
[0063]
在其中一个示例中,步骤s201中,反应在碱存在的条件下进行,反应条件为微波反应,温度为80℃~90℃。应采用的溶剂和碱的种类可以不作特别限制,举例可如溶剂为dmf,碱为diea。
[0064]
在其中一个示例中,步骤s202中,反应在酸存在的条件下进行,反应温度为室温。应采用的溶剂和酸的种类可以不作特别限制,举例可如溶剂为二氯甲烷,酸为三氟乙酸。
[0065]
本发明还提供一种药物,包括如上所述的哌嗪类化合物或其药学上可接受的盐,以及药学上可接受的载体。
[0066]
本发明还提供如上所述的哌嗪类化合物或其药学上可接受的盐在制备降解bcl-2蛋白的药物中的应用。
[0067]
本发明还提供如上所述的哌嗪类化合物或其药学上可接受的盐在制备治疗或预防肿瘤及其相关疾病的药物中的应用。
[0068]
在其中一个示例中,所述肿瘤及其相关疾病为急性淋巴细胞白血病、慢性淋巴细胞白血病、小淋巴细胞淋巴瘤、急性粒细胞白血病、慢性粒细胞白血病、套细胞淋巴瘤、多发性骨髓瘤、非霍奇金淋巴瘤、肺癌、食管癌、胃癌、肝癌、胰腺癌、黑色素瘤、前列腺癌、乳腺癌或卵巢癌。
[0069]
本发明还提供一种治疗或预防肿瘤及其相关疾病的方法,包括施加有效剂量的如上所述的哌嗪类化合物或其药学上可接受的盐。
[0070]
在其中一个示例中,所述肿瘤及其相关疾病为急性淋巴细胞白血病、慢性淋巴细胞白血病、小淋巴细胞淋巴瘤、急性粒细胞白血病、慢性粒细胞白血病、套细胞淋巴瘤、多发性骨髓瘤、非霍奇金淋巴瘤、肺癌、食管癌、胃癌、肝癌、胰腺癌、黑色素瘤、前列腺癌、乳腺癌或卵巢癌。
[0071]
以下为具体的实施例。
[0072]
实施例中,化合物核磁共振谱图通过bruker-400 mhz核磁共振仪测定得到;lc-ms谱图通过shimadzu lc-ms 2020 型仪器或者waters lc-ms acquity h uplc型仪器测定得到。本发明所用溶剂和试剂未经特别说明均从商业途径采购得到。
[0073]
中间体制备实施例中间体制备实施例1:中间体1-6和1-9的合成合成步骤1:合成中间体1-3
在100ml单口瓶中加入中间体1-1(500mg,2.271mmol),中间体1-2(486.7mg,2.271mmol),n,n-二异丙基乙胺(878.9mg,6.813mmol)和四氢呋喃(22ml)。反应混合物加热到70
°
c,搅拌过夜,浓缩后的粗产品经过柱层析纯化(石油醚/乙酸乙酯=5:1)得到目标产物1-3(871mg,产率:93%),为黄色固体。
[0074]
ms (esi) m/z = 415 [m+h]
+
。
[0075]
合成步骤2:合成中间体1-5在100ml单口瓶中加入中间体1-4(1.2 g,2.104mmol)和二氯甲烷(45ml)。完全溶解后,冷却到0
°
c搅拌。随后加入中间体1-3(871mg,2.104mmol)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(807.9mg,4.208mmol),4-二甲氨基吡啶(514.1 mg,4.208 mmol)和三乙胺(638.7 mg,6.312 mmol)。反应混合物室温搅拌过夜.浓缩后的粗产品经过柱层析纯化(石油醚/乙酸乙酯=3:2)得到目标产物1-5(1.8g,产率:89%),为黄色固体。
[0076]
ms (esi) m/z = 967 [m+h]
+
。
[0077]
合成步骤3:合成中间体1-6在50ml单口瓶中加入中间体1-5(1.8g,1.863mmol)和二氯甲烷(20ml)。完全溶解后,加入三氟乙酸(5ml)。室温搅拌过夜后,浓缩得到的粗产品在甲基叔丁基醚中打浆得到目标产物1-6(1.48 g,收率: 81%),为黄色固体。
[0078]
ms (esi) m/z = 867 [m+h]
+
。
[0079]1h nmr (400 mhz, dmso-d6) δ 11.72 (s, 2 h), 8.70
ꢀ–ꢀ
8.67 (m, 2 h), 8.57 (d, j = 2 hz, 1 h), 8.38
ꢀ–ꢀ
8.36 (m, 1 h), 8.04 (d, j = 2.4 hz, 1 h), 7.84
ꢀ–ꢀ
7.81 (m, 1 h), 7.56 (d, j = 2.4 hz, 1 h), 7.53
ꢀ–ꢀ
7.50 (m, 2 h), 7.39 (d, j = 8.4 hz, 2 h), 7.14 (d, j = 9.2 hz, 1 h), 7.08 (d, j = 8.4 hz, 2 h), 6.73
ꢀ–ꢀ
6.70 (m, 1 h), 6.41
ꢀ–ꢀ
6.39 (m, 1 h), 6.25 (d, j = 1.6 hz, 1 h), 3.83
ꢀ–ꢀ
3.52 (m, 6 h), 3.37
ꢀ–ꢀ
3.34 (m, 2 h), 3.31
ꢀ–ꢀ
3.28 (m, 2 h), 3.12
ꢀ–ꢀ
2.99 (m, 2 h), 2.89
ꢀ–ꢀ
2.67 (m, 4 h), 2.19 (s, 2 h), 2.01 (s, 2 h), 1.93 (s, 1 h), 1.86 (d, j = 14.4 hz, 2 h), 1.45
ꢀ–ꢀ
1.32 (m, 4 h), 0.94 (s, 6 h)。
[0080]
合成步骤4:合成中间体1-8向中间体1-6(2.0g,4.47mmol)和中间体1-7(1.31g,6.70mmol)的dmso(5.0ml)溶液中加入dipea(2.89g,22.34mmol,3.69ml)。反应液室温搅拌16小时后,lcms检测无原料剩余。反应液加入至冰水中。搅拌20分钟后,过滤。滤饼用水冲洗,干燥后得到目标中间体1-8 (2.37 g,产率:95%),为黄色固体。
[0081]
合成步骤5:合成中间体1-9向中间体1-8(2.37g,4.23mmol)的二氯甲烷(10ml)溶液中加入三氟乙酸(481.92mg,4.23mmol,20ml)。反应液室温搅拌2小时后lcms检测无原料剩余。反应液浓缩后,经反相色谱柱纯化(甲醇:水:三氟乙酸=9:11:0.02)得到目标中间体1-9 (1.5 g,产率:70%),为黄色固体。
[0082]
ms (esi) m/z = 925.6 [m+h]
+
。
[0083]1h nmr (400 mhz, dmso-d6) δ 13.02 (s, 1h), 11.73 (s, 2 h), 8.72
ꢀ–ꢀ
8.66 (m, 2 h), 8.55 (d, j = 2 hz, 1 h), 8.37
ꢀ–ꢀ
8.34 (m, 1 h), 8.03 (d, j = 2.4 hz, 1 h), 7.83
ꢀ–ꢀ
7.80 (m, 1 h), 7.54 (d, j = 2.4 hz, 1 h), 7.52
ꢀ–ꢀ
7.49 (m, 2 h), 7.38 (d, j = 8.4 hz, 2 h), 7.12 (d, j = 9.2 hz, 1 h), 7.06 (m, 2 h), 6.72
ꢀ–ꢀ
6.70 (m, 1 h), 6.42
ꢀ–ꢀ
6.39 (m, 1 h), 6.24 (d, j = 1.6 hz, 1 h), 3.82
ꢀ–ꢀ
3.52 (m, 6 h), 3.38
ꢀ–ꢀ
3.32 (m, 4 h), 3.30
ꢀ–ꢀ
3.27 (m, 2 h), 3.13
ꢀ–ꢀ
2.99 (m, 2 h), 2.88
ꢀ–ꢀ
2.65 (m, 4 h), 2.18 (s, 2 h), 2.02 (s, 2 h), 1.87 (d, j = 14.4 hz, 2 h), 1.43
ꢀ–ꢀ
1.32 (m, 4 h), 0.95 (s, 6 h)。
[0084]
中间体制备实施例2:中间体2-4的合成合成步骤1:合成中间体2-3向化合物2-1(1.66g,6.0 mmol)的dmf(12 ml)溶液中加入化合物2-2 (1.25 g, 6.6 mmol)和diea (2..32g, 18 mmol)。反应液微波85
°
c下反应50分钟后。当tlc检测原料完全消失后,所得溶液用乙酸乙酯稀释(200 ml),水洗,饱和氯化钠洗涤,无水硫酸钠干燥并浓缩。残留物经正向硅胶柱纯化(石油醚: 乙酸乙酯 = 1:1)得产物2-3(1.3g,产率16%),为黄色固体。
[0085]
ms (esi) m/z = 317.1 [m-100+h]
+
。
[0086]
合成步骤2:合成中间体2-4室温下,向中间体2-3的二氯甲烷(10 ml)溶液中加入三氟乙酸(5 ml)。反应液室温搅拌2小时后浓缩,用乙酸乙酯研磨,过滤,用mtbe洗涤,干燥得到中间体2-4 (1.3 g,产率98%),为黄色固体。
[0087]
ms (esi) m/z = 317.1 [m+h]
+
。
[0088]1h nmr (400 mhz, dmso-d6) δ 11.14 (s, 1 h), 7.85 (s, 3h), 7.45 (t, j = 7.2 hz, 1h), 7.19 (d, j = 7.2 hz, 1h), 7.10 (d, j = 7.2 hz, 1h), 6.84 (t, j = 6.4 hz, 1h), 5.07 (dd, j = 5.2, 12.8 hz, 1h), 3.58 (q, j = 6.4 hz, 2h), 3.00 (s, 2h), 2.94-2.85 (m, 1h), 2.62-2.50 (m, 2h), 2.05-2.00 (m, 1h)。
[0089]
中间体制备实施例3:中间体3-4的合成中间体3-4按照中间体制备实施例2的方法合成得到目标中间体3-4 (1.2 g, 两步产率11%),为黄色固体。
[0090]
ms (esi) m/z = 331.1 [m+h]
+
。
[0091]1h nmr (400 mhz, dmso-d6) 11.11(s, 1h), 7.74 (s, 2h), 7.62-7.58 (m, 1h), 7.15 (d, j = 8.4 hz, 1h), 7.05 (d, j = 7.2 hz, 1h), 6.78-6.75 (m, 1h), 5.08-5.04 (m, 1h), 3.43-3.36 (m, 2h), 2.90-2.86 (m, 3h), 2.62-2.51 (m, 2h), 2.08-2.01 (m, 1h), 1.86-1.80 (m, 2h)。
[0092]
中间体制备实施例4:中间体4-4的合成
中间体4-4按照中间体制备实施例2的方法合成得到目标中间体4-4(1.4g,两步产率15%),为白黄固体。
[0093]
ms (esi) m/z = 345.1 [m+h]
+
。
[0094]1h nmr (400 mhz, dmso-d6) 11.11(s, 1 h), 7.84 (s, 2h), 7.62-7.57 (m, 1h), 7.13 (d, j = 8.4 hz, 1h), 7.04 (d, j = 6.8 hz, 1h), 6.62 (s, 1h), 5.08-5.04 (m, 1h), 3.34 (s, 2h), 2.90-2.83 (m, 3h), 2.62-2.51 (m, 2h), 2.06-2.01 (m, 1h),1.65-1.60(m, 4h)。
[0095]
中间体制备实施例5:中间体5-4的合成中间体5-4按照中间体制备实施例2的方法合成得到目标中间体5-4 (2.3g, 两步产率26%),为黄色固体。
[0096]
ms (esi) m/z = 359.1[m+h]
+
。
[0097]1h nmr (400 mhz, dmso-d6) δ11.14(s, 1h), 7.72 (s, 2h), 7.61-7.57 (m, 1h), 7.10 (d, j = 8.4 hz, 1h), 7.03 (d, j = 7.2 hz, 1h), 6.56-6.53 (m, 1h), 5.07-5.03 (m, 1h), 3.32-3.28 (m, 2h), 2.90-2.78 (m, 3h), 2.62-2.51 (m, 2h), 2.05-1.90 (m, 1h), 1.62-1.54 (m, 4h), 1.41-1.37 (m, 2h)。
[0098]
中间体制备实施例6:中间体6-4的合成中间体6-4按照中间体制备实施例2的方法合成得到目标中间体6-4 (2.0 g, 两步产率23%),为黄色固体。
[0099]
ms (esi) m/z = 361.1 [m+h]
+
。
[0100]1h nmr (400 mhz, dmso-d6) δ 10.10(s, 1 h), 7.88 (s, 2h), 7.60 (t, j = 8.0 hz, 1h), 7.17 (d, j = 8.4 hz, 1h), 7.06 (d, j = 6.8 hz, 1h), 6.40 (d, j = 5.6 hz, 1h), 5.05 (dd, j = 5.2, 12.8 hz, 1 h), 3.67-3.62 (m, 4h), 3.54-3.50 (m, 2h), 3.00 (s, 2h), 2.90-2.85 (m, 1h), 2.62-2.50 (m, 2h), 2.03 (t, j = 7.6 hz, 1h)。
[0101]
中间体制备实施例7:中间体7-4的合成中间体7-4按照中间体制备实施例2的方法合成得到目标中间体7-4 (1.1 g, 两步产率17%),为黄色固体。
[0102]
ms (esi) m/z = 405.2 [m+h]
+
。
[0103]1h nmr (400 mhz, dmso-d6) δ 11.11(s, 1 h), 7.84 (s, 2h), 7.62-7.58 (m, 1h), 7.15 (d, j = 8.8 hz, 1h), 7.05 (d, j = 6.8 hz, 1h), 6.62-6.59 (m, 1h), 5.08-5.04 (m, 1h), 3.65-3.59 (m, 8h), 3.50-3.46 (m, 2h), 2.97-2.86 (m, 3h), 2.62-2.51 (m, 2h), 2.05-1.99 (m, 1h)。
[0104]
中间体制备实施例8:中间体8-4的合成中间体8-4按照中间体制备实施例2的方法合成得到目标中间体8-4 (1.2g,两步产率16%),为黄色固体。
[0105]
ms (esi) m/z = 493.2 [m+h]
+
。
[0106]1h nmr (400 mhz, dmso-d6) δ 11.11(s, 1h), 7.84 (s, 2h), 7.61-7.57 (m, 1h), 7.15 (d, j = 8.8 hz, 1h), 7.05 (d, j = 6.8 hz, 1h), 6.61 (s, 1h), 5.08-5.04 (m, 1h), 3.64-3.47 (m, 18h), 2.99-2.86 (m, 3h), 2.62-2.51 (m, 2h), 2.08-2.01 (m, 1h)。
[0107]
化合物制备实施例实施例1:cpd 1的合成向中间体1-9(8mg, 8.64
µ
mol)的dmso(1ml)溶液中依次加入hoat (5mg, 36.76
µ
mol),edci(5mg, 26.18
ꢀµ
mol),nmm(20.35mg, 201.19
µ
mol)和中间体2-4(3.7mg, 11.70
µ
mol)。反应液在室温下搅拌16小时。反应结束后,反应液倒入水(100ml)中,并用乙酸乙酯(3
×
25ml)萃取。有机相合并后,用饱和食盐水(100 ml)洗涤。所得溶液用无水硫酸钠干燥,过滤,减压浓缩。残留物经反向柱层析纯化后,得目标化合物cpd 1 (5mg,产率47%),为淡黄色固体。
[0108]
ms (esi) m/z = 1224.0 [m+h]
+
。
[0109]
实施例2:cpd 2的合成化合物2按照化合物合成实施例1的方法,由中间体1-9和中间体3-4反应合成得到目标化合物cpd 2 (7mg,产率65%),为浅黄色固体。
[0110]
ms (esi) m/z = 1238.0 [m+h]
+
。
[0111]
实施例3:cpd 3的合成化合物3按照化合物合成实施例1的方法,由中间体1-9和中间体4-4反应合成得到目标化合物cpd 3(7mg,产率65%),为浅黄色固体。
[0112]
ms (esi) m/z = 1251.9 [m+h]
+
。
[0113]
实施例4:cpd 4的合成化合物4按照化合物合成实施例1的方法,由中间体1-9和中间体5-4反应合成得到目标化合物cpd 4 (7mg,产率51%),为浅黄色固体。
[0114]
ms (esi) m/z = 1266.1 [m+h]
+
。
[0115]
实施例5:cpd 5的合成化合物5按照化合物合成实施例1的方法,由中间体1-9和中间体6-4反应合成得到目标化合物cpd 5(7mg,产率51%),为浅黄色固体。
[0116]
ms (esi) m/z = 1268.4 [m+h]
+
。
[0117]
实施例6:cpd 6的合成化合物6按照化合物合成实施例1的方法,由中间体1-9和中间体7-4反应合成得到目标化合物cpd 6 (6mg,产率53%),为浅黄色固体。
[0118]
ms (esi) m/z = 1312.0 [m+h]
+
。
[0119]
实施例7:cpd 7的合成化合物7按照化合物合成实施例1的方法,由中间体1-9和中间体8-4反应合成得到目标化合物cpd 7 (4mg,产率41%),为浅黄色固体。
[0120]
ms (esi) m/z = 1401.9 [m+h]
+
。
[0121]
生物活性检测实验(1)化合物对rs4;11肿瘤细胞半数生长抑制浓度(gi
50
)的测定celltiter-glo细胞活力检测:通过对atp进行定量测定来检测培养物中活细胞数目。细胞以3000个细胞/孔的数量接种在96孔板中,待测化合物从最高浓度1μm进行4倍梯度稀释,从高到低共设置10个浓度,对细胞进行处理。药物处理三天后,细胞活力通过celltiter-glo试剂盒(promega)进行测定。用graphpad prism软件拟合剂量反应曲线(非线性回归)并测定细胞半数生长抑制浓度(gi
50
)。
[0122]
人急性淋巴细胞白血病rs4;11细胞高表达并依赖抗凋亡蛋白bcl-2,抑制bcl-2蛋白可抑制rs4;11细胞的生长和存活。利用celltiter-glo检测实施例中化合物处理rs4;11细胞3天后的细胞活力(图1,表1)。结果表明,所有实施例化合物均可以显著抑制rs4;11细胞的生长和存活,其半数生长抑制浓度(gi
50
)低于200nm(表1)。值得一提的是,化合物cpd1-3对rs4;11细胞半数生长抑制浓度gi
50
低于10nm(图1),与商品化母本抑制剂venetoclax(abt199,gi
50
=3.7 nm)基本一致。
[0123]
表1
(2)化合物对抗凋亡蛋白bcl-2降解以及rs4;11细胞凋亡诱导的测定蛋白免疫印迹测定:将化合物溶解于一定体积的二甲亚砜中,配制成10 mm的溶液,按照图2所示浓度加入对应的细胞中,作用16h或者8h,将化合物作用过的细胞进行收集,用预冷的pbs洗涤一次,预冷的ripa裂解液与蛋白酶和磷酸酶抑制剂混合,冰上裂解细胞半小时,以13000rpm离心十分钟,取上清。用bca法定量总蛋白量,细胞裂解液用5x蛋白上样缓冲液稀释,99℃加热变性五分钟。蛋白在sds-page电泳分离、转膜、抗体孵育,利用辣根过氧化物酶底物产生化学发光。用chemidoc mp imaging system(bio-rad)机器进行拍照,并通过软件对蛋白条带灰度值进行定量。
[0124]
利用蛋白免疫印迹检测实施例化合物处理人急性淋巴细胞白血病rs4;11细胞8小时或16小时后相关蛋白水平,β-actin为内参蛋白,以化合物cpd1、cpd2(图2),以及化合物cpd3、cpd7和cpd6(图3)。图2实验结果表明,化合物cpd1和cpd2都能够诱导抗凋亡蛋白bcl-2以及两个免疫转录因子ikaros和aiolos蛋白的降解,并且这种降解作用呈剂量依赖性。伴随着凋亡蛋白bcl-2降解的发生,凋亡生物标志物cleaved caspase-3蛋白水平也逐渐升高,标志着细胞凋亡程序已启动。图3实验结果表明,化合物cpd3、cpd7和cpd6都能够诱导抗凋亡蛋白bcl-2以及两个免疫转录因子ikaros和aiolos蛋白的降解。伴随着凋亡蛋白bcl-2降解的发生,凋亡生物标志物cleaved caspase-3蛋白水平也逐渐升高,标志着细胞凋亡程序已启动。
[0125]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0126]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1