3-异香豆素基色酮化合物的制备方法
1.本发明属于有机合成技术领域,具体涉及一种合成多取代3-异香豆素基色酮的方法。
背景技术:
2.色酮,化学名苯并-γ-吡喃酮,具有良好的生物活性,是一类重要的药物合成中间体,也是目前备受关注的天然活性产物之一。研究发现,色酮类化合物具有广泛的生理活性,例如抗炎、抗血小板凝聚、降血脂血糖、抑菌、抗癌、抗人体免疫缺陷病毒(hiv)等,具有很高的研究价值。
3.近年来,随着科研工作者对色酮类化合物的深入研究,许多新型的色酮类衍生物被大量报道,特别是3-取代色酮具有重要的生物和药理活性,例如抗癌、抗菌和抗氧化等。因此,3-取代色酮是当今有机化学合成以及新药开发领域的研究热点之一,已引起研究者们的极大兴趣。
4.3-取代色酮类化合物合成的传统策略是通过过渡金属催化3-卤代色酮而获得,这就需要对色酮进行预先官能团化反应,从而限制了工业生成中的应用。近年来,通过分子间的串联环化反应构建3-取代色酮取得了显著进展(chinese chemical letters 2020, 31, 3073-3082.)。然而,开发更加简洁高效、环境友好的制备方法和策略制备具有潜在应用价值的3取代色酮化合物仍具有极其迫切需求和重要意义。据我们所知,到目前为止,3-异香豆素基色酮是一类未开发的新化合物,而以简单易得的2-羟基-n,n-二甲基烯胺酮化合物和2-炔基苯甲醛化合物合成3-异香豆素基色酮衍生物还未见专利和文献报道。
技术实现要素:
5.为了解决现有技术不足,本发明提供了一种简单高效的3-异香豆素基色酮制备方法。
6.为解决上述技术问题,本发明采用的技术方案是:在溶剂、催化剂存在条件下,2-羟基-n,n-二甲基烯胺酮化合物和2-炔基苯甲醛化合物在空气、40~120℃下反应,薄层色谱监测反应进程,直至反应完全,反应产物用乙酸乙酯萃取2~3次,收集有机相用无水硫酸钠干燥,然后减压浓缩,残渣经硅胶柱层析分离纯化得到目标化合物3-异香豆素基色酮,反应方程式如下:其中ar1、ar2为芳基, ar1、ar2能替换为取代的芳基、芳香杂环;r选自芳基、取代的芳基、烷基。
7.所述取代的芳基中的取代基选自卤素、烷基、烷氧基、硝基。
8.所述催化剂选自氧化银、硝酸银、碳酸银、氯化银、氟化银、醋酸银、三氟乙酸银;溶剂选自丙酮、二甲基亚砜、氯苯、1,4-二氧六环、乙酸乙酯、苯甲醚、乙腈、1,2-二氯乙烷、乙醇、四氢呋喃、环己烷。
9.所述2-羟基-n,n-二甲基烯胺酮化合物与催化剂的摩尔比为1:0.05~1,2-羟基-n,n-二甲基烯胺酮化合物和2-炔基苯甲醛化合物的摩尔比为1:1~4。
10.所述2-羟基-n,n-二甲基烯胺酮化合物按常规方法制备,例如参照sandipbalasahebwakade, dipak kumar tiwari. synthesis of 3-keto-quinolines from enaminones, anilines and dmso: transition metal free one pot cascade. tetrahedron 75 (2019) 4024-4030文献中方法制得。
11.所述2-炔基苯甲醛化合物按常规方法制备,例如参照wu d, hao w j, rao q, et al. engaging 1, 7-diynes in a photocatalytic kharasch-type addition/1, 5-(sn
′′
)-substitution cascade toward β-gem-dihalovinyl carbonyls. chemical communications, 2021, 57(15): 1911-1914文献方法制备。
12.上述3-异香豆素基色酮化合物制备是在银催化作用下,2-乙炔基苯甲醛自身环化形成异色烯,而后2-羟基-n,n-二甲基烯胺酮对异色烯进行亲核进攻得到中间体,中间体自身环合并脱去金属配体,再经过脱氢与脱n,n-二甲胺得到最终产物。
13.本发明与现有技术相比,具有以下优点:1、本发明合成的3-异香豆素基色酮化合物是一类全新的杂环化合物;2、本发明利用简单易得的原料:n,n-二甲基烯胺酮是通过广泛存在的α-甲基酮类化合物在n,n-二甲基甲酰胺二甲基缩醛(dmf-dma)中加热反应12h,通过后处理即可得到;2-苯基乙炔基苯甲醛化合物由2-溴苯甲醛与苯乙炔化合物通过suzuki偶联反应获得;3、本发明通过简单的银催化即可实现2-羟基-n,n-二甲基烯胺酮与2-炔基苯甲醛的二次环化得到目标产物;4、所获得的产物结构丰富,底物适应性较好;5、本发明的合成方法简洁高效,操作简便,环境友好,产率高等特点,适用于工业生产。
附图说明
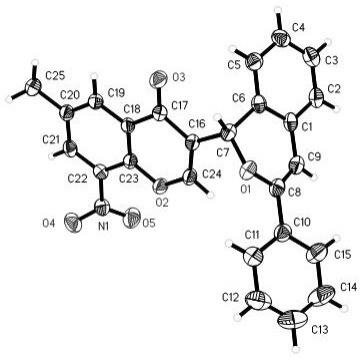
14.图1为化合物3l的单晶结构图。
具体实施方式
15.下面通过实施例对本发明作进一步详细说明,但本发明保护范围不局限于所述内容,实施例中试剂如无特殊说明,均为常规市售试剂或按常规方法制得的试剂,产物结构经过核磁共振、高分辨质谱以及代表性产物的单晶衍射测试等确证;实施例1:本实施例3-异香豆素基色酮的制备如下:在空气气氛、80℃下,在15ml反应管中加入2-羟基-n,n-二甲基烯胺酮1(0.5mmol)、2-炔基苯甲醛2 (1.0mmol)、氧化银(0.2mmol),加入1ml丙酮作为溶剂,磁力搅拌下反应,通过tcl监测反应,直至原料反应完全后,添加乙酸乙酯萃取3次,收集合并上层有机相,加入无水na2so4进行干燥,将干燥后的有机层50℃下浓缩,最后浓缩物进行硅胶柱
层析分离,硅胶柱采用石油醚-乙酸乙酯的混合溶剂洗脱分离,收集洗脱液,50℃干燥后,得到目标化合物3-异香豆素基色酮化合物3a;反应通式如下:,其中r为苯基;化合物3a的结构、形态、熔点、核磁、高分辨质谱数据如下:v
石油醚
/v
乙酸乙酯 = 12:1, r
f = 0.2; 白色固体: 142 mg,产率 80%; 熔点 = 160
–
161℃;1h nmr (600 mhz, cdcl3): δ = 8.32 (d, j = 8.0 hz, 1h, arh), 7.71
–
7.68 (m, 2h, arh), 7.67
–
7.64 (m, 1h, arh), 7.62 (s, 1h, c=ch), 7.44
–
7.39 (m, 2h, arh), 7.36
–
7.33 (m, 2h, arh), 7.32
–
7.29 (m, 2h, arh), 7.20 (t, j = 8.3 hz, 2h, arh), 7.09 (d, j = 7.5 hz, 1h, arh), 6.83 (s, 1h, c=ch), 6.52 (s, 1h, c-ch);
13
c nmr (150 mhz, cdcl3): δ = 176.3, 156.0 156.0, 151.6, 134.0, 133.7, 131.3, 128.8, 128.5, 128.2, 128.2, 127.9, 126.9, 126.0, 125.2, 125.1, 125.1, 125.0, 124.0, 123.8, 122.2, 118.0, 100.5, 71.1;hrms (tof es+): m/z calcd for c
24h16o3 [(m+h)
+
], 353.1172, found, 353.1182.实施例2:本实施例3-异香豆素基色酮化合物3b的制备方法同实施例1,不同在于:化合物1为2-羟基-5-甲基-n,n-二甲基烯胺酮,化合物2为2-苯基乙炔基苯甲醛;化合物3b的结构、形态、熔点、核磁、高分辨质谱数据如下:v
石油醚
/v
乙酸乙酯 = 9:1, r
f = 0.2; 白色固体: 143 mg, 产率 78%; 熔点 = 100
–
101℃;1h nmr (600 mhz, cdcl3) δ = 8.10 (s, 1h, arh), 7.69 (d, j = 7.7 hz, 2h, arh), 7.59 (s, 1h, c=ch), 7.46 (d, j = 8.7 hz, 1h, arh), 7.34 (t, j = 7.4 hz, 2h, arh), 7.30 (t, j = 7.8 hz, 3h, arh), 7.18 (d, j = 7.6 hz, 2h, arh), 7.09 (d, j = 7.5 hz, 1h, arh), 6.82 (s, 1h, c=ch), 6.51 (s, 1h, c-ch), 2.46 (s, 3h, arch3); 13
c nmr (150 mhz, cdcl3) δ = 175.4, 154.9, 153.3, 150.6, 134.2, 133.9, 133.0, 130.3, 127.7, 127.5, 127.2, 127.2, 126.9, 125.9, 124.2, 124.1, 124.1, 124.0, 122.8, 122.6, 121.0, 116.7, 99.5, 70.1, 19.8; hrms (tof es+): m/z calcd for c
25h18o3 [(m+h)
+
], 367.1329, found, 367.1335.
实施例3:本实施例3-异香豆素基色酮化合物3c的制备方法同实施例1,不同在于:化合物1为2-羟基-5-氟-n,n-二甲基烯胺酮,化合物2为2-苯基乙炔基苯甲醛;化合物3c的结构、形态、熔点、核磁、高分辨质谱数据如下:v
石油醚
/v
乙酸乙酯 = 9:1, r
f = 0.2; 黄色固体: 141 mg,产率 76%; 熔点 = 159
–
160℃;1h nmr (600 mhz, cdcl3) δ = 7.95 (d, j = 5.3 hz, 1h, arh), 7.69 (d, j = 7.5 hz, 2h, arh), 7.60 (s, 1h,c=ch), 7.42
–
7.38 (m, 2h, arh), 7.36
–
7.30 (m, 4h, arh), 7.22
–
7.18 (m, 2h, arh), 7.09 (d, j = 7.4 hz, 1h,arh), 6.81 (s, 1h, c=ch), 6.52 (s, 1h, c-ch); 13
c nmr (150 mhz, cdcl3) δ = 175.8, 159.6 (c
–
f, j = 247.5 hz), 156.3, 152.4, 151.7, 134.1, 131.2, 129.0, 128.8, 128.4, 128.4, 127.8, 127.1, 125.3, 125.3, 125.3, 125.2, 124.1, 122.1, (c
–
f, j = 25.5 hz),121.8, 120.3, (c
–
f, j = 8.0 hz), 111.0, (c
–
f, j = 23.9 hz), 100.7, 71.2;hrms (tof es+): m/z calcd for c
24h15
fo
3 [(m+h)
+
], 371.1078, found, 371.1083.实施例4:本实施例3-异香豆素基色酮化合物3d的制备方法同实施例1,不同在于:化合物1为2-羟基-5-氯-n,n-二甲基烯胺酮,化合物2为2-苯基乙炔基苯甲醛;化合物3d的结构、形态、熔点、核磁、高分辨质谱数据如下:v
石油醚
/v
乙酸乙酯 = 10:1, r
f = 0.2; 白色固体: 128 mg,产率 66%; 熔点 = 173
–
174℃;1h nmr (600 mhz, cdcl3) δ = 8.28 (d, j = 2.6 hz, 1h, arh), 7.68 (d, j = 7.6 hz, 2h, arh), 7.60 (d, j = 2.6 hz, 1h, arh), 7.58 (s, 1h, c=ch), 7.35 (t, j = 7.9 hz, 3h, arh), 7.31 (t, j = 7.2 hz, 2h), 7.22
–
7.18 (m, 2h, arh), 7.09 (d, j = 7.5 hz, 1h, arh), 6.80 (s, 1h, c=ch), 6.51 (s, 1h, c-ch).; 13
c nmr (150 mhz, cdcl3) δ= 175.4, 156.3, 154.5, 151.6, 134.1, 134.1, 131.2, 131.3, 129.0, 128.8, 128.4, 128.4, 127.7, 127.1, 125.5, 125.3, 125.3, 125.2, 125.1, 124.1, 122.4, 119.9, 100.7, 71.1;hrms (tof es+): m/z calcd for c
24h15
clo
3 [(m+h)
+
], 387.0782, found, 387.0787.实施例5:本实施例3-异香豆素基色酮化合物3e的制备方法同实施例1,不同在于:化合物2-羟基-5-溴-n,n-二甲基烯胺酮,化合物2为2-苯基乙炔基苯甲醛;化合物3e的结构、形态、熔点、核磁、高分辨质谱数据如下:v石油醚
/v
乙酸乙酯 = 10:1, r
f = 0.2; 白色固体: 151 mg, 产率 70%; 熔点 = 204
–
205℃;1h nmr (600 mhz, cdcl3) δ = 8.44 (d, j = 2.5 hz, 1h, arh), 7.73 (dd, j = 8.8, 2.5 hz, 1h, arh), 7.69
ꢀ–ꢀ
7.67 (m, 2h, arh), 7.58 (s, 1h, c=ch), 7.35 (t, j = 7.3 hz, 2h, arh), 7.33
–
7.29 (m, 3h, arh), 7.22
–
7.18 (m, 2h, arh), 7.09 (d, j = 7.5 hz, 1h, arh), 6.80 (s, 1h, c=ch), 6.51 (s, 1h, c-ch); 13
c nmr (150 mhz, cdcl3) δ = 175.3, 156.3, 155.0, 151.6, 136.8, 134.1, 131.4, 129.0, 128.8, 128.7, 128.4, 128.4, 127.6, 127.1, 125.4, 125.3, 125.3, 125.2, 124.1, 122.5, 120.1, 118.8, 100.7, 71.1; hrms (tof es+): m/z calcd for c
24h15
bro
3 [(m+h)
+
], 431.0277, found, 431.0275.实施例6:本实施例3-异香豆素基色酮化合物3f的制备方法同实施例1,不同在于:化合物1为2-羟基-4-溴-n,n-二甲基烯胺酮,化合物2为2-苯基乙炔基苯甲醛;化合物3f的结构、形态、熔点、核磁、高分辨质谱数据如下:v
石油醚
/v
乙酸乙酯 = 11:1, r
f = 0.2; 白色固体: 155 mg, 产率 72%; 熔点 = 137
–
138℃;1h nmr (600 mhz, cdcl3) δ = 8.17 (d, j = 8.6 hz, 1h, arh), 7.74
–
7.65 (m, 2h, arh), 7.59 (s, 1h, c=ch), 7.56
–
7.46 (m, 2h, arh), 7.36
–
7.30 (m, 4h, arh), 7.24
–
7.16 (m, 2h, arh), 7.08 (d, j = 7.5 hz, 1h, arh), 6.79 (s, 1h, c=ch), 6.51 (s, 1h, c-ch); 13
c nmr (150 mhz, cdcl3) δ = 175.8, 156.2, 156.1, 151.6, 134.1, 131.4, 129.0, 129.0, 128.8, 128.4, 128,4, 128.1, 127.7, 127.5, 127.1, 125.3, 125.3, 125.2, 124.1, 123.0, 122.7, 121.2, 100.7, 71.1; hrms (tof es+): m/z calcd for c
24h15
bro
3 [(m+h)
+
], 431.0277, found, 431.0280.实施例7:本实施例3-异香豆素基色酮化合物3g的制备方法同实施例1,不同在于:化合物1为2-羟基-5-甲氧基-n,n-二甲基烯胺酮,化合物2为2-苯基乙炔基苯甲醛;产品3g的结构、形态、熔点、核磁、高分辨质谱数据如下:
2h, arh), 7.28 (d, j = 7.5 hz, 1h, arh), 7.22
–
7.19 (m, 1h, arh), 7.07 (d, j = 7.5 hz, 1h, arh), 6.81 (s, 1h, c=ch), 6.56 (s, 1h, c-h); 13
c nmr (151 mhz, dmso-d6) δ = 175.1, 165.6 (c
–
f, j = 252.7 hz), 157.4, 157.3, (c
–
f, j = 14 hz), 151.4, 134.2, 131.7, 129.5, 129.1, 129.0, 129.0, 128.7, (c
–
f, j = 11 hz), 128.3, 127.6, 125.4, 125.3, 125.3, 124.5, 121.9, 121.1, 115.0, (c
–
f, j = 23,1 hz), 105.9, (c
–
f, j = 25.8 hz), 101.7, 71.9; hrms (tof es+): m/z calcd for c
24h15
fo
3 [(m+h)
+
], 371.1078, found, 371.1081.实施例14:本实施例3-异香豆素基色酮化合物3n的制备方法同实施例1,不同在于:化合物1为2-羟基-n,n-二甲基烯胺酮,化合物2为2-[2-(3-甲基苯基)乙炔基]苯甲醛;化合物3n的结构、形态、熔点、核磁、高分辨质谱数据如下:v
石油醚
/v
乙酸乙酯 = 10:1, r
f = 0.2; 白色固体: 130 mg, 产率71%; 熔点 = 164
–
165℃;1h nmr (600 mhz, dmso-d6) δ = 8.15 (d, j = 8.0 hz, 1h, arh), 7.93 (s, 1h, c=ch), 7.82 (t, j = 7.8 hz, 1h, arh), 7.63 (d, j = 8.5 hz, 1h, arh), 7.53 (d, j = 8.8 hz, 2h, arh), 7.47 (d, j = 8.0 hz, 1h, arh), 7.33 (t, j = 7.5 hz, 1h, arh), 7.26 (dd, j = 13.0, 7.2 hz, 2h, arh), 7.20 (t, j = 7.5 hz, 1h, arh), 7.14 (d, j = 7.5 hz, 1h, arh), 7.06 (d, j = 7.5 hz, 1h, arh), 6.79 (s, 1h, c=ch), 6.55 (s, 1h, c-h), 2.29 (s, 3h, arch3); 13
c nmr (150 mhz, dmso-d6) δ = 175.8, 157.1, 156.2, 151.7, 138.1, 135.1, 134.2, 131.8, 130.2, 129.1, 128.9, 128.5, 127.5, 126.4, 125.8, 125.7, 125.4, 124.4, 123.9, 122.6, 121.8, 119.0, 101.6, 72.0, 21.5; hrms (tof es+): m/z calcd for c
25h18o3 [(m+h)
+
], 367.1329, found, 367.1332.实施例15:本实施例3-异香豆素基色酮化合物3o的制备方法同实施例1,不同在于:化合物1为2-羟基-n,n-二甲基烯胺酮,化合物2为2-[2-(4-叔丁基苯基)乙炔基]苯甲醛;化合物3o的结构、形态、熔点、核磁、高分辨质谱数据如下:v
石油醚
/v
乙酸乙酯 = 12:1, r
f = 0.2; 白色固体: 100 mg, 产率,49%; 熔点 = 184
–
185℃;1h nmr (600 mhz, dmso-d6) δ = 8.16 (dd, j = 8.0, 1.6 hz, 1h, arh), 7.86
–
arh), 6.71 (s, 1h, c=ch), 6.55 (s, 1h, c-h), 6.03 (d, j = 7.0 hz, 2h, ch2); 13
c nmr (150 mhz, dmso-d6) δ = 175.9, 157.2, 156.2, 149.4, 147.9, 146.8, 135.0, 134.4, 129.2, 129.0, 129.0, 126.3, 126.2, 125.7, 125.0, 125.0, 124.0, 121.5, 121.3, 119.0, 106.6, 105.2, 101.8, 101.6, 71.5; hrms (tof es+): m/z calcd for c
25h16o5 [(m+h)
+
], 397.1071, found, 397.1073.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1