一种新型的β-榄香烯硫化氢供体型衍生物、其制备方法及医药用途与流程
一种新型的
β-榄香烯硫化氢供体型衍生物、其制备方法及医药用途
技术领域
1.本发明涉及β-榄香烯衍生物的制备技术领域,尤其涉及一种新型的β-榄香烯硫化氢供体型衍生物及其可药用盐、其制备方法及医药用途。
背景技术:
2.β-榄香烯最初是从姜科植物温郁金(curcuma aromatic salisb)中提取得到的倍半萜类化合物,具有抗菌、抗病毒、抗肿瘤、抗血栓、保肝、增强免疫力等功效(见刘梅,郭小红,etal.现代药物与临床,2021,36,204)。药理研究发现,β-榄香烯还具有显著的抗动脉粥样硬化活性和心血管保护作用,并具有抗氧化、抗炎等辅助药效功能(见zhongying,liujun,etal.chin.j.nat.med.2015,13,415)。
3.由于β-榄香烯属挥发油类,结构中只含有c、h两种元素,水溶性差,生物利用度较低、β-榄香烯的活性中等。因此,如何对β-榄香烯进行结构改造与修饰,以获得理化性质改善、活性更优、成药性更佳的新药候选分子是非常必要的。
4.h2s是继发现一氧化氮(no)和一氧化碳(co)之后,人们开始关注的一种新的气体信号分子。h2s是含硫氨基酸代谢产物,具有舒张血管、抗高血压等活性,在心血管疾病中有许多重要的调节作用。新型h2s供体分子在保持原有药物活性的同时通过释放h2s达成协同增效作用,具有良好的应用前景。
5.为了提高β-榄香烯的降脂活性和心血管保护疗效,改善天然产物β-榄香烯的成药性,运用药物设计策略的拼合原理,通过采用不同的连接链,将四种不同类型的h2s供体分子与β-榄香烯的活性代谢产物进行拼合,以期通过二者协同作用,提升整个药物分子的心血管保护活性,值得注意的是,现有技术中并未见将h2s供体与β-榄香烯拼合制备衍生物的相关报道。
技术实现要素:
6.针对现有技术存在的上述问题,本发明的第一个目的在于提供一种新型的β-榄香烯硫化氢供体型衍生物及其可药用盐,所述化合物具有离体血管舒张活性,可在体外释放h2s,细胞水平上具有降脂活性以及氧化损伤保护活性的优点。
7.本发明的第二个目的在于提供一种新型的β-榄香烯硫化氢供体型衍生物及其可药用盐的制备方法,所述制备方法具有操作简易、反应时间短、收率高等优点。
8.本发明的第三个目的在于提供一种新型的β-榄香烯硫化氢供体型衍生物及其可药用盐可作为优良的心血管保护药物先导化合物。
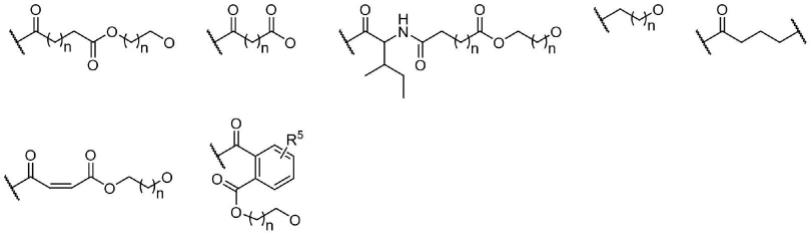
9.为实现上述第一个目的,本发明提供了如下技术方案:一种新型的β-榄香烯硫化氢供体型衍生物及其可药用盐,所述β-榄香烯硫化氢供体型衍生物及其可药用盐具有如下通式i或ii的结构:
[0010][0011]
其中,r1与r3独立地选自c
1-10
脂肪链酰基、c
1-10
脂肪链醚键、c
1-14
氨基酸链酰基、取代或未取代的c
6-10
芳酰基;
[0012]
所述c
6-10
芳酰基可被一个或多个取代基取代,所述取代基选自卤素、oh、no2、cf3、c
1-3
烷基或c
1-3
烷氧基;
[0013]
r2与r4独立地选自如下基团之一:
[0014][0015]
通过采用上述技术方案,采用药物设计拼合原理,在β-榄香烯分子中引入活性硫化氢供体片段,在保留天然产物活性的同时释放硫化氢,提高整个药物分子的作用效果,因此,获得增强其保护心血管功能的效果。
[0016]
为实现上述第二个目的,本发明提供了如下技术方案:一种新型的β-榄香烯硫化氢供体型衍生物及其可药用盐的制备方法,其特征在于,包括:将对羟基硫代苯甲酰胺或5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one或1,2-二硫杂环戊烯-3-硫酮或硫辛酸与溴乙醇经过成醚反应生成醇,然后与酸酐反应生成酸类衍生物,所述酸类中间体分别与榄香醇或其衍生物分子的羟基缩合生成酯,得到相应的目标化合物。
[0017]
为实现上述第三个目的,本发明提供了如下技术方案:一种新型的β-榄香烯硫化氢供体型衍生物及其可药用盐在药物制备中的用途,所述药物用于治疗心血管疾病。
[0018]
综上所述,本发明具有以下有益效果:
[0019]
1、由于本发明采用药物设计策略的拼合原理,通过采用不同的连接链,将四种不同类型的h2s供体分子与β-榄香烯的活性代谢产物进行拼合,通过二者协同作用,提升整个药物分子的心血管保护活性。
[0020]
2、本发明中优选采用较稳定的硫化氢缓释供体对羟基硫代苯甲酰胺,5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one,1,2-二硫杂环戊烯-3-硫酮等,由于其原料均可通过购买或简易的合成得到,且存在易于接入药物分子的反应官能团,因此简化了实验操作。
[0021]
3、本发明的方法,通过选择β-榄香烯的活性代谢产物13-β-榄香醇和14-β榄香醇作为先导化合物,选用含有酯键或醚键连接链,可以在体内通过酶或非酶统计释放,因此均可产生相应的药理活性。
附图说明
[0022]
图1为本发明公开的实施例对ox-ldl刺激的巨噬细胞吞脂的抑制作用示意图;
[0023]
图2为本发明公开的实施例1-12目标化合物的结构图;
[0024]
图3为本发明公开的实施例13-30目标化合物的结构图。
具体实施方式
[0025]
以下结合附图1-3和实施例对本发明作进一步详细说明。
[0026]
本发明涉及的β-榄香烯硫化氢供体型衍生物及其可药用盐可以以一种药学可接受的盐或药物组合物的形式对患者给药。某个复合物需与适当载体或赋形剂混合形成药物组合物从而保证达到治疗效果的所必须的剂量。所述β-榄香烯硫化氢供体型衍生物及其可药用盐及其含有该类化合物的组合物可以制成多种剂型,包括片剂、滴丸剂、胶囊剂、注射剂和口服液体制剂。这些剂型能用于速释或缓释给药。
[0027]
当β-榄香烯硫化氢供体型衍生物及其可药用盐及其含有这些化合物的组合物注射给药时,可以用水溶性或脂溶性溶剂将此类化合物配制成溶液剂、悬浊剂和乳剂。当β-榄香烯硫化氢供体型衍生物及其可药用盐及其含有这些化合物的组合物口服给药时,可以采用常用技术将其与药学可接受的赋形剂制成复合物。这些赋形剂可以将这些化合物制成多种可以被病人剂型,如片剂、丸剂、胶囊剂、口服液体制剂等。
[0028]
每1000重量份的口服制剂原料包括:50g的β-榄香烯硫化氢供体型衍生物及其可药用盐及其含有这些化合物的组合物、15g的羟丙甲基纤维素e5、18g的微晶纤维素mcc102、适量的8%聚维酮k30、2g的硬酯酸镁;取上述配方,用常规方法制备成口服制剂。
[0029]
原料和/或中间体的制备例
[0030]
5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one的制备:
[0031]
s1:制备对羟基硫代苯甲酰胺:向250ml的圆底烧瓶中加入50ml浓盐酸和硫代乙酰胺(3.0g,2eq),充分搅拌溶解完全后,加入对羟基苯甲腈(2.5g,1eq),加热至50℃,充分反应4h后停止加热,自然冷却至室温,冷却过程中有大量固体析出,待固体析出量无明显增加后,过滤并用水冲洗至滤液呈中性,然后将滤饼干燥,得到对羟基硫代苯甲酰胺(3.0g,收率95%),淡黄色固体;
[0032]
s2:向250ml烧杯中加入四氢呋喃(thf),冰浴下加入步骤s1制得对羟基硫代苯甲酰胺,充分搅拌溶解完全后,缓慢加入氯羰基亚磺酰氯(2.2ml,2eq),室温下反应过夜,反应结束后,减压浓缩以石油醚:乙酸乙酯=(10:1,v:v)柱层析,分离得到5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one(1.0g,收率46%),橙黄色油状液体。
[0033]1h nmr(300mhz,dmso-d6)δ10.96(s,1h),8.04(d,j=8.8hz,2h),6.97(d,j=8.8hz,2h);13c nmr(75mhz,dmso-d6)δ188.18,185.67,164.71,131.28,122.46,116.99.esi-msm/z:210.0[m-h]-[0034]
去甲茴三硫的制备:将茴三硫(5.0g,1.0eq)、dmap(500mg,0.2eq)溶于50mldcm中,充分搅拌溶解完全后,室温下逐滴加入bbr3的dcm溶液(11ml,5.0eq),溶液变成橙红色混悬液,在室温下继续反应24h后,完毕,将反应液分十批加入200ml水中,充分搅拌反应1h后,静置过滤,滤饼用大量水冲洗并干燥,得橙红色固体去甲茴三硫4.0g,收率95%;
[0035]1h nmr(300mhz,dmso-d6)δ10.52(s,1h),7.79(d,j=8.8hz,2h),7.71(s,1h),6.89(d,j=8.7hz,2h);
13
c nmr(75mhz,dmso-d6)δ188.18,185.67,164.71,131.28,122.46,116.99.esi-msm/z:227.0[m+h]
+
[0036]
实施例
[0037]
实施例1:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基(2-(4-(3-oxo-3h-1,2,4-dithiazol-5-yl)phenoxy)ethyl)琥珀酸酯的合成,该化合
物记作i-1。化合物i-1的合成包括以下步骤反应:
[0038]
s1:将5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one(1.0g,收率46%)、k2co3(2.0g,3eq)和溴乙醇(500μl,1.5eq)溶于二甲基甲酰胺(dmf)中,在90℃下搅拌反应6h,完毕,自然冷却至室温,反应结束后,用20ml水稀释和用乙醚萃取,柱层析纯化得醇中间体0.6g(pe:ea=4:1,v:v),即为5-(4-(2-羟乙氧基)苯基)-3h-1,2,4-二噻唑-3-one,收率为47%;
[0039]
s2:将琥珀酸酐(250mg,1.1eq)溶于15ml无水二氯甲烷溶剂(dcm)中,充分搅拌溶解完全后,逐滴加入三乙胺-无水dcm-步骤s1制得的醇中间体(0.6g,1eq)的混合溶液,在100℃下搅拌反应30min后,加入催化量的4-二甲氨基吡啶(dmap)反应4h,完毕,减压浓缩以石油醚:乙酸乙酯=(10-4):1(v:v)柱层析,分离得到500mg羧酸中间体,产率为62%;
[0040]
s3:将步骤s2得到的羧酸中间体(180mg,1.1eq)、催化量dmap,edci(100mg,1.2eq)溶于dcm中,活化反应10min后加入13-β-榄香醇(100mg,1eq),室温反应。tlc监测反应进程,完毕,加入15mldcm溶剂稀释,有机层用20ml水洗涤2次后用乙醚萃取,柱层析纯化得化合物i-1为200mg(石油醚:乙酸乙酯=2:1,v:v),产率80%;1hnmr(300mhz,chloroform-d)δ7.64(d,j=8.8hz,2h),7.01(d,j=8.8hz,2h),5.86(dd,j=17.7,10.5hz,1h),5.08(s,1h),5.04(s,1h),4.97(d,j=4.2hz,1h),4.93(s,1h),4.87(s,1h),4.64(s,3h),4.51(d,j=4.8hz,2h),4.27(d,j=4.8hz,2h),2.74(s,4h),2.05(t,j=8.0hz,3h),1.75(s,4h),1.61(s,12h),1.38(s,7h),1.32(d,j=8.7hz,15h),1.05(s,4h);
13
cnm r(75mhz,chloroform-d)δ172.15,171.89,161.67,149.97,148.17,147.36,134.06,119.06,115.27,112.29,110.97,110.08,104.49,66.43,66.09,62.55,52.62,41.71,39.78,39.75,33.00,29.04,28.93,27.02,24.84,16.58.esi-msm/z:580.2[m+na]
+
。
[0041]
实施例2:化合物1-(2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)7-(4-(3-羰基-3h-1,2,4-二噻唑-5-基)苯基)庚二酸酯的合成,该化合物记作i-2。
[0042]
化合物i-2的合成包括以下步骤反应:
[0043]
s1:将庚二酸(150mg,2eq)、催化量dmap,edci(85mg,1eq)溶于dcm中,活化反应10min后加入5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one(100mg,1eq),室温反应。tlc监测反应进程,完毕,加入10mldcm溶剂稀释,有机层用10ml水洗涤3次后用乙醚萃取,柱层析纯化得羧酸中间体100mg(pe:ea=2:1,v:v),产率62%;
[0044]
s2:将步骤s1制得的羧酸中间体(100mg,1eq),催化量dmap,edci(60mg,1.2eq)溶于dcm中,活化反应10min后加入13-β-榄香醇(50mg,1eq),室温反应。tlc监测反应进程,完毕,加入10mldcm溶剂稀释,有机层用20ml水洗涤3次后用乙醚萃取,柱层析纯化得化合物i-2为100mg(石油醚:乙酸乙酯=2:1,v:v),产率66%;1h nmr(300mhz,chloroform-d)δ8.19
–
8.08(m,2h),7.33
–
7.26(m,2h),5.78(d,j=10.7hz,1h),5.03(d,j=11.7hz,2h),4.96
–
4.90(m,1h),4.88(s,1h),4.83(t,j=1.8hz,1h),4.59(d,j=3.4hz,3h),2.62(t,j=7.4hz,2h),2.40(t,j=7.4hz,2h),2.02(dt,j=10.9,5.5hz,2h),1.71(s,7h),1.48(d,j=2.9hz,6h),1.27(d,j=6.3hz,2h),1.01(s,3h);
13
c nmr(75mhz,chloroform-d)δ186.83,185.80,173.21,171.19,155.81,150.02,148.52,147.40,129.81,128.84,122.81,112.34,111.01,110.13,52.76,41.94,39.87,39.79,34.16,34.11,33.12,28.55,27.11,24.85,24.57,24.43,16.67.esi-ms m/z:578.3[m+na]
+
。
[0045]
实施例3:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基(2-(4-(3-thioxo-3h-1,2-dithiol-5-yl)phenoxy)ethyl)琥珀酸酯的合成,该化合物记作i-3。
[0046]
化合物i-3的合成步骤和实施例1的区别仅在于:在步骤s1中,用去甲茴三硫(4.0g,收率95%)替换5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one,柱层析纯化得醇中间体收率为47%;制得的化合物i-3为48mg,产率67.2%,橙红色固体;1h nmr(400mhz,chloroform-d)δ7.62(d,j=8.8hz,2h),7.40(s,1h),6.99(d,j=8.8hz,2h),5.81(dd,j=17.8,10.5hz,1h),5.04(d,j=1.3hz,1h),5.00(s,1h),4.94
–
4.90(m,1h),4.89(t,j=1.3hz,1h),4.83(t,j=1.7hz,1h),4.60(s,2h),4.59
–
4.57(m,1h),4.52
–
4.46(m,2h),4.24(dd,j=5.4,4.1hz,2h),2.70(s,4h),1.99(s,2h),1.71(d,j=0.7hz,3h),1.56(s,8h),1.00(s,3h);
13
c nmr(75mhz,chloroform-d)δ215.14,172.81,172.19,171.92,161.74,149.99,148.20,147.39,134.78,128.65,124.63,115.55,112.31,110.98,110.11,66.45,66.16,62.66,52.64,41.74,39.81,39.76,33.01,29.07,28.96,27.04,24.85,16.59.esi-ms m/z:595.2[m+na]
+
。
[0047]
实施例4:化合物1-(2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)7-(4-(3-硫代-3h-1,2-二硫醇-5-基)苯基)庚二酸酯的合成,该化合物记作i-4,
[0048]
化合物i-4的合成步骤和实施例2的区别仅在于:在步骤s1中,用去甲茴三硫(100mg,收率47%)替换5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one,柱层析纯化得羧酸中间体80mg,产率47%;制得的化合物i-4为58mg,产率62.3%,橙黄色固体;1h nmr(300mhz,chloroform-d)δ7.74
–
7.64(m,2h),7.41(s,1h),7.26
–
7.19(m,2h),5.90
–
5.70(m,1h),5.09
–
4.98(m,2h),4.93(h,j=3.5hz,1h),4.88(q,j=1.4hz,1h),4.83(p,j=1.6hz,1h),4.59(d,j=3.1hz,3h),2.61(t,j=7.5hz,2h),2.40(t,j=7.4hz,2h),2.10
–
1.94(m,3h),1.85
–
1.66(m,8h),1.54
–
1.40(m,5h),1.26(t,j=7.2hz,1h),1.01(s,3h);
13
c nmr(75mhz,chloroform-d)δ215.47,173.21,171.74,171.45,153.64,149.99,148.47,147.38,136.00,129.13,128.21,122.94,112.31,110.96,110.10,66.09,52.69,41.87,39.83,39.77,34.10,33.06,28.52,27.06,24.84,24.54,24.43,16.61.esi-ms m/z:593.2[m+na]
+
。
[0049]
实施例5:化合物1-(2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)8-(4-(3-硫代-3h-1,2-二硫醇-5-基)苯基)辛二酸酯的合成,该化合物记作i-5。
[0050]
化合物i-5的合成步骤和实施例2的区别仅在于:在步骤s1中,用辛二酸(140mg,2eq)替换庚二酸(150mg,2eq);用去甲茴三硫(100mg,收率58%)替换5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one(100mg,1eq),柱层析纯化得羧酸中间体90mg,产率58%;制得的化合物i-5为60mg,产率66.3%,橙黄色固体,且化合物i-5的碳链相比于化合物i-2的碳链延长一个碳原子;1h nmr(300mhz,chloroform-d)δ7.71
–
7.65(m,2h),7.41(s,1h),7.26
–
7.19(m,2h),5.89
–
5.71(m,1h),5.05(d,j=1.4hz,1h),5.01(s,1h),4.93(h,j=2.5hz,1h),4.88(q,j=1.4hz,1h),4.83(p,j=1.6hz,1h),4.59(d,j=3.1hz,3h),2.60(t,j=7.5hz,2h),2.36(dt,j=9.4,7.2hz,3h),2.09
–
1.96(m,2h),1.86
–
1.55(m,15h),1.54
–
1.31(m,10h),1.01(s,4h);
13
c nmr(75mhz,chloroform-d)δ215.51,173.45,171.80,171.62,
153.65,150.02,148.48,147.40,136.02,129.13,128.23,122.97,112.31,110.94,110.11,66.06,64.94,52.68,41.85,39.82,34.26,33.04,28.76,27.04,24.86,24.75,24.60,19.08,16.59,13.71.esi-ms m/z:607.2[m+na]
+
。
[0051]
实施例6:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基(2-(4-(3-thioxo-3h-1,2-dithiol-5-yl)phenoxy)ethyl)马来酸酯的合成,该化合物记作i-6。
[0052]
化合物i-6的合成步骤和实施例3的区别仅在于:在步骤s2中,用马来酸酐(250mg,1.1eq)替代琥珀酸酐(250mg,1.1eq);柱层析纯化得羧酸中间体80mg,产率51%;制得的化合物i-6为46mg,产率67.5%,橙红色固体,和化合物i-3相比化合物i-6的连接链中引入了不饱和双键。1h nmr(300mhz,chloroform-d)δ7.68
–
7.56(m,2h),7.40(s,1h),7.06
–
6.97(m,2h),6.97
–
6.90(m,2h),5.89
–
5.68(m,1h),5.11
–
5.02(m,2h),4.96
–
4.91(m,1h),4.88(q,j=1.4hz,1h),4.83(p,j=1.6hz,1h),4.71(s,2h),4.63
–
4.57(m,3h),4.30(dd,j=5.5,3.7hz,2h),2.08
–
1.98(m,2h),1.72
–
1.68(m,3h),1.58(s,3h),1.49
–
1.46(m,2h),1.25(s,2h),1.00(s,3h);
13
c nmr(101mhz,chloroform-d)δ215.18,172.70,164.75,164.44,161.57,149.91,147.70,147.31,134.86,134.29,133.08,128.67,124.78,115.52,112.33,111.75,110.13,67.06,65.95,63.25,52.63,41.77,39.76,39.75,33.01,29.71,27.03,24.84,16.59.esi-ms m/z:593.2[m+na]
+
。
[0053]
实施例7:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基3-甲基-2-(4-羰基-4-(4-(4-(3-硫代-3h-1,2-二硫醇-5-基)苯氧基)丁氧基)丁酰氨基)戊酸酯的合成,该化合物记作i-7。
[0054]
化合物i-7的合成包括以下步骤反应:
[0055]
s1:将13,14-β-榄香醇(500mg,1eq)、boc-l-异亮氨酸(630mg,1.2eq)、dcc(515mg,1.1eq)、dmap(27mg,0.1eq)溶于dcm中,室温下反应4-10h后加入10ml二氯甲烷稀释,然后依次用10%盐酸洗1次,饱和nahco3溶液洗1次,水洗1次,饱和nacl洗1次,干燥,柱层析纯化得boc保护的中间体100mg(石油醚:乙酸乙酯=10:1,v:v),产率69-82%;
[0056]1h nmr(300mhz,chloroform-d)δ5.81(dd,j=17.7,10.6hz,1h),5.05(d,j=14.7hz,3h),4.95
–
4.91(m,1h),4.88(q,j=1.4hz,1h),4.83(t,j=1.7hz,1h),4.64(d,j=5.6hz,2h),4.58(d,j=1.7hz,1h),4.31(dd,j=9.1,4.8hz,1h),2.06
–
1.96(m,2h),1.71(d,j=1.2hz,4h),1.57(s,5h),1.45(s,13h),1.01(s,3h),1.00
–
0.86(m,7h).
[0057]
s2:将步骤s1制得的boc保护的中间体(100mg,1eq)溶于dcm中,冰浴下充分搅拌并缓慢滴加0.5ml三氟乙酸,滴毕,继续反应0.5-1h。减压浓缩反应液,所得油状液体溶于dcm,减压浓缩以二氯甲烷:甲醇=40:1(v:v)柱层析,分离得到伯胺中间体(50mg,收率72-84%);
[0058]1h nmr(500mhz,chloroform-d)δ5.82(t,j=13.4hz,2h),4.95(d,j=2.0hz,1h),4.93
–
4.88(m,7h),4.82(t,j=1.0hz,1h),4.79(t,j=1.0hz,1h),4.69(dq,j=2.0,1.0hz,2h),4.66(dq,j=2.2,1.0hz,2h),4.55(t,j=1.0hz,1h),4.53(t,j=1.0hz,1h),3.88(q,j=5.5hz,2h),3.33(dd,j=7.1,5.5hz,2h),3.07(dd,j=7.3,5.5hz,2h),2.23(ddd,j=7.6,5.1,1.3hz,2h),2.15
–
2.07(m,2h),1.82(dd,j=6.8,5.7hz,2h),1.73
–
1.68(m,8h),1.65
–
1.45(m,10h),1.40
–
1.34(m,2h),1.31
–
1.23(m,2h),1.05
–
1.01(m,12h),0.94(t,j=
7.4hz,6h).
[0059]
s3:将实施例3中s2步骤的产物(100mg,1eq)、催化量dmap,edci(60mg,1.2eq)溶于dcm中,活化反应10min后加入步骤s2制得的伯胺中间体(50mg,1eq),室温反应。tlc监测反应进程,完毕,加入10mldcm溶剂稀释,有机层用15ml水洗涤3次后用乙醚萃取,减压浓缩后柱层析纯化得化合物i-7为63mg(石油醚:乙酸乙酯=(10-4):1,v:v),产率51%;
[0060]1h nmr(300mhz,chloroform-d)δ7.68
–
7.55(m,2h),7.40(s,1h),7.00
–
6.90(m,2h),6.17(d,j=8.6hz,1h),5.87
–
5.71(m,1h),5.05(d,j=10.9hz,2h),4.98
–
4.91(m,1h),4.88(q,j=1.4hz,1h),4.83(t,j=1.7hz,1h),4.66
–
4.60(m,2h),4.58(d,j=1.7hz,1h),4.18(t,j=5.9hz,2h),4.05(t,j=5.7hz,2h),2.67(t,j=6.6hz,2h),2.55(dd,j=7.1,5.2hz,2h),2.05(s,1h),2.00(dd,j=11.5,4.4hz,2h),1.71(d,j=1.2hz,3h),1.68
–
1.55(m,7h),1.50
–
1.42(m,3h),1.26(t,j=7.2hz,2h),1.00(s,3h),0.91(qd,j=5.6,3.0hz,7h);
13
cnmr(101mhz,chloroform-d)δ215.00,173.07,172.85,171.76,171.14,162.31,149.90,147.77,147.28,134.54,128.59,124.08,115.44,115.42,112.30,111.81,110.11,67.73,66.96,64.22,56.52,52.68,41.55,39.78,39.73,38.02,32.97,30.89,29.43,26.99,25.67,25.29,25.11,24.83,16.59,15.50,11.69.esi-ms m/z:736.3[m+na]
+
。
[0061]
实施例8:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基3-甲基-2-(4-羰基-4-(2-(4-(3-硫代-3h-1,2-二硫醇-5-基)苯氧基)乙氧基)丁酰氨基)戊酸酯的合成,该化合物记作i-8。
[0062]
化合物i-8的合成包括以下步骤反应:
[0063]
s1:同实施例3,区别在仅于用溴丁醇(500μl,1.5eq)替换溴乙醇(500μl,1.5eq),反应结束后,用250ml水稀释和用乙醚萃取,柱层析纯化得醇中间体0.6g,收率为47%;
[0064]
s2:同实施例3;
[0065]
s3:同实施例7,减压浓缩后柱层析纯化得化合物i-8为39mg,产率62.1%,黄色固体,和化合物i-7相比化合物i-8的链长延长两个碳原子;1h nmr(300mhz,chloroform-d)δ7.68
–
7.57(m,2h),7.40(s,1h),7.05
–
6.94(m,2h),5.89
–
5.73(m,1h),4.95
–
4.90(m,1h),4.87(q,j=1.4hz,1h),4.83(t,j=1.8hz,1h),4.58(t,j=2.8hz,1h),4.49(dd,j=5.5,3.8hz,2h),4.27
–
4.21(m,2h),4.17
–
4.01(m,2h),2.72(s,4h),2.05(s,1h),2.00
–
1.91(m,1h),1.84
–
1.57(m,9h),1.57
–
1.41(m,5h),1.31
–
1.23(m,2h),1.18(d,j=1.3hz,3h),0.98(s,3h);
13
c nmr(75mhz,chloroform-d)δ215.35,173.16,173.02,172.09,171.31,162.06,150.22,148.06,147.60,135.02,128.94,124.87,115.85,112.63,112.14,110.45,67.31,66.46,62.95,56.84,52.98,41.83,40.09,40.06,38.34,33.28,31.08,29.61,27.30,25.43,25.18,16.90,15.83,12.03.esi-ms m/z:708.2[m+na]
+
。
[0066]
实施例9:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基(2-(4-(3-thioxo-3h-1,2-dithiol-5-yl)phenoxy)ethyl)邻苯二甲酸酯的合成,该化合物记作i-9。
[0067]
化合物i-9的合成步骤和实施例3的区别仅在于:在步骤s2中,用邻苯二甲酸酐(250mg,1.1eq)替换琥珀酸酐(250mg,1.1eq),柱层析纯化得化合物i-9为57mg,产率76.5%,橙红色固体,和化合物i-3相比化合物i-9引入苯环作为链接链。1h nmr(300mhz,chloroform-d)δ7.82
–
7.75(m,1h),7.71(dt,j=7.4,3.7hz,1h),7.65
–
7.59(m,2h),7.57
(dd,j=5.7,3.3hz,2h),7.39(s,1h),7.07
–
6.96(m,2h),5.89
–
5.69(m,1h),5.14
–
5.07(m,1h),5.03(s,1h),4.92(q,j=1.3hz,1h),4.90
–
4.85(m,1h),4.82(q,j=1.7hz,1h),4.77(s,2h),4.72
–
4.64(m,2h),4.57(d,j=1.9hz,1h),4.39
–
4.28(m,2h),2.10
–
1.95(m,2h),1.70(d,j=1.2hz,3h),1.64(d,j=6.7hz,2h),1.60(q,j=1.9hz,1h),1.46(s,3h),0.99(s,3h);
13
c nmr(101mhz,chloroform-d)δ215.07,172.78,167.62,166.89,161.77,149.90,147.94,147.35,134.73,132.02,131.66,131.40,131.28,129.10,128.91,128.63,124.59,115.58,112.33,111.32,110.15,67.28,66.05,63.49,52.62,41.75,39.79,39.76,33.01,27.03,24.87,16.60.esi-ms m/z:621.2[m+h]
+
。
[0068]
实施例10:化合物2-(2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)1-(2-(4-(3-硫代-3h-1,2-二硫醇-5-基)苯氧基)乙基)3-氟邻苯二甲酸酯的合成,该化合物记作i-10。
[0069]
化合物i-10的合成步骤和实施例3的区别仅在于:在步骤s2中,用3-氟酞酐(250mg,1.1eq)替换琥珀酸酐(250mg,1.1eq),柱层析纯化得化合物i-10为55mg,产率73.2%,橙红色固体,和化合物i-3相比化合物i-10引入f取代的苯环作为链接链。1h nmr(400mhz,chloroform-d)δ7.87
–
7.77(m,1h),7.67
–
7.57(m,2h),7.50(td,j=8.1,5.4hz,1h),7.39(s,1h),7.34(td,j=8.5,1.0hz,1h),7.07
–
6.97(m,2h),5.87
–
5.76(m,1h),5.30(s,1h),5.07(dt,j=16.9,1.1hz,2h),4.97
–
4.86(m,2h),4.83(p,j=1.6hz,1h),4.76
–
4.73(m,3h),4.58(dt,j=1.8,0.9hz,1h),4.40
–
4.32(m,2h),4.12(q,j=7.1hz,1h),2.09
–
1.97(m,3h),1.70(dd,j=1.5,0.8hz,3h),1.68
–
1.59(m,5h),1.00(s,3h);
13
c nmr(101mhz,chloroform-d)δ215.17,172.78,171.15,164.78,161.81,149.83,147.71,147.33,134.77,131.26,128.57,125.71,124.59,120.40,115.62,112.32,111.77,110.18,67.45,65.95,63.72,60.40,52.62,41.77,39.77,39.74,33.06,27.04,24.84,21.06,16.59,14.21.esi-ms m/z:639.2[m+h]
+
。
[0070]
实施例11:化合物2-((1r,2s,5r)-2-甲基-5-(丙-1-烯-2-基)-2-乙烯基环己基)烯丙基(2-(4-(3-thioxo-3h-1,2-dithiol-5-yl)phenoxy)ethyl)琥珀酸酯的合成,该化合物记作i-11。
[0071]
化合物i-11的合成步骤和实施例3的区别仅在于:在步骤s3中,用14-β-榄香醇(100mg,1eq)替换13-β-榄香醇(100mg,1eq),柱层析纯化得化合物i-11为65mg,产率67.3%,橙红色固体;1h nmr(300mhz,chloroform-d)δ7.68
–
7.57(m,2h),7.04
–
6.94(m,2h),5.75(dd,j=17.8,10.5hz,1h),5.13(d,j=1.5hz,1h),4.99
–
4.82(m,3h),4.71(t,j=1.5hz,2h),4.47(d,j=4.8hz,2h),4.24(dd,j=5.4,4.0hz,2h),4.11(t,j=7.2hz,1h),2.69(s,4h),1.74(d,j=1.3hz,3h),1.56
–
1.21(m,8h),0.99(s,3h);
13
c nmr(75mhz,chloroform-d)δ215.14,172.78,172.18,171.79,161.76,150.00,149.27,145.92,134.77,128.64,124.64,115.56,113.45,111.05,108.50,68.48,66.17,62.63,48.33,45.62,39.67,32.97,29.05,28.97,26.65,21.07,16.00,14.21.esi-ms m/z:595.2[m+na]
+
。
[0072]
实施例12:化合物2-((1r,2s,5r)-2-甲基-5-(丙-1-烯-2-基)-2-乙烯基环己基)烯丙基3-甲基-2-(4-羰基-4-(2-(4-(3-硫代-3h-1,2-二硫醇-5-基)苯氧基)乙氧基)丁酰氨基)戊酸酯的合成,该化合物记作i-12。
[0073]
化合物i-12的合成步骤和实施例7的区别仅在于:在步骤s1中,用14-β-榄香醇
(500mg,1eq)替换13-β-榄香醇(500mg,1eq),柱层析纯化得化合物i-12为40mg,产率62.9%,黄色固体;1h nmr(400mhz,chloroform-d)δ7.66
–
7.58(m,2h),7.39(s,1h),7.03
–
6.95(m,2h),6.19(d,j=8.6hz,1h),5.91
–
5.67(m,1h),5.24
–
5.13(m,1h),5.01
–
4.88(m,3h),4.69
–
4.52(m,2h),4.51
–
4.42(m,3h),4.24(dd,j=5.3,4.2hz,2h),2.82
–
2.65(m,2h),2.62
–
2.53(m,2h),1.85
–
1.76(m,2h),1.58
–
1.53(m,3h),1.04
–
0.97(m,4h),0.96
–
0.92(m,4h),0.93
–
0.89(m,3h),0.88
–
0.84(m,1h).
13
c nmr(75mhz,chloroform-d)δ215.16,172.85,172.73,171.70,170.93,161.74,148.40,145.48,134.79,128.63,124.61,120.52,116.62,115.54,77.25,66.12,62.63,56.46,47.35,44.47,39.57,38.51,38.07,34.92,30.78,29.27,25.16,23.29,22.78,21.55,15.51,11.69.esi-ms m/z:708.3[m+na]
+
。
[0074]
实施例13:化合物4-(4-((2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)氧代)丁氧基)苯并硫代酰胺的合成,该化合物记作i-13。
[0075]
化合物i-13的合成包括以下步骤反应:
[0076]
s1:向50ml的圆底烧瓶中加入对羟基硫代苯甲酰胺(100mg,1eq),充分搅拌溶解完全后,加入k2co3(180mg,2eq),加热至80℃并回流30min,然后加入二溴丁烷(5eq),在80℃下继续加热3h,后停止加热,然后过滤,将滤液减压浓缩后加入ea稀释、加水萃取、干燥,柱层析纯化得溴代衍生物51mg(石油醚:乙酸乙酯=8:1,v:v),收率为49.3%;
[0077]
s2:将榄香烯酸类衍生物(100mg,1eq)、催化量dmap,edci(60mg,1.2eq)溶于dcm中,活化反应10min后加入步骤s1制得的溴代衍生物(50mg,1eq),室温反应。tlc监测反应进程,完毕,加入10mldcm溶剂稀释,有机层用15ml水洗涤3次后用乙醚萃取,减压浓缩后柱层析纯化得化合物i-13为63mg(石油醚:乙酸乙酯=(10-4):1,v:v),产率51%,1h nmr(300mhz,dmso-d6)δ9.61(s,1h),9.30(s,1h),7.95(d,j=8.8hz,2h),6.93(d,j=8.9hz,2h),5.88
–
5.70(m,1h),5.00
–
4.80(m,4h),4.80
–
4.73(m,1h),4.57(d,j=2.2hz,1h),4.04(t,j=6.5hz,2h),3.92(s,2h),3.41(t,j=6.2hz,2h),2.89(s,1h),2.73(s,1h),2.00(dd,j=9.1,3.4hz,4h),0.96(s,3h);
13
cnmr(75mhz,chloroform-d)δ201.34,162.54,150.73,150.20,147.64,131.02,129.12,114.07,112.17,109.95,109.94,73.21,69.71,68.04,52.78,41.44,39.95,39.83,33.19,27.09,26.26,26.11,24.84,16.61.esi-ms m/z:450.3[m+na]
+
。
[0078]
实施例14:化合物1-(4-氨基甲硫杂酰苯基)7-(2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)庚二酸酯的合成,该化合物记作i-14。
[0079]
化合物i-14的合成步骤和实施例2的区别仅在于:在步骤s1中,用对羟基硫代苯甲酰胺(50mg,1eq)替换5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one(100mg,1eq),柱层析纯化得羧酸中间体50mg,产率36%;制得的化合物i-14为45mg,产率65.8%,白色固体。1h nmr(300mhz,dmso-d6)δ9.87(s,1h),9.51(s,1h),7.98
–
7.89(m,2h),7.15(d,j=8.5hz,2h),5.81(dd,j=17.8,10.4hz,1h),5.00(s,2h),4.90(d,j=3.2hz,1h),4.85(d,j=1.7hz,1h),4.79(s,1h),4.57(s,3h),2.59(t,j=7.3hz,2h),2.37(t,j=7.3hz,2h),2.08
–
1.95(m,2h),1.72
–
1.53(m,10h),1.53
–
1.32(m,7h),0.96(s,3h);
13
c nmr(101mhz,chloroform-d)δ201.43,173.24,171.64,153.41,149.97,148.43,147.35,136.82,128.61,121.43,112.27,110.93,110.06,66.07,52.68,41.85,39.81,39.74,34.10,34.08,33.05,28.51,27.04,24.80,24.53,24.43,16.60.esi-ms m/z:520.2[m+na]
+
。
[0080]
实施例15:化合物4-((6-((2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)氧代)己基)氧代)苯并硫代酰胺的合成,该化合物记作i-15。
[0081]
化合物i-15的合成步骤和实施例13的区别仅在于:在步骤s1中,用二溴己烷(5eq)替换二溴丁烷(5eq),柱层析纯化得化合物i-15为59mg(石油醚:乙酸乙酯=2:1,v:v),产率68.4%,白色固体,和化合物i-13相比化合物i-15连接链延长两个碳原子;1h nmr(300mhz,dmso-d6)δ9.64(s,1h),9.32(s,1h),8.01
–
7.87(m,2h),7.00
–
6.83(m,2h),5.80(dd,j=17.9,10.5hz,1h),5.03
–
4.72(m,5h),4.57(d,j=2.2hz,1h),4.01(t,j=6.4hz,2h),3.89(s,2h),2.00(dd,j=12.2,3.8hz,2h),1.69(d,j=18.9hz,5h),1.58
–
1.27(m,13h),0.96(s,3h);
13
c nmr(75mhz,chloroform-d)δ201.44,162.67,150.91,150.31,147.72,131.04,129.18,114.13,112.22,110.00,109.95,73.25,70.18,68.29,52.87,41.49,40.04,39.90,33.25,29.75,29.13,27.15,26.12,25.94,24.89,16.67.esi-ms m/z:478.3[m+na]
+
。
[0082]
实施例16:化合物4-((8-((2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)氧代)辛基)氧代)苯并硫代酰胺的合成,该化合物记作i-16。
[0083]
化合物i-16的合成步骤与实施例13的区别仅在于:在步骤s1中,用二溴辛烷(5eq)替换二溴丁烷(5eq),柱层析纯化得化合物i-16为73mg(石油醚:乙酸乙酯=8:1,v:v),收率为73.6%,白色固体,和化合物i-13相比化合物i-15连接链延长四个碳原子;1h nmr(300mhz,chloroform-d)δ7.93
–
7.80(m,2h),6.92
–
6.81(m,2h),5.89
–
5.73(m,1h),5.08
–
4.75(m,5h),4.57(d,j=1.9hz,1h),4.02
–
3.89(m,4h),3.39(t,j=6.5hz,2h),2.01(dt,j=9.5,5.6hz,3h),1.86
–
1.73(m,2h),1.51
–
1.20(m,18h),1.00(s,3h);
13
cnmr(101mhz,chloroform-d)δ201.33,171.15,162.56,150.87,150.21,147.60,130.97,129.12,113.99,112.10,109.87,73.13,70.24,68.28,52.80,41.41,39.96,33.18,29.73,29.38,29.30,29.06,27.08,26.19,25.91,24.79,22.60,16.60.esi-ms m/z:506.3[m+na]
+
。
[0084]
实施例17:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基5-(1,2-二噻戊环-3-基)戊酸酯的合成,该化合物记作i-17。
[0085]
化合物i-17的合成包括以下步骤反应:
[0086]
将α-硫辛酸(100mg,1eq)、催化量dmap,edci(120mg,1.2eq)溶于dcm中,活化反应10min后加入13-β榄香醇(50mg,1eq),室温反应。tlc监测反应进程,完毕,加入10mldcm溶剂稀释,有机层用15ml水洗涤2次后用乙醚萃取,柱层析纯化得化合物i-17为40mg(石油醚:乙酸乙酯=10:1,v:v),产率36%;1h nmr(400mhz,chloroform-d)δ5.97(d,j=8.7hz,1h),5.81(dd,j=17.8,10.5hz,1h),5.07(d,j=1.3hz,1h),5.04(d,j=1.1hz,1h),4.97
–
4.91(m,1h),4.89(q,j=1.4hz,1h),4.83(t,j=1.7hz,1h),4.70
–
4.66(m,1h),4.64(dd,j=7.5,1.3hz,2h),4.58(dt,j=1.9,0.9hz,1h),3.62
–
3.52(m,1h),3.23
–
3.07(m,2h),2.51
–
2.41(m,1h),2.25(td,j=7.5,1.4hz,2h),2.05(s,1h),2.00(dd,j=11.8,4.2hz,2h),1.96
–
1.86(m,2h),1.76
–
1.64(m,8h),1.63
–
1.55(m,2h),1.52
–
1.39(m,6h),1.26(t,j=7.1hz,1h),1.23
–
1.12(m,1h),1.01(s,3h),0.93(t,j=7.1hz,6h);
13
c nmr(75mhz,chloroform-d)δ173.23,150.03,148.47,147.40,112.31,111.00,110.09,66.09,56.36,52.67,41.83,40.26,39.83,38.53,34.66,34.17,33.05,29.74,28.84,27.05,24.87,24.73,16.61.esi-ms m/z:431.2[m+na]
+
。
[0087]
实施例18:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)
烯丙基2-(5-(1,2-二噻戊环-3-基)戊酰氨基)-3-甲基戊酸酯的合成,该化合物记作i-18。
[0088]
化合物i-18的合成步骤与实施例17的区别仅在于:使用实施例7中步骤s2制得的产物(100mg,1eq)替换13-β-榄香醇(50mg,1eq),柱层析纯化得化合物i-18为28mg(石油醚:乙酸乙酯=8:1,v:v),收率为73.6%,无色油状液体。1h nmr(300mhz,chloroform-d)δ5.79(ddd,j=19.9,11.0,6.0hz,1h),4.97
–
4.80(m,2h),4.63
–
4.55(m,1h),4.18
–
3.99(m,1h),3.93
–
3.83(m,1h),3.65
–
3.52(m,1h),3.24
–
3.05(m,1h),2.55
–
2.33(m,2h),2.23
–
2.04(m,1h),2.02
–
1.88(m,3h),1.77
–
1.58(m,9h),1.58
–
1.38(m,6h),1.27(dd,j=9.6,2.6hz,2h),1.18(d,j=1.3hz,3h),1.06
–
0.94(m,4h),0.91(t,j=7.4hz,2h);
13
c nmr(75mhz,chloroform-d)δ172.43,171.96,149.91,147.73,147.31,112.29,111.79,110.10,66.98,56.36,56.29,52.64,41.50,40.22,39.76,38.48,38.05,36.41,36.35,34.64,32.95,28.87,26.96,25.33,25.14,24.86,16.56,15.53,11.68.esi-ms m/z:544.3[m+na]
+
。
[0089]
实施例19:化合物2-((1r,2s,5r)-2-甲基-5-(丙-1-烯-2-基)-2-乙烯基环己基)烯丙基5-(1,2-二噻戊环-3-基)戊酸酯的合成,该化合物记作i-19。
[0090]
化合物i-19的合成步骤与实施例17的区别仅在于:使用14-β-榄香醇的(50mg,1eq)替换13-β-榄香醇(50mg,1eq),柱层析纯化得化合物i-19为36mg(石油醚:乙酸乙酯=8:1,v:v),收率为66.5%,无色油状液体;1hnmr(300mhz,chloroform-d)δ5.76(dd,j=17.8,10.4hz,1h),5.13(q,j=1.4hz,1h),4.98
–
4.93(m,1h),4.93
–
4.83(m,2h),4.71(d,j=1.7hz,2h),4.48(t,j=2.8hz,2h),3.57(dd,j=7.9,6.2hz,1h),3.27
–
3.06(m,2h),2.46(dd,j=12.6,6.2hz,1h),2.36(t,j=7.4hz,2h),2.11
–
1.98(m,1h),1.92(dt,j=12.9,6.9hz,2h),1.78
–
1.62(m,10h),1.62
–
1.54(m,3h),1.54
–
1.42(m,5h),1.00(s,3h);
13
c nmr(101mhz,chloroform-d)δ173.08,150.02,149.26,146.14,113.37,111.03,108.47,68.09,56.33,48.36,45.64,40.23,39.69,39.64,38.51,34.64,34.13,32.99,28.81,26.66,24.72,21.11,16.01.esi-ms m/z:431.2[m+na]
+
。
[0091]
实施例20:化合物2-((1r,2s,5r)-2-甲基-5-(丙-1-烯-2-基)-2-乙烯基环己基)烯丙基2-(5-(1,2-二噻戊环-3-基)戊酰氨基)-3-甲基戊酸酯的合成,该化合物记作i-20。
[0092]
化合物i-20的合成步骤与实施例17的区别仅在于:使用实施例12中步骤s2制得的产物(100mg,1eq)替换13-β-榄香醇(50mg,1eq),柱层析纯化得化合物i-20为35mg(石油醚:乙酸乙酯=8:1,v:v),收率为71.6%,无色油状液体;1h nmr(400mhz,chloroform-d)δ6.09
–
5.98(m,1h),5.18(d,j=6.1hz,1h),5.00
–
4.88(m,3h),4.72
–
4.41(m,3h),3.61
–
3.50(m,1h),3.22
–
3.05(m,2h),2.46(dq,j=12.4,6.2hz,1h),2.25(t,j=7.4hz,2h),1.97
–
1.83(m,3h),1.77
–
1.60(m,5h),1.60
–
1.36(m,9h),1.20(ddq,j=13.6,9.3,7.0hz,1h),1.05
–
0.89(m,10h).
13
c nmr(75mhz,chloroform-d)δ172.44,171.90,148.52,145.27,114.81,108.54,91.46,69.22,60.42,56.37,47.76,46.75,40.23,39.49,39.06,38.49,38.07,36.38,34.65,28.88,28.85,28.14,25.34,25.26,23.31,23.05,21.77,21.09,15.69,15.56,14.22,11.67.esi-ms m/z:544.3[m+na]
+
。
[0093]
实施例21:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基(2-(苯并硫代酰胺)乙基)琥珀酸酯的合成,该化合物记作i-2。
[0094]
化合物i-21的合成步骤和实施例1的区别仅在于:在步骤s1中,使用对羟基硫代苯甲酰胺替换实施例1中的5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one,柱层析纯化得化合物
i-21为45mg(石油醚:乙酸乙酯=2:1,v:v),收率为51.6%,橙红色固体;1h nmr(400mhz,chloroform-d)δ7.48
–
7.42(m,2h),6.92(s,2h),6.90
–
6.85(m,2h),5.82(t,j=13.5hz,1h),4.95(d,j=2.0hz,1h),4.92(t,j=2.3hz,1h),4.91
–
4.86(m,3h),4.70(dt,j=2.1,1.1hz,1h),4.66(dt,j=2.1,1.0hz,1h),4.49(dt,j=13.2,1.2hz,1h),4.37(t,j=6.2hz,2h),4.20(td,j=6.2,2.3hz,2h),2.72
–
2.60(m,4h),2.26
–
2.16(m,2h),1.72(q,j=1.1hz,3h),1.68
–
1.62(m,1h),1.61
–
1.50(m,2h),1.46(d,j=5.9hz,1h),1.40
–
1.25(m,2h),1.03(s,3h).
13
c nmr(75mhz,chloroform-d)δ205.26,171.80,171.47,160.75,149.65,149.13,147.66,132.89,128.34,114.68,112.55,111.41,111.04,67.37,67.02,64.66,49.30,40.47,39.69,36.88,31.83,29.01,28.95,27.33,24.01,17.31.esi-ms m/z:522.2[m+na]
+
。
[0095]
实施例22:化合物1-(2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)7-(苯并硫代酰胺)庚二酸酯的合成,该化合物记作i-22。
[0096]
化合物i-22的合成步骤与实施例2的区别仅在于:在s1步骤中,使用对羟基硫代苯甲酰胺(100mg,1eq)替换5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one(100mg,1eq),柱层析纯化得化合物i-22为46mg,收率为60.6%,淡黄色固体;1h nmr(400mhz,chloroform-d)δ7.53
–
7.46(m,2h),7.11
–
7.02(m,2h),6.93(s,2h),5.82(t,j=13.4hz,1h),5.00
–
4.84(m,5h),4.68(ddt,j=20.7,2.2,1.0hz,2h),4.49
–
4.42(m,1h),2.54(t,j=7.0hz,2h),2.32(td,j=7.0,2.2hz,2h),2.25(d,j=1.1hz,1h),2.17(s,1h),1.72(q,j=1.1hz,3h),1.69
–
1.56(m,6h),1.55
–
1.36(m,5h),1.31
–
1.23(m,1h),1.03(s,3h).
13
cnmr(75mhz,chloroform-d)δ205.26,173.18,171.78,152.32,149.65,149.13,147.66,133.70,128.51,121.46,112.55,111.41,111.04,67.37,49.29,40.47,39.69,36.88,34.43,33.73,31.83,28.77,27.43,24.56,24.23,24.01,17.31.esi-ms m/z:520.2[m+na]
+
。
[0097]
实施例23:化合物1-(2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)8-(苯并硫代酰胺)辛二酸酯的合成。
[0098]
化合物i-23的合成步骤与实施例22的区别仅在于:在s1步骤中,用辛二酸(140mg,2eq)替换庚二酸(150mg,2eq),柱层析纯化得化合物i-23为66mg,收率为59.7%,橙黄色黄色固体;1h nmr(400mhz,chloroform-d)δ7.54
–
7.47(m,2h),7.10
–
7.04(m,2h),6.94(s,2h),5.88
–
5.79(m,1h),4.92(ddd,j=15.9,9.2,2.1hz,2h),4.84(ddd,j=4.7,1.9,1.0hz,2h),4.80(dt,j=13.0,1.0hz,1h),4.68(ddt,j=20.7,2.1,1.0hz,2h),4.49(dt,j=13.2,1.1hz,1h),2.56(t,j=7.0hz,2h),2.32(t,j=7.1hz,2h),2.22
–
2.15(m,2h),1.72(q,j=1.1hz,3h),1.69
–
1.62(m,3h),1.61
–
1.51(m,4h),1.48
–
1.41(m,1h),1.37
–
1.28(m,5h),1.16(d,j=8.1hz,1h),1.03(s,3h).
13
c nmr(75mhz,chloroform-d)δ205.26,173.21,171.78,152.32,149.65,149.11,147.69,133.68,128.51,121.50,112.56,111.41,111.04,67.37,49.32,40.47,39.69,36.88,34.48,33.75,31.83,28.40,28.39,27.14,24.99,24.95,23.97,17.31.esi-ms m/z:534.3[m+na]
+
。
[0099]
实施例24:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基(2-(苯并硫代酰胺)乙基)马来酸酯的合成。
[0100]
化合物i-24的的合成步骤与实施例6的区别仅在于:在s1步骤中,使用对羟基硫代苯甲酰胺(100mg,1eq)替换的去甲茴三硫(100mg,1eq),柱层析纯化得化合物i-23为38mg,收率为45.0%,橙黄色黄色固体;1h nmr(400mhz,chloroform-d)δ7.47
–
7.41(m,2h),6.91
(s,2h),6.89
–
6.83(m,2h),6.26(d,j=5.7hz,2h),5.82(t,j=13.4hz,1h),4.95(d,j=2.0hz,1h),4.92(t,j=2.3hz,1h),4.89(t,j=1.7hz,1h),4.87(ddt,j=3.8,1.7,1.1hz,3h),4.70(dt,j=2.1,1.1hz,1h),4.67
–
4.62(m,2h),4.40(t,j=6.1hz,2h),4.20(td,j=6.2,2.0hz,2h),2.26
–
2.17(m,2h),1.75
–
1.69(m,4h),1.62
–
1.54(m,2h),1.47
–
1.35(m,2h),1.24(s,1h),1.03(s,3h).
13
c nmr(75mhz,chloroform-d)δ205.26,166.76,166.35,160.79,149.65,149.02,147.66,132.89,132.46,132.39,128.34,114.68,112.55,111.41,111.13,66.61,65.76,63.50,49.29,40.47,39.69,36.88,31.83,27.21,24.01,17.31.esi-ms m/z:520.2[m+na]
+
。
[0101]
实施例25:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基3-甲基-2-(4-羰基-4-(4-(苯并硫代酰胺)丁氧基)丁酰氨基)戊酸酯的合成。
[0102]
化合物i-25的的合成步骤与实施例1的区别仅在于:在步骤s1中,使用对羟基硫代苯甲酰胺(1.0g,收率70%)替换5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one(1.0g,收率46%);在步骤s3中,使用实施例7中步骤s2制得的产物(100mg,1eq)替换13-β-榄香醇(100mg,1eq),柱层析纯化得化合物i-25为51mg,收率为49.1%,黄色固体;1h nmr(500mhz,chloroform-d)δ7.70(d,j=9.2hz,1h),7.47
–
7.43(m,2h),6.90(s,2h),6.86
–
6.82(m,2h),5.82(t,j=9.2hz,1h),4.92(dd,j=5.1,2.2hz,1h),4.90(d,j=2.0hz,1h),4.88
–
4.84(m,3h),4.70(dt,j=2.1,1.1hz,1h),4.66(dt,j=2.0,0.9hz,1h),4.50(t,j=1.1hz,1h),4.41(dd,j=9.2,6.6hz,1h),4.33(dd,j=6.5,5.9hz,2h),4.22
–
4.18(m,2h),2.73
–
2.60(m,4h),2.29
–
2.24(m,1h),2.16(t,j=1.0hz,1h),2.11
–
2.02(m,1h),1.78
–
1.70(m,4h),1.56
–
1.46(m,4h),1.45
–
1.30(m,3h),1.03(s,3h),0.94
–
0.84(m,6h).
13
c nmr(125mhz,chloroform-d)δ205.26,173.05,171.97,171.84,160.80,149.63,149.03,147.61,132.95,128.34,114.67,112.55,111.41,110.94,67.81,66.52,64.53,57.25,49.33,40.41,39.70,36.85,36.82,31.83,31.49,30.01,26.91,25.03,23.85,17.30,15.77,11.45.esi-ms m/z:635.3[m+na]
+
。
[0103]
实施例26:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基3-甲基-2-(4-羰基-4-(2-(苯并硫代酰胺)乙氧基)丁酰氨基)戊酸酯的合成。
[0104]
化合物i-26合成步骤与实施例8的区别仅在于:在s1步骤中,使用对羟基硫代苯甲酰胺(100mg,1eq)替换实施例8中的去甲茴三硫(100mg,1eq),柱层析纯化得化合物i-26为39mg(石油醚:乙酸乙酯=2:1,v:v),收率为33.7%,黄色固体;1h nmr(500mhz,chloroform-d)δ7.78(d,j=9.2hz,1h),7.47
–
7.40(m,2h),6.91(s,2h),6.87
–
6.83(m,2h),5.85
–
5.78(m,1h),4.96
–
4.87(m,4h),4.76(dt,j=13.0,0.9hz,1h),4.68(ddt,j=20.9,2.0,1.0hz,2h),4.57(dt,j=13.0,0.9hz,1h),4.43(dd,j=9.0,6.6hz,1h),4.12
–
4.04(m,4h),2.76
–
2.67(m,2h),2.65
–
2.56(m,2h),2.23
–
2.13(m,2h),2.07(ddd,j=6.7,5.7,0.9hz,1h),1.83
–
1.69(m,8h),1.61
–
1.50(m,2h),1.48
–
1.40(m,2h),1.32(qd,j=7.2,5.6hz,2h),1.26
–
1.18(m,1h),1.03(s,3h),0.92(t,j=7.2hz,3h),0.87(d,j=6.8hz,3h).
13
c nmr(125mhz,chloroform-d)δ205.26,173.05,172.10,171.99,160.86,149.59,149.03,147.62,133.00,128.34,114.67,112.53,111.41,110.73,67.99,67.81,65.11,57.22,49.30,40.40,39.70,36.85,36.82,31.83,31.49,30.02,26.91,26.51,26.16,25.03,23.88,17.37,15.77,11.45.esi-ms m/z:663.3[m+na]
+
。
[0105]
实施例27:化合物2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基(2-(苯并硫代酰胺)乙基)邻苯二甲酸酯的合成。
[0106]
化合物i-27的合成步骤与实施例9的区别仅在于:在s1步骤中,使用对羟基硫代苯甲酰胺(100mg,1eq)替换实施例9中的去甲茴三硫(100mg,1eq),柱层析纯化得化合物i-27为55mg,收率为74.7%,橙红色固体;1h nmr(500mhz,chloroform-d)δ7.71
–
7.62(m,2h),7.53
–
7.48(m,2h),7.46
–
7.41(m,2h),6.95
–
6.88(m,4h),5.85
–
5.77(m,1h),4.97(dd,j=13.5,2.1hz,1h),4.93
–
4.89(m,3h),4.87(dt,j=13.2,1.1hz,1h),4.78(dt,j=13.1,1.0hz,1h),4.70(dq,j=2.0,1.0hz,1h),4.66(dq,j=2.0,1.0hz,1h),4.46(td,j=6.2,1.3hz,2h),4.30
–
4.25(m,2h),2.16(ddd,j=7.8,5.2,1.5hz,1h),2.09
–
2.02(m,1h),1.72(q,j=1.1hz,3h),1.65(dt,j=12.8,5.4hz,1h),1.56
–
1.46(m,2h),1.40
–
1.19(m,3h),1.03(s,3h).
13
c nmr(125mhz,chloroform-d)δ205.26,167.44,160.96,149.62,148.88,147.76,132.92,131.68,131.43,131.33,130.97,128.98,128.34,114.67,112.55,111.41,111.13,68.10,66.65,64.65,49.42,40.41,39.69,36.85,31.83,27.02,23.88,17.30.esi-ms m/z:570.2[m+na]
+
。
[0107]
实施例28:化合物2-(2-((1r,3s,4s)-4-甲基-3-(丙-1-烯-2-基)-4-乙烯基环己基)烯丙基)1-(2-(苯并硫代酰胺)乙基)3-氟邻苯二甲酸酯的合成,该化合物记作i-28。
[0108]
化合物i-28的合成步骤与实施例10的区别仅在于:在s1步骤中,使用对羟基硫代苯甲酰胺(100mg,1eq)替换实施例10中的去甲茴三硫(100mg,1eq),柱层析纯化得化合物i-28为61mg,收率为79.8%,橙红色固体;1h nmr(500mhz,chloroform-d)δ7.61
–
7.53(m,2h),7.49
–
7.43(m,2h),7.33(ddd,j=7.9,6.7,2.4hz,1h),6.95
–
6.88(m,4h),5.82(t,j=13.4hz,1h),5.00
–
4.84(m,5h),4.78
–
4.64(m,3h),4.47(td,j=6.2,3.0hz,2h),4.25(t,j=6.2hz,2h),2.20(ddd,j=7.5,5.2,1.4hz,1h),2.13
–
2.03(m,1h),1.75
–
1.70(m,3h),1.67(dt,j=12.8,5.5hz,1h),1.63
–
1.52(m,1h),1.47
–
1.30(m,3h),1.21(dt,j=12.8,7.9hz,1h),1.03(s,3h).
13
c nmr(125mhz,chloroform-d)δ205.26,166.95,166.92,164.40,164.34,160.91,160.81,158.90,149.63,148.88,147.72,132.95,130.24,130.18,130.11,130.04,128.35,125.30,125.28,119.35,119.31,119.19,119.15,114.67,112.55,111.41,111.13,68.17,66.65,64.65,49.42,40.41,39.69,36.85,31.83,27.02,23.84,17.30.esi-ms m/z:588.2[m+na]
+
。
[0109]
实施例29:化合物2-((1r,2s,5r)-2-甲基-5-(丙-1-烯-2-基)-2-乙烯基环己基)烯丙基(2-(苯并硫代酰胺)乙基)琥珀酸酯的合成。
[0110]
化合物i-29的合成步骤与实施例11的区别仅在于:在s1步骤中,使用对羟基硫代苯甲酰胺(100mg,1eq)替换实施例11中的去甲茴三硫(100mg,1eq),柱层析纯化得化合物i-29为53mg,收率为50.8%,橙红色固体;1h nmr(500mhz,chloroform-d)δ7.53
–
7.45(m,2h),6.98(s,2h),6.91
–
6.83(m,2h),5.87
–
5.76(m,1h),4.98
–
4.85(m,3h),4.82(ddq,j=12.5,1.8,1.0hz,2h),4.69(ddt,j=17.4,2.0,0.9hz,2h),4.44
–
4.32(m,3h),4.20(td,j=6.2,1.9hz,2h),2.76(td,j=8.3,1.2hz,2h),2.70
–
2.56(m,2h),2.12
–
2.04(m,1h),1.99
–
1.91(m,1h),1.75(t,j=1.0hz,3h),1.68
–
1.53(m,2h),1.52
–
1.34(m,2h),1.31
–
1.20(m,1h),1.15(dd,j=12.8,8.0hz,1h),1.04(s,3h).
13
c nmr(125mhz,chloroform-d)δ205.26,171.80,171.47,160.75,149.44,148.81,146.67,132.89,128.34,114.68,112.78,111.93,
110.38,68.23,67.02,64.66,43.09,42.68,40.50,36.88,32.97,29.01,28.95,26.17,20.03,19.50.esi-ms m/z:522.2[m+na]
+
。
[0111]
实施例30:化合物2-((1r,2s,5r)-2-甲基-5-(丙-1-烯-2-基)-2-乙烯基环己基)烯丙基3-甲基-2-(4-羰基-4-(2-(苯并硫代酰胺)乙氧基)丁酰氨基)戊酸酯的合成,该化合物记作i-30。
[0112]
化合物i-30的合成步骤与实施例17的区别仅在于:使用实施例25步骤s2得到的羧酸中间体(200mg,1.1eq)替换α-硫辛酸(100mg,1eq,使用实施例12中步骤s2制得的产物(100mg,1eq)替换13-β榄香醇(50mg,1e,柱层析纯化得化合物i-30为43mg,收率为63.8%,黄色固体;1h nmr(500mhz,chloroform-d)δ7.67(d,j=9.0hz,1h),7.49
–
7.41(m,2h),6.90(s,2h),6.88
–
6.83(m,2h),5.86
–
5.77(m,1h),5.00
–
4.86(m,4h),4.79(dt,j=13.2,1.1hz,1h),4.69(ddt,j=17.9,2.2,1.0hz,2h),4.41
–
4.32(m,3h),4.25
–
4.16(m,2h),4.12(dd,j=9.2,6.6hz,1h),2.74
–
2.58(m,4h),2.38
–
2.31(m,1h),2.10(s,1h),1.92
–
1.78(m,1h),1.79
–
1.68(m,4h),1.65
–
1.50(m,2h),1.49
–
1.42(m,1h),1.39
–
1.30(m,1h),1.28(td,j=7.2,5.7hz,2h),1.21
–
1.13(m,1h),1.05(s,3h),0.93
–
0.85(m,6h).
13
c nmr(125mhz,chloroform-d)δ205.26,173.05,171.97,171.84,160.80,149.49,148.80,146.67,132.95,128.34,114.67,113.15,111.93,110.43,69.54,66.52,64.53,57.25,43.14,42.67,40.50,36.85,36.82,32.97,31.49,30.01,26.08,25.03,20.01,19.50,15.77,11.45.esi-ms m/z:635.3[m+na]
+
。
[0113]
性能检测试验
[0114]
一、对5-(4-羟基苯基)-3h-1,2,4-二噻唑-3-one(d1)、对羟基硫代苯甲酰胺(d2)、α-硫辛酸(d3)、去甲茴三硫(d4)和实施例1-20制备的化合物进行体外h2s释放测试,检测结果见表1。
[0115]
1、实验方法:取d1-4和实施例1-20提供的化合物各100μm,分别于37℃条件下在l-半胱氨酸(1mm)存在的磷酸缓冲液中孵育,时间间隔设置为0到150分钟(0,2,5,10,20,40,60,80,100,120,150min)。到达设定时间后,取出200μl测试样品,依次加入醋酸锌(1%w/v,20μl),三氯乙酸(10%w/v,20μl)终止反应,再加入n,n-二甲基对苯二胺的硫酸盐的盐酸溶液(20μm,40μl),加入fecl3的hcl溶液(30μm,40μl)。10min后,在酶标仪(thermoscientific)下测量670nm处的吸光度。用nahs(5,10,20,40,60,80,100,150μm)建立标准曲线,计算目标化合物的h2s释放水平。
[0116]
表1:体外h2s体外释放结果
[0117][0118]
结合实施例1-20和d1-4以及表1可以看出,所有实施例化合物均能有效释放硫化氢,释放量约在40分钟后缓慢下降。特别是化合物i-3,i-4,i-8,i-9,i-10,i-13,i-14,i-28表现出了较强的体外硫化氢释放能力。α-硫辛酸作为硫化氢供体时的硫化氢释放浓度普遍偏低,100μm的实施例17-20仅能达到20μm左右的硫化氢释放;而以去甲茴三硫作为硫化氢供体化合物的硫化氢释放水平最佳。
[0119]
二、对实施例1-20制备的化合物、去甲茴三硫(d4)和13-β榄香醇(d5)进行离体血管舒张活性测试,检测结果见表2。
[0120]
1、实验方法:sd大鼠麻醉后,取胸主动脉血管,将血管置于盛有krebs缓冲液的黑底培养皿中,显微镜下剔除周围脂肪组织,剪取2mm左右血管。开机,调节温度于37℃,在chamber中加入5ml预热的krebs,将血管套上压力传感器的钢丝,通氧气。调节初始预张力保持在9.8mn,期间每20min换一次krebs,稳定1h左右。用高钾溶液刺激10min左右,观察血管张力有明显上升趋势,并趋于稳定状态,说明血管处于收缩状态,随后用缓冲液洗脱,使张力恢复到9.8mn。加入高钾溶液(25mm)刺激血管收缩,并处于稳定收缩状态。加入实施例1-20(设置浓度梯度,累积给药),观察血管张力,读取数据处理。
[0121][0122]
表2:对kcl诱导大鼠离体胸主动脉环收缩的影响(mean
±
sd,n=4)
[0123]
表2-1
[0124][0125][0126]
表2-2
[0127]
i-1018.12
±
9.2325.08
±
9.7938.87
±
7.9651.85
±
7.0261.41
±
7.75i-117.47
±
7.81-8.64
±
41.1514.98
±
17.1713.20
±
18.347.43
±
10.73i-120.64
±
3.112.75
±
4.036.75
±
6.547.93
±
5.6813.00
±
5.68i-134.61
±
2.894.13
±
13.5417.37
±
11.5215.38
±
9.9230.23
±
8.96i-141.20
±
1.414.53
±
2.022.67
±
4.234.19
±
4.426.38
±
4.32i-156.68
±
7.684.72
±
7.220.07
±
10.5710.31
±
3.2212.18
±
11.15i-16-4.54
±
9.521.71
±
2.998.86
±
3.2112.44
±
7.8019.64
±
6.42i-17-3.41
±
6.59-5.69
±
18.596.38
±
2.398.99
±
1.2611.51
±
1.94i-18-5.90
±
13.31-8.16
±
13.912.19
±
13.311.21
±
11.0714.47
±
12.33i-1919.80
±
41.5222.40
±
29.4940.75
±
11.7954.52
±
17.6267.27
±
32.01i-201.10
±
2.692.78
±
6.91-3.60
±
12.565.16
±
13.3614.67
±
10.58d50.09
±
0.434.63
±
1.205.63
±
0.8827.81
±
20.1053.06
±
13.51d43.08
±
5.245.39
±
12.5642.24
±
9.7361.69
±
8.9775.01
±
9.14
[0128]
结合实施例1-20和d4-5并结合表2可以看出,β-榄香烯h2s供体型衍生物均具有不同程度的扩血管活性,且大部分化合物的扩血管活性呈现剂量依赖性。其中i-1,i-7,i-10,i-19活性较好,20μm浓度下即可产生超过50%的血管舒张活性。推测连接链中含有芳基基
17优良的硫化氢释放能力及细胞降脂活性,有利于其发挥细胞氧化损伤保护活性。
[0137]
五、对实施例1-20制备的化合物、去甲茴三硫(d4)、13-β榄香醇(d5)和trolox((d6)分别对正常细胞的细胞毒性进行研究,检测结果见表4和表5。
[0138]
1、实验方法:bmdm原代骨髓巨噬细胞取自6周龄c57雄性小鼠:小鼠脱颈处死后,在75%酒精中浸泡5-10min。在无菌条件下,用眼科剪在腿部开口,剪除去多余皮肤和肌肉,取出股骨和胫骨。置于预冷的pbs中清洗,转移至预热好的培养基中,将股骨和胫骨上残余肌肉去除。用眼科剪将股骨两端剪去,用1ml注射器冲洗骨髓腔,两头各冲洗数次,至骨髓腔变白。收集洗出液,移液枪反复吹打数次,分散细胞。细胞悬液过200目细胞筛,滤去杂质,于离心机上离心5min,1000r/min。离心后用含血清的培养基重悬细胞。细胞计数仪计数,调整细胞密度至5
×
106后,将细胞种于相应的培养皿中。一般一只小鼠铺一块48孔板。细胞生长3-4天后,更换新鲜的培养基继续培养至第6-7天,可开始进行实验。96孔板,周围一圈加pbs,分别设置纯培养基,纯细胞组做对照,三个复孔。每孔200μl。加入实施例24h后加mtt(5mg/mlpbs溶解,每孔20μl),4h后弃去培养基加dmso溶解甲瓒,每孔150μl,摇床10-15min,570nm处测量吸光度。
[0139]
表4:对正常细胞的细胞毒性影响
[0140][0141]
表5:化合物对正常细胞的细胞毒性影响
[0142][0143]
结合实施例1-20和d4-6以及表4可以看出,除i-13,i-15和i-16以外,其他实施例在起效浓度及更高浓度下均不存在明显的巨噬细胞和内皮细胞杀伤作用,具有一定的安全性。推测实施例i-13、i-15及i-16由于醚键链接链的存在,高浓度下难以解离引起毒性,后续化合物设计可考虑尽量避免使用。
[0144]
综上,本发明所提供的化合物与现有技术相比,具有包括以下方面的创造性:采用药物设计策略的拼合原理,通过采用不同的连接链,将四种不同类型的硫化氢供体分子与β-榄香烯的活性代谢产物进行拼合,通过二者协同作用,提升整个药物分子的心血管保护活性;部分实施例具有有效的血管舒张、抗氧化以及细胞降脂等心血管保护作用,可作为抗动脉粥样硬化的先导化合物进一步开展研究。本发明针对β-榄香烯硫化氢供体型衍生物及其可药用盐的制备方法所涉及的研究设计考虑了包括但不限于如下的因素:设计理念、创新性、合成难度、使用成本、安全性等。
[0145]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1