一种人GLI1蛋白Ser937位点磷酸化抗体的制备方法及其应用
一种人gli1蛋白ser937位点磷酸化抗体的制备方法及其应用
技术领域
1.本发明涉及抗体技术领域,具体为一种人gli1蛋白ser937位点磷酸化抗体的制备方法及其应用。
背景技术:
2.hedgehog(hh)信号通路在哺乳动物器官发育、再生和体内平衡中具有重要意义,hh通路的失调被发现是先天性综合征的原因。在脊椎动物中,hh配体包括sonic hh(shh)、indian hh(ihh)和desert hh(dhh),分别在不同的组织器官中差异表达。ihh参与软骨内骨化,dhh的作用局限于卵巢颗粒细胞和睾丸支持细胞等性腺,shh在胚胎发育的各个阶段具有时空表达特性,保持着活跃的状态,但是在成年后的机体中,shh通路的活性显著下降。shh通路的异常表达会导致机体大脑,肺,肾上腺,肢体等器官和组织的发育异常及相关疾病发生。此外,shh信号随后被证明可以在成年组织中调节干细胞的稳态,持续的shh信号激活引发多种肿瘤发生,如皮肤基底细胞癌、肺癌、胰腺癌、前列腺癌、胃癌、结肠癌、食道癌、乳腺癌与肝癌等。研究hh信号的调控将不仅为组织器官的生理过程而且为其病理过程提供新的理论,具有重要的意义。
3.hedgehog信号通路主要由分泌型糖蛋白配体hedgehog、跨膜型蛋白受体patched(ptch)和跨膜g蛋白偶联型受体smoothened(smo)及转录因子gli家族组成。ptch是一种12次跨膜型蛋白,具有结合hh配体及抑制smo受体的双重功能。在配体缺失情况下,ptch与smo结合并抑制其活性,关键转录因子gli在蛋白酶体内被截断,并以羧基端被截断的形式进入细胞核内,抑制下游靶基因的转录。但当hh配体存在时,ptch与hh配体结合,解除对smo的抑制,smo向初级纤毛顶端移位,进一步激活gli转录因子家族,激活下游靶基因cyclin d1、myc、ptch和gli1等的转录,参与细胞的增殖及组织的分化。
4.脊椎动物中gli转录因子包括gli1、gli2和gli3,是hh信号激活或者失活下游靶基因的关键转录因子。当没有shh刺激时,gli2和gli3通过pka、gsk3β和ck1激酶磷酸化以及scf/β-trcp泛素连接酶的有限降解,使得gli2和gli3被翻译后修饰成转录抑制形式而抑制shh信号。当存在shh刺激时,smo通过cos2/kif7和sufu两个抑制性调节分子结合,抑制pka活性而增加gli2和gli3的转录激活形式激活shh信号靶基因转录。gli1既是hh通路的激活因子也是其靶基因,因此gli1的表达水平可反映hh通路的活化程度。在gli1翻译后修饰方面,ampk激酶不仅减少gli1的核定位且磷酸化s102-、s408-和t1074-gli1导致其β-trcp中介的泛素化降解而抑制hh信号。mekk2和mekk3通过磷酸化gli1的s201、s204、s243、s968、t1074和s1078位点影响gli1蛋白稳定性、与sufu的结合能力以及与dna的结合能力而抑制gli1转录活性。mekk1磷酸化gli1多个位点而抑制hh信号活性和髓母细胞瘤增殖。plk1激酶通过磷酸化gli1的s481位点而增加gli1核输出以及与sufu的结合,而抑制hh信号。阐明gli1翻译后修饰的调控机制有助于深入理解hh信号功能。
5.现有的gli1磷酸化抗体虽然可以用于westernblot实验检测正常细胞、肿瘤细胞的表达差异,但尚未有做免疫组化的,也无法为临床肿瘤疾病的诊断或治疗提供潜在的作
用靶点。
技术实现要素:
6.针对上述存在的技术不足,本发明的目的是提供一种人gli1蛋白ser937位点磷酸化抗体的制备方法及其应用,以解决背景技术中提出的问题。
7.为解决上述技术问题,本发明采用如下技术方案:
8.本发明提供一种人gli1蛋白ser937位点磷酸化抗体的制备方法,包括如下步骤:
9.(1)确定人gli1 ser937蛋白磷酸化位点;
10.本发明通过如下方式进行确定:
11.1、通过生物信息学分析筛选人gli1蛋白中可能发生磷酸化位点,锁定了gli1中7个主要符合“sp”排列的ser(s)位点:s70、s569、s686、s885、s927、s937、s968为潜在位点。
12.2、利用点突变试剂盒构建gli1点突变质粒,方案是将这些s位点替换成不能被磷酸化修饰的丙氨酸(a),经测序验证构建成功。
13.3、293t细胞中共转染8
×3’
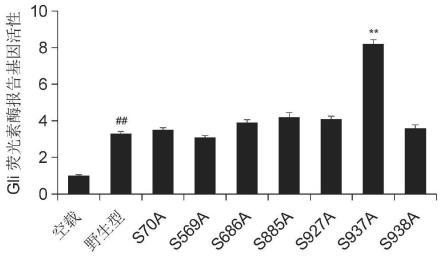
gli-bs-luc荧光素酶报道基因质粒、renilla海肾荧光素酶报道基因质粒,与上述gli1点突变质粒,48h后利用双荧光素酶报告基因检测系统检测gli荧光素酶报告基因活性。结果显示:与野生型相比,s885a和s927a突变体上调报告基因活性约40%,而s937a突变体可以上调260%(如图1所示),最终确定人gli1蛋白特异性磷酸化位点ser937。
14.(2)根据gli1靶点序列及已知的磷酸化位点ser937,设计需要合成的磷酸化及非磷酸化多肽序列;
15.(3)合成氨基酸序列的抗原合成肽,将该多肽与载体蛋白偶联用作抗原;
16.(4)将步骤(3)合成的抗原合成肽免疫动物并收集抗血清;
17.该免疫动物优选新西兰白兔,共免疫6次,前3次免疫2周一次,后3次免疫,1周1次。
18.第一次免疫每兔500μg多肽抗原,之后每次免疫每兔250μg多肽抗原,于第3次免疫一周后采少量血清进行elisa检测,第6次加强免疫一周后放全血得到兔多抗血清。
19.(5)将步骤(4)收集的抗血清进行纯化和鉴定,得到人gli1蛋白ser937位点磷酸化抗体。
20.所述步骤(3)中的磷酸化多肽序列为:paqepsyqp[s937]pkflg-cys。
[0021]
优选地,所述步骤(3)中的合成多肽的方式为固相合成法,并通过hplc条件进行纯化,且纯度》95%。
[0022]
优选地,所述步骤(3)中的载体蛋白为钥孔血蓝蛋白。
[0023]
优选地,所述步骤(5)中的鉴定方式为:通过elisa检测。
[0024]
elisa检测流程如下:
[0025]
①
将抗原(肽)用碳酸盐缓冲液稀释至5μg/ml,向elisa板上的对应孔中添加100μl抗原;4℃孵育过夜;
[0026]
②
弃去液体,洗涤缓冲液冲洗两次;
[0027]
③
每孔加入200μl封闭缓冲液,在室温下孵育2小时;
[0028]
④
弃去封闭缓冲液,用清洗缓冲液清洗平板三次;
[0029]
⑤
添加100μl样品(1:1000、1:4000、1:16000和1:64000,封闭缓冲液稀释)和对照
(免疫前血清1:1000),在室温下孵育30-60分钟;
[0030]
⑥
用清洗缓冲液清洗平板三次;
[0031]
⑦
加入100μl hrp标记的山羊抗兔igg(1:5000,封闭缓冲液稀释),37℃下孵育30分钟;
[0032]
⑧
用清洗缓冲液清洗平板三次;
[0033]
⑨
向每个孔中加入100μl底物,室温下避光孵育60分钟;
[0034]
⑩
添加终止溶液终止显色,并在酶标仪上读板。
[0035]
本发明提供一种人gli1蛋白ser937位点磷酸化抗体的应用,应用于肿瘤、神经系统、呼吸系统疾病的诊断、治疗及预后判定的药物制剂中。
[0036]
本发明的有益效果在于:
[0037]
本发明研究发现人gli1在ser937位点发生磷酸化,本发明提供磷酸化抗体在实际应用中能够检测人gli1蛋白的翻译后磷酸化修饰情况;
[0038]
本发明是针对人gli1蛋白ser937位点磷酸化多克隆抗体,有助于探讨gli1蛋白对hh信号通路的调控作用;
[0039]
本发明提供的磷酸化抗体在实际应用中便于探讨人gli1蛋白特定位点磷酸化修饰与特定生物学事件如细胞命运、增殖与分化,器官发育、组织稳态等的相关性;
[0040]
本发明提供的磷酸化抗体有助于探讨gli1蛋白的磷酸化修饰在肿瘤疾病发生发展过程中的作用机制,为临床肿瘤疾病的诊断与治疗提供潜在的作用靶点;
[0041]
本发明制备得到的高特异性的人gli1蛋白ser937位点磷酸化抗体可用western blot实验检测正常细胞、肿瘤细胞的表达差异,有助于研究gli1蛋白的磷酸化修饰在肿瘤疾病发生发展过程中的作用,为临床肿瘤疾病的诊断或治疗提供潜在的作用靶点。还可以用ihc、elisa免疫学相关实验以检测人gli1蛋白的磷酸化水平,探讨其与肿瘤、神经系统、呼吸系统等疾病的关系,在疾病诊断、治疗及预后判定等方面具有广泛的临床应用前景。
附图说明
[0042]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0043]
图1为本发明实施例提供的gli荧光素酶报告基因活性示意图;
[0044]
图2为本发明实施例提供的合成肽pser937-klh的hplc纯化结果示意图;
[0045]
图3为本发明实施例提供的合成肽pser937-klh的mass spectral检测结果示意图;
[0046]
图4为本发明实施例提供的合成肽gli-klh的hplc纯化结果示意图;
[0047]
图5为本发明实施例提供的合成肽gli-klh的mass spectral检测结果示意图;
[0048]
图6为本发明实施例提供的p-gli1(s937)抗体对磷酸化抗原和非磷酸化抗原的elisa检测数据图;
[0049]
图7为本发明实施例提供的纯化后的ser937位点非磷酸化抗体的elisa检测数据图;
[0050]
图8为本发明实施例提供的敲降gli1后p-gli1(s937)示意图;
[0051]
图9为本发明实施例提供的转染空载、野生型gli1、s937a位点突变gli1质粒后p-gli1(s937)示意图;
[0052]
图10为本发明实施例提供的人shh型髓母细胞瘤组织切片中p-gli1(s937)和gli1免疫组化染色示意图。
具体实施方式
[0053]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0054]
本发明通过生物信息软件筛选人gli1氨基酸序列中可能发生磷酸化的潜在位点,构建对应gli1点突变质粒,荧光素酶报告基因实验筛选gli1有效磷酸化位点,制备特异性磷酸化抗体:p-gli1(s937),体外验证p-gli1(s937)识别gli1磷酸化的特异性与有效性。
[0055]
实施例一:确定人gli1 ser937蛋白磷酸化位点
[0056]
1、通过生物信息学分析筛选人gli1蛋白中可能发生磷酸化位点,锁定了gli1中7个主要符合“sp”排列的ser(s)位点:s70、s569、s686、s885、s927、s937、s968为潜在位点。
[0057]
2、利用点突变试剂盒构建gli1点突变质粒,方案是将这些s位点替换成不能被磷酸化修饰的丙氨酸(a),经测序验证构建成功。
[0058]
3、293t细胞中共转染8
×3’
gli-bs-luc荧光素酶报道基因质粒、renilla海肾荧光素酶报道基因质粒,与上述gli1点突变质粒,48h后利用双荧光素酶报告基因检测系统检测gli荧光素酶报告基因活性。结果显示:与野生型相比,s885a和s927a突变体上调报告基因活性约40%,而s937a突变体可以上调260%(如图1所示),最终确定人gli1蛋白特异性磷酸化位点ser937。
[0059]
实施例二:gli1磷酸化抗体的制备
[0060]
1、根据gli1靶点序列及已知的磷酸化位点ser937,设计需要合成的磷酸化及非磷酸化多肽序列,利用ncbi网站的blastp对该合成肽进行同源性分析,ser937位点合成肽序列与家兔无同源性。
[0061]
paqepsyqp[s937]pkflg-cys
[0062]
paqepsyqspkflg-cys
[0063]
2、制备磷酸化抗体
[0064]
其具体步骤如下:
[0065]
(1)根据设计的序列采用固相合成法合成多肽,用hplc条件进行纯化,并通过lc/ms鉴定,纯度》95%(如图2-图5所示);
[0066]
(2)通过klh载体蛋白偶联得到多肽,作抗原蛋白用;
[0067]
(3)免疫的动物优选新西兰白兔,共免疫6次,于第3次免疫一周后采少量血清进行elisa检测,第6次加强免疫一周后放全血得到兔多抗血清。抗原免疫流程如表1所示:
[0068]
免疫次数免疫周期免疫剂量免疫动物状态第一次免疫1天500μg良好
第二次免疫14天250μg良好第三次免疫28天250μg良好第四次免疫35天250μg良好第五次免疫42天250μg良好第六次免疫49天250μg良好
[0069]
表1
[0070]
(4)通过抗原亲和纯化法进行纯化,得到磷酸化抗体,期间进行elisa效价测定,elisa检测流程如下:
[0071]
①
将抗原(肽)用碳酸盐缓冲液稀释至5μg/ml,向elisa板上的对应孔中添加100μl抗原;4℃孵育过夜;
[0072]
②
弃去液体,洗涤缓冲液冲洗两次;
[0073]
③
每孔加入200μl封闭缓冲液,在室温下孵育2小时;
[0074]
④
弃去封闭缓冲液,用清洗缓冲液清洗平板三次;
[0075]
⑤
添加100μl样品(1:1000、1:4000、1:16000和1:64000,封闭缓冲液稀释)和对照(免疫前血清1:1000),在室温下孵育30-60分钟;
[0076]
⑥
用清洗缓冲液清洗平板三次;
[0077]
⑦
加入100μl hrp标记的山羊抗兔igg(1:5000,封闭缓冲液稀释),37℃下孵育30分钟;
[0078]
⑧
用清洗缓冲液清洗平板三次;
[0079]
⑨
向每个孔中加入100μl底物,室温下避光孵育60分钟;
[0080]
⑩
添加终止溶液终止显色,并在酶标仪上读板。
[0081]
通过elisa验证磷酸化抗体符合标准,磷酸化抗体1:64000稀释至少可检测到100ng的磷酸化多肽,即od值大于0.3,同时磷酸化抗体1:1000稀释针对100ng非磷酸化多肽检测为阴性,即od值小于0.3(如表2,图6、图7所示)。
[0082]
动物id多肽对照(-)1:1ksa1:1ksa1:4ksa1:16ksa1:64k1#兔磷酸化磷酸化抗原0.0590.0572.1361.8951.4210.8142#兔磷酸化磷酸化抗原0.0550.0542.0551.8641.3930.7971#兔磷酸化非磷酸化抗原0.0570.0660.1510.1090.0750.0342#兔磷酸化非磷酸化抗原0.0520.0580.1430.0910.0700.0311#兔非磷酸化非磷酸化抗原0.0580.0572.0271.8241.3510.7722#兔非磷酸化非磷酸化抗原0.0630.0661.9781.7941.2640.753
[0083]
表2
[0084]
实施例三:基于实施例二所述的人gli1蛋白ser937位点磷酸化抗体在细胞及组织内的应用检测
[0085]
1、体外实验证实p-gli1(s937)抗体识别gli1的磷酸化
[0086]
293t细胞感染敲降gli1的慢病毒gli1-shrna,48h后westernblot分别检测gli1与p-gli1(s937)的表达,结果表明:gli1总蛋白被有效降低的同时p-gli1(s937)也相应下降(如图8所示)。293t细胞转染空载、gli1(wt)、gli1(s937a)质粒后,western blot结果显示,相比于转染空载,转染野生型gli1(wt)可增加p-gli1(s937)的表达,而转染gli1(s937a)则
无p-gli1(s937)上升,说明gli1的s937a位点突变后将不再被该抗体识别。当该抗体事先与对应的多肽片段结合后再重新孵育,则完全检测不到p-gli1(s937)条带(如图9所示)。由此可见,p-gli1(s937)磷酸化抗体的特异性和有效性。
[0087]
2、p-gli1(s937)在髓母细胞瘤中的应用
[0088]
利用shh型髓母细胞瘤的组织切片进行p-gli1(s937)和gli1免疫组化染色。结果显示:gli1主要定位于shh型髓母细胞瘤细胞核而细胞质中极少存在,而p-gli1(s937)在细胞核中有明显表达,且多量地存在质中(如图10所示)。
[0089]
本发明提供磷酸化抗体在实际应用中能够应用于ihc、elisa、westernblot等免疫学实验中检测人gli1蛋白的磷酸化修饰情况,从而探讨人gli1蛋白磷酸化修饰在肿瘤相关疾病中的意义。
[0090]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1