鸭呼肠孤病毒单克隆抗体NDRV-σC及其检测试剂盒和应用
鸭呼肠孤病毒单克隆抗体ndrv-σ
c及其检测试剂盒和应用
技术领域
1.本发明涉及单克隆抗体,具体涉及一种鸭呼肠孤病毒单克隆抗体ndrv-σc及其检测试剂盒和应用。
背景技术:
2.某地雏番鸭和半番鸭等发生了以肝脏和脾脏不规则出血和坏死等为主要特征的新型鸭病毒病,经鉴定,该病病原为新型鸭呼肠孤病毒,属于基因ii型鸭呼肠孤病毒(duck reovirus,drv)。随后该病毒也陆续从鹅、番鸭、樱桃谷鸭和麻鸭等水禽中分离到,比基因ⅰ型鸭呼肠孤病毒mdrv(muscovey duck reovirus,mdrv)宿主范围更为广泛。目前,基因ii型(ndrv)已成为流行的优势基因型,其特征性病变为肝脾出现严重的坏死和出血(俗称“出血性坏死性肝炎”或“脾出血坏死症”)。
3.ndrv基因组由10个节段的双链rna构成,全长23419bp。病毒粒子由二十面体对称的双层衣壳组成,直径70nm、无囊膜。依据sds-page电泳结果均可将基因组分为3个群,分别是:l组群(l1,l2,l3),m组群(m1,m2,m3)和s组群(s1,s2,s3, s4)。ndrv的σc蛋白是由s1基因编码的一种结构蛋白,构成病毒的外衣壳,由326个氨基酸所组成,大小约为35kda,其氨基酸序列较为保守。研究认为σc蛋白是以同源三聚体的形式发挥作用和功能,具有结合病毒特异性受体作用,介导该病毒入侵细胞,并且该蛋白具有特异性中和反应所需的表面抗原,可以诱导机体产生针对病毒的特异性抗体。
4.目前,ndrv的主要检测方法有病毒分离、rt-pcr、病毒中和试验(vnt)和间接elisa等。其中elisa方法对于抗原和抗体均可检测,且该方法具有操作简单、快速、易批量化、以及灵敏性高和特异性强等优点,已成为病原流行病学抗体检测的首选方法。现有研究表明,各品种的鸭及鹅均可被ndrv感染及致病,而目前又没有一种商品化的广谱通用型血清二抗,这给ndrv病的血清学诊断带来诸多不便。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供了一种鸭呼肠孤病毒单克隆抗体ndrv-σc及其检测试剂盒和应用。本发明基于 ndrvσc蛋白具有良好的抗原性,可以诱导机体产生针对该病毒的特异性抗体的特点;利用原核表达的重组σc蛋白作为免疫原制备了针对ndrvσc蛋白的特异性单克隆抗体(mab),可用于特异性检测ndrv的试剂盒。
6.为实现上述目的,本发明所设计一种鸭呼肠孤病毒单克隆抗体 ndrv-σc,它是由保藏编号为cctcc no:c2022276的杂交瘤细胞株ndrv-mab-7c6所分泌得到。
7.分泌上述鸭呼肠孤病毒单克隆抗体ndrv-σc的杂交瘤细胞株ndrv-mab-7c6,其保藏编号为cctcc no:c2022276。
8.将上述杂交瘤细胞株ndrv-mab-7c6于2022年9月5日送交至中国.武汉.武汉大学中国典型培养物保藏中心进行保藏,其 cctcc no:c2022276。
9.本发明还提供了一种上述鸭呼肠孤病毒单克隆抗体ndrv-σc 在制备检测鸭呼肠
孤病毒中的应用。
10.本发明还提供了一种用于鸭呼肠孤病毒抗体阻断elisa检测的试剂盒,其特征在于:所述试剂盒包括上述的鸭呼肠孤病毒单克隆抗体ndrv-σc。
11.进一步地,所述试剂盒还包括鸭呼肠孤病毒σc蛋白、封闭液、 tmd底物显色液和显色终止液。
12.上述可以使用现有技术中elisa检测时常用的成分。比如,封闭液可以使用一定浓度的bsa蛋白、脱脂奶粉或者明胶等。显色终止液可以使用一定浓度的硫酸溶液。
13.本发明还提供了一种上述试剂盒的检测方法,包括以下步骤:
14.(1)包被:将纯化的ndrvσc蛋白(实施例1制备)用碳酸盐包被缓冲液稀释至一定的浓度,每孔100μl包被于96孔酶标板中,置于4℃孵育过夜。
15.(2)洗涤:将包被好的板用pbst洗3次,每次3min,最后一次拍干。
16.(3)封闭:加入1%的bsa,每孔200μl,37℃封闭2h。
17.(4)洗涤:洗涤方式同(2)。
18.(5)被检血清样品:将被检血清、阳性血清和阴性血清用pbs 进行一定浓度的稀释,每孔100μl,37℃作用1h。
19.(6)洗涤:洗涤方式同(2)。
20.(7)单克隆抗体:将单克隆抗体(实施例1制备)进行稀释后加入酶标板中,每孔100μl,37℃作用1h。
21.(8)洗涤:洗涤方式同(2)。
22.(9)酶标二抗:将羊抗鼠hrp-igg进行稀释后加入酶标板中,每孔100μl,37℃作用1h。
23.(10)显色:加入tmb显色液,每孔100μl,37℃避光作用8min。
24.(11)终止反应:加入2m h2so4终止液,每孔50μl,终止反应。
25.(12)读数:终止反应后,在酶标仪中测定od
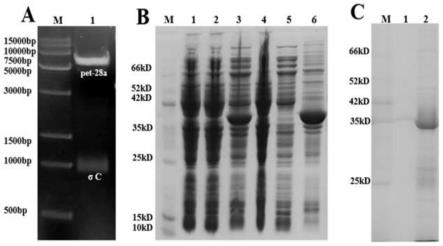
450nm
的值。
26.本发明还提供了一种上述鸭呼肠孤病毒单克隆抗体ndrv-σc 或者上述试剂盒在鸭群临床血清学监测中的应用
27.本发明还提供了一种上述鸭呼肠孤病毒单克隆抗体ndrv-σc 或者上述试剂盒在用于禽类接种鸭呼肠孤病毒疫苗后的免疫状况评估中的应用。
28.本发明的有益效果:
29.1.本发明采用原核表达系统表达和纯化了鸭呼肠孤病毒σc蛋白,该蛋白主要以包涵体的形式存在,纯化效果良好。
30.2.本发明经间接elisa筛选到的单克隆抗体7c6,具有很强的特异性和很高的效价,效价可达28。
31.3.本发明使用单克隆抗体7c6作为阻断抗体建立了阻断elisa 抗体检测的方法,该方法能特异性地识别ndrv阳性血清,而与其它鸭常见病抗体阳性血清无交叉反应,具有良好的特异性。
附图说明
32.图1为重组原核表达载体的酶切鉴定、重组蛋白的表达和纯化图;
33.图中,a,m:dna marker;1:pet28a-ndrv σc ecorⅰ和 hindⅲ双酶切;
34.b,m:蛋白marker;1-2:pet-28a空载;3:诱导后菌液;4:诱导前菌液;5:诱导后上清;6:诱导后沉淀;
35.c,m:蛋白marker;1:阴性对照;2:纯化后的ndrvσc蛋白;
36.图2为二免两周后小鼠血清抗体水平检测图;
37.图3为7c6株单抗wb检测图;
38.图4为7c6株单抗ifa检测图;
39.图5为特异性检验图;
40.图6为敏感性检验图;
具体实施方式
41.下面结合具体实施例对本发明作进一步的详细描述,以便本领域技术人员理解。
42.实施例1 杂交瘤细胞株ndrv-mab-7c6的制备
43.1.毒株、细胞、血清和实验动物
44.毒株:鸭呼肠孤病毒ndrv-yl(genbank number:mz733722) 毒株由胡薛英老师馈赠,本实验室保存。
45.细胞:非洲绿猴肾细胞(vero-ccl)由本实验室保存。
46.菌株:质粒构建所用的大肠杆菌rosetta(de3)由本实验室保存,trans t1感受态细胞购于transgen biotech公司。
47.质粒载体:peasy-blunt克隆载体购于transgen biotech公司,原核表达载体pet28a(+)由本实验室保存。
48.实验动物:5~6周龄balb/c雌性实验小鼠购自湖北省实验动物研究中心。
49.2.重组质粒pet-28a-ndrvσc的构建、蛋白表达及纯化
50.根据ndrv yl株的s1基因序列(genbank number: mz733722),利用oligo 6.0软件,以σc基因的orf为目标区设计了一对引物,引物由擎科生物公司合成。其序列如下:
51.ndrvσc-f:5
’‑
atggatcgcaacgaggtgatac-3’;
52.ndrvσc-r:5
’‑
ctagcccgtggcgacggt-3’。
53.经rt-pcr扩增获得σc目的片段,将pet-28a(+)载体用 ecorⅰ和hindⅲ双酶切后,进行胶回收。使用t4 dna ligase将载体和σc片段体外连接,得到重组质粒。选取酶切鉴定阳性的重组质粒送武汉擎科生物公司测序验证,鉴定正确的重组质粒命名为 pet-28a-ndrvσc(图1a)。
54.将重组质粒pet-28a-ndrvσc转入宿主菌e.coli rosetta(de3) 中,经37℃0.5mm iptg诱导5h,超声裂解细菌收集上清及沉淀后分别进行sds-page检测。结果表明,表达的σc蛋白主要以包涵体的形式存在于细胞沉淀中,大小约为35kda,大小与预期相符 (图1b)。通过透析法纯化后的σc蛋白纯度高,电泳显示条带单一 (图1c)。
55.3.动物免疫
56.选取四至六周龄的健康雌性balb/c小鼠,采用皮下多点注射的方式进行免疫,免疫体积为0.5ml/点。根据纯化后σc蛋白浓度和最终免疫剂量,取适量蛋白与等体积的弗氏完全佐剂进行乳化,随后通过皮下注射进行首免。取适量蛋白与等体积的弗氏不完全佐剂
混匀进行乳化,随后进行二免,两周后,断尾采血,分离血清。利用间接elisa方法检测血清抗体效价(图2),选取血清抗体水平相对较高的2号小鼠进行后续的杂交瘤制备实验。
57.4.阳性杂交瘤细胞株的建立
58.按常规方法制备小鼠腹腔巨噬细胞作为饲养层细胞,脾细胞与骨髓瘤细胞(sp2/0)按5∶1的比例在融合剂peg4000作用下融合,经间接elisa筛选抗体分泌阳性的杂交瘤细胞,按有限稀释法进行克隆。最终得到了一株能稳定分泌ndrvσc单克隆抗体的杂交瘤细胞7c6。
59.将上述制备得到的杂交瘤细胞株ndrv-mab-7c6于2022年9 月5日送交至中国.武汉.武汉大学中国典型培养物保藏中心进行保藏,其cctcc no:c2022276。
60.实施例2
61.由杂交瘤细胞株ndrv-mab-7c6制备鸭呼肠孤病毒单克隆抗体ndrvσc的方法,包括以下步骤:
62.将0.5ml灭菌的石蜡油注射小鼠腹腔,一周后再注入106个杂交瘤细胞ndrv-mab-7c6,7-10天后,小鼠腹部的腹水极度膨胀时抽取腹水,该腹水中含有大量单克隆抗体ndrvσc,分装备用。
63.上述鸭呼肠孤病毒单克隆抗体ndrvσc的测定:
64.1.单克隆抗体ndrvσc效价测定
65.运用间接elisa方法对腹水中ndrvσc抗体效价进行测定, 7c6株效价可达到1:108。
66.2.单克隆抗体的ifa与wb鉴定
67.vero细胞接种到6cm细胞培养皿中,待细胞长至80%~90%时,接毒ndrv yl,当刚出现明显病变时收样,用2
×
lba裂解液处理细胞。通过western blot检测ndrvσc蛋白单抗特异性。结果显示,获得的杂交瘤细胞株7c6分泌的mab能够与ndrv yl全病毒发生反应,在约34kda处出现特异性条带(图3),而与未接ndrv 的vero细胞呈阴性反应。结果表明制备的mab能够特异识别天然 ndrv的σc蛋白。。
68.vero细胞接种24孔板,细胞长至80%~90%时,接毒ndrv yl 进行ifa检测(图4)。结果显示,制备的mab与ndrv呈阳性反应,产生绿色荧光;而阴性对照组无荧光(图3),表明制备的mab 具有较强的特异性。
69.实施例3
70.利用上述鸭呼肠孤病毒单克隆抗体ndrvσc优化抗体检测方法的条件
71.(1)蛋白包被浓度和单克隆抗体浓度的最优条件
72.将抗原浓度与血清稀释度分别倍比稀释,通过方阵滴定确定最佳浓度。将ndrvσc蛋白稀释为1μg/ml、0.5μg/ml、0.25μg/ml、 0.125μg/ml、0.0625μg/ml共5个浓度梯度,同时,将单克隆抗体稀释为2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml、0.125μg/ml 共5个浓度梯度。
73.方阵滴定结果显示,当ndrvσc蛋白浓度为0.25μg/ml,单抗浓度为0.25μg/ml,pi值最大(表1),因此,最佳蛋白包被浓度为0.25μg/ml,最佳单抗浓度为0.25μg/ml。
74.表1 方阵滴定法确定最佳蛋白与单抗浓度
[0075][0076]
(2)最佳血清稀释度的确定
[0077]
将ndrv抗体阳性血清和阴性血清以1∶1、1∶2、1∶4、1∶8、1∶16进行稀释,计算在各血清稀释度下的pi值。结果显示,当血清稀释度为1∶4时,pi值最大(表2)最佳血清稀释度为1∶ 4。
[0078]
表2 最佳血清稀释度的确定
[0079][0080]
(3)最佳抗原包被时间的确定
[0081]
为了确定最佳的抗原包被时间,将ndrvσc蛋白分别包被8h, 12h,16h。结果显示,ndrvσc蛋白包被12h后,pi值达到最大 (表3)。因此,最佳抗原包被时间为12h。
[0082]
表3 最佳抗原包被时间的确定
[0083][0084]
(4)最佳bsa浓度及封闭时间的确定
[0085]
将bsa稀释为1%,3%,5%,3个浓度,分别封闭1h,1.5h, 2h。通过方正滴定法,计算各条件下的pi值。结果显示,当bsa 浓度为1%,封闭时间为1.5h时,pi值最大(表4)。因此,最佳 bsa浓度为1%,最佳封闭时间为1.5h。
[0086]
表4 最佳bsa浓度和封闭时间的确定
[0087][0088]
(5)最佳血清孵育时间的确定
[0089]
将ndrv抗体阳性血清和阴性血清孵育1h,1.5h,2h,计算各孵育时间的pi值。结果显示,当血清孵育时间为1.5h时,pi值最大(表5)。因此,血清最佳孵育时间为1.5h。
[0090]
表5 最佳血清孵育时间的确定
[0091][0092]
(6)最佳单抗孵育时间的确定
[0093]
将ndrvσc单克隆抗体孵育1h,1.5h,2h,计算各孵育时间的pi值。结果显示,当单抗孵育时间为1h时,pi值最大(表6)。因此,单抗的最佳孵育时间为1h。
[0094]
表6 最佳单抗孵育时间的确定
[0095][0096]
(7)最佳酶标二抗稀释度及孵育时间的确定
[0097]
采用方阵滴定的方式,酶标二抗反应时间分别设置为1h、1.5h、 2h,酶标二抗稀释度分别设置为1:2000,1:3000,1:5000。结果显示,酶标二抗反应时间为1h,酶标二抗稀释度1:5000时, pi值最大(表7)。
[0098]
因此,最佳酶标二抗的稀释度为1:5000,最佳孵育时间为1h。
[0099]
表7 最佳酶标二抗浓度与孵育时间的确定
[0100][0101]
(8)最佳底物反应时间的确定
[0102]
底物反应时间分别设置为6min、8min、10min、12min。结果显示,pi值最大时的底物反应时间为8min,即为最佳底物反应时间(表8)。
[0103]
表8 最佳底物反应时间的确定
[0104][0105]
(9)阴阳临界值的确定
[0106]
为确定方法的阴阳临界值,检测已确定为阴性的50份鸭血清,通过计算其平均pi值与标准差,确定阴阳临界值。结果显示,平均pi值为-0.5%,标准差为5.1%,阴阳临界值=平均pi值+3
×
标准差=14.8%。
[0107]
(10)特异性检验
[0108]
为了确定阻断elisa检测方法是否特异性识别新型鸭呼肠孤病毒抗体,检测了七种鸭中其它病毒阳性血清。结果显示,其它病毒阳性血清的阻断率均明显低于阴阳临界值,判断为阴性(图5),因此该方法不与其它病毒阳性血清产生交叉反应,具有良好的特异性。
[0109]
(11)敏感性检验
[0110]
通过将阴阳性血清从1:10开始进行倍比稀释,测得每个稀释度下的pi值,完成对阻断elisa方法的敏感性检验。结果显示,当血清稀释至1:640,仍为阳性,当血清稀释至1:1280时,为阴性,因此,该方法的对血清的检测限度可达到1:640(图6)。
[0111]
(12)批间、批内重复性检验
[0112]
为了确认所建立的阻断elisa的方法具有可重复性,选取已知的阳性和阴性血清进行检测。最终检测数据显示,批内变异系数为2.5%~9.9%,批间变异系数为2.7%~4.3%,批间批内实验结果显示,该方法具有良好的重复性(表9)。
[0113]
表9 重复性检验
[0114][0115]
由上可知:用于鸭呼肠孤病毒抗体阻断elisa检测的试剂盒,其特征在于:所述试剂盒包括鸭呼肠孤病毒单克隆抗体ndrv-σc、鸭呼肠孤病毒σc蛋白(ndrvσc蛋白)、封闭液、tmd底物显色液和显色终止液。
[0116]
鸭呼肠孤病毒阻断elisa抗体检测方法的建立:
[0117]
1.细胞、质粒、血清及主要试剂:
[0118]
质粒pet-28a-ndrvσc(实施例1中构建)、分泌ndrvσc蛋白单隆抗体的杂交瘤细胞株7c6(实施例1中制备)。ndrv抗体标准阴、阳性血清由本实验室制备,ndrv临床血清样品由本实验室收集。鸭坦布苏病毒(dtmuv)、鸭瘟病毒(dpv)、鸭新城疫 (ndv)、番鸭细小病毒(mpv)、鸭病毒性肝炎(dhav)、鸭呼肠孤病毒(drv)、禽流感病毒(h9n2)等阳性血清由上海兽医研究所馈赠。
[0119]
上述用于鸭呼肠孤病毒抗体阻断elisa检测的试剂盒的阻断 elisa方法,包括以下步骤:
[0120]
(1)包被:将纯化的ndrvσc蛋白(实施例1制备)用碳酸盐包被缓冲液稀释至一定的浓度,每孔100μl包被于96孔酶标板中,置于4℃孵育过夜。
[0121]
(2)洗涤:将包被好的板用pbst洗3次,每次3min,最后一次拍干。
[0122]
(3)封闭:加入1%的bsa,每孔200μl,37℃封闭2h。
[0123]
(4)洗涤:洗涤方式同(2)。
[0124]
(5)被检血清样品:将被检血清、阳性血清和阴性血清用pbs 进行一定浓度的稀释,每孔100μl,37℃作用1h。
[0125]
(6)洗涤:洗涤方式同(2)。
[0126]
(7)单克隆抗体:将单克隆抗体(实施例1制备)进行稀释后加入酶标板中,每孔100μl,37℃作用1h。
[0127]
(8)洗涤:洗涤方式同(2)。
[0128]
(9)酶标二抗:将羊抗鼠hrp-igg进行稀释后加入酶标板中,每孔100μl,37℃作用1h。
[0129]
(10)显色:加入tmb显色液,每孔100μl,37℃避光作用8min。
[0130]
(11)终止反应:加入2m h2so4终止液,每孔50μl,终止反应。
[0131]
(12)读数:终止反应后,在酶标仪中测定od
450nm
的值。
[0132]
实施例4
[0133]
对实验室收集的297份鸭血清临床样品用所建立的阻断elisa 方法进行检测,并
将检测结果与ifa检测结果相比较,进而完成对该方法的符合率检验。结果显示,阻断elisa与ifa符合率为 95.62%(表10)。
[0134]
表10 符合率检验
[0135][0136]
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1