一种酶法制备L-抗坏血酸脂肪酸酯的方法及其产品
一种酶法制备l-抗坏血酸脂肪酸酯的方法及其产品
技术领域
1.本发明属于油脂改性,脂质深加工领域,具体涉及一种利用脂肪酶微阵列催化合成l-抗坏血酸脂肪酸酯的方法及其产品。
背景技术:
2.l-抗坏血酸棕榈酸酯(l-ap)是一种高效的脂溶性抗氧化剂,被世界卫生组织认定为安全的食品添加剂,是中国婴儿食品中唯一允许的抗氧化剂。但l-ap的熔点较高,溶解度差,其在脂溶性产品中易结晶析出,导致油中添加量和应用范围受限。将不饱和脂肪酸通过酯化l-抗坏血酸结合,制备l抗坏血酸不饱和脂肪酸酯,可降低熔点,提高脂溶性,拓展应用领域,提高功能活性。
3.目前,普遍使用化学法合成l-抗坏血酸脂肪酸酯,该方法存在能耗高、污染大、腐蚀设备,副产物多,分离难等缺点。cn 102260231a公开了一种利用浓硫酸作为催化剂制备了抗坏血酸棕榈酸酯的生产方法,但该方法存在产物和催化剂分离步骤繁琐,产生的大量酸性废水,不符合环保和可持续的要求。相比之下,酶法合成因其反应条件温和、选择性高、副产物少而备受关注。一般来说,游离脂肪酶活性低、稳定性差、难以重复使用,而固定化脂肪酶在恶劣环境中表现出更好的稳定性和催化活性。常用于催化的固定化脂肪酶为商品化酶,如novozym 435,rmim,tlim等,这些酶价格昂贵,树脂载体在有机溶剂中易溶胀,限制酶的重复使用。cn 103667384a公开了一种酶法合成抗坏血酸棕榈酸酯的方法,但是该方法使用含2-甲基四氢呋喃的混合溶剂,这种中等毒性的机溶剂不适合应用在食品添加剂制备。
技术实现要素:
4.本发明所要解决的技术问题是针对上述现有技术存在的不足而提供一种酶法制备l-抗坏血酸脂肪酸酯的方法,具有催化效率高、产物脂溶性和抗氧化性强、操作简单、绿色环保,产物分离简便、适合规模放大生产等优点。
5.本发明为解决上述提出的问题所采用的技术方案为:
6.一种酶法制备l-抗坏血酸脂肪酸酯的方法及其产品,包括以下步骤:
7.(1)将游离酶溶于pbs缓冲液中通过多重吸附法固定在微阵列载体上,冷冻干燥,即得到脂肪酶微阵列,固载量介于100~300mg/g,活力为80~180u/g;所述微阵列载体为疏水介孔硅;
8.(2)将l-抗坏血酸、脂肪酸加入反应溶剂中,恒温下搅拌一定时间以溶解l-抗坏血酸,然后加入步骤(1)所得脂肪酶微阵列,搅拌一段时间进行酯化反应,得到l-抗坏血酸脂肪酸酯粗产品;其中,在反应过程中持续通入干燥氮气,结合真空不断带走反应产生的水;
9.(3)将步骤(2)所得l-抗坏血酸脂肪酸酯粗产品进行分离纯化,先抽滤除去固定化脂肪酶和分子筛,减压蒸馏回收反应溶剂,再用纯水洗涤除去未反应的l-抗坏血酸,利用溶剂萃取结晶得到粗产物l-抗坏血酸脂肪酸酯;最后粗产物l-抗坏血酸脂肪酸酯用柱层析纯化,接着通过旋转蒸发除去溶剂后,获得纯净的l抗坏血酸脂肪酸酯。
10.按上述方案,步骤(1)中,所述的疏水介孔硅为单分散、颗粒均匀的六方体,每个颗粒的平均对角线长8~10μm,比表面积为150~300m2/g,厚度为2~3μm,介孔空腔尺寸为15~25nm,介孔的窗口尺寸为10~17nm,接触角介于105
°
~150
°
。
11.按上述方案,所述微阵列载体的制备方法如下:在hcl溶液中,加入模板剂、扩孔剂剧烈搅拌1~3h,随后加入疏水硅烷和四乙氧基硅烷(teos)的混合物,搅拌均匀后低温静置18~30h,得到混合液;然后,将该混合液转移到水热釜中140~160℃陈化18~30h,过滤出固体产物,乙醇洗涤,干燥,得到干燥的粉体;最后,将干燥的粉末放入酸性乙醇水溶液中,50~70℃搅拌去除致孔剂和扩孔剂,得到疏水介孔硅,即为微阵列载体。
12.进一步地,模板剂为嵌段式聚醚f-127、嵌段共聚物p123、聚乙二醇peg、聚氧乙烯peo等中的一种或几种;扩孔剂为均三甲苯、司班80、癸烷、十二烷等中的一种或几种;疏水硅烷为乙基三氯硅烷、丁基三氯硅烷、辛基三氯硅烷、聚甲基氢硅氧烷、丁基三乙氧基硅烷、辛基三乙氧基硅烷、十二烷基三乙氧基硅烷、十八烷基三乙氧基硅烷等中的一种或几种。
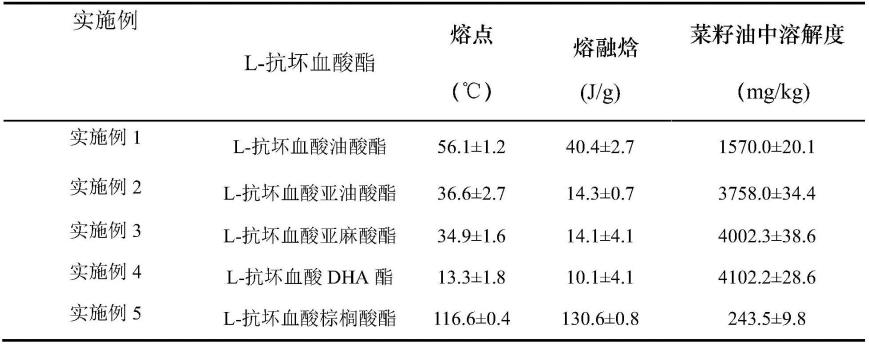
13.进一步地,hcl溶液的浓度为0.5-1.5m,模板剂、扩孔剂在hcl溶液的添加量均为0.01~0.05g/ml;疏水硅烷和teos在hcl溶液中的总添加量为100~400mmol/l,疏水硅烷与teos的摩尔比为1:3~1:10。
14.按上述方案,步骤(1)中,所述的游离酶为皱褶假丝酵母脂肪酶(crl)、南极假丝酵母脂肪酶(calb)、ns40086脂肪酶、疏棉状嗜热丝孢菌(tll)、解脂假丝酵母脂肪酶(cll)等中的一种或多种。
15.按上述方案,步骤(1)中,pbs缓冲液(50mm)ph为6.0~8.0,酶的固定化温度为10~40℃,时间为10~60min;酶液蛋白含量1.5~9.0mg/ml,载体:酶溶液=1:20~1:60(w/v,g/ml)。
16.按上述方案,步骤(2)中,所述的脂肪酸选自亚麻酸、神经酸、油酸、亚油酸、dha,epa、ara、月桂酸、棕榈酸、硬脂酸等中的一种或几种,来源于亚麻籽油、紫苏油、火麻油、月见草油、牡丹籽油、葵花籽油、大豆油、菜籽油、共轭亚油酸甘油酯、藻油、鱼油、蒜头果油、文冠果油等。
17.按上述方案,步骤(2)中,所述的反应溶剂为乙腈、丙酮、叔丁醇、叔戊醇、二甲基亚砜等中的一种或几种。
18.按上述方案,步骤(2)中,l-抗坏血酸和脂肪酸的摩尔比为1:1~1:9,l-抗坏血酸和脂肪酶微阵列在反应溶剂中的浓度分别为0.04~0.2mol/l、4~20g/l。
19.按上述方案,步骤(2)中,酯化反应的温度为50~80℃,时间为4~10h,转化率大于70%。酯化反应过程中,反应釜配备减压回流除水装置,将干燥氮气通入反应体系中,同时抽真空以带走反应产生的水,通气流量为20~100m3/h,真空度为1000~5000pa。
20.按上述方案,步骤(3)中,抽滤分离出的固定化脂肪酶经过溶剂清洗之后,冷冻干燥,可以重复使用;萃取结晶采用的有机溶剂为正己烷、氯仿等。
21.按上述方案,步骤(3)所得纯净的l抗坏血酸脂肪酸酯的含量大于95%,熔点介于-13.3~116.6℃之间,熔融焓在10.1~130.6j/g之间,食用油中溶解度介于243.5~4102.2mg/kg之间。
22.与现有技术相比,本发明的有益效果是:
23.1.本发明制备的l-抗坏血酸不饱和脂肪酸脂具有比市售的l-抗坏血酸棕榈酸脂
(l-ap)更低的熔点和更好的脂溶解性,且抗氧化性与l-ap相当,可显著拓展l抗坏血酸脂肪酸酯在食品和日化等领域的应用范围。
24.2.本发明广适于催化不同结构的脂肪酸与l-抗坏血酸的酯化反应,制备l-抗坏血酸油酸酯、亚油酸酯、亚麻酸酯、dha酯、ara酯和神经酸酯等不同结构的l-抗坏血酸脂肪酸酯,可满足不同人群和应用场景的需求。
25.3.本发明一步合成具有疏水和介孔结构的微阵列载体,避免烦琐的疏水后修饰步骤和大量甲苯等有机溶剂的使用,且孔径和疏水性可控;脂肪酶在该载体固定化后的活性和稳定性高于游离酶和商品酶;并且,该载体的笼状结构有利于脂肪酶的进入,而较小的窗口防止酶在使用过程中的泄露,有利于反应物在体系中的高效传质从而提高酶催化效率。
26.4.本发明整个过程反应条件温和,反应时间较短,相比传统化学催化方法不使用强酸性化学催化剂,不产生大量含酸废水,有效的节约生产成本减少环境污染;另外,酶微阵列可再生多次重复使用,具有较强的工业化应用前景。
附图说明
27.图1为酶法合成l-抗坏血酸脂肪酸酯示意图。
28.图2为实施例1的疏水介孔二氧化硅载体的扫描电镜图(a),透射电镜图(b),氮气等温吸脱附图(c)和孔径分布图(d)。
29.图3为对照例普通介孔二氧化硅载体(b)和实施例5中疏水介孔二氧化硅载体(a)的接触角。
30.图4为酶法合成3种l-抗坏血酸脂肪酸酯的质谱图。
31.图5为脂肪酶微阵列合成3种l-抗坏血酸脂肪酸酯的重复使用效果。
具体实施方式
32.为了更好地理解本发明,下面结合具体实施例进一步阐明本发明的内容,但本发明不仅仅局限于下面的实施例。
33.下述实施例中,疏水微阵列载体的制备过程如下:将0.05g/ml嵌段式聚醚f-127溶解于1l 1.0m的hcl溶液中,然后向溶液中加入0.05g/ml的1,3,5-三甲苯剧烈搅拌2h,得到混合液a。之后,向上述混合液a中缓慢加入100mmol辛基三甲氧基硅烷(c8)和300mmol四乙氧基硅烷(teos)的混合物,继续搅拌15min后静置24h,得到混合物b。然后将混合物b转移到水热釜中,在150℃下陈化24h,待反应釜完全冷却后,将反应釜中的混合物取出过滤,乙醇洗涤,干燥。最后将干燥的粉末放入酸性乙醇水溶液(hcl:乙醇:水=10:20:70(v/v/v))中,60℃搅拌去除致孔剂和扩孔剂,即可制备具有疏介孔结构sio2载体,即疏水微阵列载体(omms-c8),如图2所示,为单分散、颗粒均匀的六方体,粒径8~10μm,厚度为2~3μm;通过图2氮气吸脱附等温线和孔径分布数据可以计算出,介孔空腔尺寸为15~25nm,介孔的窗口尺寸为10~17nm,经测定比表面积约为200~300m2/g;如图3所示,接触角为110
°
。
34.下述实施例中,l-抗坏血酸脂肪酸酯的含量通过液相检测,检测条件如下:色谱柱为venusil xbp silica 5um 4.6
×
250mm。pda检测器,进样量10μl,柱温35℃;流动相乙腈/0.05%乙酸水(70:30,v:v),等度洗脱,流速为1ml/min,检测波长为254nm;
35.l-抗坏血酸脂肪酸酯结构测定,高分辨质谱:thermo scientific q exactive,
esi离子源,负模式,质谱条件如下:毛细管电压设置为3.2kv。鞘气和干燥气的温度分别调整为350℃和150℃。鞘气和干燥气的氮气流量分别为12l/min和15l/min。
36.l-抗坏血酸脂肪酸酯熔点、脂溶性和抗氧化性的测定分别采用差示扫描量热法(dsc)、平衡溶解度法、氧化诱导时间测定法。
37.实施例1
38.一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
39.(1)疏水酶微阵列的制备:在100ml 9mg/ml的calb酶液(溶解在0.1mol/ml,ph 7.0pbs中)中加入2g omms-c8,10℃下220rpm摇床中混合60min,离心后的沉淀置于冷冻干燥机中冻干即为酶微阵列calb@omms-c8,固载量为300mg/g,活力为180u/g;
40.(2)l-抗坏血酸脂肪酸酯的酶法制备:将0.02mol l-抗坏血酸、0.18mol的油酸,加入到100ml有机溶剂叔丁醇中,置于70℃磁力搅拌器中搅拌20min,随后加入1.0gcl@omms-c8,再置于70℃磁力搅拌器中搅拌,同时向反应体系中不断通入干燥氮气20m3/h,同时抽真空1000~5000pa带走反应产生的水。4h后取出进行hplc含量测定,l-抗坏血酸油酸酯转化率为80.5%;
41.(3)分离纯化:将步骤(2)所得产物先抽滤除去酶和分子筛,减压蒸馏回收反应溶剂;用纯水洗涤多次除去未反应的l-抗坏血酸;利用正己烷萃取结晶得到粗产物l-抗坏血酸脂肪酸酯;接着用乙酸乙酯:石油醚(1:1,v:v)作为洗脱液硅胶柱纯化,最后通过旋转蒸发除去溶剂后获得最终产物。经测定产物纯度为l-抗坏血酸油酸酯97.2%。
42.对照例
43.实施例1相比,在制备过程中不添加疏水硅烷,制备亲水的介孔sio2载体(omms),用同样固定化方法得到亲水脂肪酶微阵列calb@omms,固载量为40mg/g,活力为30u/g,催化l-抗坏血酸油酸酯转化率为20.6%,较实施例1中的疏水脂肪酶微阵列,固载量和催化效率显著降低。
44.实施例2
45.一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
46.(1)疏水酶微阵列的制备:在100ml 6mg/ml的calb酶液(溶解在0.1mol/ml,ph 7.0pbs中)中加入2g omms-c8,20℃下220rpm摇床中混合50min,离心后的沉淀置于冷冻干燥机中冻干即为脂肪酶微阵列calb@omms-c8,固载量为230mg/g,活力为100u/g;
47.(2)l-抗坏血酸脂肪酸酯的酶法制备:将0.02mol l-抗坏血酸、0.10mol的亚油酸,加入到100ml有机溶剂叔丁醇中,置于70℃磁力搅拌器中搅拌20min,随后取出加入0.8gcalb@omms-c8,再置于70℃磁力搅拌器中搅拌,同时向反应体系中不断通入干燥氮气100m3/h,带走反应产生的水。4h后取出进行hplc含量测定,l-抗坏血酸亚油酸酯转化率为85.1%;
48.(3)分离纯化:同实施例1,l-抗坏血酸亚油酸酯纯度为96.2%。
49.实施例3
50.一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
51.(1)在100ml 9mg/ml的calb酶液(溶解在0.1mol/ml,ph 7.0pbs中)中加入2g omms-c8,20℃下220rpm摇床中混合50min,离心后的沉淀置于冷冻干燥机中冻干即为脂肪酶微阵列calb@omms-c8,固载量为220mg/g,活力为160u/g;
52.(2)l-抗坏血酸脂肪酸酯的酶法制备:将0.02mol l-抗坏血酸、0.10mol的亚麻酸,加入到100ml有机溶剂叔丁醇中,置于70℃磁力搅拌器中搅拌20min,随后取出加入2.0gcalb@omms-c
p
,再置于70℃磁力搅拌器中搅拌,同时向反应体系中不断通入干燥氮气60m3/h,带走反应产生的水。4h后取出进行hplc含量测定,l-抗坏血酸亚麻酸酯转化率为86.8%;
53.(3)分离纯化:同实施例1,l-抗坏血酸亚麻酸酯纯度为96.2%。
54.实施例4
55.一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
56.(1)疏水酶微阵列的制备:在100ml 9mg/ml的calb酶液(溶解在0.1mol/ml,ph 7.0pbs中)中加入1.2g omms-c8,10℃下220rpm摇床中混合60min,离心后的沉淀置于冷冻干燥机中冻干即为脂肪酶微阵列calb@omms-c8,固载量为230mg/g,活力为110u/g。
57.(2)l-抗坏血酸脂肪酸酯的酶法制备:将0.02mol l-抗坏血酸、0.16mol的dha,加入到100ml有机溶剂叔丁醇中,置于70℃磁力搅拌器中搅拌20min,随后取出加入1.6gcalb@omms-c8,再置于70℃磁力搅拌器中搅拌,同时向反应体系中不断通入干燥氮气60m3/h,带走反应产生的水。4h后取出进行hplc含量测定,l-抗坏血酸dha酯转化率为82.5%;
58.(3)分离纯化:同实施例1,l-抗坏血酸dha酯纯度为95.8%。
59.实施例5
60.一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
61.(1)疏水酶微阵列的制备:在100ml 5.0mg/ml的calb酶液(溶解在0.1mol/ml,ph 6.0pbs中)中加入2.0g omms-c8,20℃下220rpm摇床中混合40min,离心后的沉淀置于冷冻干燥机中冻干即为脂肪酶微阵列calb@omms-c8,固载量为100mg/g,活力为90u/g。
62.(2)l-抗坏血酸脂肪酸酯的酶法制备:将0.02mol l-抗坏血酸、0.18mol的棕榈酸,加入到100ml有机溶剂叔丁醇中,置于70℃磁力搅拌器中搅拌20min,随后取出加入1.4g calb@omms-c8,再置于70℃磁力搅拌器中搅拌,同时向反应体系中不断通入干燥氮气60m3/h,带走反应产生的水。4h后取出进行hplc含量测定,l-抗坏血酸棕榈酸酯转化率为80.7%;
63.(3)分离纯化:同实施例1,l-抗坏血酸棕榈酸酯(l-ap)纯度为95.1%。
64.表1为实施例1-5制备的5种l-抗坏血酸酯的熔点及溶解度比较。表2为实施例1-5中制备的l-抗坏血酸酯的抗氧化性能比较,可知:抗氧化性与l-ap相当。
65.表1 l-抗坏血酸脂肪酸酯的熔点及溶解度
66.67.表2 l-抗坏血酸酯的抗氧化性能比较
[0068][0069]
注:表2中l-抗坏血酸酯的抗氧化性能测试时,各实施例制备的l-抗坏血酸酯在油样中的添加量均为200ppm。
[0070]
实施例6
[0071]
一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
[0072]
(1)疏水酶微阵列的制备:在100ml 9mg/ml的calb酶液(溶解在0.1mol/ml,ph 7.0pbs中)中加入1.5g omms-c8,20℃下220rpm摇床中混合50min,离心后的沉淀置于冷冻干燥机中冻干即为脂肪酶微阵列calb@omms-c8,固载量为200mg/g,活力为90u/g;
[0073]
(2)l-抗坏血酸脂肪酸酯的酶法制备:将0.02mol l-抗坏血酸、0.18mol的神经酸,加入到100ml有机溶剂叔丁醇中,置于60℃磁力搅拌器中搅拌20min,随后取出加入0.4gcalb@omms-c8,再置于60℃磁力搅拌器中搅拌,同时向反应体系中不断通入干燥氮气50m3/h,带走反应产生的水。10h后取出进行hplc含量测定,l-抗坏血酸神经酸酯转化率为72.3%;
[0074]
(3)l-抗坏血酸脂肪酸酯的分离纯化:同实施例2,经测定产物纯度分别为l-抗坏血酸神经酸酯97.2%。
[0075]
实施例7
[0076]
一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
[0077]
(1)疏水酶微阵列的制备:在100ml 1.5mg/ml的calb酶液(溶解在0.1mol/ml,ph 7.0pbs中)中加入2g omms-c8,30℃下220rpm摇床中混合20min,离心后的沉淀置于冷冻干燥机中冻干即为脂肪酶微阵列calb@omms-c8,固载量为120mg/g,活力为80u/g;
[0078]
(2)l-抗坏血酸脂肪酸酯的酶法制备:将0.02mol l-抗坏血酸、0.18mol的亚油酸,加入到100ml有机溶剂叔丁醇中,置于70℃磁力搅拌器中搅拌20min,随后取出加入1.5gcalb@omms-c8,再置于70℃磁力搅拌器中搅拌,同时向反应体系中不断通入干燥氮气50m3/h,带走反应产生的水。10h后取出进行hplc含量测定,l-抗坏血酸亚油酸酯转化率为71.3%;
[0079]
(3)l-抗坏血酸脂肪酸酯的分离纯化:同实施例2,经测定产物纯度分别为l-抗坏血酸亚油酸酯97.5%。
[0080]
实施例8
[0081]
一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
[0082]
(1)疏水酶微阵列的制备:在100ml 5mg/ml的calb酶液(溶解在0.1mol/ml,ph 7.0pbs中)中加入2g omms-c8,30℃下220rpm摇床中混合30min,离心后的沉淀置于冷冻干燥机中冻干即为脂肪酶微阵列calb@omms-c8,固载量为90mg/g,活力为120u/g;
[0083]
(2)l-抗坏血酸脂肪酸酯的酶法制备:将0.02mol l-抗坏血酸、0.02mol的亚麻酸,加入到100ml有机溶剂叔丁醇中,置于50℃磁力搅拌器中搅拌20min,随后取出加入2gcalb@omms-c8,再置于50℃磁力搅拌器中搅拌,同时向反应体系中不断通入干燥氮气100m3/h,带走反应产生的水。10h后取出进行hplc含量测定,l-抗坏血酸亚麻酸酯转化率为82.3%;
[0084]
(3)l-抗坏血酸脂肪酸酯的分离纯化:同实施例3,经测定产物纯度分别为l-抗坏血酸亚麻酸酯97.8%。
[0085]
实施例9
[0086]
一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
[0087]
(1)疏水酶微阵列的制备:在100ml 5mg/ml的calb酶液(溶解在0.1mol/ml,ph 7.0pbs中)中加入0.5g omms-c8,30℃下220rpm摇床中混合30min,离心后的沉淀置于冷冻干燥机中冻干即为脂肪酶微阵列calb@omms-c8,固载量为90mg/g,活力为100u/g;
[0088]
(2)l-抗坏血酸脂肪酸酯的酶法制备:将0.02mol l-抗坏血酸、0.18mol的亚麻酸,加入到100ml有机溶剂叔丁醇中,置于50℃磁力搅拌器中搅拌20min,随后取出加入1.5gcalb@omms-c8,再置于50℃磁力搅拌器中搅拌,同时向反应体系中不断通入干燥氮气100m3/h,带走反应产生的水。4h后取出进行hplc含量测定,l-抗坏血酸亚麻酸酯转化率为75.0%;
[0089]
(3)l-抗坏血酸脂肪酸酯的分离纯化:同实施例3,经测定产物纯度分别为l-抗坏血酸亚麻酸酯96.4%。
[0090]
实施例10
[0091]
一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
[0092]
与实施例1基本相同,不同之处在于:步骤(2)中有机溶剂为丙酮,经测定l-抗坏血酸油酸酯转化率为74.9%。
[0093]
实施例11
[0094]
一种l抗坏血酸脂肪酸酯的酶法制备方法及其产品,具体包括如下步骤:
[0095]
与实施例1-3基本相同,不同之处在于:步骤(2)后增加了脂肪酶微阵列催化合成三种l-抗坏血酸脂肪酸酯重复使用实验,即在反应结束后用反应溶剂对脂肪酶微阵列进行冲洗后并干燥处理,除去附着在酶上的原料、产物和水分,得到活化和再生后固定化酶再投入相同的反应。如图5所示,脂肪酶微阵列在重复使用10次后,仍具有较高的活性。
[0096]
本发明所列举的各原料,以及本发明原料以及酶量的上下限、区间取值,以及工艺参数(如温度、时间、均质速度)的上下限、区间取值都能实现本发明,在此不一一列举实施例。应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干改进和变换,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1