一类维生素K3衍生物及其医药用途
一类维生素k3衍生物及其医药用途
技术领域
1.本发明属于药物化学和药物治疗学领域,涉及一类维生素k3衍生物及其用于制备stat3小分子抑制剂、制备治疗肿瘤药物的医药用途。
背景技术:
2.信号转导及转录激活化因子(stats)是一个细胞质转录因子蛋白家族,负责细胞外细胞因子和生长因子的信号转导以及启动下游基因转录。其中,stat3(信号转导与转录激活因子3)是一种转录因子,参与调节细胞增殖、凋亡、侵袭、迁移及免疫应答等生理活动,其异常激活在肿瘤的发生发展中具有重要作用。目前,已在许多不同类型的癌症中观察到异常或组成型活化的stat3蛋白,活化后的stat3蛋白会进入细胞核,促进多种抗凋亡蛋白基因的表达,从而支持肿瘤的发生发展。该靶点已经成为重要的抗肿瘤靶点。
3.细胞因子或者生长因子与表面受体结合后,通过jak-stat3通路产生级联反应。jak激酶使stat3单体的ptyr705残基磷酸化,两个磷酸化的stat3单体在ptyr705-sh2结构域处结合并形成stat3的二聚化复合物,随后复合物进入细胞核中,诱导相关肿瘤基因的表达,因此在整条通路中,ptyr705-sh2结构域起到关键作用。
4.但是,现有的小分子sh2结构域抑制剂都存在活性不足或者与阳性对照药相比无统计学差异的窘境。因此,设计合成新型小分子sh2结构域抑制剂对jak-stat3细胞通路的阻断有着重要作用。
技术实现要素:
5.stat3的sh2结构域在激活stat3的募集和形成stat3同源二聚体以及stat3/dna复合物的形成中起着关键作用。本发明的目的是针对stat3的sh2结构域提供一种有效的stat3抑制剂。
6.本发明的目的是通过以下技术方案实现的:
7.结构如式i所示的维生素k3衍生物或其药学上可接受的盐或酯:
[0008][0009]
其中,r1选自氢、卤素、c1~c4烷基、卤素取代的c1~c4烷基、羟基、c1~c3烷氧基、卤素取代的c1~c4烷氧基、氰基、硝基、氨基、-(ch2)ncooh、芳香族、含1~2个杂原子的五元或六元饱和或不饱和杂环;n为0~2的整数;杂原子选自n、o、s;
[0010]
r2选自氢、卤素、氨基、甲氨基、乙氨基、c1~c3烷基、c1~c3烷氧基。
[0011]
优选的,r1选自氢、氟、溴、甲基、叔丁基、异丙氧基、三氟甲基、甲氧基、三氟甲氧
基、羟基、氨基、-(ch2)ncooh、氰基、硝基;n为0~2的整数;r2为甲基。
[0012]
更优选的,r1选自氟、三氟甲基、甲氧基、-(ch2)ncooh、氰基、硝基;n为0~2的整数;r2为甲基。
[0013]
卤素指氟、氯、溴或碘。
[0014]
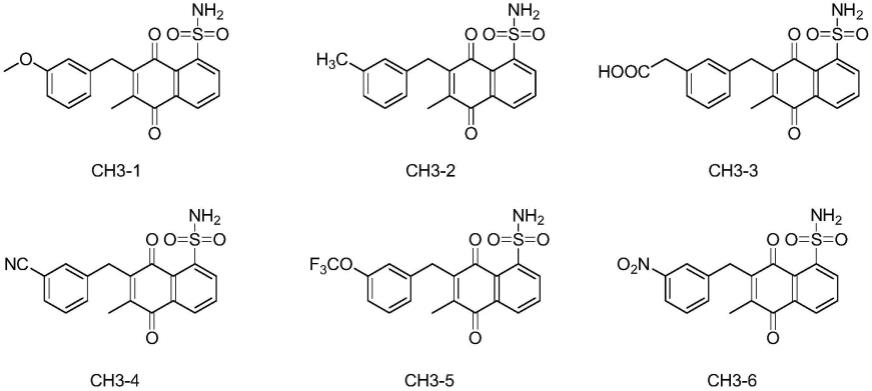
具体的,所述的维生素k3衍生物选自:
[0015][0016]
做为本发明最优选的技术方案,维生素k3衍生物的结构式如下:
[0017][0018]
化学名称:2-(3-((3-甲基-1,4-二氧代-8-磺酰胺基-1,4-二氢萘-2-基)甲基)苯基)乙酸;
[0019][0020]
化学名称:3-((3-甲基-1,4-二氧代-8-磺酰胺基-1,4-二氢萘-2-基)甲基)苯甲酸。
[0021]
所述的维生素k3衍生物药学上可接受的盐为钠盐、盐酸盐。
[0022]
所述的维生素k3衍生物药学上可接受的酯为甲酯、乙酯、叔丁酯。
[0023]
药理实验证明,本发明所述的维生素k3衍生物可以通过抑制肿瘤细胞的增殖、诱导肿瘤细胞的凋亡来达到抗肿瘤的目的,具有抗肿瘤效果,且对正常细胞毒性较低。尤其是化合物ch3-3、ch3-10对肺癌细胞a549体现出强力的生长抑制作用,且具有较好的安全性。
[0024]
本发明的另一个目的是提供所述的维生素k3衍生物或其药学上可接受的盐或酯在制备stat3抑制剂中的用途。
[0025]
本发明的另一个目的是提供所述的维生素k3衍生物或其药学上可接受的盐或酯在制备预防和/或治疗肿瘤药物中的用途。
[0026]
所述的肿瘤为肺癌。
[0027]
本发明的另一个目的是提供一种药物组合物,所述的药物组合物含有治疗有效量的维生素k3衍生物或其药学上可接受的盐或酯。
附图说明
[0028]
图1为化合物ch3-3对a549细胞的ic
50
。
[0029]
图2为化合物ch3-9对a549细胞的ic
50
。
[0030]
图3为10μm的化合物ch3-1~ch3-9处理下mcf-10a细胞生存率。
具体实施方式
[0031]
为了进一步阐明本发明的技术方案,下面给出一系列实施例,这些实施例完全是例证性的,它们仅用来对本发明具体描述,不应当理解为对本发明的限制。
[0032]
实施例1
[0033]
1)制备1-萘磺酰胺
[0034][0035]
将1-萘磺酰氯(10g,21.9mmol)加入到盛有40ml四氢呋喃的1l圆底烧瓶中,搅拌,在冰浴中滴加15ml温度为0℃的氨水(浓度25%~28%),滴加完毕后,薄层色谱跟踪检测反应,反应完成后,减压蒸馏出有机溶剂和氨水分解出的氨气,析出固体,过滤,真空干燥,得
到1-萘磺酰胺(8.70g,收率96.7%),该化合物无需进一步纯化,直接用于下一步反应。
[0036]1h nmr(400mhz,dmso-d6)δ8.65(d,j=8.3hz,1h,ar-h),8.20(d,j=8.2hz,1h,ar-h),8.17
–
8.06(m,2h,ar-h),7.75
–
7.69(m,1h,ar-h),7.69
–
7.68(m,1h,ar-h),7.67(d,j=3.9hz,2h,nh2),7.63(d,j=7.9hz,1h,ar-h).
[0037]
2)制备5,8-二氧代-二氢萘-1-磺酰胺
[0038][0039]
将无水硫酸高铈(160g,677.45mmol)用750ml浓度为2mol/l的稀硫酸溶解,控温65℃;将1-萘磺酰胺(8.70g,41.98mmol)加入盛有200ml乙腈的500ml圆底烧瓶中,控温65℃,搅拌,缓慢滴加入至硫酸高铈水相体系中,从滴加开始计时,薄层色谱监测,20分钟后停止反应,待反应液冷却后,过滤,滤液用1200ml二氯甲烷萃取,干燥除水后低压旋蒸,得到淡黄色固体,真空干燥,得5,8-二氧代-二氢萘-1-磺酰胺(5.85g,收率58.43%),直接用于下一步反应无需纯化。
[0040]1h nmr(300mhz,dmso-d6)δ8.45(d,j=9.2hz,1h,ar-h),8.28(d,j=8.9hz,1h,ar-h),8.06(t,j=7.8hz,1h,ar-h),7.38(s,2h,nh2),7.23
–
7.10(m,2h,ar-h).
[0041]
3)合成6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺
[0042][0043]
取3g 5,8-二氧代-二氢萘-1-磺酰胺和1.37ml冰乙酸溶于120ml乙腈和二氯甲烷(乙腈和二氯甲烷的体积比为1:1)混合溶液中,快速滴加含233mg硝酸银和6.25g过硫酸铵的水溶液120ml,80℃回流搅拌4h,薄层色谱跟踪监测反应。反应结束后,水相用450ml二氯萃取,有机层用水和饱和氯化钠分别洗涤一次,有机层经无水硫酸钠干燥,抽滤,减压旋蒸得到棕黄色粉末状固体,经甲醇打浆纯化得到6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺(2.6g,收率58.56%)。
[0044]1h nmr(300mhz,chloroform-d)δ8.58(d,j=8.0hz,1h,ar-h),8.40(d,j=7.9hz,1h,ar-h),7.92(t,j=7.8hz,1h,ar-h),6.93(s,1h,ar-h),5.96(s,2h,nh2),2.28(s,3h,ch3).
[0045]
4)合成7-(3-甲氧基苄基)-6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺(化合物ch3-1)
[0046]
取300mg 6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺和1.59mmol间甲氧基苯乙酸溶于30ml乙腈和二氯甲烷(乙腈和二氯甲烷的体积比为1:1)混合溶液中,快速滴加含13.52mg硝酸银和363.28mg过硫酸铵的水溶液30ml,80℃回流搅拌4h,薄层色谱跟踪监测反
应。反应结束后,水相用150ml二氯萃取,有机层用水和饱和氯化钠分别洗涤一次,有机层经无水硫酸钠干燥,抽滤,减压旋蒸得到浅黄色粉末状固体,经硅胶柱层析(洗脱剂为石油醚:乙酸乙酯=3:1v/v)纯化得到化合物ch3-1(收率14.21%)。
[0047]1h nmr(300mhz,dmso-d6)δ8.49
–
8.38(m,1h),8.35
–
8.23(m,1h),8.01(t,j=7.9hz,1h),7.38(s,2h),7.18(t,j=7.8hz,1h),6.87
–
6.69(m,3h),3.96(s,2h),3.71(s,3h),2.18(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.96,183.58,159.83,146.16,143.72,142.86,139.91,134.33,134.11,133.78,130.57,130.04,129.79,120.95,114.82,111.90,55.40,32.00,13.98。
[0048]
实施例2
[0049]
合成7-(3-甲基苄基)-6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺(化合物ch3-2)
[0050]
参照实施例1化合物ch3-1的合成方法,仅将间甲氧基苯乙酸替换为等摩尔间甲基苯乙酸,得到化合物ch3-2,收率47.13%,浅黄色粉末状固体。
[0051]1h nmr(300mhz,dmso-d6)δ8.42(dd,j=8.0,1.3hz,1h),8.30(dd,j=7.8,1.4hz,1h),8.01(t,j=7.9hz,1h),7.39(s,2h),7.15(t,j=7.5hz,1h),7.01(dd,j=13.0,6.2hz,3h),3.95(s,2h),2.24(s,3h),2.18(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.97,183.55,146.06,143.94,142.87,138.30,138.15,134.34,134.10,133.79,130.59,129.77,129.39,128.89,127.38,125.88,31.97,21.47,13.98。
[0052]
实施例3
[0053]
合成2-(3-((3-甲基-1,4-二氧代-8-磺酰胺基-1,4-二氢萘-2-基)甲基)苯基)乙酸(化合物ch3-3)
[0054]
参照实施例1化合物ch3-1的合成方法,仅将间甲氧基苯乙酸替换为等摩尔1,3-苯二乙酸,得到化合物ch3-3,收率45.76%,浅黄色粉末状固体。
[0055]1h nmr(300mhz,dmso-d6)δ12.30(s,1h),8.42(dd,j=7.9,1.3hz,1h),8.30(dd,j=7.8,1.4hz,1h),8.01(t,j=7.9hz,1h),7.38(s,2h),7.20(d,j=7.5hz,1h),7.16
–
7.01(m,3h),3.98(s,2h),3.52(s,2h),2.18(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.94,183.54,173.15,146.17,143.81,142.88,138.31,135.77,134.35,134.11,133.80,130.60,129.85,129.76,128.92,127.82,127.06,31.93,13.97。
[0056]
实施例4
[0057]
合成7-(3-氰基苄基)-6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺(化合物ch3-4)
[0058]
参照实施例1化合物ch3-1的合成方法,仅将间甲氧基苯乙酸替换为等摩尔3-氰基苯乙酸,得到化合物ch3-4,收率37.53%,浅黄色粉末状固体。
[0059]1h nmr(300mhz,dmso-d6)δ8.42(dd,j=7.9,1.4hz,1h),8.28(dd,j=7.8,1.4hz,1h),8.00(t,j=7.9hz,1h),7.75(d,j=1.8hz,1h),7.65(ddt,j=14.1,8.0,1.4hz,2h),7.54
–
7.35(m,3h),4.05(s,2h),2.16(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.82,183.54,146.91,142.87,142.55,140.26,134.27,134.24,133.97,133.71,132.23,130.63,130.53,130.10,129.87,119.30,111.94,31.70,14.04。
[0060]
实施例5
[0061]
合成7-(3-三氟甲氧基苄基)-6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺(化合物ch3-5)
[0062]
参照实施例1化合物ch3-1的合成方法,仅将间甲氧基苯乙酸替换为等摩尔3-三氟甲氧基苯乙酸,得到化合物ch3-5,收率38.56%,浅黄色粉末状固体。
[0063]1h nmr(300mhz,dmso-d6)δ8.42(dd,j=8.0,1.3hz,1h),8.29(dd,j=7.8,1.3hz,1h),8.01(t,j=7.9hz,1h),7.40(d,j=6.7hz,3h),7.28(dd,j=7.7,1.5hz,2h),7.23
–
7.16(m,1h),4.05(s,2h),2.17(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.85,183.56,148.97,148.95,146.66,142.92,142.88,141.30,134.30,134.18,133.76,130.82,130.54,129.83,127.91,121.53,119.15,31.74,13.98。
[0064]
实施例6
[0065]
合成7-(3-硝基苄基)-6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺(化合物ch3-6)
[0066]
参照实施例1化合物ch3-1的合成方法,仅将间甲氧基苯乙酸替换为等摩尔3-硝基苯乙酸,得到化合物ch3-6,收率33.73%,淡黄色粉末状固体。
[0067]1h nmr(300mhz,dmso-d6)δ8.42(dd,j=7.9,1.3hz,1h),8.30(dd,j=7.8,1.3hz,1h),8.14(t,j=2.0hz,1h),8.09
–
7.98(m,2h),7.72(dt,j=7.8,1.4hz,1h),7.57(t,j=7.9hz,1h),7.39(s,2h),4.14(s,2h),2.20(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.82,183.56,148.36,146.80,142.90,142.70,140.84,135.67,134.33,134.18,133.79,130.56,130.42,129.83,123.66,121.82,31.76,14.08。
[0068]
实施例7
[0069]
合成7-(3-溴苄基)-6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺(化合物ch3-7)
[0070]
参照实施例1化合物ch3-1的合成方法,仅将间甲氧基苯乙酸替换为等摩尔3-溴苯乙酸,得到化合物ch3-7,收率36.34%,淡黄色粉末状固体。
[0071]1h nmr(300mhz,dmso-d6)δ8.42(dd,j=7.9,1.3hz,1h),8.29(dd,j=7.8,1.3hz,1h),8.01(t,j=7.9hz,1h),7.48(d,j=2.2hz,1h),7.39(d,j=7.1hz,3h),7.30
–
7.18(m,2h),4.00(s,2h),2.17(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.86,183.54,146.57,143.02,142.87,141.33,134.29,134.18,133.76,131.53,131.10,130.56,129.83,129.66,127.92,122.29,31.72,14.03。
[0072]
实施例8
[0073]
合成7-(3-三氟甲基苄基)-6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺(化合物ch3-8)
[0074]
参照实施例1化合物ch3-1的合成方法,仅将间甲氧基苯乙酸替换为等摩尔3-三氟甲基苯乙酸,得到化合物ch3-8,收率37.20%,淡黄色粉末状固体。
[0075]1h nmr(300mhz,dmso-d6)δ8.42(dd,j=8.0,1.3hz,1h),8.29(dd,j=7.8,1.3hz,1h),8.01(t,j=7.9hz,1h),7.66(d,j=2.2hz,1h),7.60
–
7.47(m,3h),7.39(s,2h),4.10(s,2h),2.18(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.85,183.60,146.67,142.95,142.88,140.04,134.30,134.20,133.77,132.89,130.55,130.02,129.84,129.43,126.49,125.56,125.51,123.54,31.89,14.04。
[0076]
实施例9
[0077]
合成7-(3-氟苄基)-6-甲基-5,8-二氧代-5,8-二氢萘-1-磺酰胺(化合物ch3-9)
[0078]
参照实施例1化合物ch3-1的合成方法,仅将间甲氧基苯乙酸替换为等摩尔3-氟苯乙酸,得到化合物ch3-9,收率39.87%,淡黄色粉末状固体。
[0079]1h nmr(300mhz,dmso-d6)δ8.42(dd,j=7.9,1.3hz,1h),8.29(dd,j=7.8,1.3hz,1h),8.01(t,j=7.9hz,1h),7.44
–
7.27(m,3h),7.15
–
6.97(m,3h),4.01(s,2h),2.17(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.88,183.54,164.36,161.14,146.57,143.07,142.86,141.39,141.29,134.29,134.17,133.76,130.86,130.75,130.56,129.83,124.96,124.92,115.76,115.48,113.66,113.39,31.76,13.99。
[0080]
实施例10
[0081]
合成3-((3-甲基-1,4-二氧代-8-磺酰胺基-1,4-二氢萘-2-基)甲基)苯甲酸(化合物ch3-10)
[0082]
参照实施例1化合物ch3-1的合成方法,仅将间甲氧基苯乙酸替换为等摩尔3-羧甲基苯乙酸,得到化合物ch3-10,收率40.25%,淡黄色粉末状固体。
[0083]1h nmr(300mhz,dmso-d6)δ12.96(s,1h),8.42(d,j=7.9hz,1h),8.30(d,j=7.7hz,1h),8.01(t,j=7.9hz,1h),7.77(d,j=7.6hz,2h),7.49(d,j=7.7hz,1h),7.44
–
7.30(m,3h),4.06(s,2h),2.20(s,3h);
13
c nmr(75mhz,dmso-d6)δ184.90,183.55,167.70,146.33,143.51,142.91,139.00,134.38,134.08,133.84,133.36,131.45,130.59,129.78,129.72,129.32,127.77,31.92,14.03。
[0084]
实施例11
[0085]
化合物ch3-1~ch3-10的抗肿瘤细胞增殖活性评价
[0086]
1.1采用mtt法测试化合物ch3-1~ch3-10及化合物ly-17对肿瘤细胞的抑制活性
[0087]
非小细胞肺癌细胞(a549)购自中国科学院上海生化与细胞生物学研究所细胞库(中国上海)。非小细胞肺癌细胞(a549)在dmem培养基中培养,细胞培养基含有50μg/ml青霉素、50μg/ml链霉素、10%胎牛血清。细胞在组织培养瓶中于37℃、含5%co2的湿润环境中生长至80%汇合,然后用1
×
trypsin-versene进行胰蛋白酶消化并分裂。
[0088]
供试化合物:化合物ch3-1~ch3-10;阳性对照:化合物ly-17(wo2014028909a1):
[0089][0090]
药液的配制:取供试化合物和阳性对照,采用生物级别的99.9%dmso配制成10mm的化合物母液,用对应的培养基稀释化合物,得到浓度为20μm的药液。
[0091]
mtt实验:将a549细胞传代后计数,按照3500-4000个/孔的密度配制细胞悬浮液,混匀后,吸取细胞悬浮液接种到96孔板中,每孔100μl,贴壁过夜,次日给药,吸出96孔板中的细胞培养液,实验组:按每孔100μl加入含不同化合物(20μm)的培养基,空白组:按每孔100μl加入不含药物的培养基;孵育72小时,然后吸出96孔板中的药液,每孔加入100μl含有10%cck-8的培养基,避光孵育4小时,结束后取出96孔板,荧光酶标仪测量每孔的吸光值,检测波长为470nm,参照波长为630nm。
[0092]
肿瘤细胞的生长抑制率:增殖抑制率(%)=(1﹣a
实验组
/a
空白组
)
×
100%
[0093]
表1为化合物对a549细胞的抑制活性结果,可见:10个化合物对a549细胞均有增殖抑制作用,尤其是化合物ch3-1、ch3-3、ch3-4、ch3-6、ch3-9、ch3-10对a549细胞抑制活性显著,显著优于阳性药ly-17或与阳性药ly-17接近,尤其是化合物ch3-3与ch3-10在20μm浓度下能达到对肿瘤生长的完全抑制(》95%)。
[0094]
表1.化合物对a549细胞的抑制率
[0095][0096]
1.2采用mtt法测试化合物ch3-3、ch3-9的ic
50
(半抑制浓度)值
[0097]
mtt实验:将a549细胞传代后计数,按照3500-4000个/孔的密度配制细胞悬浮液,混匀后,吸取细胞悬浮液接种到96孔板中,每孔100μl,贴壁过夜,次日给药,采用生物级别的99.9%dmso配制10mmol的化合物母液,用对应的培养基稀释化合物至终浓度分别为0、0.125、0.25、0.5、1、2、4、8、16、32μm共10个浓度梯度,吸出96孔板中的细胞培养液,按每孔100μl加入含不同浓度化合物的培养基,空白组:按每孔100μl加入不含药物的培养基;孵育72小时,然后吸出96孔板中的药液,每孔加入100μl含有10%cck-8的培养基,避光孵育4小时。结束后取出96孔板,荧光酶标仪测量每孔的吸光值,检测波长为470nm,参照波长为630nm。
[0098]
肿瘤细胞的生长抑制率:增殖抑制率(%)=(1﹣a
实验组
/a
空白组
)
×
100%
[0099]
图1为化合物ch3-3对a549细胞的抑制活性结果,ic
50
为5.828μm。
[0100]
图2为化合物ch3-9对a549细胞的抑制活性结果,ic
50
(半抑制浓度)为8.451μm。
[0101]
实施例12
[0102]
化合物ch3-1~ch3-9对正常细胞毒性评价
[0103]
2.1采用mtt法测试化合物ch3-1~ch3-9及化合物ly-17对正常细胞的毒性
[0104]
人正常乳腺上皮细胞(mcf-10a)购自中国科学院上海生化与细胞生物学研究所细胞库(中国上海)。人正常乳腺上皮细胞(mcf-10a)在dmem培养基中培养,细胞培养基含有50μg/ml青霉素、50μg/ml链霉素、10%胎牛血清。细胞在组织培养瓶中于37℃、含5%co2的湿润环境中生长至80%汇合,然后用1
×
trypsin-versene进行胰蛋白酶消化并分裂。
[0105]
供试化合物:化合物ch3-1~ch3-9;阳性对照:化合物ly-17。
[0106]
药液的配制:取供试化合物和阳性对照,采用生物级别的99.9%dmso配制成10mm的化合物母液,用对应的培养基稀释化合物,得到浓度为10μm的药液。
[0107]
mtt实验:将mcf-10a细胞传代后计数,按照3500-4000个/孔的密度配制细胞悬浮液,混匀后,吸取细胞悬浮液接种到96孔板中,每孔100μl,贴壁过夜,次日给药,吸出96孔板中的细胞培养液,实验组:按每孔100μl加入含不同化合物(10μm)的培养基,空白组:按每孔100μl加入不含药物的培养基;孵育72小时,然后吸出96孔板中的药液,每孔加入100μl含有10%cck-8的培养基,避光孵育4小时,结束后取出96孔板,荧光酶标仪测量每孔的吸光值,检测波长为470nm,参照波长为630nm。
[0108]
肿瘤细胞的生长抑制率:增殖抑制率(%)=(1﹣a
实验组
/a
空白组
)
×
100%
[0109]
图3为10μm下化合物对mcf-10a细胞的毒性结果,可见9个化合物处理下mcf-10a细胞生存率显著高于对照ly-17,说明本发明维生素k3衍生物具有较好的安全性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1