一类载药的大分子及其制备方法与流程
本公开属于医药领域,涉及负载药物及药代动力学修饰剂的树枝状聚合物,尤其是涉及通过特定连接子将药物连接于树枝状聚合物。
背景技术:
1、目前,虽然药物的研究开发取得了长足进步,但还是有许多药物在临床试验阶段因其物理性质(如溶解性)使得其难以配制成合适的制剂进行给药,或由于给药后发生的高药物浓度期间导致的毒性效应及差的治疗指数而失败。此外,还包括其它缺点如吸收差、生物利用度低、体内稳定性差、靶向性差导致的全身性副作用、以及在给药后无法控制其在体内的生物分布、代谢和肾或肝清除。随着药物研究的不断进步,出现了一些新的研究领域和一些具有重大潜力的技术方法来推动药物的开发,如在脂质体、胶束或聚合胶束制剂中配制药物试剂,以及将药物试剂共价附着至亲水聚合物主链等。虽然这些策略可增溶药物活性剂且在某些情况下改善生物利用度和靶向性,但药物活性剂的释放存在困难,在某些情况下,在药物分子到达靶向器官之前,载体就会快速降解释放出药物活性剂。很多情况下药物活性剂从载体的释放速率为可变的,因此使药物在体内或在靶器官中达不到有效治疗剂量。
2、近年来,已发现树枝状聚合物在生物技术和药物应用领域取得明显进步(xiangyang shi等人,sci china mater,2018,61(11),1387–1403.)。树枝状聚合物是具有密集分支结构的特定种类的聚合物,从核心分子出发不断地向外重复支化生长而得到的结构类似于树状的大分子,即核心经过分支长到一定长度后分成两个分枝,如此重复进行,直到长得足够稠密以致于长成像球形一样的树丛(vgajbhiye等人,journal of pharmacyand pharmacology,2009,61,989–1003.),其特征在于比普通聚合物更高浓度的官能团/单位分子体积。特别是树枝状聚合物的独特性质,例如其高分支程度、多价、球形结构和良好确定的分子量,使得其给予用于药物递送的新支架的希望。在过去十年中,关于生物相容性树枝状聚合物的设计和合成及其对生物科学的许多领域包括药物递送的应用的研究也越来越受关注。
3、澳大利亚的starpahrma公司利用其开发的树枝状聚赖氨酸进行抗癌药物的负载和运输,来增强药物的药理性质,确保了药物在适当的时候被送到身体的适当部位,这种方法被称为“药物输送”,这项技术以商标面市。其中-多西他赛、-卡巴他赛以及-伊立替康是该公司目前利用技术重点开发处于临床研究阶段的3款抗癌药物,显示了很好的开发前景。
4、cn103796684a公开了通过二酸连接子将药物与树枝状聚合物连接起来的大分子,尤其是通过包含被氧、氮或硫原子间断的c1-c10的饱和支链或直链的二酸连接子连接。
技术实现思路
1、本公开提供了一类通过单酸连接子将药物与树枝状聚合物连接起来的大分子。
2、本公开提供一种大分子,其包含:
3、i)具有表面氨基的树枝状聚合物d,其中至少两个不同的端基共价连接于所述树枝状聚合物的表面氨基:
4、ii)第一端基,其为包含羧基的药学活性剂或其残基a;
5、iii)第二端基,其为药代动力学修饰剂;
6、其中所述第一端基通过连接子-x1-l-x2-共价连接于所述树枝状聚合物的表面氨基,x1为-o-,与药学活性剂或其残基a的羧基连接形成酯键,x2为-c(o)-,与树枝状聚合物d的表面氨基连接形成酰胺键,
7、l为任选被一个或多个氧、硫或氮原子间断的c1-10亚烷基、c2-10亚烯基、c2-10亚炔基、3至8元环烷基、3至8元杂环基、6至10元芳环基或5至10元杂芳环基(即l为c1-10亚烷基、c2-10亚烯基、c2-10亚炔基、3至8元环烷基、3至8元杂环基、6至10元芳环基或5至10元杂芳环基,或被一个或多个氧、硫或氮原子间断的c1-10亚烷基、c2-10亚烯基、c2-10亚炔基、3至8元环烷基、3至8元杂环基、6至10元芳环基或5至10元杂芳环基),其中所述亚烷基、亚烯基、亚炔基、环烷基、杂环基、芳环基和杂芳环基任选被一个或多个r’取代基取代;
8、r’选自羟基、c3-7环烷基、c3-7亚环烷基、c1-6烷氧基、卤代烷基、卤代烷氧基、卤素、硝基、氰基、酰基、巯基、硫醚基、亚磺酰基、磺酰基、-nr1r2、芳基、杂芳基和杂环基;
9、r1、r2各自独立地选自氢、羟基、c1-6烷基、环烷基和c1-6烷氧基。
10、在一些实施方案中,l为被一个或多个氧、硫或氮原子间断的c1-10亚烷基,所述亚烷基任选被一个或多个r’取代基取代。
11、在一些实施方案中,l为被一至三个独立地选自硫或氮的原子间断的c1-10亚烷基,所述亚烷基任选被一个或多个r’取代基取代。
12、在一些实施方案中,l为c1-10亚烷基,所述亚烷基任选被一个或多个r’取代基取代。
13、在一些实施方式中,r’选自卤素、c3-7环烷基、c3-7亚环烷基、c1-6卤代烷基、-or1、-sr1、-nr1r2和-c(o)r3,
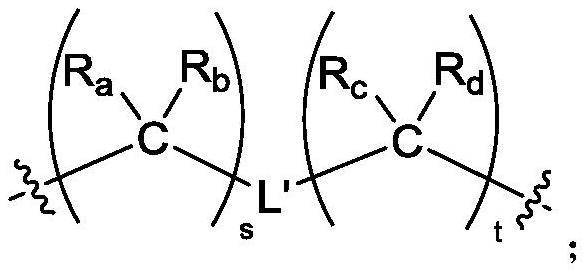
14、其中r1、r2各自独立地选自氢、羟基、c1-6烷基、c3-7环烷基、c1-6烷氧基和c(o)r4,所述c1-6烷基、c3-7环烷基和c1-6烷氧基任选被选自羟基、卤素、c1-6烷基、c1-6烷氧基、c2-6烯基、c2-6炔基、c1-6卤代烷基、c1-6卤代烷氧基、硝基、氰基、氨基和c1-6烷基氨基中的一个或多个取代基取代;
15、r3、r4各自独立地选自氢、c1-6烷基、c1-6卤代烷基和c1-6烷氧基。
16、在一些实施方案中,r1不为氢。
17、在一些实施方案中,r’选自c3-7亚环烷基、-or1、-sr1和-nr1r2,其中r1、r2各自独立地选自氢、c1-6烷基、c3-7环烷基、c1-6烷氧基和c(o)r4,其中所述c1-6烷基、c3-7环烷基和c1-6烷氧基任选被选自羟基、卤素、c1-6烷基、c1-6烷氧基、c1-6卤代烷基、c1-6卤代烷氧基、氨基和c1-6烷基氨基中的一个或多个取代基取代,r4选自氢、c1-6烷基、c1-6卤代烷基和c1-6烷氧基。
18、在一些实施方案中,r’选自-nr1r2,其中r1、r2各自独立地选自氢、c1-6烷基、c3-7环烷基、c1-6烷氧基和c(o)r4,所述c1-6烷基、c3-7环烷基和c1-6烷氧基任选被选自羟基、卤素、c1-6烷基、c1-6烷氧基、c1-6卤代烷基、c1-6卤代烷氧基、氨基和c1-6烷基氨基中的一个或多个取代基取代,r4选自氢、c1-6烷基、c1-6卤代烷基和c1-6烷氧基。
19、在一些实施方案中,r’选自-nr1r2,其中r1、r2各自独立地选自氢、c1-6烷基和c(o)r4,r4选自氢、c1-6烷基、c1-6卤代烷基和c1-6烷氧基;优选r1、r2各自独立地选自氢和c1-6烷基,且r1、r2不同时为氢。
20、在一些实施方案中,所述c1-10亚烷基为c1-6亚烷基。
21、在一些实施方案中,l为
22、ra、rb各自独立地选自氢、c1-6烷基,或ra、rb与其相连的碳原子一起形成c3-7环烷基;rc、rd各自独立地选自氢、c1-6烷基,或rc、rd与其相连的碳原子一起形成c3-7环烷基;
23、l’选自-ch2-、-o-、-s-和-nr3-;
24、r3为氢或c1-6烷基;
25、s和t各自独立地选自1至4的整数;
26、ra、rb、rc、rd在每次出现时可选择相同或不同的基团。
27、在一些实施方案中,至少有一个ra、rb与其相连的碳原子一起形成c3-7环烷基或至少有一个rc、rd与其相连的碳原子一起形成c3-7环烷基。
28、在一些实施方案中,l为c1-10亚烷基,所述c1-10亚烷基任选被一个或多个-nr1r2取代,其中r1、r2各自独立地选自氢、c1-6烷基和c(o)r4,r4选自氢、c1-6烷基、c1-6卤代烷基和c1-6烷氧基;优选r1、r2各自独立地选自氢和c1-6烷基,且r1、r2不同时为氢。
29、在一些具体实施方案中,所述大分子结构选自如下:
30、
31、
32、在一些实施方案中,选择本公开的连接子可以提供所需的药物释放速率,例如,快速释放或者缓慢释放。
33、在一些实施方案中,大分子的药学活性剂的释放速率比不依赖于大分子递送的快一些,可能至少快1倍。在一些实施方案中,大分子的药学活性剂的释放速率比不依赖于大分子递送的释放的更慢,可能慢两倍、三倍、四倍、五倍、六倍、七倍、八倍、九倍、十倍或者十倍以上、十五倍以上、二十倍以上、三十倍以上。低释放速率的大分子适合将大分子配制成长时间例如1周到3个月、1个月到6个月、6个月以上的时间内缓慢释放的药物。快速释放优选在0-8h内,尤其是0-4h内,特别是0-2h,更特别是5-60分钟内释放大于50%的药学活性剂。中等释放优选在1-72小时内,尤其是2-48小时内释放大于50%的药学活性剂。药学活性剂的释放速率可以通过选择合适的连接子进行控制,释放速率还依赖药物活性剂的特性。在一些实施方案中,药学活性剂通过相同的连接子连接于树枝状聚合物。在另一些实施方案中,药学活性剂通过两种或者多种连接子与树枝状聚合物进行连接,以使药学活性剂可以以不同的释放速率从大分子释放。
34、在一些实施方案中,所述的第一端基与第二端基以1:2-2:1的比率存在,尤其是1:2、1:1、2:1。在一些实施方案中,所述大分子包含为封闭基团、药物或者靶向基团的第三端基。封闭基团可以是酰基。在一些实施方案中,第一端基、第二端基和第三端基的比率为1:1:1-1:2:2,尤其是1:2:1。在一些实施方案中,其中至少50%的端基包含第一端基或者第二端基中的一者。在特定实施方案中,药物活性剂结合至大于14%、25%、27%、30%、39%、44%或48%的表面氨基。在一些实施方案中,药代动力学修饰剂结合至大于15%、25%、30%、33%或46%的表面氨基。
35、本公开所述药学活性剂可选自:麻醉剂、抗酸剂、抗体、抗感染药、生物制品、心血管药物、造影剂、利尿剂、补血药、免疫抑制剂、激素和类似物、营养制品、眼科药物、疼痛治疗剂、呼吸药物、佐剂、同化剂、抗关节炎药、抗惊厥药、抗组胺药、消炎药、抗溃疡病药、行为矫正药物、肿瘤药物、中枢神经系统药物、避孕药、糖尿病治疗药物、生育药物、生长促进剂、止血药、免疫刺激剂、肌肉松弛药、肥胖治疗剂、骨质疏松症药物、肽、镇静剂和安定药、尿道酸化剂或维生素。
36、在一些实施方案中,药物活性剂为肿瘤药物、类固醇、阿片类镇痛药、呼吸系统药物、中枢神经系统(cns)药物、高胆固醇血症药物、抗高血压药物、抗菌剂、免疫抑制药物、抗生素、促黄体激素释放激素(lhrh)激动剂、lhrh拮抗剂、抗病毒药、抗逆转录病毒药物、雌激素受体调节剂、生长抑素类似物、抗炎药物、维生素d2类似物、合成甲状腺素、抗组胺剂、抗真菌剂或非类固醇类抗炎药物(nsaid),优选肿瘤药物。
37、在一些实施方案中,所述的肿瘤药物选自苯丁酸氮芥、苯达莫司汀、甲氨蝶呤、培美曲塞,或这些药物分子的结构改造物。
38、在一些实施方案中,所述的药学活性剂选自紫杉烷类药物、喜树碱衍生物、核苷类药物、蒽环类药物、海鞘素衍生物、蛋白酶体抑制剂、微管抑制剂、bcl-2抑制剂、bcl-xl抑制剂、选择性核输出抑制剂、抗代谢药物、酪氨酸激酶抑制剂、plk1抑制剂、cdk4/6抑制剂、btk抑制剂、非甾体激素受体拮抗剂和类固醇,优选紫杉烷类药物、喜树碱衍生物、bcl-2抑制剂或bcl-xl抑制剂。
39、在一些实施方案中,可用的活性剂包括但不限于布洛芬、酮洛芬、非诺洛芬、氟比洛芬、奥沙普秦、萘普生、吲哚美辛、舒林酸、依托度酸、双氯芬酸、甲灭酸、甲氯芬那酸、氟芬那酸、托灭酸、利克飞龙、二氟尼柳、阿司匹林、吡哌酸、那氟沙星4-苯基丁酸、维甲酸、吉非贝齐、氟伐他汀、普伐他汀、阿伐他汀、鹅去氧胆酸、猪去氧胆酸、熊去氧胆酸、石胆酸、脱氧胆酸、甘氨脱氧胆酸等在一些实施方案中,所述的药学活性剂在水溶液中是微溶或者不溶的。
40、第二端基为药代动力学修饰剂,可以修饰或调解药学活性剂或大分子的药代动力学特征,包括吸收、分布、代谢和/或排泄。在特定的实施方案中,药代动力学修饰剂延长药学活性剂的血浆半衰期,使得连接于大分子的药学活性剂的半衰期比单纯的药学活性剂或在非树枝状聚合物载体上的药学活性剂的半衰期更长。优选地,大分子或组合物的半衰期比单纯的药学活性剂或在非树枝状聚合物载体上的药学活性剂的半衰期长至少2倍且更优选地至少10倍。
41、所述的药代动力学修饰剂可选自聚乙二醇、聚乙基噁唑啉、聚乙烯基吡咯烷酮、聚丙二醇、叶酸盐或关于细胞表面受体的配体的叶酸盐衍生物。在一些实施方案中,所述的药代动力学修饰剂是聚乙二醇。在一些实施方案中,所述的聚乙二醇具有220至5500da范围内的分子量,例如可以是220-2500da、570-2500da、220-1100da、570-1100da、1000-5500da、1000-2500da、1000-2300da的分子量。在一些实施方案中,所述的药代动力学修饰剂与所述树枝状聚合物表面氨基形成酰胺键。
42、靶向基团为结合至具有一些选择性的生物靶细胞、器官或组织的试剂,从而有助于将大分子导向体内特定的靶标并使其在该靶细胞、器官或组织中积聚。另外,靶向基团可以为通过受体介导的胞吞作用积极进入细胞或组织的大分子提供机制。特定的实例包括凝集素和抗体以及其它针对细胞表面受体的配体(包括小分子)。该相互作用可通过任何类型的键或缔合(包括共价键、离子键和氢键、范德华力)进行。合适的靶向基团包括结合于细胞表面受体的那些,例如,叶酸受体、肾上腺素能受体、生长激素、促黄体激素受体、雌激素受体、表皮生长因子受体、成纤维细胞生长因子受体(如fgfr2)、il-2受体、cftr和血管上皮生长因子(vegf)受体。
43、在一些实施方案中,靶向基团为促黄体激素释放激素(lhrh)或其结合于促黄体激素释放激素受体的衍生物。在一些实施方案中,靶向基团为lyp-1,其为靶向肿瘤的淋巴系统而非正常组织的淋巴系统的肽。在一些实施方案中,靶向基团可为rgd肽。rgd肽为含有序列-arg-gly-asp-的肽,该序列为细胞外基质蛋白质中主要的整联蛋白识别位点。在一些实施方案中,靶向基团可为叶酸。雌激素也可用于表达雌激素受体的靶细胞。
44、在一些实施方案中,靶向基团可直接地或优选地通过连接基团结合至树枝状聚合物核心。连接基团可为能够结合至核心的官能团和靶向基团上的官能团的任何二价基团。
45、本公开的大分子包含树枝状聚合物,其中结构单元的最外代具有表面氨基。大分子的树枝状聚合物的特性并不特别地重要,条件是它具有表面氨基。例如,树枝状聚合物可以为聚赖氨酸、聚赖氨酸类似物、聚酰氨基胺(pamam)、聚乙烯亚胺(pei)或聚醚羟胺(peham)树枝状聚合物。在一些实施方案中,树枝状聚合物是聚赖氨酸或聚赖氨酸类似物。聚赖氨酸或聚赖氨酸类似物包含核心和2-7代赖氨酸或赖氨酸类似物,例如包含2代、3代、4代、5代、6代或者7代赖氨酸或赖氨酸类似物。
46、在一些实施方案中,所述的赖氨酸具有如1所示结构:
47、在一些实施方案中,所述赖氨酸类似物具有如2所示结构:
48、在一些实施方案中,所述赖氨酸类似物具有如3所示结构:其中a为1或者2;b和c相同或不同且为1至4的整数。
49、在一些实施方案中,所述赖氨酸类似物具有如4所示结构:其中a为0至2的整数;b和c相同或不同且为2至6的整数。
50、在一些实施方案中,所述赖氨酸类似物具有如5所示结构:其中a为0至5的整数;b和c相同或不同且为1至5的整数。
51、在一些实施方案中,所述赖氨酸类似物具有如6所示结构:其中a为0至5的整数;b和c相同或不同且为0至5的整数。
52、在一些实施方案中,所述赖氨酸类似物具有如7所示结构:其中a为0至5的整数;b和c相同或不同且为1至5的整数。
53、在一些实施方案中,所述赖氨酸类似物具有如8所示结构:其中a为0至5的整数;b、c和d相同或不同且为1至5的整数。
54、在一些实施方案中,所述赖氨酸类似物具有如9所示结构:其中a为0至5的整数;b和c相同或不同且为1至5的整数。
55、本公开所述的树枝状聚合物,尤其是聚赖氨酸或聚赖氨酸类似物的核心可选自二苯甲基胺(bha)、赖氨酸的二苯甲基胺(bhalys)或赖氨酸类似物或者:
56、其中a为1至9,优选1至5的整数;
57、其中a、b和c可相同或不同且为1至5的整数,d为0至100的整数,优选1至30的整数;
58、其中a和b可相同或不同,且为0至5的整数;
59、其中a和c可相同或不同且为1至6的整数,b为0至6的整数;
60、其中a和d可相同或不同且为1至6的整数,b和c可相同或不同且为0至6的整数;
61、其中a和b相同或不同且为1至5的整数,特别是1至3的整数,尤其是1;
62、其中a、b和c相同或不同,且为选自1至6的整数;
63、其中a、b和c相同或不同,且为选自0至6的整数;
64、其中a、b和c相同或不同,且为选自0至6的整数;
65、其中a、b和c可相同或不同,为0至6的整数,d、e和f可相同或不同,为1至6的整数;
66、其中a、b和c可相同或不同,为1至6的整数;
67、其中a、b、c和d可以相同或不同,且为0至6的整数;
68、其中a、b、c和d可以相同或不同,且为1至6的整数;或者
69、其中a、b、c和d可以相同或不同,且为0至6的整数,e、f、g和h可以相同或不同,且为1至6的整数。
70、本公开还涉及一种式(b)所述的化合物,
71、a-x1-l-x2-o-rx (b)
72、其中a为包含羧基的药学活性剂或其残基,x1为-o-,与a的羧基连接形成酯键,x2为-c(o)-,rx为氢或羧基保护基,l如前文所述。可选择的药学活性剂如前文所述,优选培美曲塞。
73、本公开还涉及一种药物组合物,其包含本公开的大分子和药学上可接受的载体。在一些实施方案中,所述的药物组合物中,不含增溶赋形剂,例如聚乙氧基蓖麻油、聚山梨醇酯。在一些实施方案中,所述的药物组合物通过透皮、口服、注射等方式给药。
74、本公开的大分子配制成的组合物,其包括适于口服、直肠、局部、鼻、吸入、气雾剂、眼部、或肠胃外(包括腹膜内、静脉内、皮下或肌内注射)施用的那些。组合物可方便地以单位剂型呈现并且可通过制药领域众所周知的任何方法制备。所有方法包括使大分子与构成一种或多种辅助成分的载体缔合的步骤。通常,组合物通过使大分子与液体载体缔合形成溶液或悬浮液制备,或可选地使大分子与适于形成固体,任选地颗粒产物的制剂组分缔合,然后,如果必要,将产物成型为所需的递送形式。本公开的固体制剂,当为颗粒时,通常将包含约1纳米至约500微米的颗粒尺寸范围。通常,针对预期用于静脉内施用的固体制剂,颗粒直径范围通常将为约1nm至约10微米。组合物可含有本公开的大分子,所述大分子为具有小于1000nm,例如,5至1000nm,特别是5至500nm,尤其是5至400nm(如5至50nm且特别是5至20nm)的颗粒直径的纳米颗粒。在特定实施方案中,组合物含有具有5至20nm的平均尺寸的大分子。在一些实施方案中,大分子在组合物中为多分散的,pdi为1.01至1.8之间,特别是1.01至1.5之间,且尤其是1.01至1.2之间。在特定实施方案中,大分子在组合物中为单分散的。特别优选的为无菌的、冻干的组合物,所述组合物在注射前于水性媒介物中重构。
75、在一些实施方案中,组合物含有具有5至20nm的平均尺寸的大分子。在一些实施方案中,所述大分子的颗粒尺寸d90或者d50小于1000nm,例如,5至1000nm,特别是5至500nm,尤其是5至400nm(如5至50nm,特别是5至20nm)。在特定实施方案中,组合物含有具有d50为5至20nm的大分子。
76、本公开的大分子也可用于提供药物活性剂的控释和/或缓释制剂。在缓释制剂中,选择制剂成分以在延长的时期里(如数天、数周或数月)从制剂中释放大分子。这类制剂包括经皮贴剂或在可皮下沉积的可植入装置中或通过静脉注射、皮下注射、肌内注射、硬膜内注射或颅内注射。在控释制剂中,选择单酸连接子以在给定的时间窗口中释放其大部分的药物活性剂。例如,当已知大部分的大分子在靶器官、组织或肿瘤中积聚所花费的时间时,在积聚时间已过去之后可以选择连接子以释放其大部分的药物活性剂。这可允许在给定时间点在需要其作用的位点递送高载药量。可选地,选择连接子以在延长的时期里于治疗水平释放药物活性剂。在一些实施方案中,制剂可具有多种控释特性。例如,制剂包含其中药物通过不同的连接子连接的大分子,这允许快释药物的突释然后在延长的时期里以较低但恒定的治疗水平较慢释放。在一些实施方案中,制剂可具有缓释和控释特性。例如,可以选择制剂成分以在延长的时期里释放大分子且选择连接子以递送恒定的低治疗水平的药物活性剂。在一些实施方案中,药物活性剂通过不同的连接子连接于相同的分子。在一些实施方案中,每个药物-连接子组合连接于相同制剂中的不同的大分子。
77、在一些实施方案中,所述的药物组合物中,大分子被配制为在5分钟至60分钟之间释放大于50%的药学活性剂。在一些实施方案中,所述的药物组合物中,大分子被配制为在2小时至48小时之间释放大于50%的药学活性剂。在一些实施方案中,所述的药物组合物中,大分子被配制为在5天至30天之间释放大于50%的药学活性剂。
78、本公开还提供了一种药物组合物,包括至少一种前述大分子,以及药学上可接受的载体、稀释剂或赋形剂。
79、在某些实施方式中,所述的药物组合物的单位剂量为0.001mg-1000mg。
80、在某些实施方式中,基于组合物的总重量,所述的药物组合物含有0.01%-99.99%的前述大分子。在某些实施方式中,所述的药物组合物含有0.1%-99.9%的前述大分子。在某些实施方式中,所述的药物组合物含有0.5%-99.5%的前述大分子。在某些实施方式中,所述的药物组合物含有1%-99%的前述大分子。在某些实施方式中,所述的药物组合物含有2%-98%的前述大分子。
81、在某些实施方式中,基于组合物的总重量,所述的药物组合物含有0.01%-99.99%的药学上可接受的载体、稀释剂或赋形剂。在某些实施方式中,所述的药物组合物含有0.1%-99.9%的药学上可接受的载体、稀释剂或赋形剂。在某些实施方式中,所述的药物组合物含有0.5%-99.5%的药学上可接受的载体、稀释剂或赋形剂。在某些实施方式中,所述的药物组合物含有1%-99%的药学上可接受的载体、稀释剂或赋形剂。在某些实施方式中,所述的药物组合物含有2%-98%的药学上可接受的载体、稀释剂或赋形剂。
82、本公开另一方面提供治疗或抑制肿瘤生长的方法,其包括施用有效量的本公开的大分子或药物组合物,其中第一端基的药物活性剂为肿瘤药物。本公开中所述的肿瘤选自黑色素瘤、脑瘤、食管癌、胃癌、肝癌、胰腺癌、结肠直肠癌、肺癌、肾癌、乳腺癌、卵巢癌、前列腺癌、皮肤癌、神经母细胞瘤、肉瘤、骨软骨瘤、骨瘤、骨肉瘤、精原细胞瘤、睾丸肿瘤、子宫癌、头颈肿瘤、多发性骨髓瘤、恶性淋巴瘤、真性红细胞增多症、白血病、甲状腺肿瘤、输尿管肿瘤、膀胱癌、胆囊癌、胆管癌、绒毛膜上皮癌和儿科肿瘤(尤因家族性肉瘤、维尔姆斯肉瘤、横纹肌肉瘤、血管肉瘤、胚胎睾丸癌、成神经细胞瘤、视网膜母细胞瘤、肝胚细胞瘤、肾母细胞瘤等)。
83、在本公开另一方面,提供用肿瘤药物治疗后降低过敏症的方法,其包括施用本公开的药物组合物,其中所述组合物基本上不含增溶赋形剂诸如cremophor el和聚山梨醇酯80。
84、在本公开的另一方面,提供降低肿瘤药物或肿瘤药物的制剂的毒性的方法,其包括施用本公开的大分子,其中所述肿瘤药物为大分子的第一端基。在一些实施方案中,降低的毒性为血液毒性、神经毒性、胃肠毒性、心脏毒性、肝毒性、肾毒性、耳毒性或脑病毒性。
85、在本公开的另一方面,提供降低与肿瘤药物或肿瘤药物的制剂相关的副作用的方法,其包括施用本公开的大分子,其中所述肿瘤药物为大分子的第一端基。在一些实施方案中,减少的副作用选自嗜中性白血球减少、白细胞减少、血小板减少、骨髓中毒性、骨髓抑制、神经病、疲劳、非特异性神经认知问题、眩晕、脑病、贫血、味觉障碍、呼吸困难、便秘、厌食、甲病症、液体潴留、虚弱、疼痛、恶心、呕吐、粘膜炎、秃发、皮肤反应、肌痛和过敏症。
86、在一些实施方案中,本公开的大分子或包含大分子的药物组合物可以减少或消除具有试剂诸如皮质类固醇和抗组胺剂的术前用药的需要。
87、制备树枝状聚合物的方法在本领域为已知的。例如,大分子的树枝状聚合物可通过发散方法或收敛方法或其混合制备。
88、在发散方法中,将结构单元的每代依序加入至核心或前一代。保护具有一个或两个表面氨基的表面代。如果氨基中的一者得到保护,那么游离的氨基与连接子、连接子-药物活性剂或药代动力学修饰剂中的一者反应。如果两个氨基均得到保护,它们以不同的保护基团得到保护,那么可以去除一个保护基团而不去除另一个保护基团。去除氨基保护基团中的一者并与连接子、连接子-药物活性剂或药代动力学修饰剂中的一者反应。一旦初始端基已连接于树状物,那么去除另一氨基保护基团且加入另一第一和第二端基。这些基团通过本领域已知的酰胺形成连接于表面氨基。
89、在收敛方法中,结构单元的每一代在前一代上建立以形成树枝化基元。在树枝化基元连接于核心之前或之后,第一和第二端基可如以上所述连接于表面氨基。
90、在混合方法中,将结构单元的每一代加入至核心或结构单元的前一代。然而,在最后一代加入至树状物之前,将表面氨基与端基(例如,第一和第二端基,第一和第三端基或第二和第三端基)官能化。然后将官能化的末代加入至结构单元的亚表面层并将树枝化基元连接至核心。
91、药物活性剂通过本领域已知的酯形成与连接子的羧酸中的一者反应。例如,形成活化的羧酸,诸如使用酰氯或酸酐且与药物活性剂的羟基反应。如果药物活性剂具有一个以上的羟基,那么其它的羟基可以得到保护。
92、在靶向试剂连接于核心的情况下,核心上的官能团可在树状物形成期间得到保护然后去保护并与靶向试剂、连接基团或靶向试剂-连接基团反应。可选地,在形成树状物之前,核心可与联接基团或靶向试剂-连接基团反应。
93、合适的保护基团、其引入和去除的方法描述于greene&wuts,protectinggroupsin organic synthesis,第三版,1999。
94、本公开还包括大分子或其药学上可接受的盐的各种氘代形式,大分子中的每个可用的氢原子可独立地被氘原子置换。本领域技术人员将知晓如何合成本公开的大分子或其药学上可接受的盐的氘代形式。
95、本公开还包括同位素标记的大分子,大分子中的一个或多个原子被具有不同于自然界中最常见的原子质量或质量数的原子替换。可用于本公开的大分子的同位素的实例包括氢、碳、氮、氧、氟、碘和氯的同位素,例如3h、11c、14c、18f、123i或125i。
96、除非有相反陈述,否则下列用在说明书和权利要求书中的术语具有下述含义。
97、“卤素”是指氟、氯、溴或碘。
98、“卤代”是指被一个或多个选自氟、氯、溴、碘的原子取代。
99、“烷基”是指具有1至10个碳原子的直链或支链饱和烃基。在适当的情况下,烷基可具有指定的碳原子数,例如,c1-4烷基,所述烷基包括在直链或支链排列中具有1、2、3或4个碳原子的烷基。合适的烷基的实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、2-甲基丁基、3-甲基丁基、4-甲基丁基、正己基、2-甲基戊基、3-甲基戊基、4-甲基戊基、5-甲基戊基、2-乙基丁基、3-乙基丁基、庚基、辛基、壬基和癸基。
100、“亚烷基”是指具有1至10个碳原子的直链或支链二价烷基。
101、术语“烯基”包括具有2至12个碳原子的支链和直链烯烃或含有脂族烃基团的烯烃,或若规定指定碳原子数,则意指该特定数目。例如“c2-6烯基”表示具有2、3、4、5或6个碳原子的烯基。烯基的实例包括但不限于,乙烯基、烯丙基、1-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、2-甲基丁-2-烯基、3-甲基丁-1-烯基、1-戊烯基、3-戊烯基及4-己烯基。
102、术语“炔基”包括具有2至12个碳原子的支链和直链炔基或含有脂族烃基的烯烃,或若规定指定碳原子数,则意指该特定数目。例如乙炔基、丙炔基(例如1-丙炔基、2-丙炔基)、3-丁炔基、戊炔基、己炔基及1-甲基戊-2-炔基。
103、“亚烯基”、“亚炔基”是指衍生自烯基或炔基的部分不饱和的支链或直链二价烃基。在某些实施例中,此类亚烯基任选地被取代。亚烯基的非限制性实例包括亚乙烯基、亚丙烯基、亚丁烯基、亚戊烯基、亚己烯基、亚庚烯基、亚辛烯基、亚壬烯基、亚癸烯基及类似基团;亚炔基的非限制性实例包括亚乙炔基、亚丙炔基、亚丁炔基、亚戊炔基、亚己炔基及类似基团。
104、“环烷基”是指饱和或不饱和的环烃。环烷基环可包括指定的碳原子数。例如,3至8元环烷基包括3、4、5、6、7或8个碳原子。合适的环烷基的实例包括但不限于环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、1,4-环己二烯基、环庚基和环辛基。
105、“亚环烷基”是指衍生自环烷基的二价环烃基。例如等。所述的烷基被亚环烷基取代可包括例如如下的情形:
106、即所述亚环烷基与同一碳原子相连。
107、术语“烷氧基”是指-o-(烷基)和-o-(非取代的环烷基),其中烷基的定义如上所述。烷氧基的非限制性实例包括:甲氧基、乙氧基、丙氧基、丁氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基。烷氧基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自h原子、d原子、卤素、烷基、烷氧基、卤代烷基、羟基、羟烷基、氰基、氨基、硝基、环烷基、杂环基、芳基、杂芳基中的一个或多个取代基所取代。
108、“芳基”意指在各个环中至多7个原子的任何稳定的、单环或双环碳环,其中至少一个环为芳族的。此类芳基的实例包括但不限于苯基、萘基、四氢萘基、茚满基、联苯基或联萘基。
109、“杂环烷基”或“杂环基”是指环烃,其中一至四个碳原子已被独立地选自n、n(r),s,s(o)、s(o)2和o的杂原子替换。杂环可为饱和的或不饱和的。合适的杂环基的实例包括四氢呋喃基、四氢噻吩基、吡咯烷基、吡咯啉基、吡唑啉基、吡喃基、哌啶基、吡唑啉基、二硫杂环戊二烯基、氧杂硫杂环戊二烯基、二氧杂环己基、二氧杂环己烯基、吗啉代和噁嗪基。
110、“杂芳基”表示在各个环中至多7个原子的稳定的单环或双环,其中至少一个环为芳族且至少一个环含有选自o、n和s的1至4个杂原子。在本定义范围内的杂芳基包括但不限于吖啶基、咔唑基、噌啉基、喹喔啉基、喹唑啉基、吡唑基、吲哚基、苯并三唑基、呋喃基、噻吩基、苯硫基、3,4-亚丙基二氧苯硫基(3,4-propylenedioxythiophenyl)、苯并噻吩基、苯并呋喃基、苯并二噁烷、苯并二氧杂环己烯、喹啉基、异喹啉基、噁唑基、异噁唑基、咪唑基、吡嗪基、哒嗪基、吡啶基、嘧啶基、吡咯基、四氢喹啉、噻唑基、异噻唑基、1,2,4-三唑基、1,2,3-三唑基、1,2,4-噁二唑基、1,2,4-噻二唑基、1,3,5-三嗪基、1,2,4三嗪基、1,2,4,5四嗪基和四唑基。
111、“树枝状聚合物”是指含有核心和至少一个连接于所述核心的树枝化基元的分子。每个树枝化基元由至少一层或一代分支的结构单元构成,产生具有每代结构单元的分支的越来越多的分支结构。连接于核心的树枝化基元的最大数目受限于核心上官能团的数目。
112、“结构单元”是指具有至少三个官能团的分支的分子,一个官能团用于连接于核心或结构单元的上一代且至少两个官能团用于连接于结构单元的下一代或形成树状物聚合物的表面。
113、“代”是指构成树枝化基元或树枝状聚合物的结构单元的层数。例如,一代树枝状聚合物将具有一层连接于所述核心的分支的结构单元,例如,核心-[[结构单元]]u,其中u为连接于核心的树枝化基元的数目。两代树枝状聚合物在连接于核心的每个树枝化基元中具有两层结构单元,当所述结构单元具有一个分支点时,所述树枝状聚合物可为:核心[[结构单元][结构单元]2]u,三代树状物在连接于核心的每个树枝化基元中具有三层结构单元,例如核心-[[结构单元][结构单元]2[结构单元]4]u,6代树枝状聚合物具有六层连接于核心的结构单元,例如,核心-[[结构单元][结构单元]2[结构单元]4[结构单元]8[结构单元]16[结构单元]32]u等。结构单元的最后一代(最外代)提供树枝状聚合物的表面官能化和可用于结合端基的官能化基团的数目。例如,在具有两个树枝化基元连接于核心的树枝状聚合物中(u=2),如果每个结构单元具有一个分支点并且存在6代时,那么最外代具有64个结构单元和128个可用于结合端基的官能团。
114、“微溶的”是指在水中具有1mg/ml至10mg/ml的溶解度的药物或药物活性剂。在水中溶解度小于1mg/ml的药物被认为是不溶的。
115、“增溶赋形剂”是指用于将不溶的或微溶的药学活性剂溶解于水性制剂的制剂添加剂。实例包括表面活性剂如聚乙氧基蓖麻油包括cremophor el、cremophorrh40和cremophor rh60、d-α生育酚-聚乙二醇1000琥珀酸盐、聚山梨醇酯20、聚山梨醇酯80、solutol hs15、山梨醇单油酸酯(sorbitan monoleate)、泊洛沙姆407、labrasol等。
116、“羧基保护基”是本领域已知的适当的用于羧基保护的基团,参见文献(“protective groups in organic synthesis”,5th ed.t.w.greene&p.g.m.wuts)中的羧基保护基团,作为示例,优选地,所述的羧基保护基可以是取代或非取代的c1-10的直链或支链烷基、取代或非取代的c2-10的直链或支链烯基或炔基、取代或非取代的c3-8的环状烷基、取代或非取代的c5-10的芳基或杂芳基、或(c1-8烷基或芳基)3硅烷基;优选c1-6的直链或支链烷基,更优选c1-4的直链或支链烷基。例如,甲基、乙基、烯丙基、异戊烯基、三甲基硅基乙基等。
117、“任选的”或“任选”是指意味着随后所描述的事件或环境可以但不必发生,该说明包括该事件或环境发生或不发生的场合。例如,“l为任选的被一个或多个氧、硫或氮原子间断的c1-10直链亚烷基”意味着c1-10直链亚烷基可以被一个或多个氧、硫或氮原子间断但不必须被间断,该说明包括c1-10直链亚烷基被氧、硫或氮原子间断的情形和c1-10直链亚烷基不被氧、硫或氮原子间断的情形。
118、“取代的”指基团中的一个或多个氢原子,优选为最多5个,更优选为1~3个氢原子彼此独立地被相应数目的取代基取代。不言而喻,取代基仅处在它们的可能的化学位置,本领域技术人员能够在不付出过多努力的情况下确定(通过实验或理论)可能或不可能的取代。
119、本公开所述化合物的化学结构中,键“/”并未指定构型,即键“/”可以为或或者同时包含和两种构型。本公开所述化合物的化学结构中,键并未指定构型,即可以为z构型或e构型,或者同时包含两种构型。
120、本公开所述化合物或其可药用盐、或其异构体的任何同位素标记的衍生物都被本公开所覆盖。能够被同位素标记的原子包括但不限于氢、碳、氮、氧、磷、氟、氯、碘等。它们可分别被同位素2h(d)、3h、11c、13c、14c、15n、18f、31p、32p、35s、36cl和125i等代替。除另有说明,当一个位置被特别地指定为氘(d)时,该位置应理解为具有大于氘的天然丰度(其为0.015%)至少3000倍的丰度的氘(即,至少45%的氘掺入)。
121、本公开中药学活性剂或其残基、药学活性剂、药学活性剂或其残基a可互换使用,均是指具有药学活性的分子或者基团。
- 还没有人留言评论。精彩留言会获得点赞!