一种内切型硫酸软骨素/硫酸皮肤素4-O-硫酸酯酶及其应用
一种内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶及其应用
技术领域
1.本发明涉及一种内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶及其在体内和体外的应用,属于生物酶技术领域。
背景技术:
2.硫酸软骨素(cs)/硫酸皮肤素(ds)是一类高度聚阴离子的线性直链糖胺聚糖(gags)。它们广泛分布于动物细胞表面和细胞外基质中,参与生物体一系列的生理学、病理学过程,如细胞增殖、细胞迁移、组织入侵、炎症反应与病原微生物感染等。cs/ds在动物体内通过一个葡萄糖醛酸-半乳糖-半乳糖-木糖(-glcua-gal-gal-xyl-)四糖连接序列与各种核心蛋白共价偶联,形成cs/ds蛋白聚糖,以发挥其各种生物学功能。在cs/ds糖链合成过程中,葡萄糖醛酸(glcua)和n-乙酰半乳糖胺(galnac)在各种糖基转移酶的催化作用下及交替连接形成由-4glcuaβ1
–
3galnacβ1-重复链接而成的cs基本糖链骨架,其中部分glcua在c5差向异构酶的作用下生成艾杜糖醛酸(idoua),形成了cs/ds杂合链结构,增加了其结构复杂性;另外,在各种硫酸基转移酶的作用下,cs/ds主链的己糖醛酸(hexua)c2位,galnac的c4、c6位可发生不同程度的硫酸化,形成不同硫酸化模式的二糖单元,包括常见的单硫酸化二糖a/ia unit(glcuaβ1
–
3galnac(4s)/idouaα1
–
3galnac(4s))和c unit(glcuaβ1
–
3galnac(6s)),以及稀有的高硫酸化二糖,如d unit(glcua(2s)β1
–
3galnac(6s))、e unit(glcuaβ1
–
3galnac(4s,6s))、b/ib unit(glcua(2s)β1
–
3galnac(4s)/idoua(2s)α1
–
3galnac(4s))等。糖醛酸的差向异构化及硫酸化模式的多样性,使cs/ds糖链具有高度的结构复杂性及结构不均一性,为cs/ds结构功能研究和结构均一寡糖的制备带来了极大的困难。
3.大量研究表明,cs/ds在动物体内的表达具有时空特异性,其结构变化通常与各种生理和病理学过程密切相关,如轴突生长、细胞老化、炎症反应、肿瘤发生及动脉粥样硬化等。越来越多的证据表明,cs/ds的硫酸化模式可能编码了独特的生物学信息,并通过与各种蛋白(如生长因子、细胞因子或其他细胞外成分)的相互作用,在各种不同的生命过程中发挥关键作用。因此,研究特定cs/ds糖链的硫酸化模式与生物学功能的关系,是阐明cs/ds构效关系的关键。
4.硫酸酯酶作为一种可以特异性水解硫酸cs/ds糖链中硫酸基团的专一性水解酶类,根据其催化特异性的不同,可分为糖醛酸2-o-硫酸酯酶(δ
4,5
hex-2-o-sulfatase)、n-乙酰半乳糖胺-4-o-硫酸酯酶(galnac-4-o-sulfatase)和n-乙酰半乳糖胺-6-o-硫酸酯酶(galnac-6-o-sulfatase)三大类;根据其底物降解模式的不同,cs/ds硫酸酯酶又可分为仅从糖链端基水解硫酸基团的外切型cs/ds硫酸酯酶和可以降解糖链内部硫酸基团的内切型cs/ds硫酸酯酶。与外切酶相比,内切型硫酸酯酶能够选择性去除cs/ds糖链内部特定位置的硫酸基团而不改变其碳链骨架结构,对于研究cs/ds糖链硫酸化模式与功能的关系以及糖链的硫酸化模式编辑具有重要应用价值。但目前已鉴定并进行深入酶学性质分析的细菌来源cs/ds硫酸酯酶的种类和数量依然极为有限,仅包括bacteroides thetaiotaomicron、
vibrio sp.fc509及photobacterium sp.qa16来源的三种galnac-4-o-硫酸酯酶,且由于这些酶的内切活性通常很低,难以作为工具酶用于cs/ds的结构和功能研究,尤其是用于至今为止并没有任何有关将内切型cs/ds硫酸酯酶应用于体内外cs/ds功能研究和应用的报道。因此,发现和鉴定可以应用于体内外cs/ds结构和功能研究的高活性内切型cs/ds硫酸酯酶,对于cs/ds构效关系研究、硫酸化模式编辑、功能寡糖的制备以及与cs/ds有关的疾病的治疗具有重要意义。
技术实现要素:
5.针对现有技术的不足,本发明提供了一种内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶及其应用,该酶具有高效的内切型cs/ds糖链galnac-4-o-硫酸基团降解能力,能从galnac-4-o-单硫酸化aunit丰富的cs-a多糖、galnac-4,6-o-双硫酸化eunit丰富的cs-e多糖和差向异构化的ia unit丰富的ds多糖内部水解4-o-硫酸基团,不仅可以有效作用于细胞表面4-o-硫酸化的cs/ds多糖,抑制细胞表面cs/ds与cs-a特异性结合蛋白(rvar2)的结合;还可以在体内与透明质酸酶(haase)协同作用,促进其对体内各器官和组织中cs的降解,在cs/ds结构和功能研究中具有巨大的研究和应用价值,其特殊的内切酶活性、高的比酶活和良好的生物相容性使它有潜力应用于4-o-硫酸化的cs/ds结构功能研究、硫酸化模式的编辑和相关疾病的治疗。
6.本发明还提供了特异性结合4-o-硫酸化cs的生物素化蛋白(bio-rvar2)和其绿色荧光蛋白融合形式蛋白(rvar2-stgfp),可以作为探针有效检测内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶水解galnac-4-o-硫酸基团的效果,用于体内外4-o-硫酸化cs/ds的检测。
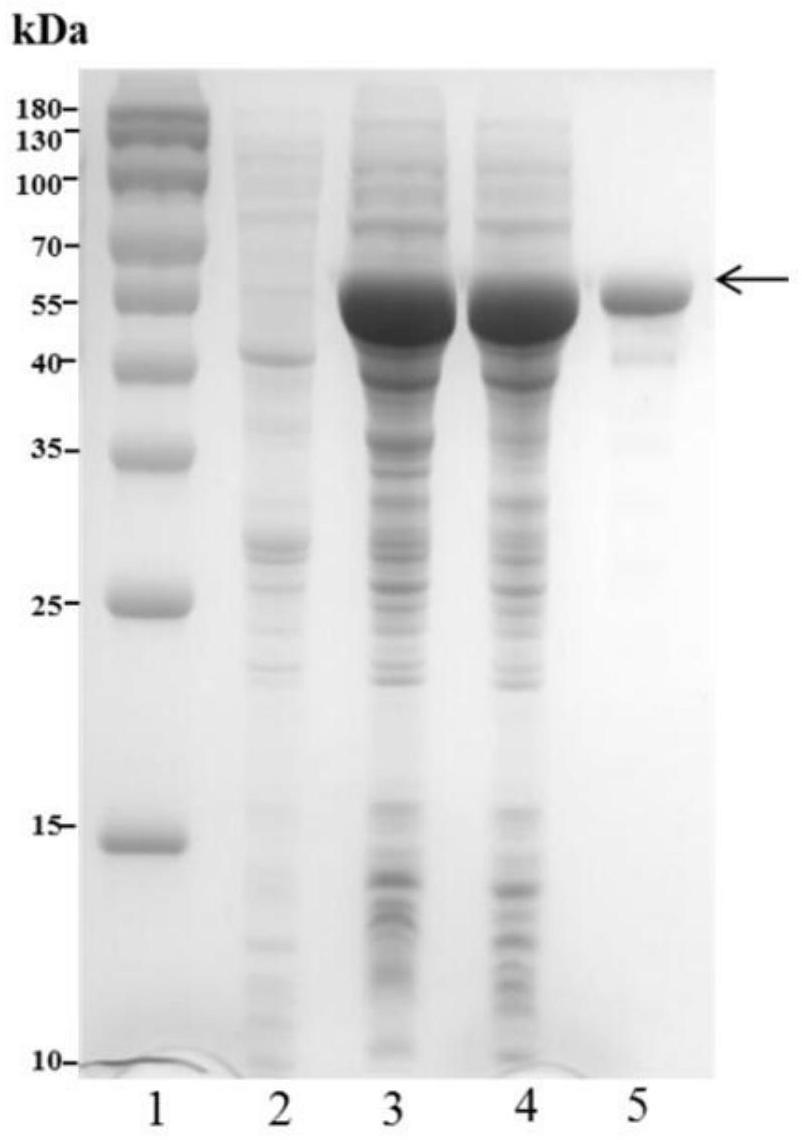
7.本发明的技术方案是:
8.一种内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶,该酶用于从硫酸软骨素/硫酸皮肤素的糖链内部特异性高效水解galnac-4-o-硫酸基团。
9.根据本发明优选的,所述内切型硫酸酯酶为来源于菌株bacteroides intestinalis的内切型galnac-4-o-硫酸酯酶endobi4sf,genbank编码为edv06292.1。
10.根据本发明优选的,所述内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶在50℃下降解不饱和cs-a二糖(δa)及cs-a多糖的酶活为15~20u/mg。
11.根据本发明优选的,所述内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶在含有5mm dtt条件下降解不饱和cs-a二糖(δa)及cs-a多糖的酶活为15~25u/mg。
12.根据本发明优选的,所述内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶在细胞培养条件下降解不饱和cs-a二糖(δa)及cs-a多糖的酶活为10~15u/mg。
13.上述内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶在制备去4-o-硫酸化cs/ds的寡糖或多糖中的应用。
14.根据本发明优选的,所述应用是以含4-o-硫酸根的cs/ds多糖为底物,向底物中添加上述endobi4sf,进行去硫酸化后得到去4-o-硫酸化cs/ds的寡糖或多糖。
15.进一步优选的,所述endobi4sf对含4-o-硫酸根的cs/ds多糖去硫酸化效果的检测方法如下:
16.向4-o-硫酸化cs/ds的寡糖或多糖中加入检测探针rvar2-stgfp,弱荧光强度或无
荧光强度则所检测cs/ds寡糖或多糖不含有4-o-硫酸基团;
17.所述检测探针rvar2-stgfp由cs-a特异性结合蛋白var2csa的cs-a特异性结合区id1-id2a结构域(rvar2)融合绿色荧光蛋白(stgfp)经异源表达纯化得到。
18.上述内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶在cs/ds糖链硫酸化模式编辑中的应用。
19.上述内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶在4-o-硫酸化cs/ds与其特异性结合蛋白相互作用中的应用。
20.上述内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶在含有4-o-硫酸基团的cs/ds的细胞的信号转导中的应用。
21.上述内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶在处理细胞、组织和器官中4-o-硫酸化cs/ds中的应用。
22.根据本发明优选的,所述细胞包括4t1、a549、hela、hepg2、hek 293t、hep3b2.1-7、huh-7、ht29和p815。
23.上述内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶在促进体外透明质酸酶对cs降解和体内透明质酸酶对各器官和组织中cs的降解中的应用。
24.根据本发明优选的,所述体外透明质酸酶和体内透明质酸酶包括人、动物和微生物来源的透明质酸酶或其它透明质酸降解酶。
25.有益效果:
26.1、本发明中的内切型galnac-4-o-硫酸酯酶endobi4sf来源于微生物bacteroides intestinalis,能够特异性地水解cs/ds多糖中galnac残基的4-o-硫酸基团。并且该酶不仅能够水解cs-a多糖内部a unit中的4-o-硫酸基团将其转化为o unit,还能够水解cs-e多糖内部4,6-o-双硫酸化e unit中的4-o-硫酸基团将其转化为c unit,水解ds多糖内部含有大量糖醛酸差向异构化idoua的ia unit中的4-o-硫酸基团将其转化为io unit,具有很强的底物结构特异性和广泛的底物选择性。同时,该酶具有较高的酶活力和较好的温度稳定性,在其最适条件对不饱和cs-a二糖(δa)及cs-a多糖的酶活为15~20u/mg;在含有5mm dtt的条件下对不饱和cs-a二糖(δa)及cs-a多糖的酶活为15~25u/mg;在生理条件下对不饱和cs-a二糖(δa)及cs-a多糖的酶活为10~15u/mg,具有较好的理论研究及应用价值。
27.2、本发明提供的检测探针rvar2-stgfp能够特异性结合富含4-o-硫酸基团的cs/ds,而内切型galnac-4-o-硫酸酯酶endobi4sf能够解除4-o-硫酸化cs/ds糖链与rvar2-stgfp的结合,因此rvar2-stgfp可以作为探针检测内切型硫酸软骨素/硫酸皮肤素4-o-硫酸酯酶水解galnac-4-o-硫酸基团的效果,检测去4-o-硫酸化cs/ds的寡糖或多糖的制备情况。同时还可以检测体外分子水平和体内外细胞、组织和器官水平检测4-o-硫酸化cs/ds,对利用内切型galnac-4-o-硫酸酯酶endobi4sf研究细胞表面及细胞外基质cs/ds的结构和功能具有重要意义。
28.3、本发明提供的内切型galnac-4-o-硫酸酯酶endobi4sf能够特异性地作用于细胞表面和细胞外基质中含有galnac-4-o-硫酸基团的cs/ds多糖,对不同细胞的作用能力存在一定的差异性,为细胞表面gags组成和细胞外4-o-硫酸化多糖的生物学功能研究提供了亟需的工具酶。
29.4、本发明提供的内切型galnac-4-o-硫酸酯酶endobi4sf能够在体内外与透明质
酸酶协同作用,促进透明质酸酶对4-o-硫酸化cs的降解,在硫酸酯酶的体内外应用及其相关疾病治疗中具有重要应用价值。
附图说明
30.图1为重组硫酸酯酶endobi4sf的sds-聚丙烯酰胺凝胶电泳图谱;
31.其中:泳道1、蛋白质分子量标准,条带自上至下大小为180kda,130kda,100kda,70kda,55kda,40kda,35kda,25kda,15kda,10kda;泳道2、空载体菌株破碎后菌液上清,上样量8μl;泳道3、重组菌株破壁后菌液,上样量10μl;泳道4、重组菌株破壁后菌液上清,上样量8μl;泳道5、经镍柱纯化的重组endobi4sf,上样量4μl(2μg);
32.图2为温度、ph、金属离子、酶孵育时间对硫酸酯酶endobi4sf的活性影响曲线图;
33.图中:a是不同温度下endobi4sf对a unit二糖的降解速率图,b是不同ph缓冲液中endobi4sf对a unit二糖的降解速率图,c是体系中含5mm不同金属离子及其他非金属试剂时endobi4sf对a unit二糖的降解速率图,d是endobi4sf在不同温度下孵育不同时间时对a unit二糖的降解速率图。
34.图3为硫酸酯酶endobi4sf降解不同硫酸化模式的不饱和cs二糖的降解产物的高效液相色谱(hplc)分析图;
35.图中:a是以不饱和a unit二糖为底物时endobi4sf的降解分析图,b是以不饱和c unit二糖为底物时endobi4sf的降解分析图,c是以不饱和d unit二糖为底物时endobi4sf的降解分析图,d是以不饱和e unit二糖为底物时endobi4sf的降解分析图;δo(δ
4,5
hexua1
–
3galnac),δa(δ
4,5
hexua1
–
3galnac(4s)),δc(δ
4,5
hexua1
–
3galnac(6s)),δd(δ
4,5
hexua(2s)1
–
3galnac(6s)),δe(δ
4,5
hexua1
–
3galnac(4s,6s));
36.图4为硫酸酯酶endobi4sf降解富含4-o-硫酸根的cs-a、cs-e和ds多糖的降解产物的高效液相色谱(hplc)分析图;
37.图中:a是endobi4sf降解cs-a多糖的降解产物分析图,b是endobi4sf降解cs-e多糖的降解产物分析图,c是endobi4sf降解ds多糖的降解产物分析图;δo(δ
4,5
hexua1
–
3galnac),δa(δ
4,5
hexua1
–
3galnac(4s)),δc(δ
4,5
hexua1
–
3galnac(6s)),δd(δ
4,5
hexua(2s)1
–
3galnac(6s)),δe(δ
4,5
hexua1
–
3galnac(4s,6s)),δb(δ
4,5
hexua(2s)1
–
3galnac(4s)),δu(δ
4,5
hexua(2s)1
–
3galnac);
38.图5为硫酸酯酶endobi4sf处理对cs-a竞争性抑制rvar2与固定化cs-a结合的影响分析图;
39.图6为硫酸酯酶endobi4sf处理对cs-a与rvar2-stgfp结合能力的影响分析图;
40.图7为硫酸酯酶endobi4sf处理对cs-e抑制wnt-3a信号通路能力的影响分析图;
41.图8为硫酸酯酶endobi4sf处理后细胞表面多糖的提取及二糖组成分析图;
42.图9为硫酸酯酶endobi4sf处理对细胞表面cs/ds与rvar2相互作用的影响分析图;
43.图中:左图为endobi4sf对4t1细胞的处理效果图,中图为endobi4sf对hela细胞的处理效果图,右图为endobi4sf对hek 293t细胞的处理效果图;
44.图10为以rvar2-stgfp作为探针检测硫酸酯酶endobi4sf对细胞表面4-o-硫酸化cs/ds的可视化激光扫描共聚焦检测分析图;
45.图中:a是endobi4sf处理后4t1细胞表面多糖的染色效果图;b是endobi4sf处理后
hela细胞表面多糖的染色效果图;
46.图11为硫酸酯酶endobi4sf处理对不同细胞系与rvar2-stgfp结合影响的流式细胞分析图;
47.图中:a为4t1细胞经endobi4sf处理后与rvar2-stgfp结合的流式细胞分析图;b为a549细胞经endobi4sf处理后与rvar2-stgfp结合的流式细胞分析图;c为hela细胞经endobi4sf处理后与rvar2-stgfp结合的流式细胞分析图;d为hepg2细胞经endobi4sf处理后与rvar2-stgfp结合的流式细胞分析图;e为hek 293t细胞经endobi4sf处理后与rvar2-stgfp结合的流式细胞分析图;f为hep3b细胞经endobi4sf处理后与rvar2-stgfp结合的流式细胞分析图;g为huh-7细胞经endobi4sf处理后与rvar2-stgfp结合的流式细胞分析图;h为ht29细胞经endobi4sf处理后与rvar2-stgfp结合的流式细胞分析图;i为p815细胞经endobi4sf处理后与rvar2-stgfp结合的流式细胞分析图;
48.图12为硫酸酯酶endobi4sf处理对细胞活力的影响分析图;
49.图13为硫酸酯酶endobi4sf和透明质酸酶haase体外降解cs-a的协同作用研究结果图;
50.图中:图a是haase降解endobi4sf去硫酸化前后cs-a的降解速率比较图,图b是在添加不同含量的endobi4sf后haase对cs-a的降解速率分析图。
51.图14为硫酸酯酶endobi4sf和透明质酸酶haase的体内降解各组织器官中4-o-硫酸化cs的协同作用研究。
具体实施方式
52.以下实施例的阐述,是为了全面公开本发明如何实施的一些常用技术,而不是为了限制本发明的应用范围。发明人已经尽最大努力确保实施例中各个参数的准确性(例如量,温度,等等),但是一些实验误差和偏差也应该予以考虑。除非另有说明,本发明中分子量是指平均分子量,温度是指摄氏度。
53.生物材料来源:
54.肠道厌氧微生物多形拟杆菌(bacteroides intestinalis)菌株购自德国微生物和细胞培养物保藏中心dsmz。
55.不饱和cs二糖底物a unit(δa)、c unit(δc)、d unit(δd)和e unit(δe)二糖由相应cs多糖经硫酸软骨素酶abc完全降解经产物分离制备而得
56.cs-a多糖来源于牛软骨,cs-e来源于鱿鱼软骨,ds来源于猪小肠黏膜。
57.所述cs-a结合蛋白rvar2来源于已报道plasmodium falciparum中cs-a特异性结合蛋白var2csa的cs-a特异性结合区id1-id2a结构域。
58.所述rvar2-stgfp由cs-a结合蛋白rvar2融合不带电荷的绿色荧光蛋白(stgfp)经异源表达纯化得到。
59.实施例1、多形拟杆菌(bacteroides intestinalis)菌体培养及基因组dna提取
60.将多形拟杆菌(bacteroides intestinalis)划线于pyg固体培养基,37℃倒置厌氧培养过夜,挑取单克隆接种于5ml的pyg液体培养基中,37℃、200rpm倒置厌氧培养过夜。取1ml菌液进行基因组dna的提取,提取基因组采用天根生化科技(北京)有限公司生产的细菌基因组dna提取试剂盒(dp302),提取方法参照试剂商提供的操作说明书。
61.所述pyg液体培养基每升组分如下:胰蛋白胨5g,蛋白胨5g,酵母提取物10g,牛肉膏5g,葡萄糖5g,k2hpo
4 2g,tween-80 1ml,半胱氨酸盐酸盐
·
h2o 0.5g,刃天青1mg,蒸馏水950ml,维生素k溶液0.2ml,氯化血红素溶液10ml,buffer s 40ml;
62.所述buffer s每升组分如下:cacl2·
2h2o 0.25g,mgso4·
7h2o 0.5g,k2hpo
4 1g,kh2po41g,nahco
3 10g,nacl 2g,蒸馏水1l。
63.所述pyg固体培养基是在pyg液体培养基的基础上添加1.5g/100ml的琼脂。
64.实施例2、endobi4sf的基因序列分析
65.endobi4sf的基因序列(genbank:edv06292.1)来自于ncbi数据库中bacteroides intestinalis的基因组序列,其基因编码区长1,548bp,编码的蛋白质由515个氨基酸组成,理论分子量为59.13kda,sds-page所示的分子量与其理论分子量基本一致。信号肽分析结果显示,endobi4sf的n-末端有一个长20个氨基酸序列的ii型信号肽,说明此蛋白在发挥其降解作用时是被分泌到胞外的。blast多序列比对结果显示,其与已鉴定的来源于bacteroides thetaiotaomicron的galnac-4-o-硫酸酯酶(uniprotkb/swiss-prot:q8a2f6.1)具有最高的序列相似性,相似度达82.09%。
66.实施例3、endobi4sf表达载体的构建及其大肠杆菌中的重组表达及分离纯化
67.以实施例1中提取的bacteroides intestinalis的基因组dna为模板,使用相应引物进行pcr扩增获得带有酶切位点的、不含有信号肽的endobi4sf目的片段:
68.正向引物:5
’‑
catatgttgcaaggctgcaaaaccc-3’69.反向引物:5
’‑
ctcgaggtaaggtatcatgtcgg-3’70.在正向和反向引物中,标注有下划线的碱基序列分别为限制性内切酶ndei和xhoi的酶切位点。phanta hs super-fidelity dna polymerase dna聚合酶购自南京诺唯赞生物科技股份有限公司,pcr反应体系按照公司提供的产品说明操作。
71.pcr反应条件:94℃预变性5min;94℃变性40s,60℃退火30s,72℃延伸1min 30s,30个循环;72℃延伸15min,4℃保存。
72.pcr产物经琼脂糖凝胶电泳胶回收得到带有酶切位点的endobi4sf目的片段,并将其通过粘性末端连接连至使用同样限制性内切酶酶切后的pet-22b表达载体中,用于粘性末端连接的t4 dna ligase购自宝生物公司,连接酶与底物反应的体系、片段与载体的比例、反应温度以及反应时间均遵循使用说明书。将连接产物转化至大肠杆菌感受态细胞bl21(de3)(购自南京诺唯赞生物科技股份有限公司),涂布到含100μg/ml氨苄青霉素的lb固体培养基上,37℃倒置培养14h,挑取单克隆到含氨苄青霉素抗性的lb液体培养基中,37℃、200rpm培养12~14h后,提取质粒;将含有目标质粒的菌体收集进行质粒抽提验证阳性克隆,结果得到大小正确的目标质粒,初步证明重组质粒构建正确。阳性菌株由生工生物公司进行dna测序,测序结果表明插入表达载体pet-22b的endobi4sf目的片段序列正确,且在其5’端和3’端分别含有ndei和xhoi酶切位点。
73.将序列正确的阳性菌株进行扩大培养,加入终浓度为0.05mm iptg,16℃诱导表达24h。表达结束后收集菌体,菌体破碎后离心分离得到破碎菌体的上清,利用ni sepharose 6fast flow(ge healthcare)亲和层析凝胶对目的蛋白进行层析纯化,并通过聚丙烯酰胺凝胶电泳(sds-page)对纯化的目的蛋白进行检测,检测结果如图1所示。纯化后的重组endobi4sf在电泳胶上基本均呈单一条带,且位置与他们的理论分子量相吻合,纯度达到
90%(图1)。
74.实施例4、endobi4sf的酶学性质分析
75.利用不饱和a unit二糖作为底物,研究温度、ph、金属离子、酶孵育时间对重组硫酸酯酶endobi4sf活性影响分析,分析结果如下:
76.1、温度对酶活性的影响
77.将10mg/ml的不饱和硫酸软骨素a unit二糖、150mm的tris-hcl缓冲液(ph 7.0)、质量浓度为1%的endobi4sf酶液以及去离子水按照3:10:3:14(体积比)的比例混合后,分别在0℃、10℃、20℃、30℃、40℃、50℃、60℃、70℃条件下反应5min,反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶反应作为阴性对照,反应产物稀释后上样superdex
tm peptide 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶水解产生的非硫酸化的峰的比率来表示酶反应速率,将此读数比率最大的条件定义为100%相对酶活力(relative activity),检测结果如图2a所示。
78.由图2a可知,endobi4sf水解不饱和a unit的最适反应温度为50℃,同时在30~40℃时也保有较好的酶活力,但温度高达70℃时酶几近失活。
79.2、ph对酶活性的影响
80.将10mg/ml的不饱和硫酸软骨素a unit二糖、含有不同缓冲离子对的150mm反应缓冲液(ph范围为5.0~10.0)、质量浓度为1%的endobi4sf酶液以及去离子水按照3:10:3:14(体积比)的比例混合后,在最适温度下反应5min。反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶反应作为阴性对照,反应产物稀释后上样superdex peptide
tm 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶水解产生的非硫酸化的峰的比率来表示酶反应速率,将此读数比率最大的条件定义为100%相对酶活力(relative activity),检测结果如图2b所示。
81.由图2b可知,endobi4sf水解不饱和a unit的最适ph为ph 7.0,最适缓冲条件是tris-hcl缓冲溶液,其在naac-hac(ph 6.0)缓冲溶液和nah2po
4-na2hpo4(ph 7.0)缓冲溶液中依然具有较好的酶活性,溶液ph高于9时表现出极低的酶活力。
82.3、金属离子、二价金属离子螯合剂及还原试剂对酶活性的影响
83.将10mg/ml的不饱和硫酸软骨素a unit二糖、150mm的tris-hcl缓冲液(ph 7.0)、100mm金属离子、金属离子螯合剂及还原试剂、质量浓度为1%的endobi4sf酶液以及去离子水按照3:10:1.5:3:12.5(体积比)的比例混合,在最适温度下反应5min。反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶反应作为阴性对照,反应产物稀释后上样superdex peptide
tm 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶水解产生的非硫酸化的峰的比率来表示酶反应速率,将此读数比率最大的条件定义为100%相对酶活力(relative activity),检测结果如图2c所示。
84.由图2c可知,一价金属离子中,li
+
对酶有微弱的促进作用,二价金属离子中,ca
2+
对酶活力也有微弱的促进作用,没有离子对酶活性有特别强的促进作用且金属离子螯合剂edta对酶活力的抑制作用也不是特别强。但还原试剂dtt对酶活力有一定的促进作用(130%),能在一定程度上提高酶活力。
85.4、温度对酶稳定性的影响
86.将10mg/ml的不饱和硫酸软骨素a unit二糖、150mm的tris-hcl缓冲液(ph 7.0)、在不同温度(0℃~60℃)下热处理1、2、4、8、12、24h后的质量浓度为1%的endobi4sf酶液以及去离子水按照3:10:3:14(体积比)的比例混合后,在最适温度下反应5min。反应结束后,沸水浴处理使酶失活,加沸水浴灭活的酶反应作为阴性对照,反应产物稀释后上样superdex peptide
tm 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶水解产生的非硫酸化的峰的比率来表示酶反应速率,将此读数比率最大的条件定义为100%相对酶活力(relative activity),检测结果如图2d所示。
87.由图2d可知,endobi4sf在30℃以下的孵育温度有较好的稳定性,而孵育温度高于40℃时,酶活性迅速降低,说明它是一个不能长时间耐受高温环境的温度敏感型酶。
88.实施例5、endobi4sf降解不同硫酸化模式的不饱和cs二糖产物分析
89.将1mg/ml的不同硫酸化模式的不饱和cs二糖(δa、δc、δd和δe)、150mm的tris-hcl缓冲液(ph 7.0)、1mg/ml的endobi4sf酶液及去离子水按照1:10:1:18(体积比)的比例混合,30℃反应12h,以加灭活酶的反应体系作为阴性对照,反应结束后沸水浴灭活,取1μg产物进行2-ab荧光标记并进行hplc分析。hplc分析条件为阴离子交换层析;所用层析柱为ymc-pack pa-g阴离子交换柱;流动相为0.016-0.46m nah2po4;检测条件为荧光检测器,激发光330nm,发射光420nm,室温检测,检测结果如图3所示。
90.由图3可知,endobi4sf能够水解不饱和cs二糖δa和δe中的4-o-硫酸基团并生成相应的δo和δc产物;无法降解其他位置硫酸化的二糖如含有δ
4,5
hexua 2-o-硫酸基团和galnac-6-o-硫酸基团的δc和δd,说明此酶具有底物降解特异性。
91.实施例6、endobi4sf降解不同硫酸化模式的cs/ds多糖的降解产物分析
92.分别将30μg不同的富含4-o-硫酸根的cs/ds多糖(cs-a、cs-e和ds)溶于50mm的tris-hcl缓冲液(ph 7.0)中,加入5μg的endobi4sf酶液进行降解,30℃反应过夜。取2μg降解产物85℃灭活,加入5miu硫酸软骨素裂解酶(csase abc)将其完全降解为二糖后,进行2-ab荧光标记并进行hplc分析。hplc分析条件为阴离子交换层析;所用层析柱为ymc-pack pa-g阴离子交换柱;流动相为0.016-0.46m nah2po4;检测条件为荧光检测器,激发光330nm,发射光420nm,室温检测,检测结果如图4所示。
93.由图4可知,经过过夜降解后,富含4-o-硫酸根的cs-a、cs-e和ds多糖中的4-o-硫酸根全部被水解产生其相应的脱硫酸化产物,说明endobi4sf是一种高效的、底物作用范围广泛的4-o-硫酸化特异性硫酸酯酶。
94.实施例7、endobi4sf酶活力的测定
95.最适条件下:将10mg/ml的δa二糖及cs-a多糖,150mm的tris-hcl缓冲液(ph 7.0)、质量浓度为1%的endobi4sf酶液以及去离子水按照3:10:3:14(体积比)的比例混合,分别在50℃反应30s、1min、2min、5min,85℃灭活反应,降解多糖的反应加csase abc酶将其完全降解为二糖再分析其降解效率。
96.在体系中含有还原性试剂的条件下:将10mg/ml的不饱和4-o-硫酸化cs/ds二糖(δa)及cs-a多糖,150mm的tris-hcl缓冲液(ph 7.0)、0.1m还原剂二硫苏糖醇(dtt)、质量浓度为1%的endobi4sf酶液以及去离子水按照3:10:1.5:3:12.5(体积比)的比例混合,分
别在50℃反应30s、1min、2min、5min,85℃灭活反应,降解多糖的反应加csase abc酶将其完全降解为二糖再分析其降解效率。
97.细胞培养条件下:将10mg/ml的δa二糖及cs-a多糖,pbs缓冲液(ph 7.6),质量浓度为1%的endobi4sf酶液以及去离子水按照3:10:3:14(体积比)的比例混合,分别在37℃反应30s、1min、2min、5min,85℃灭活反应,降解多糖的反应加csase abc酶将其完全降解为二糖再分析其降解效率。
98.反应产物上样superdex peptide
tm 10/300gl(ge)进行凝胶过滤层析,流动相为0.2m碳酸氢铵,流速为0.4ml/min,通过检测样品在232nm处光吸收值,计算硫酸酯酶水解产生的非硫酸化的峰的峰面积,根据标准曲线计算生成非硫酸化产物的摩尔量,从而计算产生硫酸基团的摩尔量。酶活力单位(u)定义为单位时间(1min)内产生1μmol硫酸基团所需的酶量。
99.经计算,endobi4sf在最适条件下对δa二糖及cs-a多糖的酶活力分别为17.53
±
1.49和15.96
±
0.56;在体系中含有还原性试剂的条件下对δa二糖及cs-a多糖的酶活力分别为21.04
±
0.88和16.26
±
0.22;在细胞培养条件下对δa二糖及cs-a多糖的酶活力分别为12.34
±
0.45和12.00
±
2.07。dtt对酶降解二糖内硫酸根的促进作用大于降解多糖内部硫酸根的促进作用。
100.实施例8、endobi4sf在外源cs-a抑制rvar2与固定化cs-a相互作用实验中的应用
101.将0.15μg经endobi4sf、csase abc酶在37℃过夜处理的cs-a和0.2μgcs-a结合蛋白rvar2混合均匀,共孵育20min后,将共孵育产物加入至含0.1μg/孔的cs-a的96孔板中(所述cs-a由生物素-亲和素系统固定),室温反应1h,之后用pbst(含有0.05% tween-20的pbs缓冲溶液)洗涤三次洗去未与板底固定化的cs-a结合的rvar2蛋白。为了检测结合的rvar2蛋白,在每一个孔中分别加入50μl用3%脱脂奶粉进行一千倍稀释的6*his polyclonal rabbit抗体,与板底rvar2蛋白中的6*his标签特异性结合2h,随后用pbst洗涤三次后,加入两千倍稀释的horseradish peroxidase(hrp)-conjugated streptavidin goat anti-rabbit二抗来识别一抗,1h后用pbst洗涤三次除去多余抗体。最后按50μl/孔加入tmb溶液黑暗中显色30min,酶标仪biotek cytation 5imaging reader(biotek,usa)检测光吸收值。结合强度通过其在450nm处的光吸收值来表示,结果如图5所示。
102.由图5可知,经过endobi4sf处理后与rvar2共孵育的cs-a多糖部分失去了竞争性抑制rvar2与96孔板固定化cs-a结合的能力,说明4-o-硫酸基团是使rvar2蛋白可以特异性识别cs-a的一个决定因素,而硫酸酯酶也可以作为一个研究多糖与蛋白相互作用的重要工具酶。
103.实施例9、将rvar2-stgfp应用于endobi4sf去硫酸化效果检测
104.在含0.1μg/孔的cs-a的96孔板中(所述cs-a由生物素-亲和素系统固定)中分别加入endobi4sf和csase abc酶,37℃处理30min,pbs洗三次洗去添加的酶,按0.5μg/孔加入rvar2-stgfp,在37℃、黑暗下中孵育30min使rvar2-stgfp与固定化的多糖链结合,然后加入pbs洗三次洗去未结合的荧光蛋白,每孔加入100μl的pbs,酶标仪biotek cytation5imaging reader(biotek,usa)检测其荧光强度。结合强度通过检测激发光:490nm,发射光520nm的强度来表示,结果如图6所示。
105.由图6可知,rvar2-stgfp与cs-a有显著结合的能力。经过endobi4sf处理后,跟
csase abc酶相似的是,rvar2-stgfp与板上固定化的cs-a的结合能力显著减弱,说明cs-a经过硫酸酯酶处理失去4-o-硫酸基团后,失去了rvar2-stgfp对其的特异性识别能力从而导致荧光强度减弱,说明endobi4sf能够作用于固定化cs-a多糖中的4-o-硫酸基团,且rvar2-stgfp可应用于硫酸酯酶去硫酸化作用效果的检测。
106.实施例10、endobi4sf处理对cs-e抑制wnt细胞信号通路能力的影响
107.外源cs-e可高亲和力结合wnt-3a,显著竞争性抑制wnt细胞信号通路。为了研究外源cs-e中4-o-硫酸基团在cs-e抑制wnt细胞信号通路中的关键作用,我们向在24孔板中培养的nih3t3细胞中分别加入未经硫酸酯酶处理的cs-e和cs-c、经endobi4sf处理后的cs-e和cs-c至终浓度为20μg/ml,在l培养基和wnt3a cm培养基中分别培养24h(所述l培养基和wnt3a cm培养基由l细胞经转染plncx空载体和plncx-wnt 3a质粒后在dmem培养基中连续培养三天后收集培养上清制备得到),然后进行荧光素酶活力检测,结果如图7所示。
108.由图7可知,cs-e显著抑制wnt-3a诱导的荧光素酶活性,而endobi4sf处理产生的去硫酸化作用几乎完全解除了外源cs-e对wnt细胞信号通路的抑制作用,说明4-o-硫酸化在cs-e抑制wnt细胞信号通路的过程中发挥关键作用,进一步证明了endobi4sf是研究cs/ds结构功能关系的有力工具。
109.实施例11、endobi4sf处理后细胞表面多糖的二糖组成分析
110.分别收集6盘37℃培养的4t1细胞和hela细胞,然后分别加入20mg的endobi4sf进行处理,对处理后的细胞依次进行丙酮和无水乙醇处理进行脱水脱脂、蛋白酶处理,tca处理去除蛋白后,经乙醇沉淀收集细胞表面多糖并利用pd-10desalting column对其进行脱盐处理。向提取到的细胞总gags中加入csase abc处理并对产物进行2-ab标记,对其二糖组成进行分析,结果如图8所示。
111.由图8可知,经endobi4sf处理后细胞的总gags中4-o-硫酸化的cs二糖单元含量显著降低,且相应的非硫酸化o unit二糖单元数量升高,说明endobi4sf在复杂的细胞表面环境中依然能够发挥作用,表明其在细胞表面4-o-硫酸化的cs/ds的结构和功能研究中具有重要的应用潜力。
112.实施例12、细胞elisa实验检测endobi4sf对细胞表面多糖的降解活性
113.将细胞4t1、hela和hek 293t分别接种到96孔板中,分为细胞实验组、阳性对照组和阴性对照组,待细胞贴壁生长至细胞密度80%时,吸出上层培养基,加入4%的多聚甲醛将细胞固定在板底,用1% bsa封闭两小时,pbs洗一遍后向三组细胞实验组孔中分别按40μg/50μl/孔加入pbs缓冲液稀释的endobi4sf,阳性对照组孔按8μg/50μl/孔加入csase abc酶,阴性对照组孔加入相同体积的bsa,37℃反应30min,每组实验设三组平行。用pbs洗三次洗去多余酶终止反应后,分别加入0.4μg生物素化的cs-a结合蛋白rvar2(bio-rvar2),与处理后的细胞在37℃下共孵育1.5h。再用pbs洗三次洗去多余未结合的bio-rvar2,加入两千倍稀释的hrp-conjugated streptavidin抗体,孵育1h后用pbst洗涤三次除去多余抗体。最后按50μl/孔加入tmb溶液黑暗中显色30min,酶标仪biotek cytation 5imaging reader(biotek,usa)检测光吸收值,结合强度通过其在450nm处的光吸收值来表示,结果如图9所示。
114.由图9可知,endobi4sf处理后的细胞样品(细胞实验组)在450nm处的光吸收值有显著降低,这个结果与用csase abc酶处理(阳性对照组)相同,表明经硫酸酯酶处理的细胞
其表面失去被bio-rvar2特异性识别的能力,进一步证明了endobi4sf可以作用于细胞表面4-o-硫酸化的多糖,为各种硫酸化模式多糖在细胞水平上的结构功能研究奠定了基础。
115.实施例13、激光扫描共聚焦显微镜用于endobi4sf对细胞表面多糖处理效果的可视化检测
116.将细胞4t1和hela分别接种到经多聚赖氨酸处理的细胞爬片的24孔板中,分为细胞实验组、阳性对照组和阴性对照组,,培养至细胞密度70%-80%时吸出上层培养基,加入4%的多聚甲醛室温封闭10min,后弃上清,加入1%的bsa封闭2h,向细胞实验组每孔加入400μg的endobi4sf,向性对照组每孔加入8μg的csase abc酶,阴性对照组每孔加入相同体积的bsa,在37℃下处理30min,pbs洗三次洗去多余的酶终止反应后,三组均按30μg/孔加入rvar2-stgfp荧光探针室温下与细胞共孵育30min。之后用pbs洗三次以洗去过量的未结合的蛋白,在1%的bsa中用dapi进行细胞核染色,制片后用激光扫描共聚焦显微镜scanning laser microscope lsm 700(carl zeiss inc.,germany)进行观察,检测结果如图10所示。
117.由图10可知,未经酶处理的细胞(阴性对照组)的细胞表面多糖能被rvar2-stgfp荧光探针特异性识别并染色呈现绿色;经过endobi4sf处理的细胞(细胞实验组)并不能被rvar2-stgfp完全染色,说明endobi4sf的处理使细胞表面的多糖失去了绝大多数与荧光探针rvar2-stgfp特异性识别的能力,表明此硫酸酯酶具有降解细胞表面多糖的4-o-硫酸基团的能力并影响其与rvar2-stgfp的特异性结合。但与硫酸酯酶相比,csase abc酶处理的细胞(阳性对照组)表面经rvar2-stgfp染色的程度相对更弱,说明硫酸酯酶作用于细胞表面多糖时仍有部分4-o-硫酸基团未能被完全去除,说明这些硫酸基团可能与某些细胞表面及细胞外的物质成分相互作用,抑制了酶与底物的结合使酶无法完全作用于这些硫酸根。
118.实施例14、endobi4sf对各种不同细胞系表面多糖的降解效果的流式细胞分析
119.在37℃下分别培养4t1、a549、hela、hepg2、hek 293t、hep3b、huh-7、ht29和p815细胞,待细胞贴壁生长且生长至细胞密度为80%时,收集板上细胞然后分别加入endobi4sf至终浓度0.5μg/μl处理30min,pbs洗三次洗去多余的酶终止反应后,加入5μg检测探针rvar2-stgfp至终浓度50μg/ml与细胞共孵育30min,之后用pbs洗三次以洗去过量的未结合的蛋白,细胞荧光强度通过流式细胞仪acea novocyte flow cytometer(agilent,usa)进行检测来表示结合强度,荧光检测的检测波长分别是激发光:490nm,发射光520nm,实验结果如图11所示。
120.由图11可知,经过endobi4sf处理后的细胞样品,荧光强度均表现出一定程度的降低。其中,4t1、a549、hela、hepg2和hek 293t细胞的强度降低最明显,说明endobi4sf亦可作用于活细胞表面的4-o-硫酸化的糖胺聚糖。另外与前几种细胞相比,hep3b2.1-7、huh-7、ht29和p815细胞在经过此硫酸酯酶处理后荧光强度降低不如上述细胞明显,说明endobi4sf对活细胞表面多糖的处理效果因细胞种类的不同而有所差异,可能是不同细胞表面不同4-o-硫酸化的糖胺聚糖的含量和细胞表面环境导致的。
121.实施例15、endobi4sf对细胞活力的影响
122.为了检测endobi4sf的添加是否会对细胞产生毒性,通过同一时间(4h)不同酶量(0.5,1,2,3,4mg/ml)和相同酶量(1mg/ml)不同时间(0,2,4,8,12,24,36,48,60h)的mtt实验进行验证,细胞培养结束后加入mtt至终浓度0.5μg/μl,置于37℃额外培养4h,弃上清,向沉淀中加入100μl的dmso溶解并检测od570nm处的吸光值。实验结果如图12所示。
123.由图12可知,endobi4sf对细胞无毒性,具有良好的生物相容性和细胞生物学研究应用价值。
124.实施例16、endobi4sf与透明质酸酶(haase)协同作用效果的体外检测
125.为了验证endobi4sf与haase的协同作用,首先用10u的haase分别降解未经处理的cs-a,以及经endobi4sf进行去硫酸化后的cs-a,然后分别反应不同的时间(0.5,1,5,10,20,30,60min),反应结束后灭活取上清,通过dns法对haase的降解活性进行检测,结果如图13a所示。
126.由图13a可知,haase降解经endobi4sf进行去硫酸化处理后的cs-a的降解速率要显著高于其降解富含4-o-硫酸化的cs-a的降解速率,表明endobi4sf的去硫酸化作用能够有效促进haase对cs的降解能力。
127.为了进一步验证endobi4sf与haase的协同作用,我们用10u的haase和不同剂量的endobi4sf(0.1、0.2、0.4、0.5、0.6、1、2和10u)混合处理cs-a 10min,并同样用dns法对haase降解活性进行检测,结果如图13b所示。
128.由图13b可知,随着硫酸酯酶剂量的增加,haase降解cs-a的活性得到了明显的增强,在haase与endobi4sf的比例达到5:1的时候其活性达到最强,进一步证明了haase与endobi4sf在降解4-o-硫酸化cs-a的过程中存在协同作用,为其体内应用研究奠定了基础。
129.实施例17、在动物体内对endobi4sf与透明质酸酶(haase)协同作用效果的检测
130.分别将100u的endobi4sf,500u的haase和两种酶的混合样品通过尾静脉注射至18~20g的昆明小鼠体内,反应30min后通过同样的方式注射400μg的rvar2-stgfp荧光蛋白,20min后,将小鼠安乐死,将其器官取出用凝胶成像仪fluor chem q cell biosciences检测其各器官的荧光强度,检测结果如图14所示。
131.由图14可知,与未加酶处理的对照组小鼠相比,注射endobi4sf与haase的小鼠肺部和肝脏荧光强度显著降低且比分别注射这两种酶的实验组小鼠(按照相同剂量分别注射endobi4sf和haase)还要低,说明endobi4sf与haase可协同作用降解器官各细胞表面的cs/ds多糖且硫酸酯酶的加入使haase得到了更利于其降解的底物,加强了haase的作用效果,证明endobi4sf也可以应用于动物体内不同硫酸化模式cs/ds的相关研究。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1