一种芳基并杂环化合物及其制备方法和用途
1.本发明涉及药物化学和药物治疗学领域。具体而言,本发明涉及一种由通式i所表示的并环系列化合物及立体异构体、其制备方法、手性拆分方法、包含该化合物的药物组合物及其用途。本发明提供的由通式i所表示的化合物与单胺类转运蛋白有较高的结合活性。因此本发明的并环类化合物可以用于预防或治疗精神分裂症、抑郁症、焦虑症等精神类疾病。
背景技术:
2.精神疾病是指在各种生物学、心理学以及社会环境因素影响下,人体出现大脑功能失调,导致认知、情感、意志和行为等精神活动出现不同程度障碍为临床表现的疾病。通常精神类疾病包括精神分裂症、抑郁症、焦虑症、注意力缺陷障碍、意志缺失、自闭症等等,一大主要病因是大脑内单胺类神经递质如去甲肾上腺素、多巴胺等失去平衡,对患者个人和社会均产生严重的危害。
3.以抑郁症为例,其在成年人中的患病率达到了10%~20%,是影响全球公共卫生安全的第四大疾病。根据最新统计数据,我国抑郁症患者达到9000万以上,在发病率逐年升高的同时呈现低龄化趋势。抑郁症具有机制复杂、亚型较多、诊断困难且患者个体差异大等特点,这给抑郁症的治疗带来了巨大挑战。现有抗抑郁药主要是根据单胺神经递质假说设计开发的,药物通过增加神经突触间隙的单胺递质水平或增强相关的神经系统功能起效。目前临床一线抗抑郁药物主要为选择性5-羟色胺重摄取抑制剂(ssris)和5-羟色胺、去甲肾上腺素双重重摄取抑制剂(snris)。这些药物在长期临床实践中被证实存在快感缺乏、认知功能低下和性功能障碍等副作用,且起效缓慢、治疗无效率高,不利于患者建立治疗的信心,甚至出现青少年患者自杀风险升高的问题。
4.研究显示,在snris的基础上增加对多巴胺转运体抑制作用的5-羟色胺(5-ht)、去甲肾上腺素(ne)、多巴胺(da)三重再摄取抑制剂(tris)能够改善患者快感缺乏等症状,具有起效更快、疗效更好等优势。因此,tris被认为是通过优化单胺策略开发新型抗抑郁药物的重要方向。基于tris对大脑内单胺类递质的调节作用,其也被广泛用于精神分裂症、焦虑症、注意力缺陷障碍、自闭症、肥胖以及神经性疼痛等疾病的治疗研究。此外,对单胺能系统中的其它受体如5-ht受体或da受体进行调节,进而平衡大脑内的神经递质,对精神类疾病及其它相关疾病起到治疗效果。
技术实现要素:
5.本发明的第一个目的在于提供一种具有单胺类转运体蛋白结合活性的并环化合物,包括其立体异构体或其药学上可接受的盐、前药或溶剂化物。该类化合物可以用于预防、诊断和治疗精神分裂症、抑郁症、焦虑症、注意力缺陷障碍、疼痛、神经退行性疾病等中枢系统疾病以及肥胖症和肥胖相关疾病。
6.本发明的第二个目的在于提供上述并环化合物的制备方法。
7.本发明的第三个目的在于提供上述并环化合物的手性拆分方法。
8.本发明的第四个目的在于提供由通式i表示的并环化合物、其立体异构体及其药学上可接受的盐、前药或其溶剂化物的药物组合物。
9.为了达到本发明的目的,采用了以下技术方案:
10.本发明提供了如式(i)所示的化合物,
[0011][0012]
环a选自5-7元杂芳基或芳基,所述5-7元杂芳基或芳基被1-3个卤素、氨基、羟基、c
1-c4烷基、c
1-c3烷氧基、c
2-c4烯基或三氟甲基任选地取代;
[0013]
m是1、2或者3;优选地,m为1或2;
[0014]
n是1、2或者3;优选地,n为1或2;
[0015]
r1和r2各自独立地是(i)氢、c
1-c4烷基、c
1-c3烷氧基、c
2-c4烯基、c
2-c4炔基、3-5元环烷基、c
5-c
10
芳基或5-10元芳烷基;
[0016]
所述c
1-c4烷基、c
1-c3烷氧基、c
2-c4烯基、c
2-c4炔基、3-5元环烷基被1-3个卤素、氨基、3-5元环烷基任选地取代;所述c
5-c
10
芳基或5-10元芳烷基被1-3个卤素、氨基、c
1-c4烷基、c
1-c3烷氧基或三氟甲基任选地取代;
[0017]
或者(ii)r1和r2与它们所连接的氮原子一起形成5-7元杂环基,所述5-7元杂环基被苯甲基、c
1-c4烷基任选地取代;所述苯甲基被1-3个卤素、氨基、硝基、羟基、c
1-c4烷基任选地取代;
[0018]
r3和r4各自独立地是(i)氢、c
1-c4烷基、c
1-c3烷氧基、c
2-c4烯基、c
2-c4炔基、3-5元环烷基、5-10元芳基或杂芳基、5-10元芳烷基或杂芳烷基;
[0019]
所述c
1-c4烷基、c
1-c3烷氧基、c
2-c4烯基、c
2-c4炔基、3-5元环烷基被1-3个卤素、氨基任选地取代,所述5-10元芳基或杂芳基、5-10元芳烷基或杂芳烷基被1-3个卤素、氨基、c
1-c4烷基、c
1-c3烷氧基、三氟甲基、苯基任选地取代;
[0020]
或者(ii)r3和r4与它们连接的碳原子一起形成3-6元环烷基,所述3-6元环烷基被1-3个卤素、氨基任选地取代。
[0021]
在一些实施例中,环a选自被1-2个卤素、氨基、羟基、c
1-c4烷基、c
1-c3烷氧基、c
2-c4烯基或三氟甲基任选取代的噻吩、呋喃或苯环。
[0022]
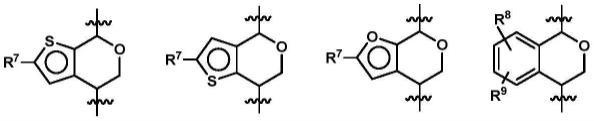
在一些实施例中,环a并二氢吡喃的结构单元具有如下结构:
[0023][0024]
r7是氢、卤素、c
1-c4烷基或c
1-c3烷氧基;
[0025]
r8和r9独立地选自氢、卤素、c
1-c4烷基、c
1-c3烷氧基或羟基。
[0026]
在一些实施例中,环a并二氢吡喃的结构单元选自如下结构:
[0027][0028]
在一些实施例中,r1和r2各自独立地是(i)氢、c
1-c4烷基、c
1-c3烷氧基、3-5元环烷基或甲基环丙基;或者(ii)r1和r2与它们所连接的氮原子一起形成5-7元含1-2个氮原子的杂环基,所述5-7元含1-2个氮原子的杂环基可被苯甲基任选地取代;所述苯甲基被1-3个卤素、氨基、硝基、羟基、c
1-c4烷基任选地取代;优选地,所述5-7元含1-2个氮原子的杂环基包括四氢哌啶、四氢哌嗪。
[0029]
在一些实施例中,r1和r2各自独立地是h、-ch3、-ch2ch3或-ch2ch2ch3;或者
[0030]
结构单元选自:
[0031][0032]
在一些实施例中,r3和r4各自独立地是(i)氢、c
1-c4烷基、3-5元环烷基、苯基或萘基;所述苯基或萘基可被1-3个卤素、氨基、c
1-c4烷基、c
1-c3烷氧基、三氟甲基或苯基任选地取代;
[0033]
或者(ii)r3和r4与它们连接的碳原子一起形成3-6元环烷基。
[0034]
在一些实施例中,r3和r4各自独立地是(i)氢、甲基、乙基、异丙基、甲氧基、三氟甲基,或选自如下结构:
[0035]
[0036]
或者(ii)r3和r4与它们连接的碳原子一起形成3-6元环烷基。
[0037]
在本发明的一些实施方案中,式(i)具有如下结构:
[0038][0039]
其中:
[0040]
r5和r6各自独立地是(i)氢、卤素、c
1-c4烷基、c
1-c3烷氧基、三氟甲基、三氟甲氧基、苯基或5-10元芳烷基;或者(ii)r5和r6与它们连接的碳原子一起形成6-10元芳基;
[0041]
r7选自氢、卤素或c
1-c4烷基。
[0042]
其中,r1和r2各自独立地是(i)氢、c
1-c4烷基或甲基环丙基;或者(ii)r1和r2与它们所连接的氮原子一起形成5-7元含1-2个氮原子的杂环基,所述5-7元含1-2个氮原子的杂环基可被苯甲基任选地取代;所述苯甲基被1-3个卤素、氨基、硝基、羟基、c
1-c4烷基任选地取代;
[0043]
优选地,所述5-7元含1-2个氮原子的杂环基包括四氢哌啶和四氢哌嗪。
[0044]
在一些实施例中,(ia)和(ib)具有如下结构:r1和r2各自独立地是氢、甲基、乙基、正丙基或甲基环丙基;或者结构单元选自:
[0045][0046]
结构单元选自:
[0047]
[0048]
在本发明的一些实施方案中,式(i)具有如下结构:
[0049][0050]
其中:
[0051]
r1和r2各自独立地是(i)氢、c
1-c4烷基;或者(ii)r1和r2与它们所连接的氮原子一起形成5-7元含1-2个氮原子的杂环基,所述5-7元含1-2个氮原子的杂环基可被苯甲基任选地取代;所述苯甲基被1-3个卤素、氨基、硝基、羟基、c
1-c4烷基任选地取代;
[0052]
优选地,所述5-7元含1-2个氮原子的杂环基包括四氢哌啶和四氢哌嗪;
[0053]
r5和r6各自独立地是(i)氢、卤素、c
1-c4烷基、c
1-c3烷氧基、三氟甲基、三氟甲氧基、苯基或5-10元芳烷基;或者(ii)r5和r6与它们连接的碳原子一起形成6-10元芳基;
[0054]
r7选自氢、卤素、c
1-c4烷基。
[0055]
优选地,ic选自:r1和r2各自独立地是氢,c
1-c4烷基;r5和r6各自独立地是(i)氢、卤素、c
1-c4烷基、c
1-c3烷氧基、三氟甲基、三氟甲氧基、苯基或5-10元芳烷基;或者(ii)r5和r6与它们连接的碳原子一起形成6-10元芳基;r7是氢。
[0056]
更为优选地,ic选自:r1和r2各自独立地是氢、甲基、乙基或正丙基;r5和r6各自独立地是氢、甲基、甲氧基、三氟甲基或卤素;r7是氢。
[0057]
在本发明的一些实施方案中,式(i)具有如下结构:
[0058][0059]
其中:
[0060]
r1和r2各自独立地是(i)氢、c
1-c4烷基;或者(ii)r1和r2与它们所连接的氮原子一起形成包括5-7元含1-2个氮原子的杂芳环,所述5-7元含1-2个氮原子的杂芳环可被苯甲基任选地取代;所述苯甲基被1-3个卤素、氨基、硝基、羟基、c
1-c4烷基任选地取代;
[0061]
优选地,所述5-7元含1-2个氮原子的杂芳环包括四氢哌啶和四氢哌嗪;
[0062]
r3和r4各自独立地是(i)氢、c
1-c4烷基、3-5元环烷基,所述c
1-c4烷基、3-5元环烷基可被1-3个卤素、氨基、c
1-c4烷基、c
1-c3烷氧基、三氟甲基或苯基任选地取代;或者(ii)r3和r4与它们连接的碳原子一起形成3-6元环烷基;
[0063]
r7选自氢、卤素、c
1-c4烷基。
[0064]
优选地,id选自:r1和r2各自独立地是氢,c
1-c4烷基;r3和r4各自独立地是(i)氢、c1-c4烷基或3-5元环烷基;或者(ii)r3和r4与它们连接的碳原子一起形成3-6元环烷基;r7是氢。
[0065]
更为优选地,id选自:r1和r2各自独立地是氢、甲基、乙基或正丙基;r3和r4各自独立地是(i)氢、甲基、乙基、异丙基或环丙基甲基;或者(ii)r3和r4与它们连接的碳原子一起形成环丙基、环丁基或者环戊基;r7是氢。
[0066]
在本发明的一些实施方案中,式(i)具有如下结构:
[0067][0068]
其中:
[0069]
r1和r2各自独立地是(i)氢、c
1-c4烷基;或者(ii)r1和r2与它们所连接的氮原子一起形成5-7元含1-2个氮原子的杂环基,所述5-7元含1-2个氮原子的杂环基可被苯甲基任选地取代;所述苯甲基被1-3个卤素、氨基、硝基、羟基、c
1-c4烷基任选地取代;
[0070]
优选地,所述5-7元含1-2个氮原子的杂芳环包括四氢哌啶和四氢哌嗪;
[0071]
r5和r6各自独立地是(i)氢、卤素、c
1-c4烷基、c
1-c3烷氧基、三氟甲基、三氟甲氧基、苯基或5-10元芳烷基;或者(ii)r5和r6与它们连接的碳原子一起形成6-10元芳基;
[0072]
r8和r9各自独立地是氢、c
1-c4烷基、烷氧基或羟基。
[0073]
优选地,ie选自:r1和r2各自独立地是氢或c
1-c4烷基;r5和r6各自独立地是(i)氢、卤素、c
1-c4烷基、c
1-c3烷氧基、三氟甲基、三氟甲氧基、苯基或5-10元芳烷基;或者(ii)r5和r6与它们连接的碳原子一起形成6-10元芳基;r8和r9各自独立地是氢、c
1-c4烷基、烷氧基或羟基。
[0074]
更为优选地,ie选自:r1和r2各自独立地是氢、甲基、乙基或正丙基;r5和r6各自独立地是氢、甲基、甲氧基、三氟甲基或卤素;r8和r9各自独立地是氢、甲基、甲氧基或羟基。
[0075]
在本发明的一些实施方案中,式(i)具有如下结构:
[0076][0077]
其中:
[0078]
r1和r2各自独立地是(i)氢、c
1-c4烷基;或者(ii)r1和r2与它们所连接的氮原子一起形成包括但不仅限于四氢哌啶、四氢哌嗪等5-7元含1-2个氮原子的杂环基,所述5-7元含
1-2个氮原子的杂环基可被苯甲基任选地取代;所述苯甲基被1-3个卤素、氨基、硝基、羟基、c
1-c4烷基任选地取代;
[0079]
r3和r4各自独立地是(i)氢、c
1-c4烷基、3-5元环烷基,所述c
1-c4烷基、3-5元环烷基可被1-3个卤素、氨基、c
1-c4烷基、c
1-c3烷氧基、三氟甲基或苯基任选地取代;或者(ii)r3和r4与它们连接的碳原子一起形成3-6元环烷基;
[0080]
r8和r9各自独立地是氢、c
1-c4烷基、烷氧基或羟基。
[0081]
优选地,if选自:r1和r2各自独立地是氢,甲基,乙基,正丙基;r3和r4各自独立地是(i)氢、甲基、乙基、异丙基、环丙基甲基;或者(ii)r3和r4与它们连接的碳原子一起形成环丙基、环丁基或者环戊基;r8和r9是氢、甲基、甲氧基、羟基。
[0082]
本发明公开了所涉及的如式i所示的化合物及其立体异构体,药学上可接受的盐在制备用于预防、治疗和诊断抑郁症、焦虑症、精神分裂症、注意力缺陷障碍、肥胖症、神经性疼痛以及神经退行性疾病的药物中的用途。本发明所涉及的如式i所示的化合物及其立体异构体,经生物活性测试证明均具有单胺类转运体蛋白以及5-羟色胺受体和多巴胺受体等gpcr受体结合活性,其中所述单胺转运蛋白选自5-羟色胺转运蛋白(sert)、多巴胺转运蛋白(dat)、去甲肾上腺素转运蛋白(net)中的一种或多种蛋白。
[0083]
本发明中,
[0084]
本发明中所述的氢包括氢的各种同位素,如氘和氚;
[0085]
术语“烃”(无论其单独使用或作为另一基团的一部分使用)是指包含碳原子和氢原子的任何结构;
[0086]
术语“烷基”是指直链或支链的饱和烃基,其中烷基可以任选地被一个或多个取代基取代,所述烷基包括但不限于甲基、乙基、丙基(包括所有同分异构形式)、正丙基、异丙基、丁基(包括所有同分异构形式)、正丁基、异丁基、叔丁基;
[0087]
术语“环烷基”用于表示非芳族碳环基,包括环化的烷基,环烷基可以包括二环或多环系统;所述环烷基包括但不限于环丙基、环丁基、环戊基、环已基、环庚基、十氢荼基和金刚烷基;
[0088]
术语“杂环基”用于表示含有杂原子n、o、s的非芳族碳环,所述杂环基包括但不限于四氢吡咯、四氢吡啶、四氢吡嗪;
[0089]
术语“烷氧基”用于表示-o-烷氧基基团;
[0090]
术语“芳基”是指单环芳基和/或包含至少一个芳香烃环的多环单价芳基;所述芳基包括但不限于苯基、萘基、蒽基、菲基和联苯基;
[0091]
术语“杂芳基”是指含有杂原子n、o、s的单环杂芳基和/或包含至少一个芳香烃环的多环单价杂芳基;所述杂芳基包括但不限于噻吩、呋喃、吡咯;
[0092]
术语“卤素”用于表示氟、氯、溴和碘;
[0093]
术语"药学上可接受的盐"是指由药学上可接受的无毒的酸制备而成的盐,包括无机酸和有机酸。合适的无毒酸包括无机和有机酸,但不限于,例如乙酸、海藻酸、邻氨基苯甲酸、苯磺酸、苯甲酸、棒脑磺酸、拘橡酸、乙烯基磺酸、甲酸、延胡索酸、呋喃甲酸、葡糖酸、谷氨酸、葡萄糖醛酸、半乳糖醛酸、环氧丙酸、氢溴酸、盐酸、乳酸、顺丁烯二酸、苹果酸、扁桃酸、甲磺酸、半乳糖二酸、硝酸、帕莫酸(pamoic)、泛酸、苯乙酸、丙酸、磷酸、水杨酸、硬脂酸、琥珀酸、硫酸、酒石酸等。
[0094]
术语"溶剂化物"是指本发明提供的化合物或其盐还包括与化学计量或者非化学计量量的溶剂以非共价的分子间力结合。当该溶剂是水时该溶剂化物是水合物。
[0095]
术语"立体异构体"包括所有对映异构/立体异构纯的和对映异构/立体异构富集的本发明化合物。
[0096]
化学结构式中的虚线和粗线用于表示一个或多个立体中心的化学结构,指示化学结构中立体中心的绝对立体化学结构。
[0097]
在本发明中,结构式中所描述的键并非表示较优的立体结构;含有一个或多个立体中心的化学结构包含所有可能的立体异构体形式及其混合物。
[0098]
本发明中,通过下述合成路线制备通式i的化合物,该合成方法仅为示例性的说明本发明,而并非将其限制于该发明。
[0099]
式ia化合物的合成:
[0100][0101]
反应步骤如下:
[0102]
i.以化合物1为原料,与相应的卤代芳烃反应生成化合物2。
[0103]
ii.化合物2经氢化铝锂还原得到化合物3。
[0104]
iii.化合物3与相应的胺试剂反应生成化合物4。
[0105]
iv.化合物4与相应的卤代烃反应生成化合物5。
[0106][0107]
v.化合物3与相应的胺试剂反应生成化合物6。
[0108][0109]
vi.化合物3与伯胺试剂反应生成化合物7。
[0110]
vii.化合物7与相应的卤代烃反应生成化合物8。
[0111][0112]
viii.化合物7与相应芳香基取代的卤代烃反应生成化合物9。
[0113][0114]
ix.以化合物10为原料,与相应的溴代噻吩反应生成化合物11。
[0115]
x.化合物11经氢化铝锂还原得到化合物12。
[0116]
xi.化合物12与相应的胺试剂反应生成化合物13。
[0117]
式ib化合物的合成:
[0118][0119]
反应步骤如下:
[0120]
xii.以化合物14为原料,与相应的卤代芳烃反应生成化合物15。
[0121]
xiii.化合物15经氢化铝锂还原得到化合物16。
[0122]
xiv.化合物16与相应的胺试剂反应生成化合物17。
[0123][0124]
xv.化合物16和tbscl反应生成化合物18。
[0125]
xvi.化合物18在n-buli的作用下与相应试剂反应得到化合物19。
[0126]
xvii.化合物19和相应的胺试剂反应生成化合物20。
[0127]
式ic化合物的合成:
[0128][0129]
反应步骤如下:
[0130]
xviii.以化合物10为原料,与溴代呋喃反应生成化合物21。
[0131]
xix.化合物21经氢化铝锂还原得到化合物22。
[0132]
xx.化合物22和相应的胺试剂反应得到化合物23。
[0133]
式id化合物的合成:
[0134][0135]
反应步骤如下:
[0136]
xxi.以化合物1为原料,与相应的卤代脂肪烃反应得到化合物24。
[0137]
xxii.化合物24经氢化铝锂还原得到化合物25。
[0138]
xxiii.化合物25和相应的胺试剂反应得到化合物26。
[0139][0140]
反应步骤如下:
[0141]
xxiv.以化合物27为原料,与相应的卤代脂肪烃反应得到化合物28。
[0142]
xxv.化合物28经水解得到化合物29。
[0143]
xxvi.化合物29经氢化铝锂还原得到化合物30。
[0144]
xxvii.化合物30和相应的胺试剂反应得到化合物31。
[0145]
式ie化合物的合成:
[0146][0147]
反应步骤如下:
[0148]
xxviii.以化合物32为原料,与相应的卤代芳烃反应生成化合物33。
[0149]
xxix.化合物33经氢化铝锂反应得到化合物34。
[0150]
xxx.化合物34和相应的胺试剂反应得到化合物35。
[0151][0152]
xxxi.以化合物36为原料,和相应的卤代芳烃反应得到化合物37。
[0153]
xxxii.化合物37还原得到化合物38。
[0154]
xxxiii.化合物38经氢化铝锂还原得到化合物39。
[0155]
xxxiv.化合物39和相应的胺试剂反应得到化合物40。
[0156]
式if化合物的合成:
[0157][0158]
xxxv.以化合物41为原料,与相应的卤代脂肪烃反应得到化合物42。
[0159]
xxxvi.化合物42经水解得到化合物43。
[0160]
xxxvii.化合物43经氢化铝锂还原得到化合物44。
[0161]
xxxviii.化合物44和相应的胺试剂反应得到化合物45。
[0162]
本发明所提供的如式i所示的化合物及其立体异构体具有单胺类转运体蛋白结合活性,其中所述单胺转运蛋白选自5-羟色胺转运蛋白(sert)、多巴胺转运蛋白(dat)、去甲肾上腺素转运蛋白(net)中的一种或多种蛋白,可用于精神分裂症、抑郁症、注意力缺陷障碍、神经性疼痛、神经退行性疾病等中枢系统疾病以及肥胖症和肥胖相关疾病的预防、诊断和治疗。
具体实施方式
[0163]
以下结合实施例对本发明做进一步的说明,但是这些实施例并不限制本发明的范围。
[0164]
实验及样品分析所用仪器:
[0165]1hnmr在varian mercury plus 400核磁共振仪上测定,
13
cnmr在bruker 600mhz核磁共振仪上测定。ls-ms由agilent 1100series lc/msd1946d型质谱仪测定。特殊化学试剂购自探索、毕得、安耐吉、sigma、alfa、acros和adamas等试剂公司。一般化学试剂购自国药集团上海化学试剂公司。主要溶剂包括石油醚,乙酸乙酯,二氯甲烷,甲醇等,购自国药集团,均为合成级。柱层析硅胶采用黄海化工厂化学纯硅胶,一般为200-300目。试剂处理方法参照purification of laboratory chemicals(1988年版)处理。
[0166]
实施例
[0167]
实施例1:n-甲基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0168][0169]
合成路线:
[0170][0171]
reagents and conditions:(i)etmgcl,(ipr)2nh,thf,50℃,3h;pd(tbu3p)2,thf,60℃,3h;(ii)lialh4,thf,rt,3h;(iii)cf3so3h,1,4-dioxane,80℃,3h.
[0172]
反应步骤:
[0173]
i.将1.0g 3-噻吩乙酸(7.04mmol,1.0eq)加入100ml的三口烧瓶中,加10ml无水四氢呋喃使其固体完全溶解,用氮气对烧瓶进行置换三次,再向溶液加入70mg二异丙胺(0.70mmol,0.1eq)。在冰浴下缓慢滴加8.8ml格氏试剂乙基氯化镁(2.4m in thf,21.12mmol,3.0eq),滴加过程中有大量气泡产生,并且剧烈放热,加入完毕后上述混合物在50℃下搅拌3小时,随后降至室温。将1.3g溴苯(8.45mmol,1.2eq)和107mg三叔丁基膦钯(0.21mmol,0.03eq)溶于10ml无水四氢呋喃后加入烧瓶中,升至60℃搅拌3小时,将体系降至室温,向烧瓶中缓慢滴加2n的盐酸溶液调节ph至4~6,有大量固体析出,过滤出去固体,滤液加乙酸乙酯(30ml x 3)和水(20ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,滤液浓缩得黑色油状物,使用硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~20/1)得到1.0g黄色油状物2-a,收率:65%。esi-ms(m-h)-:217.2。
[0174]
ii.将150mg 2-a(0.49mmol,1.0eq)加入50ml规格的圆底烧瓶中,加10ml干燥的四氢呋喃使之完全溶解,将体系用氮气置换三次,冰水浴下向烧瓶中缓慢滴加0.6ml氢化铝锂
(2.5m in thf,1.47mmol,3.0eq),滴加完毕后移出冰浴,室温下搅拌反应3小时,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,向其中缓慢滴加naoh溶液(1mol/l),至大量沉淀生成,过滤得滤液,滤饼加乙酸乙酯洗涤。所得滤液用乙酸乙酯(20ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,硅胶柱层析进行分离(石油醚/乙酸乙酯=10/1)得到104mg淡黄色油状物3-a,收率:78%。esi-ms(m+h)
+
:205.2.
[0175]
iii.将100mg 3-a(0.36mmol,1.0eq)加入50ml规格的圆底烧瓶中,加入5ml无水1,4-二氧六环使其溶解,再向烧瓶中加入128mg甲氨基乙醛缩二甲醇(1.08mmol,3.0eq)和286mg三氟甲磺酸(1.8mmol,5.0eq),上述混合物在80℃下搅拌反应3小时,再滴加1n氢氧化钠水溶液调节反应液ph至10~11,用乙酸乙酯(20ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~10/1)得到84mg黄色油状物4-a,收率:66%。
[0176]
iv.1h nmr(400mhz,cdcl3)δ7.26
–
7.18(m,3h),7.14
–
1.04(m,3h),6.54(d,j=4.9hz,1h),5.28(d,j=8.8hz,1h),4.22(dd,j=11.2,5.3hz,1h),4.13
–
4.08(m,1h),3.62(t,j=10.2hz,1h),3.46(d,j=12.6hz,1h),3.17(dd,j=12.3,9.9hz,1h),2.78(s,3h).
13
c nmr(151mhz,cdcl3)δ141.37,139.48,138.24,136.97,130.84,128.05,127.90,127.57,126.97,126.84,126.65,126.39,123.97,123.76,120.67,118.56,70.08,69.94,68.82,53.37,42.45,41.65,33.73,29.08.esi-ms(m+h)
+
:260.1.hmrs:calc.for c
15h17
nos([m+h]
+
)260.1104,found 260.1112.
[0177]
实施例2:n-甲基-1-(4-(4-甲苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0178][0179]
合成路线及反应步骤:
[0180]
参照实施例1中所述步骤i-iii,用4-甲基溴苯替换步骤i中的溴苯,得黄色油状物4-b,总收率:23.4%。1h nmr(400mhz,cdcl3)δ7.15
–
7.09(m,3h),7.07
–
7.02(m,2h),6.57(d,j=5.1hz,1h),5.10
–
4.98(m,1h),4.23(dd,j=11.1,5.6hz,1h),4.18
–
4.09(m,1h),3.60(t,j=10.5hz,1h),3.06
–
2.89(m,2h),2.52(s,3h),2.33(s,3h).
13
c nmr(151mhz,cdcl3)δ137.21,137.04,136.07,135.16,128.66,127.81,126.55,122.39,74.07,71.23,56.86,42.82,35.84,20.43.esi-ms(m+h)
+
:274.1.hmrs:calc.for c
16h19
nos([m+h]
+
)274.1260,found 274.1265.
[0181]
实施例3:1-(4-(4-甲氧基苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)-n-甲基甲胺
[0182][0183]
合成路线及反应步骤:
[0184]
参照实施例1中所述步骤i-iii,用4-甲氧基溴苯替换步骤i中的溴苯,得黄色油状物4-c,总收率:22.8%。1h nmr(400mhz,cdcl3)δ7.15(d,j=4.9hz,1h),7.02(d,j=8.5hz,2h),6.82(d,j=8.6hz,2h),6.58(d,j=5.0hz,1h),5.22(d,j=8.1hz,1h),4.22(dd,j=11.2,5.5hz,1h),4.17
–
4.06(m,1h),3.78(s,3h),3.64
–
3.56(m,1h),3.40
–
3.33(m,1h),3.18
–
3.07(m,1h),2.74(s,3h).
13
c nmr(151mhz,cdcl3)δ158.35,139.01,134.78,132.22,128.87,123.60,122.30,113.32,73.89,70.77,55.00,54.63,41.91,35.47.esi-ms(m+h)
+
:290.1.hmrs:calc.for c
16h19
no2s([m+h]
+
)290.1209,found 290.1216.
[0185]
实施例4:n-甲基-1-(4-(4-(三氟甲基)苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0186][0187]
合成路线及反应步骤:
[0188]
参照实施例1中所述步骤i-iii,用4-三氟甲基溴苯替换步骤i中的溴苯,得黄色油状物4-d,总收率:19.2%。1h nmr(400mhz,cdcl3)δ7.56(d,j=8.1hz,2h),7.27(d,j=8.0hz,3h),7.14(d,j=5.1hz,1h),6.53(d,j=5.1hz,1h),5.03(t,j=5.6hz,1h),4.30
–
4.20(m,2h),3.61(td,j=12.2,5.4hz,1h),3.04
–
2.94(m,3h),2.52(s,3h).
13
c nmr(151mhz,cdcl3)δ144.35,135.78,135.74,128.27,127.91,126.12,124.93,122.95,74.13,70.58,56.91,56.72,43.04,35.86.esi-ms(m+h)
+
:328.1.hmrs:calc.for c
16h16
f3nos([m+h]
+
)328.0977,found 328.0984.
[0189]
实施例5:n-甲基-1-(4-(3,4-二氯苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)-甲胺
[0190][0191]
合成路线及反应步骤:
[0192]
参照实施例1中所述步骤i-iii,用3,4-二氯碘苯替换步骤i中的溴苯,得黄色油状物4-e,总收率:14.5%。esi-ms(m+h)
+
:328.0.hmrs:calc.for c
15h15
cl2nos328.0324,found 328.0329.
[0193]
实施例6:n-甲基-1-(4-(3,4-二氯苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)-甲胺(4-e)的顺反异构体分离
[0194]
分离方法:
[0195][0196]
将分离得到的4-e溶于甲醇后,用c18柱通过combiflash进行分离,设置洗脱溶剂为甲醇/水=1/100~100/1,将收集得到的流份通过hplc检测纯度,然后合并纯度》95%的流份,得到两组产物,分别减压除去溶剂后得油状物,将量多的产物部分命名为4-e-1,量少的部分命名为4-e-2;然后将未成功分离的组分重复上述操作进行再次分离,最终得到产物透明油状物4-e-1(收率:72%)和4-e-2(5%)为淡黄色油状物。通过h-nmr确认4-e-1为反式构型,4-e-2为顺式构型。
[0197]
4-e-1:反-n-甲基-1-(4-(3,4-二氯苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)-甲胺
[0198]1h nmr(400mhz,cdcl3)δ7.33(d,j=8.2hz,1h),7.27
–
7.23(m,2h),7.18(d,j=4.9hz,1h),7.00(d,j=8.2hz,1h),6.68(d,j=5.0hz,1h),4.99
–
4.88(m,1h),4.10
–
3.99(m,2h),3.93
–
3.84(m,1h),3.07
–
2.96(m,2h),2.53(s,3h).
13
c nmr(151mhz,cdcl3)δ143.64,135.96,134.99,132.39,132.28,130.74,130.56,130.34,130.25,130.14,127.67,127.62,127.10,126.53,126.48,124.67,124.59,124.17,74.30,73.88,73.71,70.61,70.33,60.89,57.02,41.78,41.68,36.22.
[0199]
4-e-2:顺-n-甲基-1-(4-(3,4-二氯苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)-甲胺
[0200]1h nmr(400mhz,cdcl3)δ7.36(d,j=8.2hz,1h),7.25(s,1h),7.14(d,j=5.0hz,
1h),7.03
–
6.96(m,1h),6.54(d,j=5.1hz,1h),5.00(t,j=5.1hz,1h),4.22(dd,j=11.2,5.5hz,1h),4.16
–
4.08(m,1h),3.63
–
3.48(m,1h),2.96(d,j=5.8hz,2h),2.51(s,3h).
13
c nmr(151mhz,cdcl3)δ141.13,136.22,136.09,131.17,130.59,130.40,127.92,126.69,123.80,74.41,71.00,57.00,42.94,36.31.
[0201]
实施例7:反-n-甲基-1-(4-(3,4-二氯苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)-甲胺(4-e-1)的手性拆分
[0202]
拆分方法:
[0203][0204]
4-e-1a:n-甲基-1-((4s,7s)-4-(3,4-二氯苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)-甲胺
[0205]
将300mg4-e-1(0.92mmol,1.0eq)溶于30ml无水乙醇中,向溶液中加入395mg l-(-)-二苯甲酰酒石酸(1.1mmol,1.2eq)的乙醇(30ml)溶液,室温下搅拌2小时,直至大量固体析出,将混合物加热至70℃,至固体溶解完全,溶液在70℃下继续搅拌30分钟,开始缓慢降温,控制其降温速率为5℃/10min,降温过程中观察溶液是否变浑浊,如变浑浊,保持此温度继续搅拌约2小时,继续以5℃/10min的速率降温至室温,过滤得固体,干燥后称重为408mg(收率:65%),将所得固体加入50ml甲醇后,加热至70℃,使固体完全溶解,溶液以5℃/10min的速率降温,同样观察溶液的过饱和点,如有少量固体析出,维持温度继续搅拌至析出固体量不再增加,然后再继续降温至室温,过滤,干燥后得固体,将固体加入30ml乙酸乙酯和20ml水的体系中,边搅拌边滴加1n氢氧化钠溶液调节水相ph至11~12,然后室温搅拌20分钟,静置分层后得有机相,水相用乙酸乙酯(20ml x2)萃取,合并有机相后加饱和食盐水(20ml)洗涤,干燥,浓缩后得到68mg光学纯的透明油状物4-e-1a,总收率23%,手性hplc分析显示ee%=98.6%,化合物经单晶衍射确定构型为(s,s)型。
[0206]
4-e-1b:n-甲基-1
–
((4r,7r)-4-(3,4-二氯苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)-甲胺
[0207]
将300mg4-e-1(0.92mmol,1.0eq)溶于30ml无水乙醇中,向溶液中加入395mg d-(-)-二苯甲酰酒石酸(1.1mmol,1.2eq)的乙醇(30ml)溶液,室温下搅拌2小时,直至大量固体析出,将混合物加热至70℃,至固体溶解完全,溶液在70℃下继续搅拌30分钟,开始缓慢降温,控制其降温速率为5℃/10min,降温过程中观察溶液是否变浑浊,如变浑浊,保持此温
度继续搅拌约2小时,继续以5℃/10min的速率降温至室温,过滤得固体,干燥后称重为408mg(收率:65%),将所得固体加入50ml甲醇后,加热至70℃,使固体完全溶解,溶液以5℃/10min的速率降温,同样观察溶液的过饱和点,如有少量固体析出,维持温度继续搅拌至析出固体量不再增加,然后再继续降温至室温,过滤,干燥后得固体,将固体加入30ml乙酸乙酯和20ml水的体系中,边搅拌边滴加1n氢氧化钠溶液调节水相ph至11~12,然后室温搅拌20分钟,静置分层后得有机相,水相用乙酸乙酯(20ml x2)萃取,合并有机相后加饱和食盐水(20ml)洗涤,干燥,浓缩后得到54mg光学纯的透明油状物4-e-1b,总收率18%,手性hplc分析显示ee%=98.0%,化合物经单晶衍射确定构型为(r,r)型。
[0208]
实施例8:n-甲基-1-(4-(萘-1-基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0209][0210]
合成路线及反应步骤:
[0211]
参照实施例1中所述步骤i-iii,用1-溴萘替换步骤i中的溴苯,得黄色油状物4-f,总收率:14.3%。1h nmr(400mhz,cdcl3)δ7.88(t,j=7.3hz,2h),7.76(d,j=8.1hz,1h),7.55
–
7.42(m,5h),7.06(s,1h),4.93
–
4.89(m,1h),4.11
–
4.05(m,1h),3.64(td,j=11.2,3.4hz,1h),3.13(dd,j=12.4,2.8hz,1h),3.04(dd,j=12.4,8.6hz,1h),2.70
–
2.61(m,1h),2.56(s,3h).
13
c nmr(151mhz,cdcl3)δ136.94,134.95,133.04,132.49,131.64,130.71,128.33,128.10,127.74,125.85,125.41,125.38,124.55,116.75,63.63,55.87,35.80,25.77.esi-ms(m+h)
+
:310.1.hmrs:calc.for c
19h19
nos([m+h]
+
)310.1260,found 310.1269.
[0212]
实施例9:n-甲基-1-(4-(萘-2-基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0213][0214]
合成路线及反应步骤:
[0215]
参照实施例1中所述步骤i-iii,用2-溴萘替换步骤i中的溴苯,得黄色油状物4-g,总收率:19.0%。1h nmr(400mhz,cdcl3)δ8.00
–
7.87(m,5h),7.68
–
7.63(m,1h),7.57
–
7.50(m,2h),7.35(s,1h),5.13
–
5.06(m,1h),4.33
–
4.25(m,1h),3.79
–
3.64(m,2h),3.42(dd,j=
13.0,8.6hz,1h),3.24
–
3.13(m,1h),2.97
–
2.88(m,1h),2.81(s,3h).
13
c nmr(151mhz,cdcl3)δ140.25,136.57,134.98,132.60,132.16,129.65,129.12,128.78,128.05,127.80,127.54,127.31,119.70,73.10,65.63,53.93,34.07,28.19.esi-ms(m+h)
+
:310.1.hmrs:calc.for c
19h19
nos([m+h]
+
)310.1260,found 310.1271.
[0216]
实施例10:n-甲基-1-(4-(3-甲苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0217][0218]
合成路线及反应步骤:
[0219]
参照实施例1中所述步骤i-iii,用3-甲基碘苯替换步骤i中的溴苯,,得黄色油状物4-h,总收率:13.6%。esi-ms(m+h)
+
:274.1.hmrs:calc.for c
16h19
nos([m+h]
+
)274.1260,found 274.1265.
[0220]
实施例11:n-甲基-1-(4-(3-甲苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺(4-h)的顺反异构体分离
[0221][0222]
参考实施例7中所述,分离4-h得到淡黄色油状物4-h-1(收率:78.6%)和淡黄色油状物4-h-2(收率:5.7%)。通过h-nmr确认4-h-1为反式构型,4-h-2为顺式构型。
[0223]
4-h-1:反-n-甲基-1-(4-(3-甲苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0224]1h nmr(400mhz,cdcl3)δ7.20(t,j=7.5hz,1h),7.11(d,j=4.9hz,1h),7.07(d,j=7.4hz,1h),6.96(d,j=9.3hz,2h),6.58(d,j=4.9hz,1h),5.03(s,1h),4.25(dd,j=11.1,5.6hz,1h),4.17
–
4.10(m,1h),3.62(t,j=10.6hz,1h),3.03
–
2.95(m,2h),2.53(s,3h),2.32(s,3h).
13
c nmr(151mhz,cdcl3)δ140.63,138.19,137.68,135.78,129.23,128.45,127.83,127.21,125.61,123.00,74.70,71.82,57.48,43.79,36.49,21.41.
[0225]
4-h-2:顺-n-甲基-1-(4-(3-甲苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0226]1h nmr(400mhz,cdcl3)δ7.17(dd,j=9.0,6.2hz,2h),7.04(d,j=8.1hz,1h),
7.00
–
6.93(m,2h),6.71(d,j=5.0hz,1h),4.97(s,1h),4.08(s,2h),3.94(s,1h),3.08
–
2.96(m,2h),2.53(s,3h),2.31(s,3h).
13
c nmr(151mhz,cdcl3)δ143.24,137.97,136.18,135.79,128.91,128.29,127.51,127.46,125.31,123.38,74.38,70.50,57.49,42.58,36.46,21.49.
[0227]
实施例12:n-甲基-1-(4-(2-甲苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0228][0229]
合成路线及反应步骤:
[0230]
参照实施例1中所述步骤i-iii,用2-甲基碘苯替换步骤i中的溴苯,得黄色油状物4-i,总收率:15.7%。esi-ms(m+h)
+
:274.1.hmrs:calc.for c
16h19
nos([m+h]
+
)274.1260,found 274.1262.
[0231]
实施例13:n-甲基-1-(4-(2-甲苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺(4-i)的顺反异构体分离
[0232][0233]
参考实施例7中所述,分离4-i得到淡黄色油状物4-i-1(收率:81.2%)和淡黄色油状物4-i-2(收率:2.8%)。通过h-nmr确认4-i-1为反式构型,4-i-2为顺式构型。
[0234]
4-i-1:反-n-甲基-1-(4-(2-甲苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0235]1h nmr(400mhz,cdcl3)δ7.22
–
7.08(m,4h),6.94(d,j=7.3hz,1h),6.54(d,j=4.8hz,1h),5.04(s,1h),4.46(d,j=7.4hz,1h),4.26(dd,j=11.2,5.5hz,1h),3.59(t,j=10.7hz,1h),3.00(qd,j=12.4,5.8hz,2h),2.54(s,3h),2.40(s,3h).
13
c nmr(151mhz,cdcl3)δ138.58,137.85,136.39,135.78,130.50,128.29,127.09,126.84,126.26,123.07,74.79,70.59,57.51,39.79,36.52,19.52.
[0236]
4-i-2:顺-n-甲基-1-(4-(2-甲苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0237]1h nmr(400mhz,cdcl3)δ7.19(t,j=4.7hz,2h),7.10(dt,j=14.8,7.2hz,2h),6.84(d,j=7.6hz,1h),6.66(d,j=5.0hz,1h),5.01(d,j=5.5hz,1h),4.25(s,1h),4.04
(ddd,j=14.0,11.3,3.5hz,2h),3.07
–
3.03(m,2h),2.54(s,3h),2.42(s,3h).
13
c nmr(151mhz,cdcl3)δ140.80,136.38,135.82,135.07,130.31,128.79,127.40,126.61,126.04,123.53,74.15,68.94,57.12,38.57,36.26,19.66.
[0238]
实施例14:n-甲基-1-(4-(3-三氟甲基苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0239][0240]
合成路线及反应步骤:
[0241]
参照实施例1中所述步骤i-iii,用3-三氟甲基碘苯替换步骤i中的溴苯,得黄色油状物4-j,总收率:11.8%。esi-ms(m+h)
+
:328.1.hmrs:calc.for c
16h16
f3nos([m+h]
+
)328.0977,found 328.0980.
[0242]
实施例15:n-甲基-1-(4-(3-三氟甲基苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺(4-j)的顺反异构体分离
[0243][0244]
参考实施例7中所述,分离4-j得到淡黄色油状物4-j-1(收率:71.0%)和淡黄色油状物4-j-2(收率:3.0%)。通过h-nmr确认4-j-1为反式构型,4-j-2为顺式构型。
[0245]
4-j-1:反-n-甲基-1-(4-(3-三氟甲基苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0246]1h nmr(400mhz,cdcl3)δ7.52(s,1h),7.43(d,j=4.1hz,2h),7.34(s,1h),7.15(d,j=4.5hz,1h),6.54(t,j=4.7hz,1h),5.04(d,j=4.4hz,1h),4.33
–
4.18(m,2h),3.70
–
3.55(m,1h),2.99(s,2h),2.53(s,3h).
13
c nmr(151mhz,cdcl3)δ141.89,136.42,131.96,130.99(q,j=32.1hz),129.11,126.71,125.24,124.98,124.06,123.64,123.18,74.74,71.31,57.37,43.68,36.49.
[0247]
4-j-2:顺-n-甲基-1-(4-(3-三氟甲基苯基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0248]1h nmr(400mhz,cdcl3)δ7.51
–
7.39(m,4h),7.20(s,1h),6.70(s,1h),4.97(s,1h),4.11(s,2h),4.03(s,1h),3.03(s,2h),2.54(s,3h).
13
c nmr(151mhz,cdcl3)δ144.40,
136.35,135.11,131.64,129.10,128.87,127.15,126.72,124.91,124.01,123.59,74.64,70.50,57.48,42.36,36.49.
[0249]
实施例16:n-甲基-n-乙基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0250][0251]
合成路线
[0252][0253]
reagents and conditions:(iv)na2co3,dmf,90℃,2h.
[0254]
反应步骤:
[0255]
(iv)将90mg化合物3(0.35mmol,1.0eq)、56.6mg溴乙烷(0.52mmol,1.5eq)、111.3mg碳酸钠(1.05mmol,3.0eq)和3ml n,n-二甲基甲酰胺依次加入25ml茄形瓶中,加热至90℃,反应2h后向反应液中加入乙酸乙酯/水(2:1)稀释(10ml),萃取后分液得到有机相,有机相水洗(10ml x 3)后,用无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物用硅胶柱层析(二氯甲烷/甲醇=50/1~10/1)分离得到75mg黄色油状物5-a,收率:75.2%。esi-ms(m+h
+
):m/z 288.1,hmrs:calc.for c
17h21
nos([m+h]
+
)288.1417,found 288.1420.
[0256]
实施例17:n-甲基-n-乙基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺(5-a)的顺反异构体分离
[0257][0258]
参考实施例7中所述,分离5-a得到淡黄色油状物5-a-1(收率:69.3%)和淡黄色油
状物5-a-2(收率:18.7%)。通过h-nmr确认5-a-1为反式构型,5-a-2为顺式构型。
[0259]
5-a-1:反-n-甲基-n-乙基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0260]1h nmr(400mhz,cdcl3)δ7.29(dd,j=14.6,7.2hz,2h),7.25(s,1h),7.16(d,j=7.2hz,2h),7.10(d,j=5.0hz,1h),6.56(d,j=4.9hz,1h),4.98(t,j=6.1hz,1h),4.29(dd,j=11.0,5.6hz,1h),4.20(d,j=9.9hz,1h),3.62(t,j=10.6hz,1h),2.81(dd,j=12.6,7.3hz,1h),2.61(dt,j=14.0,7.0hz,3h),2.39(s,3h),1.12(t,j=7.0hz,3h).
13
c nmr(151mhz,cdcl3)δ140.29,136.49,135.94,127.99,127.96,126.42,126.12,123.12,73.09,71.63,62.17,51.59,43.33,41.55,11.41.
[0261]
5-a-2:顺-n-甲基-n-乙基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0262]1h nmr(400mhz,cdcl3)δ7.28(t,j=5.3hz,2h),7.24
–
7.13(m,4h),6.71(d,j=4.4hz,1h),4.95(s,1h),4.16
–
4.04(m,2h),3.96(s,1h),2.88(dd,j=12.4,7.4hz,1h),2.73(dd,j=12.4,5.6hz,1h),2.64(d,j=6.6hz,2h),2.42(s,3h),1.13(t,j=6.9hz,3h).
13
c nmr(151mhz,cdcl3)δ143.55,136.14,135.83,128.36,128.20,127.09,126.58,124.15,73.20,70.70,62.52,52.14,42.60,42.03,11.81.
[0263]
实施例18:n-甲基-n-正丙基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0264][0265]
合成路线及反应步骤:
[0266]
参照实施例16中所述步骤iv,用溴丙烷替换溴乙烷,得黄色油状物5-b,总收率:73.7%。esi-ms(m+h
+
):m/z 302.2,hmrs:calc.for c
18h23
nos([m+h]
+
)302.1573,found 302.1574.
[0267]
实施例19:n-甲基-n-正丙基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺(5-b)的顺反异构体分离
[0268]
[0269]
参考实施例7中所述,分离5-b得到淡黄色油状物5-b-1(收率:64.3%)和淡黄色油状物5-b-2(收率:10.1%)。通过h-nmr确认5-b-1为反式构型,5-b-2为顺式构型。
[0270]
5-b-1:反-n-甲基-n-正丙基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0271]1h nmr(400mhz,cdcl3)δ7.33
–
7.23(m,3h),7.16(d,j=7.0hz,2h),7.11
–
7.07(m,1h),6.55(dd,j=4.6,3.0hz,1h),4.97(s,1h),4.28(ddd,j=10.6,5.4,2.9hz,1h),4.20(d,j=9.6hz,1h),3.62(td,j=10.9,2.7hz,1h),2.85
–
2.76(m,1h),2.70
–
2.62(m,1h),2.51
–
2.44(m,2h),2.39(s,3h),1.62
–
1.52(m,2h),0.93(td,j=7.2,2.7hz,3h).
13
c nmr(151mhz,cdcl3)δ140.91,136.98,136.66,128.59,128.54,127.00,126.62,123.76,73.69,72.23,63.34,60.52,43.93,42.79,20.24,11.93.
[0272]
5-b-2:顺-n-甲基-n-正丙基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0273]1h nmr(400mhz,cdcl3)δ7.26(s,2h),7.18(dd,j=18.9,11.8hz,4h),6.77
–
6.65(m,1h),4.94(s,1h),4.10(p,j=11.4hz,2h),3.95(s,1h),2.87(s,1h),2.75(s,1h),2.51(s,2h),2.43(s,3h),1.59(s,2h),0.93(dd,j=7.1,4.2hz,3h).
13
c nmr(151mhz,cdcl3)δ143.55,136.19,135.79,128.38,128.20,127.05,126.59,124.24,73.12,70.72,62.99,60.31,42.59,29.70,19.93,11.84.
[0274]
实施例20:n,n-二甲基-1-(4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0275][0276]
合成路线:
[0277][0278]
reagents and conditions:(v)cf3so3h,1,4-dioxane,80℃,3h.
[0279]
反应步骤:
[0280]
v.将100mg 3-a(0.36mmol,1.0eq)加入50ml规格的圆底烧瓶中,加入5ml无水1,4-二氧六环使其溶解,再向烧瓶中加入68mg二甲基胺基乙醛缩二甲醇(0.55mmol,1.5eq)和
108mg三氟甲磺酸(0.72mmol,2.5eq),上述混合物在80℃下加热搅拌3小时,混合物加1n氢氧化钠水溶液调节ph至10~11,用乙酸乙酯(20ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~10/1)得到49.5mg黄色油状物6-a,收率:39%。1h nmr(400mhz,cdcl3)δ7.33
–
7.22(m,4h),7.17
–
7.11(m,3h),6.56(d,j=5.1hz,1h),5.24(t,j=5.2hz,1h),4.28(dd,j=11.2,5.7hz,1h),4.22
–
4.14(m,1h),3.65(t,j=10.6hz,1h),2.95
–
2.89(m,2h),2.60(s,6h),2.52
–
2.41(m,1h).
13
c nmr(151mhz,cdcl3)δ140.55,137.85,135.01,128.60(t,j=15.6hz),128.69,128.62,128.49,128.21,127.22,127.14,123.88,71.91,64.17,45.56,43.76.esi-ms(m+h)
+
:274.1.hmrs:calc.forc
16h19
nos([m+h]
+
)274.1260,found 274.1265.
[0281]
实施例21:1-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)吡咯烷
[0282][0283]
合成路线:
[0284][0285]
reagents and conditions:(vi)cf3so3h,1,4-dioxane,80℃,5h;(vii)k2co3,ki,ch3cn,mw,120℃,1h.
[0286]
反应步骤:
[0287]
vi.将100mg 3-a(0.36mmol,1.0eq)加入50ml规格的圆底烧瓶中,加入5ml无水1,4-二氧六环使其溶解,再向烧瓶中加入58mg胺基乙醛缩二甲醇(0.55mmol,1.5eq)和108mg三氟甲磺酸(0.72mmol,2.5eq),上述混合物在80℃下加热搅拌3小时,混合物加1n氢氧化钠水溶液调节ph至10~11,用乙酸乙酯(20ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~10/1)得到43.2mg黄色油状物7-a,收率:36%。1h nmr(400mhz,cdcl3)δ7.31
–
7.16(m,3h),7.17
–
7.07(m,3h),6.53(d,j=5.0hz,1h),5.23(s,1h),5.13(d,j=7.3hz,1h),4.20(dd,j=11.2,5.4hz,1h),4.13
–
4.03(m,1h),3.61(t,j=10.3hz,1h),3.43
–
3.25(m,1h),3.21
–
3.00(m,1h).
13
c nmr(151mhz,cdcl3)δ140.41,138.48,134.73,132.48,129.32,128.57,128.52,128.13,127.31,127.11,124.01,73.94,
72.14,70.56,44.89,43.18,42.21,29.70.esi-ms(m+h)
+
:246.1.hmrs:calc.for c
14h15
nos([m+h]
+
)246.0947,found 246.0948.
[0288]
vii.将90mg(0.36mmol,1.0eq)7-a、86mg 1,4-二溴丁烷(0.40mmol,1.1eq)、150mg碳酸钾(1.09mmol,3.0eq)和7mg碘化钾加入微波管中,再加入3ml乙腈,搅拌后密封,微波120℃下反应1h,将反应液过滤,得到的滤液浓缩后经过硅胶柱层析分离(pe/ea=10/1),得到20mg淡黄色油状液体8-a,收率:19.6%。1h nmr(400mhz,cdcl3)δ7.34
–
7.27(m,3h),7.17(d,j=6.9hz,2h),7.11(d,j=4.8hz,1h),6.56(d,j=5.1hz,1h),5.04(s,1h),4.30(dd,j=11.2,5.7hz,1h),4.23
–
4.14(m,1h),3.63(t,j=10.7hz,1h),2.92(dt,j=21.6,10.8hz,2h),2.72(s,4h),1.85(s,4h).
13
c nmr(151mhz,cdcl3)δ140.88,137.13,136.39,128.60,128.56,127.03,126.81,123.71,74.38,72.12,61.65,54.55,43.90,23.69.esi-ms(m+h)
+
:300.1.hmrs:calc.for c
18h21
nos([m+h]
+
)300.1417,found 300.1417.
[0289]
实施例22:1-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)哌啶
[0290][0291]
合成路线及反应步骤:
[0292]
参照实施例21中所述步骤vii,用1,5-二溴戊烷替换1,4-二溴丁烷,得淡黄色油状物8-b,收率:39.4%。1h nmr(400mhz,cdcl3)δ7.31(dd,j=11.0,4.3hz,2h),7.26(d,j=7.2hz,1h),7.16(d,j=7.8hz,2h),7.10(d,j=5.0hz,1h),6.55(d,j=5.1hz,1h),4.99(t,j=6.6hz,1h),4.27(dd,j=11.0,5.7hz,1h),4.22
–
4.15(m,1h),3.61(t,j=10.6hz,1h),2.76(dd,j=12.5,6.2hz,1h),2.63
–
2.55(m,3h),2.52(s,2h),1.70
–
1.63(m,4h),1.48(d,j=5.3hz,2h).
13
c nmr(151mhz,cdcl3)δ140.94,136.99,136.76,128.59,128.53,126.98,126.50,124.07,73.25,72.27,64.18,55.30,43.94,25.94,24.37.esi-ms(m+h)
+
:314.2.hmrs:calc.for c
19h23
nos([m+h]
+
)314.1573,found 314.1573.
[0293]
实施例23:1-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)吖庚环
[0294][0295]
合成路线及反应步骤:
[0296]
参照实施例21中所述步骤vii,用1,6-二溴己烷替换1,5-二溴戊烷,得淡黄色油状物8-c,收率:33.4%。esi-ms(m+h)
+
:328.2.hmrs:calc.for c
19h23
nos([m+h]
+
)328.1730,found 328.1726.
[0297]
实施例24:1-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)吖庚环(8-c)的顺反异构体分离
[0298][0299]
参考实施例7中所述,分离8-c得到淡黄色油状物8-c-1(收率:71.8%)和淡黄色油状物8-c-2(收率:16.0%)。通过h-nmr确认8-c-1为反式构型,8-c-2为顺式构型。
[0300]
8-c-1:反-1-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)吖庚环
[0301]1h nmr(400mhz,cdcl3)δ7.28(dd,j=16.0,6.7hz,3h),7.17(d,j=6.7hz,2h),7.09(s,1h),6.55(d,j=4.2hz,1h),4.89(s,1h),4.33
–
4.12(m,2h),3.62(t,j=10.4hz,1h),2.92(t,j=16.4hz,1h),2.82(s,4h),2.73
–
2.64(m,1h),1.76(s,2h),1.66(s,6h).
13
c nmr(151mhz,cdcl3)δ140.95,136.97,136.58,128.61,128.53,126.98,126.30,124.17,73.92,72.35,62.80,56.14,44.01,28.24,27.14.
[0302]
8-c-2:顺-1-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)吖庚环
[0303]1h nmr(400mhz,cdcl3)δ7.30(s,1h),7.17(d,j=6.3hz,4h),7.11(s,1h),6.70(s,1h),4.81(s,1h),4.10(s,2h),3.95(s,1h),3.00(s,1h),2.83(s,5h),1.77(s,2h),1.67(s,6h).
13
c nmr(151mhz,cdcl3)δ128.62,128.55,128.35,128.19,127.01,126.53,124.58,124.18,72.33,71.05,62.83,56.24,43.98,42.66,28.36,27.13.
[0304]
实施例25:1-苯甲基-4-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)哌嗪
[0305][0306]
合成路线:
[0307][0308]
reagents and conditions:(viii)nahco3,etoh,90℃,2.5h.
[0309]
反应步骤:
[0310]
viii.将80mg 7-a(0.33mmol,1eq)、3ml无水乙醇加入15ml封管中,再向其中加入92mg n-苄基-双邻氯乙基氨基盐酸盐(0.34mmol,1.05eq)、97mg碳酸氢钠(1.16mmol,3.5eq),密封,90℃下反应2.5h,过滤得到滤液,滤液旋干后经过硅胶柱层析(石油醚/乙酸乙酯=10/1)分离得到70mg黄色油状物9-a,收率:53.3%。1h nmr(400mhz,cdcl3)δ7.34(s,6h),7.26(d,j=6.0hz,2h),7.16(d,j=5.7hz,2h),7.10(s,1h),6.56(s,1h),5.00(s,1h),4.31
–
4.22(m,1h),4.18(s,1h),3.64
–
3.53(m,3h),2.84
–
2.56(m,10h).
13
c nmr(151mhz,cdcl3)δ140.27,136.31,136.12,128.61,127.97,127.94,127.60,126.40,125.97,123.37,72.52,71.60,62.80,62.47,53.18,52.46,43.31.esi-ms(m+h)
+
:405.2.hmrs:calc.for c
25h28
n2os([m+h]
+
)405.1995,found 405.2001.
[0311]
实施例26:1-对氟苯甲基-4-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)哌嗪
[0312][0313]
合成路线及反应步骤:
[0314]
参照实施例25中所述步骤viii,用n-对氟苯甲基-双邻氯乙基胺替换n-苄基-双邻氯乙基氨基盐酸盐,得黄色油状物9-b,收率:14.2%。1h nmr(400mhz,cdcl3)δ7.34
–
7.26(m,5h),7.13(dd,j=20.7,5.8hz,3h),7.00(t,j=7.2hz,2h),6.56(d,j=5.0hz,1h),5.00(s,1h),4.30
–
4.15(m,2h),3.60(t,j=10.6hz,1h),3.52(s,2h),2.84
–
2.53(m,10h).
13
c nmr(151mhz,cdcl3)δ162.02(d,j=244.8hz),161.21,140.81,136.96,136.60,133.70,130.70(d,j=7.7hz),128.57,127.03,126.62,123.98,115.02(d,j=21.1hz),73.05,72.21,63.35,62.19,53.66,52.91,43.88.esi-ms(m+h)
+
:423.2.hmrs:calc.for c
25h27
fn2os([m+h]
+
)423.1901,found 423.1912.
[0315]
实施例27:1-对甲氧基苯甲基-4-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)哌嗪
[0316][0317]
合成路线及反应步骤:
[0318]
参照实施例25中所述步骤viii,用n-对甲氧基苯甲基-双邻氯乙基胺替换n-苄基-双邻氯乙基氨基盐酸盐,得黄色油状物9-c,收率:52.1%。1h nmr(400mhz,cdcl3)δ7.32
–
7.25(m,5h),7.14(d,j=21.4hz,3h),6.87(d,j=7.4hz,2h),6.56(s,1h),4.99(s,1h),4.24(dd,j=21.5,16.8hz,2h),3.80(s,3h),3.60(t,j=10.4hz,1h),3.52(s,2h),2.86
–
2.52(m,10h).
13
c nmr(151mhz,cdcl3)δ158.83,140.82,136.96,136.61,130.56,128.58,128.56,127.03,126.62,123.98,113.63,73.06,72.21,63.34,62.34,55.26,53.56,52.84,43.88.esi-ms(m+h)
+
:435.2.hmrs:calc.for c
26h30
n2o2s([m+h]
+
)435.2101,found 435.2114.
[0319]
实施例28:1-对三氟甲基苯甲基-4-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)哌嗪
[0320][0321]
合成路线及反应步骤:
[0322]
参照实施例25中所述步骤viii,用n-对三氟甲基苯甲基-双邻氯乙基胺替换n-苄基-双邻氯乙基氨基盐酸盐,得黄色油状物9-d,收率:51.1%。1h nmr(400mhz,cdcl3)δ7.58(d,j=6.7hz,2h),7.49(s,2h),7.34
–
7.28(m,3h),7.14(d,j=19.3hz,3h),6.57(s,1h),5.03(s,1h),4.24(d,j=31.1hz,2h),3.61(s,3h),2.86
–
2.58(m,10h).
13
c nmr(151mhz,cdcl3)δ140.76,137.07,136.49,129.32,128.58,127.06,126.69,125.23,123.99,73.00,72.18,63.29,62.36,53.62,52.96,43.86.esi-ms(m+h)
+
:473.2.hmrs:calc.for c
26h27
f3n2os([m+h]
+
)473.1869,found 473.1880.
[0323]
实施例29:1-对硝基苯甲基-4-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)哌嗪
[0324][0325]
合成路线及反应步骤:
[0326]
参照实施例25中所述步骤viii,用n-对硝基苯甲基-双邻氯乙基胺替换n-苄基-双邻氯乙基氨基盐酸盐,得黄色油状物9-e,收率:51.7%。1h nmr(400mhz,cdcl3)δ8.20(s,2h),7.55(s,2h),7.32(d,j=4.3hz,3h),7.17(s,3h),6.57(s,1h),5.06(s,1h),4.23(d,j=26.4hz,2h),3.68(d,j=25.0hz,3h),2.73(d,j=82.6hz,10h).
13
c nmr(151mhz,cdcl3)δ147.19,146.36,140.71,137.11,136.37,129.55,128.57,127.07,126.71,123.99,123.56,72.96,72.15,63.25,62.06,53.65,53.00,43.84.esi-ms(m+h)
+
:450.2.hmrs:calc.for c
25h27
n3o3s([m+h]
+
)450.1846,found 450.1862.
[0327]
实施例30:1-对氨基苯甲基-4-((4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲基)哌嗪
[0328][0329]
合成路线:
[0330][0331]
反应步骤:
[0332]
将150mg 9-e(0.33mmol,1.0eq)置于25ml规格的茄形瓶中,加入5ml甲醇使之溶解,用氩气置换茄形瓶三次后,加入30mg pd/c(20wt%),反应2h后过滤,滤液旋干,粗产物用硅胶柱层析(二氯甲烷/甲醇=70/1)分离,得到80mg黄色油状物9-f,收率:65.9%。1h nmr(400mhz,cdcl3)δ7.27(dd,j=14.7,6.0hz,3h),7.19
–
7.08(m,5h),6.65(t,j=9.7hz,2h),6.56(dd,j=11.4,4.8hz,1h),4.98(s,1h),4.30
–
4.15(m,2h),3.66
–
3.56(m,3h),3.45
(d,j=11.3hz,2h),2.83
–
2.51(m,10h).
13
c nmr(151mhz,cdcl3)δ145.39,140.85,136.88,136.72,130.44,128.58,128.54,127.00,126.57,123.99,114.88,73.07,72.22,63.38,62.64,53.75,52.88,43.88.esi-ms(m+h)
+
:420.2.hmrs:calc.for c
25h27
n3o3s([m+h]
+
)420.2104,found 420.2116.
[0333]
实施例31:n-甲基-1-(2-甲基-4-苯基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0334][0335]
合成路线:
[0336][0337]
reagents and conditions:(ix)etmgcl,(ipr)2nh,thf,50℃,3h;pd(tbu3p)2,thf,60℃,3h;(x)lialh4,thf,rt,3h;(xi)cf3so3h,1,4-dioxane,80℃,3h.
[0338]
反应步骤:
[0339]
ix.将1.0g 3,4-二氯苯乙酸(4.88mmol,1.0eq)加入100ml的三口烧瓶中,加10ml无水四氢呋喃使其固体完全溶解,用氮气对烧瓶进行置换三次,再向溶液加入50mg二异丙胺(0.49mmol,0.1eq)。在冰浴下缓慢滴加4.5ml格氏试剂乙基氯化镁(2.7m in thf,12.19mmol,3.0eq),滴加过程中有大量气泡产生,并且剧烈放热,加入完毕后上述混合物在50℃下搅拌3小时,随后降至室温。将1.7g 4-溴-2-甲基噻吩(9.76mmol,2eq)和50mg三叔丁基膦钯(0.1mmol,0.02eq)溶于10ml无水四氢呋喃后加入烧瓶中,升至60℃搅拌3小时,将体系降至室温,向烧瓶中缓慢滴加2n的盐酸溶液调节ph至4~6,有大量固体析出,过滤出去固体,滤液加乙酸乙酯(30ml x 3)和水(20ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,滤液浓缩得黑色油状物,使用硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~20/1)得到540mg黄色油状物11-a,收率:36.8%。1h nmr(400mhz,cdcl3)δ10.78(s,1h),7.37(d,j=10.2hz,3h),7.08(d,j=6.1hz,2h),3.56(s,3h).esi-ms(m-h)-:299.0。
[0340]
x.将540mg 11-a(1.8mmol,1.0eq)加入50ml规格的圆底烧瓶中,加20ml干燥的四氢呋喃使之完全溶解,将体系用氮气置换三次,冰水浴下向烧瓶中缓慢滴加2.2ml氢化铝锂
(2.5m in thf,5.4mmol,3.0eq),滴加完毕后移出冰浴,室温下搅拌反应3小时,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,向其中缓慢滴加naoh溶液(1mol/l),至大量沉淀生成,过滤得滤液,滤饼加乙酸乙酯洗涤。所得滤液用乙酸乙酯(20ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,硅胶柱层析进行分离(石油醚/乙酸乙酯=10/1)得到337mg淡黄色油状物12-a,收率:65.5%。1h nmr(400mhz,cdcl3)δ7.34(dd,j=34.0,20.9hz,2h),7.10(d,j=6.2hz,1h),6.81(s,1h),6.57(s,1h),4.06(dd,j=25.4,7.7hz,3h),2.44(s,3h).esi-ms(m+h)
+
:287.0.
[0341]
xi.将150mg12-a(0.52mmol,1.0eq)加入50ml规格的圆底烧瓶中,加入5ml无水1,4-二氧六环使其溶解,再向烧瓶中加入187mg甲氨基乙醛缩二甲醇(1.56mmol,3eq)和390mg三氟甲磺酸(2.6mmol,5eq),上述混合物在80℃下搅拌反应3小时,再滴加1n氢氧化钠水溶液调节反应液ph至10~11,用乙酸乙酯(10ml x 3)和水(5ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~10/1)得到58mg黄色油状物13-a,收率:32.4%。1h nmr(400mhz,cdcl3)δ7.35(t,j=10.3hz,1h),7.27(d,j=14.6hz,1h),7.00(d,j=8.2hz,1h),6.18(s,1h),4.94(s,1h),4.19(dd,j=10.8,4.8hz,1h),4.04(s,1h),3.56(t,j=10.3hz,1h),2.91(t,j=9.3hz,2h),2.51(s,3h),2.38(s,3h).
13
c nmr(151mhz,cdcl3)δ140.72,137.61,135.21,133.38,131.95,130.40,129.89,129.76,127.32,124.05,73.79,70.39,56.61,42.27,35.87,14.60.esi-ms(m+h)
+
:342.0.
[0342]
实施例32:n-甲基-1-(7-苯基-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0343][0344]
合成路线:
[0345][0346]
reagents and conditions:(xii)etmgcl,(ipr)2nh,thf,50℃,3h;pd(tbu3p)2,thf,60℃,3h;(xiii)lialh4,thf,rt,3h;(xiv)cf3so3h,1,4-dioxane,80℃,3h.
[0347]
反应步骤:
[0348]
xii.将1.0g 2-噻吩乙酸(7.04mmol,1.0eq)加入100ml的三口烧瓶中,加10ml无水
四氢呋喃使其固体完全溶解,用氮气对烧瓶进行置换三次,再向溶液加入70mg二异丙胺(0.70mmol,0.1eq)。在冰浴下缓慢滴加8.8ml格氏试剂乙基氯化镁(2.4m in thf,21.12mmol,3.0eq),滴加过程中有大量气泡产生,并且剧烈放热,加入完毕后上述混合物在50℃下搅拌3小时,随后降至室温。将1.3g溴苯(8.45mmol,1.2eq)和107mg三叔丁基膦钯(0.21mmol,0.03eq)溶于10ml无水四氢呋喃后加入烧瓶中,升至60℃搅拌3小时,将体系降至室温,向烧瓶中缓慢滴加2n的盐酸溶液调节ph至4~6,有大量固体析出,过滤出去固体,滤液加乙酸乙酯(30ml x 3)和水(20ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,滤液浓缩得黑色油状物,使用硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~20/1)得到580mg黄色油状物15-a,收率:38%。esi-ms(m-h)-:217.2。
[0349]
xiii.将150mg 15-a(0.49mmol,1.0eq)加入50ml规格的圆底烧瓶中,加10ml干燥的四氢呋喃使之完全溶解,将体系用氮气置换三次,冰水浴下向烧瓶中缓慢滴加0.6ml氢化铝锂(2.5m in thf,1.47mmol,3.0eq),滴加完毕后移出冰浴,室温下搅拌反应3小时,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,向其中缓慢滴加naoh溶液(1mol/l),至大量沉淀生成,过滤得滤液,滤饼加乙酸乙酯洗涤。所得滤液用乙酸乙酯(20ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,硅胶柱层析进行分离(石油醚/乙酸乙酯=10/1)得到93mg淡黄色油状物16-a,收率:62%。esi-ms(m+h)
+
:205.2.
[0350]
xiv.将100mg 16-a(0.36mmol,1.0eq)加入50ml规格的圆底烧瓶中,加入5ml无水1,4-二氧六环使其溶解,再向烧瓶中加入128mg甲氨基乙醛缩二甲醇(1.08mmol,3.0eq)和286mg三氟甲磺酸(1.8mmol,5.0eq),上述混合物在80℃下搅拌反应3小时,再滴加1n氢氧化钠水溶液调节反应液ph至10~11,用乙酸乙酯(20ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~10/1)得到50mg黄色油状物17-a,收率:34%。1h nmr(400mhz,cdcl3)δ7.33
–
7.26(m,3h),7.21
–
7.16(m,3h),6.82(d,j=5.2hz,1h),5.09(d,j=8.5hz,1h),4.33
–
4.22(m,2h),3.72
–
3.61(m,1h),3.38(dd,j=12.7,2.6hz,1h),3.04(dd,j=12.6,8.9hz,1h),2.68(s,3h).
13
c nmr(151mhz,cdcl3)δ140.43,139.71,133.58,128.66,128.56,128.48,127.96,127.62,124.92,122.64,77.24,77.03,76.82,72.56,70.89,54.16,43.02,41.93,35.05.esi-ms(m+h)
+
:260.1.hmrs:calc.for c
15h17
nos([m+h]
+
)260.1104,found 260.1110.
[0351]
实施例33:n-甲基-1-(7-(4-甲苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0352]
[0353]
合成路线及反应步骤:
[0354]
参照实施例32中所述步骤xii-xiv,用4-甲基溴苯替换步骤xii中的溴苯,得黄色油状物17-b,总收率:17.0%。1h nmr(400mhz,cdcl3)δ7.16(d,j=5.2hz,1h),7.15
–
7.10(m,4h),6.82(d,j=5.2hz,1h),4.99
–
4.94(m,1h),4.30
–
4.21(m,2h),3.70
–
3.61(m,1h),3.09(dd,j=12.3,2.9hz,1h),2.91(dd,j=12.4,8.4hz,1h),2.52(s,3h),2.34(s,3h).
13
c nmr(151mhz,cdcl3)δ139.35,137.79,137.18,135.57,129.30,128.36,127.87,124.20,122.92,74.67,71.39,55.73,43.00,36.18,21.07.esi-ms(m+h)
+
:274.1.hmrs:calc.for c
16h19
nos([m+h]
+
)274.1260,found 274.1262.
[0355]
实施例34:n-甲基-1-(7-(4-甲氧基苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0356][0357]
合成路线及反应步骤:
[0358]
参照实施例32中所述步骤xii-xiv,用4-甲氧基溴苯替换步骤xii中的溴苯,得黄色油状物17-c,总收率:16.1%。1h nmr(400mhz,cdcl3)δ7.14(dd,j=10.1,6.9hz,3h),6.84(d,j=8.6hz,2h),6.81(d,j=5.2hz,1h),4.98(d,j=8.3hz,1h),4.30
–
4.15(m,2h),3.78(s,3h),3.68
–
3.54(m,1h),3.14(dd,j=12.4,2.6hz,2h),2.92(dd,j=12.5,8.5hz,1h),2.54(s,3h).
13
c nmr(151mhz,cdcl3)δ158.83,132.23,132.03,129.52,129.08,127.49,124.01,114.03,71.63,71.26,55.28,55.04,42.52,34.96,29.71.esi-ms(m+h)
+
:290.1.hmrs:calc.for c
16h19
no2s([m+h]
+
)290.1209,found 290.1213.
[0359]
实施例35:n-甲基-1-(7-(4-三氟甲基苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0360][0361]
合成路线及反应步骤:
[0362]
参照实施例32中所述步骤xii-xiv,用4-三氟甲基溴苯替换步骤xii中的溴苯,得
黄色油状物17-d,总收率:15.0%。1h nmr(400mhz,cdcl3)δ7.58(d,j=8.1hz,2h),7.35(d,j=8.0hz,2h),7.20(d,j=5.2hz,1h),6.85(d,j=5.2hz,1h),5.00
–
4.96(m,1h),4.39
–
4.34(m,1h),4.28(dd,j=11.1,5.2hz,1h),3.68(dd,j=11.0,8.8hz,1h),3.07(dd,j=12.6,2.9hz,1h),2.93(dd,j=12.5,8.4hz,1h),2.53(s,3h).
13
c nmr(151mhz,cdcl3)δ144.49,136.70,135.74,129.22,129.01,128.19,127.73,124.95,124.92,124.37,123.89,122.56,74.39,69.98,55.14,42.52,35.78.esi-ms(m+h)
+
:328.1.hmrs:calc.for c
16h16
f3nos([m+h]
+
)328.0977,found 328.0989.
[0363]
实施例36:n-甲基-1-(7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0364][0365]
合成路线及反应步骤:
[0366]
参照实施例32中所述步骤xii-xiv,用3,4-二氯碘苯替换步骤xii中的溴苯,得黄色油状物17-e,总收率:9.8%。esi-ms(m+h)
+
:328.0.hmrs:calc.for c
15h15
cl2nos([m+h]
+
)328.0324,found 328.0329.
[0367]
实施例37:n-甲基-1-(7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺(17-e)的顺反异构体分离
[0368][0369]
参考实施例7中所述,分离17-e得到淡黄色油状物17-e-1(收率:62%)和淡黄色油状物17-e-2(收率:3%)。通过h-nmr确认17-e-1为反式构型,17-e-2为顺式构型。
[0370]
17-e-1:反-n-甲基-1-(7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0371]1h nmr(400mhz,cdcl3)δ7.38(d,j=8.2hz,1h),7.26(d,j=6.2hz,1h),7.17(d,j=4.9hz,1h),7.00(d,j=8.2hz,1h),6.56(d,j=4.9hz,1h),5.11
–
5.02(m,1h),4.24(dd,j=11.3,5.7hz,1h),4.19
–
4.08(m,1h),3.63
–
3.54(m,1h),3.06
–
2.97(m,2h),2.56(s,3h).
13
c nmr(151mhz,cdcl3)δ141.14,136.22,136.08,132.67,131.17,130.58,130.39,
127.92,126.69,123.80,74.39,70.98,56.95,42.93,36.28.
[0372]
17-e-2:顺-n-甲基-1-(7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0373]1h nmr(400mhz,cdcl3)δ7.37(d,j=8.2hz,1h),7.29
–
7.21(m,2h),7.02(d,j=8.2hz,1h),6.81(d,j=5.4hz,1h),5.15(d,j=10.1hz,1h),4.08
–
3.91(m,3h),3.55(d,j=11.5hz,1h),3.18(s,1h),2.80(s,3h).
13
c nmr(151mhz,cdcl3)δ137.40,133.03,131.85,130.99,130.22,127.66,126.15,123.03,71.80,71.13,69.29,52.85,41.35,33.94.
[0374]
实施例38:反-n-甲基-1-(7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺(17-e-1)的手性拆分
[0375][0376]
17-e-1a:n-甲基-1-((4r,7r)-7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)-甲胺
[0377]
17-e-1b:n-甲基-1-((4s,7s)-7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)-甲胺
[0378]
参考实施例8中所述,拆分17-e-1得到透明油状物17-e-1a(收率:30.6%),手性hplc分析显示ee%=95.4%,化合物经单晶衍射确定构型为(r,r)型;透明油状物17-e-1b(收率:25.8%),手性hplc分析显示ee%=96%,确定构型为(s,s)型。
[0379]
实施例39:n-甲基-1-(7-(1-萘基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0380][0381]
合成路线及反应步骤:
[0382]
参照实施例32中所述步骤xii-xiv,用1-溴萘替换步骤xii中的溴苯,得黄色油状物17-f,总收率:14.7%。1h nmr(400mhz,cdcl3)δ7.88
–
7.83(m,1h),7.77
–
7.71(m,1h),
nmr(400mhz,cdcl3)δ7.83
–
7.78(m,3h),7.74(s,1h),7.49
–
7.45(m,2h),7.30(d,j=8.4hz,1h),7.19(d,j=5.1hz,1h),6.84(d,j=5.2hz,1h),4.87
–
4.83(m,1h),4.51
–
4.45(m,1h),4.34(dd,j=11.1,5.4hz,1h),3.80(t,j=10.4hz,1h),3.26
–
3.18(m,1h),3.05(dd,j=13.6,6.5hz,1h).
13
c nmr(151mhz,cdcl3)δ138.87,137.61,135.25,132.79,132.23,127.76,127.16,127.09,126.87,125.70,125.64,125.34,123.83,122.39,70.66,45.81,43.03.esi-ms(m+h)
+
:296.1.hmrs:calc.for c
18h17
nos([m+h]
+
)296.1104,found 296.1114.
[0391]
实施例42:n,n-二甲基-1-(7-(萘-2-基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0392][0393]
合成路线及反应步骤:
[0394]
参照实施例32中所述步骤xii-xiv,用2-溴萘替换步骤xii中的溴苯,用氨基乙醛缩二甲醇替换步骤xiv中的二甲基氨基乙醛缩二甲醇,得黄色油状物17-i,总收率:11.3%。1h nmr(400mhz,cdcl3)δ7.82
–
7.77(m,3h),7.74(s,1h),7.49
–
7.45(m,2h),7.30(d,j=9.6hz,1h),7.17(d,j=5.2hz,1h),6.92(d,j=5.2hz,1h),5.01
–
4.97(m,1h),4.52
–
4.45(m,1h),4.38(dd,j=11.1,5.5hz,1h),3.78(t,j=10.3hz,1h),2.77
–
2.70(m,2h),2.40(s,6h).
13
c nmr(151mhz,cdcl3)δ139.18,138.85,137.08,133.77,133.19,128.70,128.14,128.06,127.83,126.80,126.71,126.58,126.27,124.35,123.81,74.38,71.74,64.59,46.44,43.91.esi-ms(m+h)
+
:324.2.hmrs:calc.for c
20h21
nos([m+h]
+
)324.1417,found324.1424.
[0395]
实施例43:1-(7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0396][0397]
合成路线及反应步骤:
[0398]
参照实施例32中所述步骤xii-xiv,用3,4-二氯碘苯替换步骤xii中的溴苯,用氨
基乙醛缩二甲醇替换步骤xiv中的甲氨基乙醛缩二甲醇,得黄色油状物17-j,总收率:11.1%。1h nmr(400mhz,cd3odδ7.45(d,j=8.3hz,1h),7.35(dd,j=11.7,3.3hz,2h),7.12(dd,j=8.3,1.6hz,1h),6.61(d,j=5.1hz,1h),5.19(d,j=8.2hz,1h),4.29(dd,j=11.2,5.4hz,1h),4.24
–
4.16(m,1h),3.69(dd,j=11.0,8.7hz,1h),3.37(dd,j=13.3,2.9hz,1h),3.31
–
3.28(m,1h),3.16(dd,j=13.3,8.5hz,1h).
13
c nmr(151mhz,cd3od)δ140.22,136.06,131.62,130.63,129.20,128.93,128.76,126.69,125.18,123.06,71.02,68.22,42.92,40.74.esi-ms(m+h)
+
:314.2.hmrs:calc.for c
14h13
cl2nos([m+h]
+
)314.0168,found 314.0174.
[0399]
实施例44:n,n-二甲基-1-(7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)-甲胺
[0400][0401]
合成路线及反应步骤:
[0402]
参照实施例32中所述步骤xii-xiv,用3,4-二氯碘苯替换步骤xii中的溴苯,用二甲基氨基乙醛缩二甲醇替换步骤xiv中的甲氨基乙醛缩二甲醇,得黄色油状物17-k,总收率:8.7%。1h nmr(400mhz,cdcl3)δ7.91(s,1h),7.46(d,j=8.3hz,1h),7.35
–
7.31(m,2h),7.13(dd,j=8.2,1.6hz,1h),6.60(d,j=5.1hz,1h),5.30(t,j=6.3hz,1h),4.29(dd,j=11.2,5.4hz,1h),4.24
–
4.16(m,1h),3.70(dd,j=11.1,8.6hz,1h),3.17(d,j=6.5hz,3h),2.71(s,6h).
13
c nmr(151mhz,cdcl3)δ140.69,136.32,135.11,132.00,130.45,130.04,129.93,129.79,127.35,125.71,123.61,72.89,70.92,64.28,45.40,45.03,42.43.esi-ms(m+h)
+
:342.1.hmrs:calc.for c
16h17
cl2nos([m+h]
+
)342.0481,found342.0490.
[0403]
实施例45:n-环丙甲酰基-1-(7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)-甲胺
[0404][0405]
合成路线及反应步骤:
[0406][0407]
将1.0g化合物17-j(3.19mmol,1.0eq)加入100ml的三口烧瓶中,加入20ml二氯甲烷使其溶解,再向其中加入484mg三乙胺(4.79mmol,1.5eq),冰浴下缓慢加入400mg环丙甲酰氯(3.83mmol,1.2eq),移出冰浴后上述混合物在室温下搅拌2小时,反应液加水洗(5ml x 3)后用无水硫酸钠干燥,过滤并浓缩得到油状物,将其用硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~20/1)得到868mg黄色油状物17-l,收率:69%。1h nmr(400mhz,cdcl3)δ7.40(d,j=8.2hz,1h),7.33(s,1h),7.21(d,j=4.1hz,1h),7.07(d,j=8.1hz,1h),6.89(d,j=4.3hz,1h),6.15(s,1h),4.89(d,j=7.5hz,1h),4.26(m,4.32-4.18,2h),4.15
–
3.98(m,1h),3.64(t,j=11.3hz,1h),3.40
–
3.25(m,1h),1.37(s,1h),1.25(s,1h),1.06
–
0.91(m,2h),0.76(d,j=7.1hz,2h).esi-ms(m+h)
+
:382.0.
[0408]
实施例46:n-环丙甲基-1-(7-(3,4-二氯苯基)-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)-甲胺
[0409][0410]
合成路线及反应步骤:
[0411][0412]
将200mg 17-l(0.52mmol,1.0eq)加入25ml规格的圆底烧瓶中,加5ml干燥的四氢呋喃使之完全溶解,将体系用氮气置换三次,冰水浴下向烧瓶中缓慢滴加1.6ml氢化铝锂(1m in thf,1.56mmol,3.0eq),滴加完毕后移出冰浴,室温下搅拌反应3小时,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,向其中缓慢滴加naoh溶液(1mol/l),至大量沉淀生成,过滤得滤液,滤饼加乙酸乙酯洗涤。所得滤液用乙酸乙酯(10ml x 3)和水(15ml)萃取,得有机相合并,用饱和食盐水(15ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,硅胶柱层析进行分离(石油醚/乙酸乙酯=10/1)得到115mg淡黄色油状物17-m,收率:60%。1h nmr(400mhz,cdcl3)δ7.30
–
7.24(m,2h),7.19(d,j=6.9hz,2h),7.13(d,j=5.2hz,1h),6.85
–
6.79(m,1h),6.05(s,1h),4.85(d,j=7.9hz,1h),4.30
–
4.19(m,2h),4.12
–
4.00(m,1h),3.65(t,j=8.8hz,1h),3.36
–
3.26(m,1h),1.34
–
1.28(m,2h),0.96
–
0.87(m,2h),0.86
–
0.76(m,2h),0.74
–
0.64(m,2h).esi-ms(m+h)
+
:368.1.
[0413]
实施例47:n-甲基-1-(2-甲基-7-苯基-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)甲胺
[0414][0415]
合成路线:
[0416][0417]
reagents and conditions:(xv)tbscl,imidazole,二氯甲烷,rt,2h;(xvi)n-buli,ch3i,thf,-78℃~rt,3h;(xvii)cf3so3h,1,4-dioxane,80℃,5h;
[0418]
反应步骤:
[0419]
xv.将300mg16-a(1.47mmol,1.0eq)加入25规格的烧瓶中,加入5ml二氯甲烷使之溶解,再向其中加入200mg咪唑(2.94mmol,2.0eq)和264mg叔丁基二甲基氯硅烷(1.76mmol,1.2eq),上述混合物在室温下搅拌2小时,向混合物滴加饱和氯化铵水溶液淬灭,用二氯甲烷(10ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水(15ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,再用硅胶柱层析(石油醚/乙酸乙酯=60/1)分离得到得到420mg透明油状物18-a,收率:90%。1h nmr(400mhz,cdcl3)δ7.29
–
7.25(m,4h),7.23
–
7.17(m,1h),7.13(dd,j=5.1,1.1hz,1h),6.89(dd,j=5.0,3.6hz,1h),6.83
–
6.79(m,1h),4.31(t,j=6.6hz,1h),4.06(ddd,j=25.6,9.8,6.6hz,2h),0.80(s,9h),0.08(d,j=4.6hz,6h).esi-ms(m+h)+:319.1.
[0420]
xvi.将100mg 18-a(0.31mmol,1.0eq)加入25ml规格的烧瓶,加入5ml干燥四氢呋喃使之溶解,-78℃下缓慢向溶液滴加0.4ml正丁基锂(2.4m in thf,0.93mmol,3.0eq),搅拌30分钟后向上述溶液中加入89mg碘甲烷(0.63mmol,2.0eq)的四氢呋喃溶液,加毕后保持-78℃搅拌1小时,之后缓慢升至室温搅拌2小时,向上述混合物缓慢滴加饱和氯化铵水溶液淬灭,用乙酸乙酯(10ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水(15ml)洗涤,加入无水硫酸钠干燥后过滤,滤液浓缩后使用硅胶柱层析(石油醚/乙酸乙酯=100/1~60/1)分离得到68mg透明油状物19-a,收率:66%。1h nmr(400mhz,cdcl3)δ7.33(dq,j=9.6,7.2hz,6h),6.42
–
6.36(m,1h),6.30(dd,j=3.8,1.8hz,1h),4.24
–
3.99(m,3h),0.91(s,9h),0.03(s,5h).esi-ms(m+h)
+
:333.1.
[0421]
xvii.将100mg 19-a(0.30mmol,1.0eq)加入25ml规格的圆底烧瓶中,加入5ml无水1,4-二氧六环使其溶解,再向烧瓶中加入107mg甲氨基乙醛缩二甲醇(0.90mmol,3.0eq)和238mg三氟甲磺酸(1.5mmol,5.0eq),上述混合物在80℃下搅拌反应5小时,再滴加1n氢氧化
钠水溶液调节反应液ph至10~11,用乙酸乙酯(10ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水(15ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~10/1)得到22mg黄色油状物20-a,收率:27%。1h nmr(400mhz,cdcl3)δ7.31
–
7.22(m,3h),7.19
–
7.12(m,2h),6.46(s,1h),5.33(d,j=9.6hz,1h),4.28
–
4.13(m,2h),3.76
–
3.65(m,1h),3.52
–
3.41(m,1h),3.16
–
3.03(m,1h),2.78(s,3h),2.37(s,3h).
13
c nmr(151mhz,cdcl3)δ140.73,139.72,137.09,132.37,128.56,128.34,127.46,120.58,70.97,70.26,52.20,42.51,33.76,29.70,15.25,1.02.esi-ms(m+h)
+
:274.1.hmrs:calc.for c
16h19
nos([m+h]
+
)274.1260,found 274.1266.
[0422]
实施例48:n-甲基-1-(2-氟-7-苯基-6,7-二氢-4h-噻吩并[3,2-c]吡喃-4-基)-甲胺
[0423][0424]
合成路线及反应步骤:
[0425]
参照实施例47中所述步骤xv-xvii,用n-氟代双苯磺酰胺(nfsi)替换步骤xvi中的碘甲烷,得黄色油状物20-b,总收率:4.8%。1h nmr(400mhz,cdcl3)δ7.32
–
7.26(m,3h),7.20
–
7.12(m,2h),6.22(s,1h),5.25(d,j=9.2hz,1h),4.27(dd,j=10.8,4.8hz,1h),4.19
–
4.11(m,1h),3.79
–
3.70(m,1h),3.41
–
3.32(m,1h),3.14
–
3.04(m,1h),2.76(s,3h).
13
c nmr(151mhz,cdcl3)δ186.49,139.86,128.76,128.32,127.83,70.48,51.94,41.66,33.78,31.93,29.71,29.37,22.70,14.13.esi-ms(m+h)
+
:278.1.hmrs:calc.for c
15h16
fnos([m+h]
+
)278.1010,found 278.1022.
[0426]
实施例49:n-甲基-1-(4-(3,4-二氯苯基)-4,7-二氢-5h-呋喃并[2,3-c]吡喃-7-基)甲胺
[0427][0428]
合成路线:
[0429][0430]
reagents and conditions:(xvii)etmgcl,(ipr)2nh,thf,50℃,3h;pd(tbu3p)2,thf,60℃,3h;(xix)lialh4,thf,rt,3h;(xx)cf3so3h,1,4-dioxane,80℃,3h.
[0431]
反应步骤:
[0432]
xviii.将1.0g 3,4-二氯苯乙酸(4.88mmol,1.0eq)加入100ml的三口烧瓶中,加10ml无水四氢呋喃使其固体完全溶解,用氮气对烧瓶进行置换三次,再向溶液加入50mg二异丙胺(0.49mmol,0.1eq)。在冰浴下缓慢滴加4.5ml格氏试剂乙基氯化镁(2.7m in thf,12.19mmol,3.0eq),滴加过程中有大量气泡产生,并且剧烈放热,加入完毕后上述混合物在50℃下搅拌3小时,随后降至室温。将1.4g 3-溴呋喃(9.76mmol,2eq)和50mg三叔丁基膦钯(0.1mmol,0.02eq)溶于10ml无水四氢呋喃后加入烧瓶中,升至60℃搅拌3小时,将体系降至室温,向烧瓶中缓慢滴加2n的盐酸溶液调节ph至4~6,有大量固体析出,过滤出去固体,滤液加乙酸乙酯(30ml x 3)和水(20ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,滤液浓缩得黑色油状物,使用硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~20/1)得到353mg黄色油状物21-a,收率:26.2%。1h nmr(400mhz,cdcl3)δ11.33(s,1h),7.42(dd,j=8.7,7.8hz,4h),7.20(d,j=7.3hz,1h),6.34(s,1h),4.83(s,1h).esi-ms(m-h)-:269.0。
[0433]
xix.将353mg 21-a(1.3mmol,1.0eq)加入50ml规格的圆底烧瓶中,加20ml干燥的四氢呋喃使之完全溶解,将体系用氮气置换三次,冰水浴下向烧瓶中缓慢滴加1.6ml氢化铝锂(2.5m in thf,3.9mmol,3.0eq),滴加完毕后移出冰浴,室温下搅拌反应3小时,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,向其中缓慢滴加naoh溶液(1mol/l),至大量沉淀生成,过滤得滤液,滤饼加乙酸乙酯洗涤。所得滤液用乙酸乙酯(20ml x 3)和水(10ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,硅胶柱层析进行分离(石油醚/乙酸乙酯=10/1)得到250mg淡黄色油状物22-a,收率:74.7%。1h nmr(400mhz,cdcl3)δ7.40(d,j=8.2hz,3h),7.34(d,j=12.7hz,2h),7.12(d,j=7.5hz,1h),6.26(s,1h),4.01(d,j=3.1hz,3h).esi-ms(m+h)
+
:257.0.
[0434]
xx.将100mg 22-a(0.40mmol,1.0eq)加入50ml规格的圆底烧瓶中,加入10ml无水1,4-二氧六环使其溶解,再向烧瓶中加入144mg甲氨基乙醛缩二甲醇(1.20mmol,3eq)和300mg三氟甲磺酸(2.0mmol,5eq),上述混合物在80℃下搅拌反应3小时,再滴加1n氢氧化钠水溶液调节反应液ph至10~11,用乙酸乙酯(10ml x 3)和水(5ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~10/1)得到40mg棕黄色油状物23-a,收率:32.4%。1h nmr(400mhz,cdcl3)δ7.37(d,j=7.3hz,2h),7.23(s,1h),7.00(d,j=7.9hz,1h),6.10(s,1h),5.13(s,1h),4.25
–
4.04(m,2h),3.55(d,j=12.1hz,1h),3.51
–
3.43(m,1h),3.31
–
3.19(m,1h),2.76(s,3h).esi-ms(m+h)
+
:312.1.
[0435]
实施例50:n-甲基-1-(4-甲基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0436][0437]
合成路线:
[0438][0439]
reagents and conditions:(xxi)etmgcl,(ipr)2nh,thf,50℃,3h;pd(tbu3p)2,thf,60℃,3h;(xxii)lialh4,thf,rt,1h;(xxiii)cf3so3h,1,4-dioxane,80℃,3h.
[0440]
反应步骤:
[0441]
xxi.将1.0g3-噻吩乙酸(7.0mm,1.0eq)加入100ml的三口烧瓶中,加10ml无水四氢呋喃使其固体完全溶解,用氩气对烧瓶进行置换三次,向溶液加入0.1ml二异丙胺(0.7mm,0.1eq),冰浴下缓慢向上述溶液中滴加6.6ml乙基氯化镁(2.7m in thf,17.6mm,2.5eq),滴加过程中有大量气泡产生,并且剧烈放热。以上混合物在室温下搅拌3小时,随后将2g碘甲烷(14.1mm,2.0eq)和71.5mg二三叔丁基膦钯(0.14mm,0.02eq)溶于10ml无水四氢呋喃后加入烧瓶中,升至60℃搅拌3小时,将体系降至室温,向烧瓶中缓慢滴加2n的盐酸溶液调节ph至4~6,有大量固体析出,硅藻土助滤除去固体,滤液加乙酸乙酯(50mlx 3)和水(40ml)萃取,得有机相合并,饱和食盐水洗涤后,无水硫酸钠干燥,过滤,滤液浓缩后硅胶柱层析(二氯甲烷/甲醇=100/1)分离得到730mg黄色油状液体24-a,收率:33.2%。esi-ms(m-h)-:155.0.
[0442]
xxii.将730mg24-a(4.7mm,1.0eq)加入100ml规格的茄形瓶中,加入30mlthf使之完全溶解,氩气置换后,冰浴下缓慢滴加14mllialh4的thf溶液(1.0minthf,14.0mm,3.0eq),室温下反应1h,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,再向其中缓慢滴加1n氢氧化钠水溶液,至大量沉淀生成,过滤,滤饼加乙酸乙酯洗涤,所得滤液用乙酸乙酯(30ml
×
3)和水(15ml)萃取,得有机相合并,用无水硫酸钠干燥后过滤,滤液浓缩得黄色油状物,经过硅胶柱层析(pe/ea=10/1)分离得到550mg淡黄色油状液体25-a,收率:82.8%。esi-ms(m+h)
+
:143.0.1h nmr(400mhz,cdcl3)δ7.27(s,1h),7.05
–
6.94(m,2h),3.61(d,j=6.1hz,2h),3.02(dd,j=12.8,6.4hz,1h),2.11(s,1h),1.25(d,j=6.5hz,3h).
[0443]
xxiii.将400mg25-a(2.82mm,1.0eq)加入50ml茄形瓶中,加入20ml无水1,4-二氧六环使之溶解,向其中加入1.0g甲胺基乙缩醛二甲醇(8.45mm,3.0eq)和2.1g三氟甲磺酸(14.1mm,5.0eq),混合物在80℃下搅拌反应3h,加1n氢氧化钠水溶液调节反应液ph至10~11,用乙酸乙酯(30ml x 3)和水(20ml)萃取,得有机相合并,用无水硫酸钠干燥后过滤,浓
缩得黄色油状物,将所得油状物用硅胶柱层析(二氯甲烷/甲醇=100/1~50/1)分离得到457mg黄色油状物26-a,收率:82.8%。esi-ms(m+h)
+
:198.1.hmrs:calc.for c
10h15
nos([m+h]
+
)198.0947,found198.0946.
[0444]
实施例51:n-甲基-1-(4-甲基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺(26-a)的顺反异构体分离
[0445][0446]
将分离得到的457mg26-a溶于甲醇后,用c18柱通过combiflash进行分离,设置洗脱溶剂为甲醇/h2o=1/100~100/1,得到两组淡黄色油状物,通过h-nmr鉴定结构,确认得到55mg反式构型26-a-1(收率:12.0%)和180mg顺式构型26-a-2(收率:39.4%)。
[0447]
26-a-1:反-n-甲基-1-(4-甲基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0448]1h nmr(400mhz,cdcl3)δ7.21(d,j=3.7hz,1h),6.90(dd,j=16.2,4.3hz,1h),5.17(d,j=9.2hz,1h),4.12(dd,j=11.0,4.8hz,1h),3.81(dd,j=44.9,10.2hz,1h),3.46(t,j=15.4hz,1h),3.35(t,j=10.1hz,1h),3.26
–
3.10(m,1h),2.88(d,j=10.6hz,4h),1.23(d,j=6.7hz,1h),1.13(d,j=6.7hz,2h).
13
c nmr(151mhz,cdcl3)δ140.50,140.28,129.26,129.07,125.96,125.40,123.85,69.62,69.41,68.26,68.20,53.40,53.13,33.78,33.69,30.19,30.02,18.24,15.46
[0449]
26-a-2:顺-n-甲基-1-(4-甲基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0450]1h nmr(400mhz,cdcl3)δ7.17(s,1h),6.90(d,j=25.2hz,1h),4.90(s,1h),4.21
–
3.79(m,1h),3.34(t,j=10.4hz,1h),3.05
–
2.76(m,3h),2.51(d,j=3.6hz,3h),2.07(s,1h),1.27(d,j=6.8hz,1h),1.16(d,j=6.7hz,2h).
13
c nmr(151mhz,cdcl3)δ139.05,138.98,133.99,133.72,125.93,125.04,122.58,73.85,73.61,70.59,69.21,56.79,56.73,35.79,30.58,30.43,19.44,15.50.
[0451]
实施例52:n-甲基-1-(4-乙基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0452][0453]
合成路线及反应步骤:
[0454]
参照实施例50中所述步骤xxi-xxiii,用碘乙烷替换步骤xxi中的碘甲烷,得黄色油状物26-b,总收率:5.7%。esi-ms(m+h)
+
:212.1.hmrs:calc.for c
11h17
nos([m+h]
+
)212.1104,found 212.1105.
[0455]
实施例53:n-甲基-1-(4-乙基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺的顺
反异构体分离
[0456][0457]
参考实施例51中所述,分离26-b得到淡黄色油状物26-b-1(收率:24.7%)和淡黄色油状物26-b-2(收率:23.3%)。通过h-nmr确认26-b-1为反式构型,26-b-2为顺式构型。
[0458]
26-b-1:反-n-甲基-1-(4-乙基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0459]1h nmr(400mhz,cdcl3)δ7.33
–
7.12(m,1h),6.91(d,j=14.0hz,1h),5.17(s,1h),4.08(d,j=59.4hz,1h),3.87
–
3.40(m,2h),3.19(s,1h),2.96
–
2.75(m,4h),2.57(s,1h),1.72(d,j=49.6hz,1h),1.36(d,j=81.9hz,1h),1.03
–
0.89(m,3h).
13
c nmr(151mhz,cdcl3)δ139.29,139.18,129.53,129.45,126.68,125.74,123.66,123.56,69.62,69.30,66.80,66.54,53.55,53.08,36.98,36.37,33.77,33.72,26.28,24.30,11.23,10.63.
[0460]
26-b-2:顺-n-甲基-1-(4-乙基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0461]1h nmr(400mhz,cdcl3)δ7.15(s,1h),6.96
–
6.76(m,1h),4.87(s,1h),4.25
–
3.91(m,1h),3.85
–
3.40(m,1h),3.00
–
2.81(m,3h),2.50(s,3h),1.78(s,1h),1.72
–
1.62(m,1h),1.54
–
1.21(m,1h),0.98(dt,j=14.7,7.2hz,3h).
13
c nmr(151mhz,cdcl3)δ138.52,138.50,135.00,127.19,125.87,122.98,122.86,74.52,74.25,68.50,67.68,57.66,57.36,38.06,37.40,36.50,36.45,27.55,24.87,12.10,11.30.
[0462]
实施例54:n-甲基-1-(4-异丙基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0463][0464]
合成路线及反应步骤:
[0465]
参照实施例50中所述步骤xxi-xxiii,用2-碘丙烷替换步骤xxi中的碘甲烷,得黄色油状物26-c,总收率:2.3%。1h nmr(400mhz,cdcl3)δ7.15(s,1h),6.91(d,j=4.5hz,1h),4.88(s,1h),4.12
–
4.03(m,1h),3.70
–
3.62(m,1h),2.90(s,2h),2.82(s,1h),2.50(s,3h),1.01(d,j=7.0hz,3h),0.85(d,j=6.5hz,3h).
13
c nmr(151mhz,cdcl3)δ136.88,134.90,125.70,122.10,73.27,64.02,56.62,41.22,35.78,29.13,19.86,17.66.esi-ms(m+h)
+
:226.1.
[0466]
实施例55:n-甲基-1-(4,4-二甲基-4,7-二氢-5h-噻吩并[2,3-c]吡喃-7-基)甲胺
[0467][0468]
合成路线:
[0469][0470]
reagents and conditions:(xxiv)nah,dmso,rt,3h;(xxv)4.0n lioh(aq),100℃,15h;(xxvi)lialh4,thf,rt,3h;(xxvii)cf3so3h,1,4-dioxane,80℃,3h.
[0471]
反应步骤:
[0472]
xxiv.将500mg 3-噻吩乙腈(4.1mm,1.0eq)加入50ml茄形瓶中,再加入15ml二甲亚砜使之溶解,置换氩气后,向茄形瓶中分批次加入400mg钠氢(10.0mm,2.5eq),加入完毕后室温下搅拌反应30min;向上述反应体系中加入1.16g碘甲烷(8.2mm,2.0eq),室温下继续反应3h后,缓慢加入5mlh2o淬灭反应,再加入乙酸乙酯(50mlx 2)和水(15ml)萃取,有机相用水(30mlx 3)和饱和食盐水洗涤后,干燥浓缩得油状液体,经过硅胶柱层析(pe/ea=30/1)分离得到520mg无色油状液体28-a,收率:84.7%。esi-ms(m+h)
+
:152.0.1h nmr(400mhz,cdcl3)δ7.36
–
7.17(m,2h),7.08(d,j=22.4hz,1h),1.64(dd,j=39.3,25.8hz,6h).
[0473]
xxv.将530mg(3.5mm,1.0eq)28-a置于100ml茄形瓶中,加入28ml4.0n的氢氧化锂溶液,在100℃下回流反应15h后,降至室温,向反应液中加入200ml稀盐酸,再用乙酸乙酯(75ml x 3)萃取,合并有机相,用水(100ml x 3)和饱和食盐水洗涤后,有机相用无水硫酸钠干燥,减压蒸馏得到600mg白色固体29-a,收率:100%。esi-ms(m-h)-:169.0
[0474]
xxvi.将600mg29-a(3.5mm,1.0eq)加入100ml规格的茄形瓶中,加入30mlthf使之完全溶解,氩气置换后,冰浴下缓慢滴加10.5mllialh4的thf溶液(1.0minthf,10.5mm,3.0eq),室温下反应1h,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,再向其中缓慢滴加1n氢氧化钠水溶液,至大量沉淀生成,过滤,滤饼加乙酸乙酯洗涤,所得滤液用乙酸乙酯(30ml
×
3)和水(15ml)萃取,得有机相合并,用无水硫酸钠干燥后过滤,滤液浓缩得黄色油状物,经过硅胶柱层析(pe/ea=10/1)分离得到357mg淡黄色油状液体30-a,收率:64.5%。esi-ms(m+h)
+
:157.0.1h nmr(400mhz,cdcl3)δ7.31(s,1h),7.07(s,2h),3.55(s,2h),1.42(s,1h),1.32(s,6h).
[0475]
xxvii.将357mg30-a(2.3mm,1.0eq)加入50ml茄形瓶中,加入20ml无水1,4-二氧六环使之溶解,向其中加入821mg甲胺基乙缩醛二甲醇(6.9mm,3.0eq)和1.7g三氟甲磺酸(11.5mm,5.0eq),混合物在80℃下搅拌反应3h,加1n氢氧化钠水溶液调节反应液ph至10~11,用乙酸乙酯(30ml x 3)和水(20ml)萃取,得有机相合并,用无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物用硅胶柱层析(二氯甲烷/甲醇=100/1~50/1)分离得到
51.7mg淡黄色油状物31-a,收率:10.6%。1h nmr(400mhz,cdcl3)δ7.15(d,j=4.6hz,1h),6.93(d,j=4.9hz,1h),4.89(d,j=4.5hz,1h),3.72(d,j=11.1hz,1h),3.47(t,j=20.3hz,1h),2.95(d,j=6.9hz,2h),2.52(s,3h),2.17(s,1h),1.27(s,3h),1.19(s,3h).
13
c nmr(151mhz,cdcl3)δ143.24,132.90,124.10,122.72,75.19,73.93,56.79,35.76,33.56,27.68,24.36.esi-ms(m+h)
+
:212.1.
[0476]
hmrs:calc.for c
11h17
nos([m+h]
+
)212.1104,found 212.1105.
[0477]
实施例56:n-甲基-1-(5'h,7'h-螺[环丙烷-1,4'-噻吩并[2,3-c]吡喃]-7'-基)甲胺
[0478][0479]
合成路线及反应步骤:
[0480]
参照实施例55中所述步骤xxiv-xxvii,用1-溴-2-氯乙烷(1.0eq)替换步骤xxiv中的碘甲烷(2.0eq),得淡黄色油状物31-b,总收率:4.6%。1h nmr(400mhz,cdcl3)δ7.12(s,1h),6.48(s,1h),5.00(s,1h),3.99(d,j=9.9hz,1h),3.63
–
3.36(m,1h),2.98(s,2h),2.53(s,3h),1.98(s,1h),1.05
–
0.83(m,4h).
13
c nmr(151mhz,cdcl3)δ138.71,133.76,122.93,121.25,74.18,71.86,56.54,35.80,18.72,16.28,10.35.esi-ms(m+h)
+
:210.1.hmrs:calc.for c
11h15
nos([m+h]
+
)210.0947,found 210.0945.
[0481]
实施例57:n-甲基-1-(5'h,7'h-螺[环丁烷-1,4'-噻吩并[2,3-c]吡喃]-7'-基)甲胺
[0482][0483]
合成路线及反应步骤:
[0484]
参照实施例55中所述步骤xxiv-xxvii,用1,2-二溴丙烷(1.0eq)替换步骤xxiv中的碘甲烷(2.0eq),得淡黄色油状物31-c,总收率:22.5%。1h nmr(400mhz,cdcl3)δ7.17(d,j=11.3hz,2h),4.88(s,1h),4.17(d,j=11.2hz,1h),3.65(d,j=10.8hz,1h),2.91(s,2h),2.50(s,3h),2.43
–
2.35(m,1h),2.20(s,2h),2.06
–
1.96(m,4h).
13
c nmr(151mhz,cdcl3)δ142.49,133.99,125.11,123.53,74.51,73.62,57.30,39.96,36.37,34.15,30.28,15.68.esi-ms(m+h)
+
:224.1.hmrs:calc.for c
12h17
nos([m+h]
+
)224.1104,found 224.1106.
[0485]
实施例58:n-甲基-1-(5'h,7'h-螺[环戊烷-1,4'-噻吩并[2,3-c]吡喃]-7'-基)甲
胺
[0486][0487]
合成路线及反应步骤:
[0488]
参照实施例55中所述步骤xxiv-xxvii,用1,3-二溴丁烷(1.0eq)替换步骤xxiv中的碘甲烷(2.0eq),得淡黄色油状物31-d,总收率:18.5%。1h nmr(400mhz,cdcl3)δ7.16(s,1h),6.90(s,1h),4.94(s,1h),3.77(d,j=11.1hz,1h),3.47(d,j=10.8hz,1h),2.99(d,j=12.7hz,1h),2.76(s,2h),2.56(s,3h),1.73(dd,j=121.4,54.9hz,8h).
13
c nmr(151mhz,cdcl3)δ143.37,132.44,124.38,122.88,73.16,72.61,56.26,44.41,38.60,35.47,35.39,25.03,24.60.esi-ms(m+h)
+
:238.1.hmrs:calc.for c
13h19
nos([m+h]
+
)238.1260,found 238.1261.
[0489]
实施例59:1-(4-(3,4-二氯苯基)-8-甲氧基异苯并二氢吡喃-1-基)-n-甲基甲胺(化合物35-a),1-(4-(3,4-二氯苯基)-6-甲氧基异苯并二氢吡喃-1-基)-n-甲基甲胺(化合物35-b)
[0490][0491]
合成路线:
[0492][0493]
reagents and conditions:(xxviii)etmgcl,(ipr)2nh,thf,50℃,3h;pd(tbu3p)2,thf,60℃,3h;(xxix)lialh4,thf,rt,3h;(xxx)cf3so3h,1,4-dioxane,100℃,24h.
[0494]
反应步骤:
[0495]
xxviii.将1.0g 3,4-二氯苯乙酸(4.9mmol,1.0eq)加入100ml的三口烧瓶中,加10ml无水四氢呋喃使其固体完全溶解,用氮气对烧瓶进行置换三次,向溶液加入50mg二异丙胺(0.49mmol,0.1eq)。在冰浴下缓慢滴加6.1ml格氏试剂乙基氯化镁(2.4m in thf,14.7mmol,3.0eq),滴加过程中有大量气泡产生,并且剧烈放热。以上混合物在50℃下搅拌3
小时,随后降至室温后,将1.37g 3-甲氧基碘苯(5.9mmol,1.2eq)和75mg三叔丁基膦钯(0.15mmol,0.03eq)溶于10ml无水四氢呋喃后加入烧瓶中,升至60℃搅拌3小时,将体系降至室温,向烧瓶中缓慢滴加2n的盐酸溶液调节ph至4~6,有大量固体析出,过滤出去固体,滤液加乙酸乙酯(30ml x 3)和水(20ml)萃取,得有机相合并,用无水硫酸钠干燥后过滤,滤液浓缩得黑色油状物,使用硅胶柱层析进行分离(二氯甲烷/甲醇=50/1~20/1)得到903mg黄色油状物33-a,收率:59%。esi-ms(m-h)
+
:278.9.
[0496]
xxix.将900mg 33-a(3.22mmol,1.0eq)加入100ml规格的圆底烧瓶中,加30ml干燥的四氢呋喃使之完全溶解,将体系用氮气置换三次,冰水浴下向烧瓶中缓慢滴加3.9ml氢化铝锂(2.5m in thf,9.68mmol,3.0eq),滴加完毕后移出冰浴,室温下搅拌反应3小时,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,向其中缓慢滴加naoh溶液(1mol/l),至大量沉淀生成,过滤得滤液,滤饼加乙酸乙酯洗涤。所得滤液用乙酸乙酯(20ml x 3)和水(15ml)萃取,得有机相合并,用饱和食盐水(20ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,硅胶柱层析进行分离(石油醚/乙酸乙酯=10/1)得到696mg淡黄色油状物34-a,收率:73%。1h nmr(400mhz,cdcl3)δ7.45
–
7.32(m,2h),7.28(d,j=3.2hz,1h),7.20
–
7.06(m,3h),6.96
–
6.84(m,2h),4.12(d,j=3.2hz,3h),3.81(d,j=3.2hz,3h).esi-ms(m+h)
+
:297.1.
[0497]
xxx.将500mg 34-a(1.69mmol,1.0eq)加入100ml规格的封管中,加30ml无水1,4-二氧六环使其溶解,再向烧瓶中加入402mg甲氨基乙醛缩二甲醇(3.4mmol,2.0eq)和760mg三氟甲磺酸(5.07mmol,3.0eq),将封管封口后在100℃下加热搅拌24小时,混合物加1n氢氧化钠水溶液调节ph至10~11,用乙酸乙酯(20ml x 3)和水(10ml)萃取,得有机相合并,用无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物硅胶柱层析进行分离(二氯甲烷/甲醇=100/1~10/1)得到71mg 35-a(收率:12%)和124mg 35-b(收率:21%),均为黄色油状物。
[0498]
35-a:1-(4-(3,4-二氯苯基)-8-甲氧基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0499]1h nmr(400mhz,cdcl3)δ7.28
–
7.12(m,3h),6.91(dd,j=19.6,8.2hz,1h),6.76(d,j=8.0hz,1h),6.56
–
6.49(m,1h),5.40
–
5.19(m,1h),4.21
–
4.08(m,1h),3.84(s,3h),3.80
–
3.64(m,2h),3.60
–
3.45(m,2h),3.35
–
3.15(m,1h),2.75(s,3h).
13
c nmr(151mhz,cdcl3)δ155.51,155.36,143.01,141.58,137.26,132.68,132.46,131.23,130.95,130.77,130.61,130.44,130.39,129.08,128.21,128.03,121.96,108.90,68.25,65.97,55.40,49.77,42.84,33.26,33.15.esi-ms(m+h)
+
:352.1.
[0500]
35-b:1-(4-(3,4-二氯苯基)-6-甲氧基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0501]1h nmr(400mhz,cdcl3)δ7.33
–
7.27(m,1h),7.19
–
7.15(m,1h),7.03(dd,j=8.6,3.6hz,1h),6.93
–
6.88(m,1h),6.79(dd,j=8.6,2.6hz,1h),6.40
–
6.36(m,1h),5.22(d,j=8.4hz,1h),4.12(dd,j=11.2,4.2hz,1h),4.08
–
4.02(m,1h),3.67(s,2h),3.65(dd,j=7.4,4.0hz,1h),3.46
–
3.35(m,1h),3.31
–
3.17(m,1h),2.71(s,3h).esi-ms(m+h)
+
:352.1.
[0502]
实施例60:1-(4-(3,4-二氯苯基)-8-甲基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0503][0504]
合成路线及反应步骤:
[0505]
参照实施例59中所述步骤xxviii-xxx,用3-甲基碘苯替换步骤xxviii中的3-甲氧基碘苯,得黄色油状物35-c,总收率:9.3%。1h nmr(400mhz,cdcl3)δ7.35(d,j=8.2hz,1h),7.23
–
7.19(m,1h),7.08
–
7.04(m,2h),6.97(d,j=8.4hz,1h),6.77(s,1h),5.31(d,j=10.2hz,1h),4.06
–
4.00(m,2h),3.97
–
3.89(m,1h),3.52(d,j=13.2hz,1h),3.15(t,j=12.0hz1h),2.77(s,3h),2.25(s,3h).esi-ms(m+h)
+
:336.1.
[0506]
实施例61:1-(4-(3,4-二氯苯基)-6-甲基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0507][0508]
合成路线及反应步骤:
[0509]
参照实施例59中所述步骤xxviii-xxx,用3-甲基碘苯替换步骤xxviii中的3-甲氧基碘苯,得黄色油状物35-d,总收率:8.4%。1h nmr(400mhz,cdcl3)δ7.35
–
7.28(m,1h),7.21(s,1h),7.08
–
7.01(m,3h),6.94(d,j=8.3hz,1h),6.75
–
6.71(m,1h),5.48(d,j=9.6hz,1h),4.23(dd,j=11.4,3.9hz,1h),4.13
–
4.05(m,1h),3.82(dd,j=11.5,6.6hz,1h),3.43(d,j=11.9hz,1h),3.27
–
3.17(m,1h),2.78(s,3h),2.26(s,3h).esi-ms(m+h)
+
:336.1.
[0510]
实施例62:1-(4-(3,4-二氯苯基)-7-甲基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0511][0512]
合成路线及反应步骤:
dioxane,80℃,16h.
[0523]
反应步骤:
[0524]
xxxi.将134mg苯丙醛(1.0mmol,1.0eq)溶于3ml冰醋酸后加入封管中,向其中加入331mg碳酸银(1.2mmol,1.2eq),580mg 3,5-二甲基碘苯(2.5mmol,2.5eq)和22mg醋酸钯(0.1mmol,10mol%),其混合物在封管中加热至100℃搅拌6小时,冷却至室温后过滤,浓缩得到黄色油状物,将其用硅胶柱层析(石油醚/乙酸乙酯=100/1~10/1)分离得到156mg透明油状物37-a,收率:78%。1h nmr(400mhz,cdcl3)δ9.55(d,j=8.0hz,minor cho),9.51(d,j=8.0hz,1h,major cho),7.50
–
7.41(m,3h,arh),7.39
–
7.36(m,1h,arh),7.33
–
7.28(m,2h,arh),7.11(s,minor arh),7.08(s,1h,major arh),6.97(s,2h,major arh),6.92(s,1h,minor arh),6.59(d,j=8.0hz,1h,major ch),6.57(d,j=8.0hz,minor ch),2.35(s,2h,ch3),2.30(s,6h,ch3).esi-ms(m+h)
+
:237.1.
[0525]
xxxii.将540mg 37-a(2.29mmol,1.0eq)溶于20ml氯仿后加入圆底烧瓶中,再向其中加入26mg l-脯氨酸(0.23mmol,0.1eq),872mg二氢吡啶1149-23-1(3.45mmol,1.5eq),上述混合物在室温下搅拌16小时,加2n的氢氧化钠水溶液室温搅拌30分钟,使二氢吡啶1149-23-1水解后溶于水相中,分离得有机相,减压除去溶剂得油状物,硅胶柱层析(石油醚/乙酸乙酯=100/1~10/1)分离得到270mg黄色油状物38-a,收率:54%。
[0526]
xxxiii.将270mg 38-a(1.13mmol,1.0eq)加入25ml规格的圆底烧瓶中,加10ml干燥的四氢呋喃使之完全溶解,将体系用氮气置换三次,冰水浴下向烧瓶中缓慢滴加1.4ml氢化铝锂(2.5m in thf,3.39mmol,3.0eq),滴加完毕后移出冰浴,室温下搅拌反应2小时,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,向其中缓慢滴加naoh溶液(1mol/l),至大量沉淀生成,过滤得滤液,滤饼加乙酸乙酯洗涤。所得滤液用乙酸乙酯(10ml x 3)和水(15ml)萃取,得有机相合并,用饱和食盐水(15ml)洗涤,加入无水硫酸钠干燥后过滤,浓缩得黄色油状物,硅胶柱层析进行分离(石油醚/乙酸乙酯=10/1)得到239mg淡黄色油状物39-a,收率:73%。esi-ms(m+h)
+
:241.3.
[0527]
xxxiv.将200mg 39-a(0.83mmol,1.0eq)加入48ml规格的封管中,加10ml无水1,4-二氧六环使其溶解,再向烧瓶中加入196mg甲氨基乙醛缩二甲醇(1.66mmol,2.0eq)和373mg三氟甲磺酸(2.49mmol,3.0eq),将封管封口后在100℃下加热搅拌24小时,混合物加1n氢氧化钠水溶液调节ph至10~11,用乙酸乙酯(15ml x 3)和水(10ml)萃取,得有机相合并,用无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物硅胶柱层析进行分离(二氯甲烷/甲醇=100/1~10/1)得到88mg淡黄色泡沫状固体40-a,收率:36%。1h nmr(400mhz,cdcl3)δ10.19(s,1h),9.19(s,1h),7.45
–
7.20(m,6h),6.82(s,1h),6.23(s,1h),5.77(d,j=9.6hz,1h),4.81(d,j=9.2hz,1h),4.19
–
3.97(m,1h),3.69
–
3.55(m,1h),3.55
–
3.40(m,2h),3.32
–
3.17(m,1h),2.95(s,3h),2.39(s,3h),2.08(s,3h).
13
c nmr(151mhz,cdcl3)δ141.89,141.69,138.05,135.76,130.43,129.44,129.07,128.48,127.13,126.74,63.58,52.11,50.67,42.63,33.74,33.24,21.02,20.37.esi-ms(m+h)
+
:296.2.
[0528]
实施例65:1-(7-甲氧基-5-苯基-1,3,4,5-四氢苯并[c]噁庚英-1-基)-n-甲基甲胺
[0529][0530]
合成路线及反应步骤:
[0531]
参照实施例64中所述步骤xxxi-xxxiv,用3-甲氧基碘苯替换步骤xxxi中的3,5-二甲基碘苯,得黄色油状物40-b,总收率:14.5%。1h nmr(400mhz,cdcl3)δ7.35(t,j=7.2hz,2h),7.31
–
7.24(m,2h),7.18(d,j=7.6hz,2h),6.96(d,j=8.4hz,1h),6.61(d,j=8.4hz,1h),6.13(s,1h),5.23(d,j=10.6hz,1h),4.46(d,j=10.2hz,1h),4.36
–
4.25(m,1h),4.18(t,j=11.4hz,1h),3.61(s,1h),3.60(s,3h),3.40(t,j=11.3hz,1h),2.87(s,3h),2.36
–
2.19(m,1h),2.10
–
1.99(m,1h).
13
c nmr(151mhz,cdcl3)δ159.27,147.46,143.33,129.44,128.70,128.60,126.77,124.99,116.14,109.74,74.31,72.72,55.00,52.07,48.13,35.45,33.98,29.70,1.03.esi-ms(m+h)
+
:298.2.
[0532]
实施例66:1-((4,4-二甲基)-8-甲氧基异苯并二氢吡喃-1-基)-n-甲基甲胺(化合物45-a),1-((4,4-二甲基)-6-甲氧基异苯并二氢吡喃-1-基)-n-甲基甲胺(化合物45-b)
[0533][0534]
合成路线:
[0535][0536]
reagents and conditions:(xxxv)nah,dmso,rt,3h;(xxxvi)4.0n lioh(aq),100℃,15h;(xxxvii)lialh4,thf,rt,1h;(xxxviii)cf3so3h,1,4-dioxane,80℃,3h.
[0537]
反应步骤:
[0538]
xxxv.将1g 3-甲氧基苯乙腈(6.8mm,1.0eq)加入100ml两颈瓶中,再加入30ml二甲
亚砜使之溶解,置换氩气后,向茄形瓶中分批次加入680mg钠氢(17.0mm,2.5eq),加入完毕后室温下搅拌反应30min;向上述反应体系中加入1.93g碘甲烷(13.6mm,2.0eq),室温下继续反应3h后,缓慢加入10mlh2o淬灭反应,再加入乙酸乙酯(75mlx 2)和水(30ml)萃取,有机相用水(50mlx 3)和饱和食盐水洗涤后,干燥浓缩得油状液体,经过硅胶柱层析(pe/ea=30/1)分离得到1.1g无色油状液体42-a,收率:84.7%。esi-ms(m+h)
+
:176.0.1h nmr(400mhz,cdcl3)δ7.31(t,j=7.9hz,1h),7.08
–
6.98(m,2h),6.85(d,j=5.8hz,1h),3.83(s,3h),1.71(s,6h).
[0539]
xxxvi.将1.9g(10.9mm,1.0eq)42-a置于250ml茄形瓶中,加入86ml4.0 n的氢氧化锂溶液,在100℃下回流反应15h后,降至室温,向反应液中加入300ml稀盐酸,再用乙酸乙酯(150ml x 3)萃取,合并有机相,用水(150ml x 3)和饱和食盐水洗涤后,有机相用无水硫酸钠干燥,减压蒸馏得到2.1g白色固体43-a,收率:100%。esi-ms(m-h)-:193.0.1h nmr(400mhz,cdcl3)δ7.25(d,j=7.4hz,1h),7.01
–
6.93(m,2h),6.80(d,j=8.0hz,1h),3.80(s,3h),1.58(s,6h).
[0540]
xxxvii.将2.1g43-a(10.9mm,1.0eq)加入250ml规格的茄形瓶中,加入100mlthf使之完全溶解,氩气置换后,冰浴下缓慢滴加21.8mllialh4的thf溶液(1.0minthf,21.8mm,2.0eq),室温下反应1h,向烧瓶中加十水合硫酸钠淬灭反应液,直至无明显气泡生成,再向其中缓慢滴加1n氢氧化钠水溶液,至大量沉淀生成,过滤,滤饼加乙酸乙酯洗涤,所得滤液用乙酸乙酯(50ml
×
3)和水(30ml)萃取,得有机相合并,用无水硫酸钠干燥后过滤,滤液浓缩得黄色油状物,经过硅胶柱层析(pe/ea=10/1)分离得到1.82g无色油状液体44-a,收率:93.0%。esi-ms(m+h)
+
:181.0.1h nmr(400mhz,cdcl3)δ7.26(d,j=3.1hz,1h),7.01
–
6.88(m,2h),6.76(d,j=7.2hz,1h),3.81(s,3h),3.59(s,2h),1.32(s,6h).
[0541]
xxxviii.将1.82g44-a(10.0mm,1.0eq)加入250ml茄形瓶中,加入100ml无水1,4-二氧六环使之溶解,向其中加入3.57g甲胺基乙缩醛二甲醇(30mm,3.0eq)和7.5g三氟甲磺酸(50.0mm,5.0eq),混合物在80℃下搅拌反应3h,加1n氢氧化钠水溶液调节反应液ph至10~11,旋干后加入乙酸乙酯(50ml x 3)和水(30ml)萃取,得有机相合并,用无水硫酸钠干燥后过滤,浓缩得黄色油状物,将所得油状物用硅胶柱层析(二氯甲烷/甲醇=100/1~50/1)分离得到2.7g粗产物,再经过反相柱层析(甲醇/h2o=1/100~100/1)分离得到150mg淡黄色油状液体45-a(收率:6.3%)和1.1g淡黄色粉末状固体45-b(收率:47.4%)。
[0542]
45-a:1-(8-甲氧基-4,4-二甲基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0543]1h nmr(400mhz,cdcl3)δ7.25(s,1h),6.96(d,j=6.2hz,1h),6.69(d,j=6.4hz,1h),5.22(d,j=7.4hz,1h),3.85
–
3.62(m,5h),3.51(d,j=11.0hz,1h),3.22(s,1h),3.02(s,1h),2.90(s,3h),1.23(s,3h),1.17(s,3h).
13
c nmr(151mhz,cdcl3)δ155.14,145.24,128.90,119.20,117.94,107.80,71.29,68.14,55.33,50.39,33.71,33.33,27.72,25.91.esi-ms(m+h)
+
:236.2.hmrs:calc.for c
14h21
no2([m+h]
+
)236.1645,found 236.1647.
[0544]
45-b:1-(6-甲氧基4,4-二甲基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0545]1h nmr(400mhz,cdcl3)δ6.97(d,j=8.2hz,1h),6.85(s,1h),6.72(d,j=8.3hz,1h),5.10(d,j=9.6hz,1h),3.78(s,3h),3.68(d,j=11.2hz,1h),3.52(t,j=17.1hz,2h),3.15(d,j=8.6hz,1h),2.90(s,3h),2.58(s,1h),1.26(s,3h),1.16(s,3h).
13
c nmr
(151mhz,cdcl3)δ159.24,145.07,125.32,122.89,111.86,111.62,73.39,71.22,55.26,53.67,34.16,33.77,27.93,25.99.esi-ms(m+h)
+
:236.2.hmrs:calc.for c
14h21
no2([m+h]
+
)236.1645,found 236.1647.
[0546]
实施例67:1-(8-甲氧基-4-甲基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0547][0548]
合成路线及反应步骤:
[0549]
参照实施例66中所述步骤xxxv-xxxviii,调整步骤xxxv中的nah用量为1.5eq,碘甲烷用量为1.05eq,得黄色油状物45-c,总收率:1.7%。esi-ms(m+h)
+
:222.1.1h nmr(400mhz,cdcl3)δ7.17(d,j=7.7hz,1h),6.87
–
6.67(m,2h),5.07(dd,j=3.9,3.1hz,1h),4.02(d,j=8.2hz,1h),3.80(d,j=16.6hz,3h),3.51(s,1h),3.04
–
2.80(m,3h),2.51(d,j=16.8hz,3h),1.26(s,3h).esi-ms(m+h)
+
:222.1.
[0550]
实施例68:1-(6-甲氧基-4-甲基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0551][0552]
合成路线及反应步骤:
[0553]
参照实施例66中所述步骤xxxv-xxxviii,调整步骤xxxv中的nah用量为1.5eq,碘甲烷用量为1.05eq,得黄色油状物45-d,总收率:11.9%。esi-ms(m+h)
+
:222.1.1h nmr(400mhz,cdcl3)δ7.00(d,j=8.1hz,1h),6.75(dd,j=21.3,13.1hz,2h),4.85(dd,j=23.3,6.5hz,1h),4.05(dd,j=10.9,4.3hz,1h),3.81(d,j=12.7hz,4h),3.51
–
3.39(m,1h),2.93(dd,j=21.2,9.0hz,2h),2.49(s,3h),1.35(d,j=6.9hz,1h),1.24(d,j=6.8hz,2h).
[0554]
实施例69:1-(8'-甲氧基螺[环丙烷并-1,4'-异苯并二氢呋喃]-1'-基)-n-甲基甲胺
[0555][0556]
合成路线及反应步骤:
[0557]
参照实施例66中所述步骤xxxv-xxxviii,用1-溴-2-氯乙烷(1.0eq)替换步骤xxxv
中的碘甲烷(2.0eq),得黄色油状物45-e,总收率:1.42%。1h nmr(400mhz,cdcl3)δ7.15(s,1h),6.66(d,j=7.3hz,1h),6.35(s,1h),5.23(s,1h),4.06(d,j=11.5hz,1h),3.81(s,3h),3.48(s,1h),3.29(d,j=11.2hz,1h),3.05(s,2h),2.52(d,j=10.4hz,3h),1.12(s,1h),1.02
–
0.77(m,3h).
13
c nmr(151mhz,cdcl3)δ155.38,140.09,127.80,124.51,113.58,107.12,71.69,67.39,55.25,52.23,35.84,18.90,18.60,12.29.esi-ms(m+h)
+
:234.1.hmrs:calc.for c
14h19
no2([m+h]
+
)234.1489,found 234.1489.
[0558]
实施例70:1-(6'-甲氧基螺[环丙烷并-1,4'-异苯并二氢呋喃]-1's-基)-n-甲基甲胺
[0559][0560]
合成路线及反应步骤:
[0561]
参照实施例66中所述步骤xxxv-xxxviii,用1-溴-2-氯乙烷(1.0eq)替换步骤xxxv中的碘甲烷(2.0eq),得黄色油状物45-f,总收率:4.26%。1h nmr(400mhz,cdcl3)δ7.01(d,j=8.3hz,1h),6.70(d,j=6.8hz,1h),6.26(s,1h),5.05(d,j=6.7hz,1h),3.87
–
3.74(m,4h),3.58(d,j=11.3hz,1h),3.11(d,j=10.8hz,1h),3.06
–
2.97(m,1h),2.56(s,3h),1.05(s,1h),0.97(s,2h),0.85(s,1h).
13
c nmr(151mhz,cdcl3)δ158.84,140.45,128.06,125.30,110.89,107.20,75.17,71.06,55.81,55.24,36.02,19.13,17.73,13.53.esi-ms(m+h)
+
:234.1.hmrs:calc.for c
14h19
no2([m+h]
+
)234.1489,found 234.1489.
[0562]
实施例71:1-(6'-甲氧基螺[环丙烷并-1,4'-异苯并二氢呋喃]-1'r-基)-n-甲基甲胺
[0563][0564]
合成路线及反应步骤:
[0565]
参照实施例66中所述步骤xxxv-xxxviii,用1-溴-2-氯乙烷(1.0eq)替换步骤xxxv中的碘甲烷(2.0eq),得黄色粉末状固体45-g,总收率:13.4%。1h nmr(400mhz,cdcl3)δ6.99(d,j=8.0hz,1h),6.69(s,1h),6.25(d,j=1.8hz,1h),5.21(d,j=7.8hz,1h),3.73(d,j=10.7hz,4h),3.65
–
3.53(m,2h),3.25(s,1h),2.90(d,j=24.2hz,4h),0.96(d,j=12.6hz,3h),0.81(s,1h).
13
c nmr(151mhz,cdcl3)δ159.53,140.51,125.40,124.53,111.30,107.58,71.46,70.49,55.26,53.49,34.16,18.81,17.08,13.71.esi-ms(m+h)
+
:234.1.hmrs:calc.for c
14h19
no2([m+h]
+
)234.1489,found 234.1489.
[0566]
实施例72:1-(8'-甲氧基螺[环丁烷并-1,4'-异苯并二氢呋喃]-1'-基)-n-甲基甲胺
[0567][0568]
合成路线及反应步骤:
[0569]
参照实施例66中所述步骤xxxv-xxxviii,用1,3-二溴丙烷(1.0eq)替换步骤xxxv中的碘甲烷(2.0eq),得黄色油状物45-h,总收率:1.88%。esi-ms(m+h)
+
:248.2.1h nmr(400mhz,cdcl3)δ7.30(d,j=8.0hz,1h),7.21(d,j=7.3hz,1h),6.72(d,j=7.7hz,1h),5.20(d,j=9.1hz,1h),3.90(t,j=13.6hz,1h),3.82(s,4h),3.68(s,1h),3.17(s,1h),2.88(s,3h),2.29(d,j=26.8hz,1h),2.21(s,3h),2.02(s,4h).
[0570]
实施例73:1-(6'-甲氧基螺[环丁烷并-1,4'-异苯并二氢呋喃]-1's-基)-n-甲基甲胺
[0571][0572]
合成路线及反应步骤:
[0573]
参照实施例66中所述步骤xxxv-xxxviii,用1,3-二溴丙烷(1.0eq)替换步骤xxxv中的碘甲烷(2.0eq),得黄色油状物45-i,总收率:2.93%。esi-ms(m+h)
+
:248.2.1h nmr(400mhz,cdcl3)δ7.11(s,1h),6.97(d,j=7.5hz,1h),6.74(d,j=8.0hz,1h),4.86(s,1h),4.08(d,j=11.2hz,1h),3.83(d,j=1.8hz,3h),3.69(d,j=11.2hz,1h),2.97(d,j=12.2hz,1h),2.86(t,j=9.4hz,1h),2.48(d,j=1.7hz,3h),2.42(d,j=9.0hz,1h),2.23(s,2h),2.06(s,3h),1.93(s,1h).
[0574]
实施例74:1-(6'-甲氧基螺[环丁烷并-1,4'-异苯并二氢呋喃]-1'r-基)-n-甲基甲胺
[0575][0576]
合成路线及反应步骤:
[0577]
参照实施例66中所述步骤xxxv-xxxviii,用1,3-二溴丙烷(1.0eq)替换步骤xxxv中的碘甲烷(2.0eq),得黄色油状物45-j,总收率:17.3%。esi-ms(m+h)
+
:248.2.1h nmr(400mhz,cdcl3)δ7.10(s,1h),6.97(d,j=7.9hz,1h),6.74(d,j=7.7hz,1h),5.09(d,j=9.3hz,1h),4.04(d,j=11.3hz,1h),3.82(s,3h),3.70(d,j=11.2hz,1h),3.53(s,1h),
3.09(s,1h),2.87(s,3h),2.67(s,1h),2.33(d,j=9.2hz,1h),2.19(d,j=7.6hz,2h),1.99(d,j=6.6hz,2h),1.87(s,1h).
[0578]
实施例75:1-(8'-甲氧基螺[环戊烷并-1,4'-异苯并二氢呋喃]-1'-基)-n-甲基甲胺
[0579][0580]
合成路线及反应步骤:
[0581]
参照实施例66中所述步骤xxxv-xxxviii,用1,4-二溴丁烷(1.0eq)替换步骤xxxv中的碘甲烷(2.0eq),得黄色油状物45-k,总收率:1.45%。1h nmr(400mhz,cdcl3)δ7.21(d,j=6.2hz,1h),6.91(s,1h),6.68(s,1h),5.11(d,j=6.3hz,1h),3.80(s,3h),3.65(d,j=11.3hz,1h),3.45(d,j=11.3hz,1h),3.09(d,j=11.1hz,1h),3.00
–
2.88(m,1h),2.53(s,3h),1.96
–
1.62(m,8h).
13
c nmr(151mhz,cdcl3)δ155.13,145.72,127.78,123.59,118.06,107.25,71.21,68.37,55.18,52.61,44.84,40.09,37.70,35.76,26.52,26.03.esi-ms(m+h)
+
:262.2.hmrs:calc.for c
16h23
no2([m+h]
+
)262.1802,found 262.1803.
[0582]
实施例76:1-(6'-甲氧基螺[环戊烷并-1,4'-异苯并二氢呋喃]-1'-基)-n-甲基甲胺
[0583][0584]
合成路线及反应步骤:
[0585]
参照实施例66中所述步骤xxxv-xxxviii,用1,4-二溴丁烷(1.0eq)替换步骤xxxv中的碘甲烷(2.0eq),得黄色油状物45-l,总收率:9.74%。1h nmr(400mhz,cdcl3)δ6.96(s,1h),6.83
–
6.58(m,2h),4.86(s,1h),3.81
–
3.59(m,4h),3.45(s,1h),2.93(d,j=32.0hz,2h),2.47(d,j=14.0hz,3h),1.85(dd,j=75.3,32.4hz,8h).
13
c nmr(151mhz,cdcl3)δ158.45,145.75,127.49,125.02,111.35,111.19,75.11,71.51,56.74,55.17,45.30,40.27,37.50,36.43,26.38,25.89.esi-ms(m+h)
+
:262.2.hmrs:calc.for c
16h23
no2([m+h]
+
)262.1802,found 262.1803.
[0586]
实施例77:1-((4,4,6-三甲基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0587][0588]
合成路线及反应步骤:
[0589]
参照实施例66中所述步骤xxxv-xxxviii,用3-甲基苯乙腈替换步骤xxxv中的3-甲氧基苯异腈,得黄色油状物45-m,总收率:33.4%。1h nmr(400mhz,cdcl3)δ7.14(s,1h),6.96(d,j=6.0hz,2h),5.01(d,j=8.5hz,1h),3.68(d,j=11.1hz,1h),3.51(d,j=11.1hz,1h),3.30(d,j=12.4hz,1h),3.02(t,j=11.0hz,1h),2.68(s,3h),2.32(s,3h),1.28(s,3h),1.19(s,3h).esi-ms(m+h)
+
:220.2.
[0590]
实施例78:1-(4,4-二甲基-6-羟基异苯并二氢吡喃-1-基)-n-甲基甲胺
[0591][0592]
合成路线:
[0593][0594]
反应步骤:将200mg45-b(0.85mmol,1.0eq)溶于10ml二氯甲烷中,加入25ml两口瓶,置换氩气后,在冰浴条件下缓慢向溶液中加入3.75ml bbr3的二氯甲烷溶液(17%inch2cl2,2.55mmol,3.0eq),冰浴下反应20min后,将反应液缓慢加入大量冰水中,淬灭。之后用乙酸乙酯(25mlx 3)萃取,合并有机相后用饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压蒸馏得到粗产物,经过硅胶柱层析(dcm/meoh=20/1)分离得到76mg白色固体45-b,收率:40.4%。1h nmr(400mhz,cd3od)δ6.92(d,j=8.0hz,1h),6.78(d,j=16.3hz,1h),6.63(d,j=7.3hz,1h),4.84(d,j=8.4hz,1h),3.69(t,j=14.1hz,1h),3.49(s,1h),3.04(t,j=14.5hz,1h),2.91(d,j=10.6hz,1h),2.49(d,j=16.9hz,3h),1.29(s,3h),1.19(d,j=17.1hz,3h).esi-ms(m+h)
+
:222.3
[0595]
实施例79:芳基并环化合物的单胺类转运体结合蛋白结合活性测试(一):
[0596]
本部分生物活性测试在上海药明康德新药研发有限公司(以下简称药明康德)完成。应用药明康德建立的稳定表达sert、net和dat的细胞株,以及开发建立的重摄取实验方法进行样品检测。各靶点阳性参考分别为:dat的阳性对照为btcp,net为nisoxetine,sert为citalopram,由药明康德负责提供。测试化合物在指定浓度下对sert、net和dat三个转运
体的抑制率,计算ic
50
值,具体实验流程如下:
[0597]
(一)细胞培养
[0598]
1)解冻细胞并培养3至4天。
[0599]
2)将细胞传代,并在培养箱中再培养3天。
[0600]
3)用胰蛋白酶-edta消化细胞,并以1000rpm离心5分钟后收集细胞。
[0601]
4)将细胞沉淀重新分散于10ml生长培养基中。使用无菌移液器上下移液以清除团块。使用vi-cell
tm
计数细胞以确定细胞活力。
[0602]
5)使用培养基将细胞悬液稀释至1m细胞/ml(每20微升孔20,000个细胞),并接种到384孔细胞板中。
[0603]
6)将板置于37℃/5%co2的培养箱中16-20小时。
[0604]
(二)转运体测试
[0605]
1)使用bravo自动化液体处理平台(以下简称bravo),利用测定缓冲液(hbss中的20mm hepes,含0.1%bsa)以4倍浓度梯度稀释得到最高浓度为2μm的10个浓度的参考化合物溶液,一式两份;以3倍浓度梯度稀释待测化合物,得到最高浓度为6μm的10个不同浓度的待测化合物溶液,每个浓度样品两份。
[0606]
2)用washer(750rpm,15s)从孔中吸出培养基,并通过bravo将25μl/孔的化合物稀释液转移到细胞板中。注意:对于高对照孔,添加25μl含有bsa的测定缓冲液(含0.2%dmso);对于低对照孔,添加25μl的2μm参考化合物稀释溶液。
[0607]
3)以300rpm离心15s,然后在37℃孵育30分钟。
[0608]
4)与化合物一起孵育后,每孔添加25ul染料溶液。在37℃孵育30分钟。
[0609]
5)使用多模式读板仪读取板信息,计算相应的抑制率。
[0610]
部分活性测试结果如下表所示:
[0611]
表1化合物的体外三重重摄取抑制活性测试结果(一)
[0612]
[0613]
[0614][0615]
实施例80:芳基并环化合物的单胺类转运体结合蛋白结合活性测试(二):
[0616]
本部分生物活性测试在上海药明康德新药研发有限公司完成。方法同实施例79,测试化合物在指定浓度下对sert、net和dat三个转运体的抑制率,部分测试结果如下表所示:
[0617]
表2化合物的体外三重重摄取抑制活性测试结果(二)
[0618]
[0619]
[0620][0621]
实施例81:芳基并环化合物的单胺类转运体结合蛋白结合活性测试(三):
[0622]
本部分生物活性测试在上海药明康德新药研发有限公司(以下简称药明康德)完成。方法同实施例79,通过测试化合物在指定浓度下对sert、net和dat三个转运体的抑制率,结果如下表所示:
[0623]
表3化合物的体外三重重摄取抑制活性测试结果(三)
[0624]
[0625][0626]
*********。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1