一种基于CRISPR/Cas13a的核酸检测试剂盒、检测方法及应用
文档序号:33554128发布日期:2023-03-22 11:09阅读:257来源:国知局
导航: X技术> 最新专利>有机化合物处理,合成应用技术
一种基于crispr/cas13a的核酸检测试剂盒、检测方法及应用
技术领域
1.本发明属于核酸技术领域,具体涉及一种基于crispr/cas13a的核酸检测试剂盒、检测方法及应用。
背景技术:
2.目前针对rna的常规检测方法主要有逆转录-聚合酶链式反应技术(rt-pcr)、northern印迹技术和微阵列技术等,然而这些方法仍存在着不可避免的缺点。例如rt-pcr耗时长、设备昂贵;northern印迹技术操作复杂、易造成交叉污染;微阵列技术灵敏度低、特异性差。此外,由于rna具有表达量低、易降解的特性,相对于dna检测来说,rna检测技术还面临如下问题:1)rna无法在体外直接扩增,需要经过“反转录-扩增-转录”等复杂操作;2)rna降解的易感性,对检测时间有一定的限制。因此,目前对于rna的快速灵敏检测仍然具有很强的挑战性。
3.近年来,基于crispr技术的核酸检测方法具有操作简单、特异性强、检测时间短的优势,在核酸检测领域被广泛报道。crispr技术的核心原理是基于cas12a、cas13a等蛋白在向导rna(crrna)的引导下可以特异性识别dna、rna核酸序列,进而激活自身反式剪切ssdna、ssrna的能力。对于cas12a和cas13a来说,除了上述共性特点,也存在明显的差异,如cas12a利用crrna基于这种反式剪切能力,科学家们将带有荧光、电化学或生物素等信号标记的短链ssdna、ssrna(一般为6-8个碱基)作为报告分子,通过检测这些报告分子相应信号的改变,从而判断样品中是否存在靶标核酸。以rna为检测对象,研究人员以ssrna为探针,基于crispr/cas13a开发了多种针对疾病和病原菌的体外检测方法,例如癌症相关的microrna、新冠病毒等。但这类方法仍存在着灵敏度不足的问题,一般均需要利用扩增才能达到检测的目的;且作为报告分子的ssrna需要荧光、电化学等特殊基团(如辣根过氧化酶,亚甲基蓝等)的标记,从而造成试剂制备复杂、成本高等问题。
技术实现要素:
4.本发明的目的在于,针对现有技术的上述不足,提供了一种基于crispr/cas13a的核酸检测试剂盒、检测方法及应用。
5.为实现上述目的,本发明采用如下的技术方案:本发明的第一目的提供一种基于crispr/cas13a的核酸检测试剂盒,包括rna检测体系,所述rna检测体系包括crispr-cas13a,crrna,rna g-四链体或rna g-三链体和酶切缓冲液,所述crrna引导所述cas13a识别并切割所述核酸,所述rna g-四链体或rna g-三链体的两端标记能发生荧光共振能量转移的一对荧光基团,或者两端分别标记一个荧光基团和一个淬灭基团,所述酶切缓冲液含有5-20 mm 镁离子和20~100 mm钠离子或者钾离子。
6.进一步的,所述crrna为检测病毒核酸的crrna;所述病毒包括冠状病毒;所述冠状病毒为冠状病毒sars-cov-2,所述冠状病毒sars-cov-2核酸的crrna的核苷
酸序列如seq id no: 1所示。
7.进一步的,所述rna g-四链体包括terra g4、kras rna g4和orn-n rna g4中的任一种,所述rna g-三链体包括terra g3、bcl2-5 rg3和bcl2-3 rg3中的任一种。
8.还可以为其他的rna g-四链体,例如n-ras rg4、bcl-2 rg4、trf2 rg4等(nucleic acid research, 2008, 36(19);biochemistry, 2010, 49(38);nucleic acid research, 2010, 38(20));所述rna g-三链体还可以为其他可行成rna g3的序列。
9.进一步的,所述荧光基团为6-fam、tet、cy3、cy5或rox,所述荧光淬灭基团为bhq1、bhq2或bhq3。
10.进一步的,所述rna g-四链体或rna g-三链体的浓度为0.1μm ~100 μm,所述cas13a的浓度为0.1μm ~10 μm,所述crrna的浓度为0.1μm ~10 μm,所述核酸检测试剂盒还包括rna酶抑制剂,所述rna酶抑制剂的浓度为1 u/μl ~40 u/μl。
11.rna酶抑制剂的酶活定义为:以抑制5 ng rnase a活性的50%所需要的酶量定义为1个活性单位u。
12.本发明的第二目的是提供一种用于非疾病诊断目的的核酸检测方法,利用上述的核酸检测试剂盒中的rna检测体系检测所述核酸,具体包括以下步骤:步骤s1,将crispr/cas13a和crrna加入到酶切缓冲液中进行第一次孵育,所述的酶切缓冲液含有5-20 mm 镁离子,20~100 mm钠离子或者钾离子;步骤s2,在步骤s1体系中加入靶标rna以及rna g-四链体或rna g-三链体进行第二次孵育,第二次孵育完成后放入恒温槽中进行第三次孵育使cas13a失活,靶标rna、crrna和cas13a形成三元复合物,该复合物将rna g-四链体或rna g-三链体切割,利用将rna g-四链体或rna g-三链体切割剪切前后的高级结构的信号变化来检测靶标核酸。
13.进一步的,步骤s1中的第一次孵育条件为:温度37
±
5℃,时间10
±
2min;步骤s2中的第二次孵育条件为:温度37
±
5℃,时间30
±
5min;第三次孵育条件为:温度65
±
5℃,时间10
±
2min。
14.进一步的,所述核酸检测方法还包括读取结果的步骤,利用酶标仪或荧光光谱仪进行读取。
15.本发明的第三目的是提供上述的核酸检测试剂盒在非疾病诊断目的检测核酸中的应用,所述核酸为病毒核酸,所述病毒核酸为冠状病毒,所述冠状病毒为sars-cov-2。
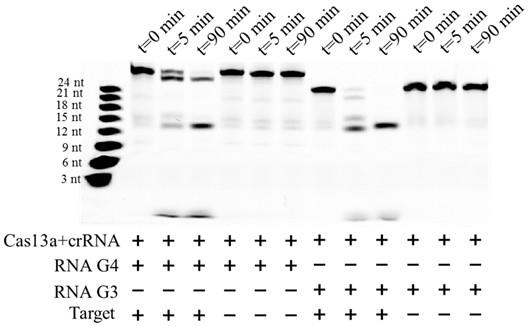
16.本发明的第四目的是提供一种用于非疾病诊断目的的冠状病毒sars-cov-2核酸检测方法,采用上述核酸检测试剂盒中的rna检测体系,并结合电化学检测完成,具体包括以下步骤:步骤s1,将crispr/cas13a、crrna和rna酶抑制剂加入到酶切缓冲液中进行第一次孵育,第一次孵育温度为37
±
5℃,时间10
±
2min;所述crrna的核苷酸序列如seq id no: 3所示;所述酶切缓冲液包含10 mm ~200 mm的hepes、5-20 mm 镁离子和20~100 mm钠离子或者钾离子;所述酶切缓冲液的ph值为7.4
±
0.4;所述cas13a的浓度为0.1 μm ~10 μm,所述crrna的浓度为0.1 μm ~10 μm,所述cas13a、所述crrna和所述酶切缓冲液的体积比为1 μl:1 μl:48 μl;步骤s2,在步骤s1体系中加入靶标rna、rna g-四链体和所述酶切缓冲液进行第二
次孵育,孵育温度为37
±
5℃,时间60
±
5min,得到酶切完成的反应体系;所述rna g-四链体的浓度为0.1μm ~100 μm,所述rna g-四链体和所述酶切缓冲液的体积比为20 μl:30 μl;所述rna g-四链体为terra g4;步骤s3,将步骤s2得到的反应体系放入水浴中进行第三次孵育,孵育温度为65
±
5℃,时间10min
±
2min,使cas13a失活,并加入氯化血红素,进行第四次孵育,孵育温度为25
±
5℃,时间60
±
5min,使得rna g-四链体与氯化血红素充分结合;所述氯化血红素的浓度为1μm ~10 μm,所述氯化血红素和所述rna g-四链体的体积比为5 μl:1 μl;步骤s4、在步骤s2体系中加入h2o2、对苯二酚和所述酶切缓冲液,室温反应15 ~20min后,采用电化学传感器进行差分脉冲伏安法检测;所述h2o2的浓度为1 mm ~50 mm,所述对苯二酚的浓度为1mm ~50 mm;所述h2o2、所述对苯二酚和所述酶切缓冲液的体积比为2 μl:2 μl:96 μl;所述电化学传感器为三电极体系,包括参比电极、对电极和工作电极,所述参比电极为银/氯化银电极,所述对电极为玻碳电极,所述工作电极为玻碳电极,采用差分脉冲伏安法,在-600 mv~100 mv的电位范围进行扫描,获得对苯二酚的最大氧化峰电流ipa值,利用靶标rna在10am~200 am浓度范围内与氧化峰电流值ipa值呈良好的相关性可计算得到所述核酸的浓度。
17.与现有技术比较,本发明提供的技术方案带来的有益效果是:(1)本发明的基于crispr/cas13a的核酸检测试剂盒的rna检测体系包括crispr-cas13a,crrna,rna g-四链体(rg4s)或rna g-三链体(rg3s)和酶切缓冲液,酶切缓冲液含有5-20 mm 镁离子和20~100 mm钠离子或者钾离子,本发明人首次发现在na
+
、k
+
溶液下,rna高级结构可以被激活的crispr/cas13a反式剪切,被切割后,rna高级结构的相应特征消失,导致信号变化,从而实现靶标核酸的检测。
18.(2)本发明通过实现让rg4s或rg3s在没有靶标分子存在时先折叠成高级结构,其作用为:基于rg4s或rg3s的高级结构在被cas13a切割前后的变化,可以实现非标记的检测,即无需对rg4s或rg3s序列进行任何标记,只需辅助添加其他与rg4s或rg3s发生作用的分子即可完成检测,而基于ssrna的检测均需进行特殊标记后才可以进行检测,因此本发明的这种方式可以大大降低检测成本;高级结构还可与多种分子(如tht或hemin)结合并产生特殊的荧光效应或过氧化物酶hrp的效果,因此可以通过多种方式进行信号的检测,比如测荧光、颜色变化、气体或电化学信号的变化等,而单链rna报告分子不存在这种特殊效应;高级结构可以让rna报告分子的5’与3’端距离相隔较近,若报告分子采用了荧光标记则可以大幅增强fret效应或淬灭效应,当有靶标分子存在时,由于rg4s或rg3s被激活的cas13a切割,高级结构被破坏,造成相应荧光信号的改变会比单链的rna报告基团更明显,从而更利于提高灵敏度。
19.(3)本发明提供的核酸检测方法,相较于ssrna易降解的特点,rg4s与rg3s在溶液中更稳定,不会对检测结果造成干扰,有利于提高检测灵敏度。
20.(4)本发明提供的一种用于非疾病诊断目的的冠状病毒sars-cov-2核酸检测方法,通过采用本发明的核酸检测试剂盒中的rna检测体系,结合电化学检测,实现sars-cov-2核酸的灵敏度高达10fm。
附图说明
21.图1为用fret实验证明terra g4和terra g3可以被cas13a切割的结果图,其中1(a)为terra g4被剪切前后的荧光谱图,1(b)为terra g3被剪切前后的荧光谱图;图2为用cd实验证明terra g4和terra g3可以被cas13a切割的结果图,其中2(a)为terra g4在剪切前后的cd谱图,2(b)为terra g4随时间变化的cd谱图,2(c)为terra g3在剪切前后的cd谱图;2(d)为terra g3随时间变化的cd谱图;图3为用nmr实验证明terra g4和terra g3可以被cas13a切割的结果图,其中3(a)为terra g4在剪切前的nmr 1
h谱图,3(b)terra g4在剪切后的nmr 1
h谱图,3(c)为terra g3在剪切前的nmr 1
h谱图,3(d)为terra g3在剪切后的nmr 1
h谱图;图4为urea page实验证明terra g4和terra g3可以被cas13a切割的结果图;图5为cas13a反式剪切ssrna、rna g4、rna g3的表观速率比较图,其中5(a)为ssrna、rna g4、rna g3浓度为1000 nm时,荧光强度随时间变化的曲线,5(b)ssrna、rna g4、rna g3浓度为500 nm时,荧光强度随时间变化的曲线,5(c)为ssrna、rna g4、rna g3分别在1000 nm和500 nm浓度下的表观剪切速率差异;图6为用cd实验证实不同序列的rg4s与rg3s在不同条件下可以被剪切的结果图,其中6(a)为kras rg4在nacl、kcl条件下,剪切前后的cd谱图,6(b)orn-n rg4在nacl、kcl条件下,剪切前后的cd谱图,6(c)为bcl-2-3 rg3在nacl、kcl条件下,剪切前后的cd谱图,6(d)为bcl-2-5 rg3在nacl、kcl条件下,剪切前后的cd谱图;图7为rg4-fq、rg3-fq作报告分子时的灵敏度测试结果图,其中7(a)为不同靶标浓度下,rg4-fq作报告分子时的荧光曲线图,7(b)不同靶标浓度下,rg4-fq作报告分子时的荧光柱状图,7(c)为不同靶标浓度下,rg3-fq作报告分子时的荧光曲线图,7(d)为不同靶标浓度下,rg3-fq作报告分子时的荧光柱状图;图8为利用rg4/tht复合物诱导的荧光增强效应实现免标记检测的结果图,其中8(a)为不同靶标浓度下,rg4结合tht后的荧光曲线图,8(b)不同靶标浓度下,rg4结合tht后的荧光柱状图;图9为rg4用作电化学传感单元的灵敏度测试结果,其中9(a)为不同rna靶标浓度下,对对苯二酚的氧化峰电流随电压的变化曲线,9(b)为不同rna靶标浓度下,对苯二酚的最大氧化峰电流;9(c)为靶标浓度与电化学信号呈单指数递减关系图;图10为不同rna靶标验证检测方法的特异性结果图,其中10(a)为terra g4-fq作报告分子时,比较mirna-20a与mirna-20b靶标之间的特异性,10(b)terra g4-fq作报告分子时,比较mirna-20a与mirna-20b靶标之间的特异性。
具体实施方式
22.为使本发明的目的、技术方案和优点更加清楚,下面结合具体实施例和附图,对本发明的具体实施方式作进一步详细描述。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
23.本发明用到的仪器、试剂和生物材料信息如下:仪器信息:圆二色谱仪(型号:v100)购自applied photophysics公司,荧光光谱仪
(型号:fluoromax-4)购自horiba公司,酶标仪(型号:spectramax i3x)购自molecular devices公司,凝胶成像系统(型号:chemidoc mp 8280)购自bio-rad公司,荧光定量pcr(型号:quantstudio 3)购自applied biosystems公司,核磁共振波谱仪(型号:700 mhz)购自bruker公司。
24.试剂信息:cas13a蛋白购买于广州美格生物技术有限公司;鼠源rna酶抑制剂(murine rnase inhibitor)购自南京诺唯赞生物科技股份有限公司;实验用depc h2o购自上海生工生物技术有限公司;hepes、mgcl2、nacl、kcl、hcl、naoh、tris、egta等试剂均购自国药基团化学试剂有限公司。
25.生物材料:sars-cov-2 n-gene、sars-cov-2 n-gene crrna、sars-cov-2 e-gene、sars-cov-2 e-gene crrna、mirna-20a、mirna-20a crrna、mirna-20b、mirna-20b crrna是通过rna合成方式得到,由北京擎科新业生物技术有限公司提供;其他rna由上海生工生物技术有限公司合成。所有的rna均经过hplc-ce方式纯化并脱盐处理。
26.本发明用到的核酸序列表如表1所示。
27.表1 核酸序列表
名称序列信息sars-cov-2n-genecrrna seqidno:1:5’gauuuagacuaccccaaaaacgaaggggacuaaaaccaaagcaagagcagcaucaccgccauug-3’sars-cov-2n-geneseqidno:2:5’aauggcuggcaauggcggugaugcugcucuugcuuugcugcugcuugac-3’sars-cov-2e-genecrrnaseqidno:3:5’gauuuagacuaccccaaaaacgaaggggacuaaaacucgaagcgcaguaaggauggcuagugua-3’sars-cov-2e-geneseqidno:4:5’uacacuagccauccuuacugcgcuucgauugugug-3’mirna-20acrrnaseqidno:5:5’gauuuagacuaccccaaaaacgaaggggacuaaaacacacuaccugcacuauaagcacuuuagugc-3’mirna-20aseqidno:6:5’guagcacuaaagugcuuauagugcagguaguguuua-3’mirna-20bcrrnaseqidno:7:5’gauuuagacuaccccaaaaacgaaggggacuaaaacaaacuaccugcacuaugagcacuuugguac-3’mirna-20bseqidno:8:5’guaguaccaaagugcucauagugcagguaguuuugg-3’terrag4seqidno:9:5
’‑
uuaggguuaggguuaggguuaggg-3’terrag4-fq5
’‑
fam-uuaggguuaggguuaggguuaggg-bhq1-3’terrag4-fret5
’‑
fam-uuaggguuaggguuaggguuaggg-tamra-3’terrag4-smfret5
’‑
fam-uuaggguuaggguuaggguuaggg-cy5-3’orn-ng4seqidno:10:5
’‑
aggguuaggguuaggguuaggg-3’krasg4seqidno:115
’‑
ggcggcggcaguggcggcgg-3’本发明用到的缓冲液配方如下:缓冲液a:20 mm hepes, 50 mm nacl, 6 mm mgcl
2, ph=7.4;缓冲液b:20 mm tris, 5 mm egta, ph=7.4;缓冲液c:20 mm hepes, 50 mm kcl, 6 mm mgcl2, ph=7.4;本发明用到的terra, telomeric repeat-containing rna;kirsten ras,kras;orn-n, terra序列的一种变体;b-cell lymphoma 2,bcl-2。
28.实施例1本实施例为通过fret实验证实terra g4和terra g3可以被激活的cas13a反式剪切。具体操作方法如下:将cas13a(1 μl, 1 μm)、sars-cov-2 n-gene crrna(1 μl, 1 μm)、1 μl rnase inhibitor和17 μl的缓冲液a(20 mm hepes, 50 mm nacl, 6 mm mgcl2, ph=7.4)于37℃下孵育10 min,然后往上述体系中分别加入terra g4-fret(20 μl, 1 μm)或terra g3-fret(20 μl, 1 μm),最后加入sars-cov-2 n-gene(10 μl, 10 nm)作为target。将混合后的反应液置于37℃恒温水浴锅下孵育30 min后,立刻放入65℃恒温槽中孵育10 min使
cas13a失活。往反应液补加250 μl缓冲液a,随后加到石英比色皿中,通过荧光光谱仪进行采样。荧光检测的激发波长为488 nm,吸收波长为500-700 nm。
29.结果如图1所示,由于terra g4-fret/terra g3-fret的两端分别带有fam和tamra荧光标记,在na
+
溶液下形成稳定的rg4/rg3结构后,上述两个荧光基团空间距离较近,产生fret效应,在谱图上表现为两个独立峰(518 nm和585 nm),而被切割的rg4/rg3不能产生这种效应,从而在荧光谱图上只有一个峰(518 nm)。在实验组中,将sars-cov-2 n-gene作为target激活cas13a的反式剪切活性,从而使得rg4/rg3的fam和tamra两个荧光基团空间距离较远而无法产生fret效应,荧光谱图表现为一个峰。在对照组中,我们将sars-cov-2 n-gene替换为缓冲液a,其余条件保持不变,结果发现这种条件下的rg4/rg3荧光谱图有两个峰。需要说明的是,在图1(b)中,为了验证rg3的形成,我们选择了缓冲液b(20 mm tris, 5 mm egta, ph=7.4)作为对照,发现在这种没有na
+
/k
+
的条件下,terra g3无法形成fret效应。上述结果说明激活的cas13a可以反式剪切rg4与rg3。
30.实施例2本实施例为cd实验证明terra g4/g3可以被激活的cas13a切割,具体操作方法如下:将cas13a(1 μl, 10 μm)、sars-cov-2 e-gene crrna(1 μl,10 μm)、1 μl rnase inhibitor和17 μl的缓冲液a于37℃下孵育10 min,然后往上述体系中加入sars-cov-2 e-gene(10 μl,10 μm)和terra g4/g3(20 μl,50 μm),经过37℃酶切2 h后,将样品稀释到250 μl进行cd检测, 波长范围为200-320 nm。
31.对于cd time-lapse实验,将cas13a(1 μl, 10 μm)、sars-cov-2 e-gene crrna(1 μl,10 μm)、1 μl rnase inhibitor和17 μl的缓冲液a于37℃下孵育10 min后,然后往上述体系中加入terra g4/g3(20 μl,50 μm)和200 μl缓冲液a,将cd装置的控温单元设置为37℃,随后加入sars-cov-2 e-gene(10 μl,10 μm)并立即开始采样,每隔5 min采样一次。
32.通过cd实验,我们发现在实验组中,加入sars-cov-2 e-gene作为target,terra g4/g3的二级结构特征与对照组条件下存在明显差异,如图1(a)、(c)所示,245 nm附近的正峰和265 nm附近的负峰发生了明显的偏移,证实了terra g4/g3可以被cas13a反式剪切。如图1(b)、(d)所示,通过cd time-lapse实验,可以发现随着剪切时间的增加,245 nm附近的正峰和265 nm附近的负峰在逐渐向右偏移,且峰值的绝对强度在逐渐变小,上述现象可以直观的反应出cas13a剪切terra g4/g3的动态过程。
33.实施例3本实施例为核磁共振实验证明terra g4/g3在形成稳定的二级结构后可以被激活的cas13a切割,具体操作方法如下:将terra g4/g3溶于360 μl缓冲液a,随后加入10% d2o (v/v),此时terra g4/g3的终浓度为0.3 mm。将上述样品置于核磁共振谱仪(bruker avance 700 mhz)中采集一维氢谱的信号,温度设置为25℃,采样次数ns=12 k,这里得到的nmr谱图为rg4/rg3未被切割时的信号。待采集完成后,将cas13a(5 μl,10 μm)、sars-cov-2 e-gene crrna(5 μl,10 μm)、1 μl rnase inhibitor和4 μl的缓冲液a于37℃下孵育10 min后,加入到上述体系中并加入sars-cov-2 e-gene(5 μl,10 μm),随后置于37℃下酶切12 h。酶切完成后,采集terra g4/g3被cas13a切割后的核磁信号。采样条件与未剪切时相同。
34.通过核磁共振实验,我们发现,在加入sars-cov-2 e-gene之前,cas13a的反式剪切能力没有被激活,terra g4在50 mm na
+
溶液中形成了稳定的二级结构,如图3(a)、(c)所示,在核磁谱图上表现为在10.5-12 ppm范围有由rg4/rg3形成的与鸟嘌呤相关的亚氨基峰特征峰;而加入sars-cov-2 e-gene之后,cas13a的反式切割能力被激活,terra g4/g3被切割,如图3(b)、(d)所示,在核磁谱图上表现为10.5-12 ppm范围内的特征峰强度也随之减弱。上述现象从原子水平证实cas13a可以反式剪切rg4与rg3。
35.实施例4本实施例为尿素-变性凝胶电泳实验证明terra g4/g3可以被激活的cas13a切割,具体操作方法如下:将cas13a(2 μl, 1 μm)、sars-cov-2 e-gene crrna(2 μl,1 μm)、1 μl rnase inhibitor和15 μl的缓冲液a于37℃下孵育10 min,随后加入terra g4/g3-fret(20 μl, 10 μm)作为报告分子,加入sars-cov-2 e-gene(10 μl, 10 nm)作为靶标激活cas13a,对照组中加入缓冲液,其余条件不变。将上述体系放入37℃水浴中酶切,分别取酶切时间t=0、t=5 min、t=1.5 h的样品,并立刻置于65℃水浴中失活。尿素聚丙烯酰胺变性胶配方为:8 m 尿素,10x tbe 1 ml,aps 100 μl,temed 10 μl,40%聚丙烯酰胺定容至10 ml。胶制好后,将样品加入相应的泳道中,设置电泳电压180v,时间为 2 h。
36.通过urea-page实验,我们发现,如图4所示,在没有加target的对照组中,由于cas13a没有被激活,rg4/rg3在不同时间下的条带大小保持一致;加入target之后,cas13a反式剪切rg4/rg3,使得其在不同时间下条带的大小出现差异,随着时间的增加,片段较长的条带亮度在逐渐减弱,而片段较短的条带亮度在逐渐变强。上述现象更加直观地证实了cas13a可以反式剪切rg4与rg3。
37.实施例5本实施例为通过荧光time-lapse实验研究cas13a反式剪切ssrna、rg4、rg3的表观速率,具体操作方法如下:将cas13a(1 μl, 1 μm)、sars-cov-2 e-gene crrna(1 μl,1 μm)、1 μl rnase inhibitor和7 μl的缓冲液a于37℃下孵育10 min,随后往上述体系中加入sars-cov-2 e-gene(10 μl, 10 nm)作为靶标激活cas13a并于37℃水浴中孵育30 min,这一步可以使target充分激活cas13a并充分顺式剪切rna靶标,已排除后续对反式剪切效果的影响。然后在反应体系中加入60 μl缓冲液a和20 μl ssrna-fq、rg4-fq或rg3-fq作报告分子,通过荧光定量pcr仪比较这三者的表观剪切速率。报告分子的浓度梯度设置为:1000 nm;500 nm。荧光定量pcr仪设置温度为37℃,采样间隔为30 s,采样时间为2 h。
38.通过荧光time-lapse实验,我们发现,如图5(a)、(b)所示,在1000 nm和500 nm这两种浓度的报告分子中,cas13a反式剪切ssrna-fq、rg4-fq和rg3-fq的表观速率呈现如下的趋势:v
rg3-fq
>v
r g4-fq
>v
ssrna-fq
。如图5(c)所示,通过曲线拟合计算报告分子的半数剪切时间,rg3-fq略小于rg4-fq,两着处于相当的水平,但远小于ssrna的半数剪切时间。上述实验结果说明,相对于ssrna而言,rg4-fq、rg3-fq作为cas13a剪切体系的报告分子具有明显的优势。
39.实施例6本实施例为cd实验证明不同序列的rg4s、rg3s在不同离子条件下可以被激活的
cas13a切割,具体操作方法如下:将cas13a(1 μl, 10 μm)、sars-cov-2 e-gene crrna(1 μl,10 μm)、1 μl rnase inhibitor和17 μl的缓冲液a(50 mm nacl)或缓冲液c(50 mm kcl)于37℃下孵育10 min,之后加入rg4s(kras rg4、orn-n rg4)或rg3s(bcl2-3 rg3、bcl2-5 rg3)等作为报告分子,具体序列见表1.1。继续添加13 μl对应的缓冲液和sars-cov-2 e-gene(10 μl,1 μm)激活cas13a,于于37℃下酶切1 h。酶切后往反应体系中添加200 μl对应缓冲液,最后检测cd信号,设置检测波长范围为200~320 nm。
40.通过cd实验,我们发现,在图6(a)-(d)中,与对照组相比,rg4、rg3的cd特征峰在nacl和kcl条件下具有明显的偏移。通过图6(a)、(b),还可以进一步发现,kras rg4、orn-n rg4在nacl和kcl条件下的峰型具有明显的差异,这是由于rg4在不同盐离子条件下会形成不同的空间构型。上述实验结果说明cas13a反式剪切rg4s、rg3s具有普适性,不受其序列和构型的限制。
41.实施例7本实施例为荧光淬灭实验研究rg4-fq、rg3-fq作报告分子时的灵敏度,具体操作方法如下:将cas13a(1 μl, 1 μm)、sars-cov-2 e-gene crrna(1 μl, 1 μm)、1 μl rnase inhibitor和17 μl的缓冲液a于37℃下孵育10 min。随后加入rna g4/g3-fq(20 μl, 1 μm)和sars-cov-2 e-gene(10 μl,不同浓度),在37℃水浴锅中进行酶切反应1 h,之后立即将反应体系置于65℃水浴锅中失活10 min。反应完成后,往体系中加入250 μl缓冲液a,加到石英比色皿中进行荧光检测。sars-cov-2 e-gene的浓度梯度为:0.00 pm、0.02 pm、0.04 pm、0.08 pm、0.16 pm、0.20 pm、1.00 pm,每组实验设置三个平行。荧光光谱仪检测激发波长设置为488 nm,接收波长设置为500~700 nm。
42.通过荧光淬灭实验可以发现,如图7(a)、(c)所示,target浓度越高,产生的荧光信号越强。rg4-fq/rg3-fq报告分子的一端标记为fam荧光基团,另一端标记为bhq1淬灭基团,当没有target存在时,rg4-fq/rg3-fq形成稳定的二级结构,fam的荧光被bhq1淬灭,荧光值很低,而当target浓度逐渐变高时,激活的cas13a酶浓度也逐渐变高,在相同时间内,反式剪切rg4-fq/rg3-fq的量也就越多,使得荧光信号逐渐增强。如图7(b)、(d)所示,三次重复的实验结果表明rg4-fq和rg3-fq作为报告分子时,检测体系的灵敏度可达0.02 pm。
43.实施例8本实施例为利用rg4+tht荧光增强效应实现核酸免标记检测,具体操作方法如下:将cas13a(1 μl, 1 μm)、sars-cov-2 e-gene crrna(1 μl, 1 μm)、1 μl rnase inhibitor和17 μl的缓冲液a于37℃下孵育10 min。报告分子的组成为:terra g4(3 μl, 10 μm)、tht(6 μl, 10 μm)、缓冲液a(11 μl),将上述物质充分混合后,与室温下轻微震荡孵育1 h。震荡完成后,加入酶切体系中,并加入不同浓度的sars-cov-2 e-gene作为target激活cas13a,于37℃酶切2 h。target浓度梯度设置为:0 pm、2 pm、10 pm、20 pm、100 pm、200 pm,每组实验有3次重复。酶切完成后,用荧光光谱仪采样,激发波长设置为420 nm,接收波长设置为450-600 nm。
44.tht在溶液中本底的荧光信号较弱,加入rg4后,会使其荧光信号显著增强。如图8(a)所示,利用rg4/tht复合物诱导的荧光增强效应,我们成功了实现了rna靶标的免标记检
测。当没有target存在时,cas13a不会被激活,rg4的结构完整,可以显著增强tht的荧光信号;随着target浓度的升高,rg4逐渐被破坏,增强tht荧光信号的能力逐渐减弱,在谱图上表现为485 nm处的峰强度逐渐变小。如图8(b)所示,三次实验的重现性较好,且这种免标记检测体系的灵敏度可达2 pm。
45.实施例9本实施例为利用rg4和电化学传感实现核酸的超灵敏检测,具体操作方法如下:将cas13a(0.4 μl, 1 μm)、sars-cov-2 e-gene crrna(0.4 μl, 1 μm)、1 μl rnase inhibitor和18.2 μl的缓冲液a于37℃下孵育10 min。随后加入terra g4(5 μl, 10 μm)、sars-cov-2 e-gene(10 μl,不同浓度)和缓冲液a(15 μl)进行酶切,在37℃水浴中酶切1 h。sars-cov-2 e-gene的浓度梯度设置为:0 fm、2 fm、10 fm、20 fm、200 fm。酶切完成后,接下来将反应体系置于65℃水浴中失活10 min,并加入hemin(25 μl, 10 μm),室温孵育1 h使g4与hemin充分结合。最后在体系中加入h2o2(2 μl, 50 μm)、hq对苯二酚(2 μl, 50 μm)和缓冲液a(20 μl),室温反应15 min后进行电化学检测。每组实验有三次重复。电化学传感器为三电极体系,包括参比电极、对电极和工作电极,其中参比电极为银/氯化银电极,对电极为玻碳电极,工作电极为玻碳电极。扫描模式选择差分脉冲伏安法(differential pulse voltammetry,dpv),在-600 mv~100 mv的电位范围进行扫描,获得对苯二酚的氧化峰电流ipa值。
46.通过电化学实验,我们发现,当没有加入sars-cov-2 e-gene作为target时,cas13a没有被激活,terra g4与hemin结合具有过氧化氢酶活性,催化电化学体系中的h2o2分解产生氧气,进而使得hq对苯二酚发生氧化还原反应生成产物bq苯醌,因此体系中余下terra g4的含量与产物bq呈正相关。如图9(a)当target含量逐渐升高时,激活的cas13a酶含量越多,反式剪切rg4的量越多,进而导致余下的rg4含量逐渐变小,产物bq的含量也逐渐变小,在电化学信号最终体现为-230 mv附近的电流峰值强度逐渐减低。图9(b)的结果表明,基于rg4的电化学检测体系重复性较好,且最低检测灵敏度可达10 fm。图9(c)结果表明,待测靶标浓度与电化学信号呈单指数递减(方程为y=0.44
×
exp(-x/33.55)+1.28),可基于该关联性利用电化学信号进行靶标浓度的换算。
47.实施例10本实施例为荧光淬灭实验研究rg4-fq、rg3-fq作报告分子时的特异性,具体操作方法如下:将cas13a(1 μl, 1 μm)、mirna-20a crrna(1 μl, 1 μm)或mirna-20b crrna(1 μl,1 μm)、1 μl rnase inhibitor和17 μl的缓冲液a于37℃下孵育10 min。接下来往体系中加入rg4-fq/rg3-fq(20 μl, 1 μm),加入mirna-20a(10 μl,1 nm)或mirna-20b(10 μl,1 nm)作为target,或者加入10 μl缓冲液a作为对照组,随后在37℃水浴锅中进行酶切反应1 h,酶切完成后,立即将反应体系置于65℃水浴锅中失活10 min,加入250 μl缓冲液a进行荧光检测。
48.通过图10(a)、(b)可以发现,基于rg4/rg3和crispr-cas13a检测体系的特异性很强。通过表1.1序列信息可以发现,mirna-20a与mirna-20b这两个target与相应crrna配对区只有3个碱基的差别,但是错配时的荧光信号较弱。只有mirna-20a与mirna-20a crrna正确配对时,才能激活cas13a的反式剪切活性,使得荧光信号显著增强。从图10中我们还可以
发现,mirna-20a与mirna-20a crrna配对以及mirna-20b与mirna-20b crrna配对,这两者的荧光信号也有差别,这是由于序列本身的差异性导致其与cas13a之间的亲和力略有差异而造成的,不影响我们对最终检测结果的判定。
49.在不冲突的情况下,本文中上述实施例及实施例中的特征可以相互结合。
50.以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:李颖 徐志辰 杨运煌
- 技术所有人:中国科学院精密测量科学与技术创新研究院
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....