一种Fam50b蛋白多克隆抗体及其制备方法与应用
一种fam50b蛋白多克隆抗体及其制备方法与应用
技术领域
1.本发明属于抗体制备技术领域,具体涉及一种fam50b蛋白多克隆抗体及其制备方法与应用。
背景技术:
2.fam50b(family with sequence similarity 50member b)是一个蛋白质编码基因。与fam50b相关的疾病包括各种恶性肿瘤,前列腺癌及子宫颈癌,还可以导致多种先天畸形,精神发育迟缓及男性不育症。此基因包含一个无内含子的orf,源于遗传缺陷。该基因与差异甲基化区(dmr)相邻,且在睾丸生殖细胞肿瘤中表达紊乱,提示fam50b对精液质量及肿瘤形成过程中起到了重要作用。
3.研究fam50b蛋白的生物学功能对研究相关疾病的发病机理以及预防该疾病的发生具有重大意义。相应的抗体是研究该蛋白功能所需要的重要材料之一,因此fam50b蛋白抗体对于深入研究fam50b的生化功能以及对于人类相关疾病的防控等将具有重要的意义。然而,目前市面上的fam50b抗体产品极少,且普遍存在特异性不高,效价低且价格昂贵的问题。
技术实现要素:
4.有鉴于此,本发明旨在提供一种fam50b蛋白多克隆抗体及其制备方法,本发明通过原核表达系统得到fam50b重组蛋白,将其作为抗原免疫动物后获得的多克隆抗体具有良好的特异性,而且还具有制备时间短、成本低、产量高等优点。
5.为了实现上述目的,本发明的技术方案具体如下:
6.本发明提供了一种fam50b蛋白多克隆抗体的制备方法,具体包括以下步骤:
7.步骤1.构建含有seq id no.1所示核苷酸序列的重组表达载体;
8.步骤2.将重组表达载体转化至大肠杆菌并诱导培养,再收集fam50b重组蛋白,所述fam50b重组蛋白含有seq id no.2所示序列;
9.步骤3.将fam50b重组蛋白作为抗原免疫动物,取动物血清分离纯化后得到多克隆抗体。
10.进一步地,在上述技术方案中,步骤1具体为:以小鼠睾丸总rna为模板,反转录获得cdna,再以cdna为模板通过pcr扩增得到含seq id no.1所示序列的目的片段,将该片段连接至原核表达载体即得。
11.更进一步地,在本发明提供的一个具体实施案例中,pcr扩增所用引物序列如seq id no.3~4所示,重组表达载体的基础载体为pgex-6p-1,目的片段与载体pgex-6p-1分别通过bamhⅰ酶和ecorⅰ酶进行双酶切后连接。
12.进一步地,在上述技术方案中,步骤2所述大肠杆菌具体为大肠杆菌bl21(de3)菌株。
13.进一步地,在上述技术方案中,步骤2中诱导培养的条件为:终浓度为0.3mm iptg,
37℃培养3h。
14.进一步地,在上述技术方案中,所述fam50b重组蛋白的收集方法为:离心收集菌沉淀,用pbs多次离心洗涤后,依次加入蛋白酶抑制剂和溶菌酶反应;将菌液超声破碎,再加入终浓度为10% triton-x100和1mm dtt进行孵育,离心取上清液,纯化后即得重组蛋白。
15.进一步地,在上述技术方案中,步骤3中的免疫实验动物为兔。
16.进一步地,在上述技术方案中,步骤3中的免疫方式具体为:
17.初次免疫,用fam50b重组蛋白与弗氏完全佐剂乳化混合后免疫实验动物;
18.待初次免疫3周后,用fam50b重组蛋白与弗氏不完全佐剂乳化混合后第二次免疫实验动物,其中fam50b重组蛋白用量为初次免疫的0.5倍;
19.待第二次免疫2周后,第三次免疫实验动物且所用试剂与第二次免疫一致;
20.待第三次免疫2周后,用fam50b重组蛋白与弗氏不完全佐剂乳化混合后第四次免疫实验动物,其中fam50b重组蛋白用量与初次免疫相同;
21.待第四次免疫完成1周后,即可取血分离抗体。
22.通过上述制备方法制得的fam50b蛋白多克隆抗体能够特异性识别fam50b蛋白,故其可应用于fam50b蛋白的检测及功能鉴定等方面。
23.本发明的有益效果:本发明通过原核表达系统得到fam50b重组蛋白,相较于天然抗原和多肽类抗原,本发明提供的重组蛋白不但含有多个不同的抗原决定簇,同时也容易短时间内大量生成。进一步利用该重组蛋白抗原生产的多克隆抗体,具有良好的特异性,可以用于检测具有高抗原同源性的已知或未知抗原亚型、低水平的同源抗原,并尽可能多的捕获抗原(例如免疫沉淀或染色质免疫沉淀)、变性蛋白质,具有可能的遗传多态性、糖基化或构象变化的靶标,跨多种检测类型检测天然蛋白。
附图说明
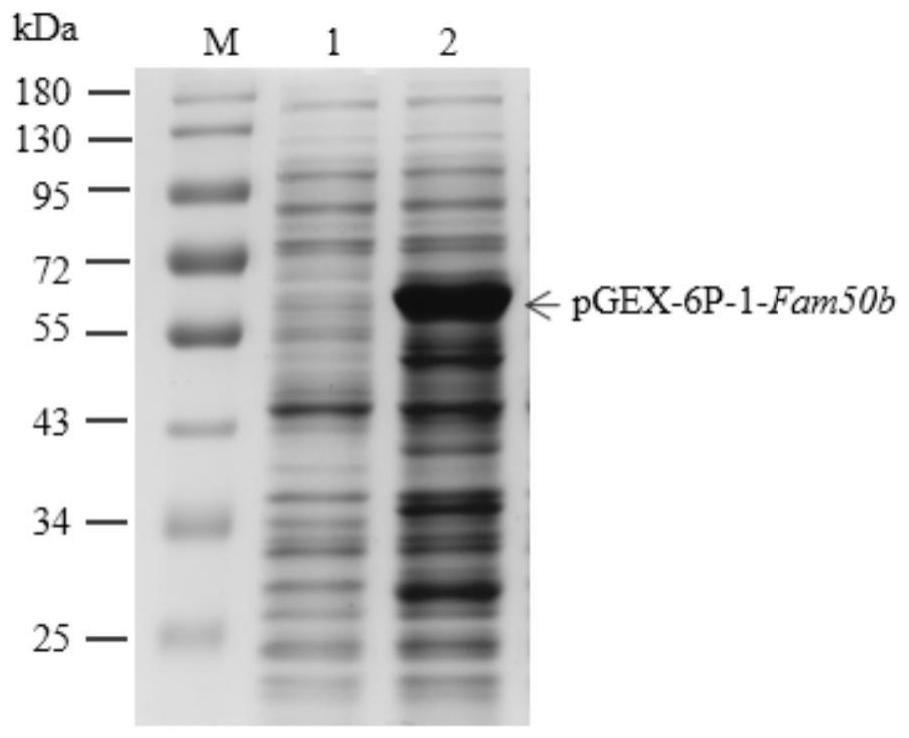
24.图1为实施例1中少量重组表达菌株诱导表达前后的sds-page示图,其中,m即marker为蛋白质标准分子量,泳道1为诱导表达前,泳道2为诱导表达后;
25.图2是实施例1中大量重组表达菌株诱导表达前后的sds-page示图,其中,m即marker为蛋白质标准分子量,泳道1为诱导前,泳道2为诱导后,泳道3为超声前,泳道4为超声后,泳道5为超声后上清,泳道6为超声后沉淀,泳道7为重组蛋白;
26.图3是本发明制备的多克隆抗体fam50b的westernblot示图,其中,m即marker为蛋白质标准分子量,1为野生型小鼠睾丸组织,2为fam50b敲除小鼠睾丸组织;
27.图4为市面上现有的三种fam50b抗体的westernblot示图;
28.图5是制备的多克隆抗体检测野生型小鼠睾丸组织的免疫荧光染色示图。
具体实施方式
29.下面将结合本发明中的实施例和附图,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,仅用于解释本发明,而不能理解为对本发明的限制。
30.下述实施例中,若无特殊说明,均为常规方法;所述试剂和材料,若无特殊说明,均可从商业途径获得。
31.实施例1
32.本例制备了一种fam50b多克隆抗体,具体过程包括如下步骤:
33.(1)pgex-6p-1-fam50b-bl21(de3)重组质粒的构建与鉴定。
34.①
采用北京天根生化科技有限公司的微量样本总rna提取试剂盒提取小鼠睾丸总rna,其中提取操作步骤参见产品说明书。
35.②
以步骤
①
获得的小鼠睾丸总rna作为模板,采用南京诺唯赞生物科技有限公司的反转录试剂进行反转录获得cdna,其中提取操作步骤参见产品说明书。
36.③
以步骤
②
获得的cdna作为模板进行pcr扩增获得fam50b目的基因片段,其中rcr扩增所用引物序列如下:
37.上游引物:5
’‑
ttccaggggcccctgggatccatggcgcagtacaaaggcac-3’(seq id no.3,下划线为bamhⅰ酶切位点),
38.下游引物:5
’‑
ctcgagtcgacccgggaattctcaccggatggtgtacctgtc-3’(seq id no.4,下划线为ecorⅰ酶切位点)。
39.④
对步骤
③
得到的pcr扩增产物与通过bamhⅰ酶和ecorⅰ酶进行双酶切的大肠杆菌表达载体pgex-6p-1进行琼脂糖凝胶电泳,分析鉴定并切胶回收。
40.⑤
将切胶回收后的pcr产物与载体用同源重组酶(南京诺唯赞生物科技有限公司)于37℃反应30min进行连接,连接完成将其转化至大肠杆菌感受态细胞dh5α,涂布于含100ng/μl氨苄抗生素的lb固体培养板上37℃倒置培养过夜,挑取单克隆培养至菌液浑浊后进行测序分析。测序结果表明,得到的目的基因(fam50b)编码区与预计相符,具体序列见seq id no.1。
41.(2)fam50b蛋白在大肠杆菌中的表达。
42.①
将构建成功的pgex-6p-1-fam50b重组质粒转化至大肠杆菌bl21(de3)感受态细胞(北京全式金生物)中,获得含seq id no.1所示序列的重组表达菌株。
43.②
将构建的重组表达单菌株挑至含有终浓度为50ng/μl amp+的lb培养基中,并于37℃、200rpm培养4-5h,然后将其转接到30mllb培养液中继续培养至菌液浓度达到od
600
为0.4-0.6时,加入终浓度为0.3mm的iptg诱导表达,其中诱导条件为37℃、3h。诱导完成后取菌液6000rpm离心1min弃上清,加入1x sds,95℃金属浴煮样10min,进行sds-page电泳;检测结果如图1所示:重组表达菌株诱导正常,载体携带的目的基因片段能正常表达且大小与预期一致。
44.③
按照步骤
②
扩大培养至1l的菌液并完成诱导,然后于4℃、4500rpm离心15min收集菌体,加入适量pbs将其重悬后移至高速离心管中并于4℃、10000rpm离心15min,将收集到的菌体置于冰上,用约30ml pbs重悬菌体,加入终浓度为1mm的蛋白酶抑制剂(pmsf)继续重悬,然后加入终浓度为1mg/ml的溶菌酶(lysozyme)充分混匀,并在冰上继续孵育30min,再将其放置于一个1l的冰桶中进行超声破碎处理。超声完成后加入终浓度10%triton-x100及终浓度为1mm的dtt,混匀后冰上孵育30min,孵育完成于4℃、10000rpm离心20min,取上清重复离心一次,收集上清液于50ml离心管中置于冰箱4℃,纯化完成后进行sds-page电泳分析。
45.按照步骤
②
的方法制备诱导前、诱导后、超声前、超声后、超声后上清、超声后沉淀以及纯化后重组蛋白的蛋白样品,并进行sds-page电泳分析。检测结果如图2所示:目的蛋
白诱导表达效果较好,目的蛋白条带大小与预测相一致且条带清晰,纯度较高。
46.(3)fam50b蛋白多克隆抗体的制备。
47.将步骤(2)制备的fam50b重组蛋白作为抗原用来免疫新西兰白兔,整个过程需要四次免疫,具体为:
48.①
第一次免疫取1mg上述纯化好的重组蛋白与等体积的弗氏完全佐剂等体积充分混合,实验兔背部皮下4-6点免疫;
49.②
3周后取0.5mg纯化后的蛋白与等体积弗氏不完全佐剂充分乳化混合后,实验兔背部皮下数个位点进行第二次免疫;
50.③
第三次免疫在第二次免疫后2周进行,各条件与第二次免疫相一致;7d后实验兔耳缘静脉取血1ml,4℃静置过夜离心取上清,用以初步检测血清抗体特异性。
51.④
第四次免疫在第三次免疫完成后2周进行,取1mg蛋白与等体积弗氏不完全佐剂充分乳化混合后进行免疫。
52.全部免疫完成1周后实验兔颈动脉取全血约100ml,4℃冰箱静置过夜,离心分离上层抗血清。
53.通过westernblot检测抗体特异性,并采用免疫荧光染色检测fam50b在野生型小鼠睾丸组织细胞中的定位情况,其中检测方法参考文献li l,tian g,peng h,et al.new class of transcription factors controls flagellar assembly by recruiting rna polymerase ii in chlamydomonas[j].procnatlacadsci u s a,2018,115(17):4435-40。
[0054]
westernblot检测结果如图3所示:westernblot结果与预测大小相一致,制备的fam50b多克隆抗体其特异性良好。图4为市面上现有的三种来自于不同公司的fam50b抗体产品的westernblot检测结果(检测方法同图3),从图3和4可知,本发明制备的特异性优于上述三种产品。
[0055]
免疫荧光染色检测结果如图5所示,显示制备的抗体可以特异性结合细胞内fam50b蛋白。
[0056]
待westernblot检测抗体特异性表达后,加入等体积的40%甘油,混合后以1ml的量分装到1.5ml的ep管中,移至-80℃进行保存。
[0057]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1