一种固定化酶联合高压提取刺五加苷B的方法
一种固定化酶联合高压提取刺五加苷b的方法
技术领域
1.本发明属于天然产物提取技术领域,具体涉及一种固定化酶联合高压提取刺五加苷b的方法。
背景技术:
2.刺五加又名西伯利亚人参,属五加科多年生木本植物,据《本草纲目》记载,刺五加具有补肾安神等功效。刺五加含有多种活性物质包括刺五加苷b、刺五加苷e、黄酮、多糖、维生素和矿物质。近年研究发现,刺五加苷b具有抗肿瘤、抗抑郁、抗病毒及改善心率失常等药效作用。刺五加苷b提取方法很多,其中传统的加热回流法是提取苷类成分最基础的方法,中国专利cn112089741b中即采用这种方法对刺五加中多种成分进行提取,但该方法耗时长、溶剂使用量大,提取率低。高压辅助提取是近年发展起来的一项高效物理辅助提取技术,在高压条件下溶剂可以进入植物细胞内部,充分溶解植物中有效成分;同时高压还可以破坏植物致密的细胞壁结构,解体细胞,使有效成分随溶剂快速溢出,具有提取时间短、溶剂消耗少、工艺参数易控制及提取效率高的特点。
3.此外,酶辅助提取技术也已经应用于刺五加苷的提取。该方法绿色环保,高度专一的酶催化作用可减小有效成分提取时的传质阻力,提高植物中天然产物的提取率。酶的种类丰富,但一种酶对植物细胞壁的分解作用往往是单一的,催化速度较慢;而多种酶协同作用将会加快细胞壁的分解,缩短提取时间,增强植物中有效成分的溶出率,在植物源天然化合物提取上具有较大优势。中国专利cn102977164a采用复合酶辅助方法提取刺五加中金丝桃苷,提取效率显著提高,但该发明中对于使用过的复合酶如何去除未给出具体办法,残留的酶会使后续活性成分的分离纯化难度增加。针对以上问题,固定化酶技术是一种有效的解决手段。酶的固定化是用固体材料将酶束缚或限制于一定区域内,进行其特有的催化反应,并可回收及重复利用。与游离酶相比,固定化酶在保持其高效专一及温和的酶催化反应特性的同时,又克服了游离酶的不足之处,呈现高稳定性、易分离回收,可重复使用等优点。
4.常见固定化酶一般是以聚乙烯醇和海藻酸钠为制备材料,其中聚乙烯醇是一种富含羟基的物质,具有很多酶结合位点,可以充分保证酶的固定效率;海藻酸钠也因为自身弹性大的特点,使固定化酶微球具有良好的成球性。但以这两种材料制备的固定化酶在使用时常存在机械强度弱、对外界敏感等缺点,使得固定化酶在使用过程中会出现吸水涨破,致使酶外泄而出现难分离的情况,大大限制了固定化酶的重复利用性,使其在工业生产中不能得到广泛应用。近年来研究发现:ca
2+
可以与海藻酸钠上的羧基形成离子键进而增加海藻酸钠固化强度,提高固定化酶稳定性;壳聚糖(cs)作为天然高分子聚合物除本身具有一定的生物粘附性外,其丰富的氨基可以与聚乙烯醇中羟基共混形成氢键,联合使用能进一步增加固定化酶延展性;同时cs分子上的氨基还可通过络合及离子交换作用对酶产生良好的吸附效果。因此,为提高固定化酶性能,本发明在常用材料的基础上,加入碳酸钙和壳聚糖,制备一种新型的碳酸钙-壳聚糖-固定化酶(caco
3-cs-固定化酶),并首次将caco
3-cs-固定化酶与高压提取技术联合应用于刺五加苷b提取。本发明建立了一种高效、绿色、节能、温和
的提取刺五加苷b的方法,易于工业化生产使用。
技术实现要素:
5.针对现有刺五加苷b提取技术中溶剂用量大、酶利用率低、操作繁琐及提取率低等不足,本发明提供一种固定化酶联合高压提取刺五加苷b的方法。同时针对固定化酶在提取液中易吸水涨破的问题,制备一种新型的caco
3-cs-固定化酶。将caco
3-cs-固定化酶与高压技术协同使用,提高了刺五加苷b的提取效率,且提取工艺中使用的固定化复合酶可直接过滤分离,简化后续纯化步骤。分离的固定化复合酶可以循环使用,降低生产成本,在工业生产上具有广泛应用前景。
6.本发明的技术方案如下:
7.一种固定化酶联合高压提取刺五加苷b的方法,具体步骤如下:
8.①
取刺五加根茎干粉,按料液比1:15~30(w/v)加入去离子水,混合均匀;按质量分数0.5-2%加入自制固定化酶,用单层纱布包裹放入反应体系,保持40℃温度,搅拌转速300rpm,浸提60~80min。
9.②
对步骤
①
浸提液进行高压提取,高压提取条件为:压强4.5~6mpa,温度45~55℃,处理时间35~50min,将粗提物减压过滤,得到粗提液。
10.③
将步骤
②
中得到的粗提液上样ab-8大孔树脂柱,上样液浓度5mg/ml,上样量为0.2bv,上样流速0.3~1bv/h。上样后用7bv浓度70%乙醇进行洗脱,流速0.5~1.2bv/h,收集洗脱液、浓缩、冻干,得刺五加苷b。
11.进一步的,所述caco
3-cs-固定化酶的制备方法如下:
12.①
取适量去离子水置于烧杯,按比例加入质量分数6-8%聚乙烯醇、0.5-2%海藻酸钠、0.25-1%壳聚糖和2-5%caco3。混合均匀后,在95~100℃,以200rpm速度,磁力搅拌10min。待试剂充分溶解均匀后,降温至40℃,得凝胶液。
13.②
按质量分数0.5-2%的比例将果胶-纤维素复合酶同时加入至步骤
①
溶液中,保持40℃,200rpm转速,磁力搅拌10min,得复合酶凝胶溶液。取适量ph=6的硼酸缓冲溶液,以质量分数1.5-3.5%的比例加入无水氯化钙,60w超声30min,制备交联固定液。
14.③
用去掉针头的5ml注射器吸取适量复合酶凝胶溶液,以2s每滴的速度滴到交联固定液中固定,边滴加边用玻璃棒搅拌。20℃静置交联2h后取出,用去离子水冲洗两遍,50℃烘干至恒重,即完成固定化酶微球制备。
15.进一步的,所述caco
3-cs-固定化酶的制备步骤
①
中聚乙烯醇和海藻酸钠为固定化酶常用制备材料,壳聚糖与caco3为改性材料。
16.进一步的,所述caco
3-cs-固定化酶的制备步骤
②
中复合酶中果胶酶与纤维素酶质量比为0.5~2:1。
17.进一步的,所述caco
3-cs-固定化酶在联合高压提取刺五加苷b时可以重复使用3~5次。
18.与现有技术相比,本发明具有以下有益效果:
19.1.本发明提供了一种新型固定复合酶的制备方法,通过载入碳酸钙使得固定化酶稳定性增加,克服固定化酶在提取天然活性成分时易吸水涨破、引入新杂质的问题,简化提取物后续分离纯化步骤。
20.2.本发明制备的固定化复合酶活性均能保持在游离酶的70%以上,且固定化复合酶比游离酶稳定性更高,可反复使用,整体利用率高于游离酶,降低酶的使用成本。
21.3.本发明公开一种固定化酶联合高压提取天然活性成分的方法并将其应用于提取刺五加中的刺五加苷b。将复合酶对细胞壁的充分酶解作用与高压增加细胞内外压力差优势相结合,促进胞内有效成分溶出,提高刺五加苷b提取效率。
22.4.本发明公开的提取技术是一种非加热提取技术,可以避免因高温而使刺五加苷b失活或变性,操作简单,工艺参数易控制,适宜由实验室推广到实际生产中。
附图说明
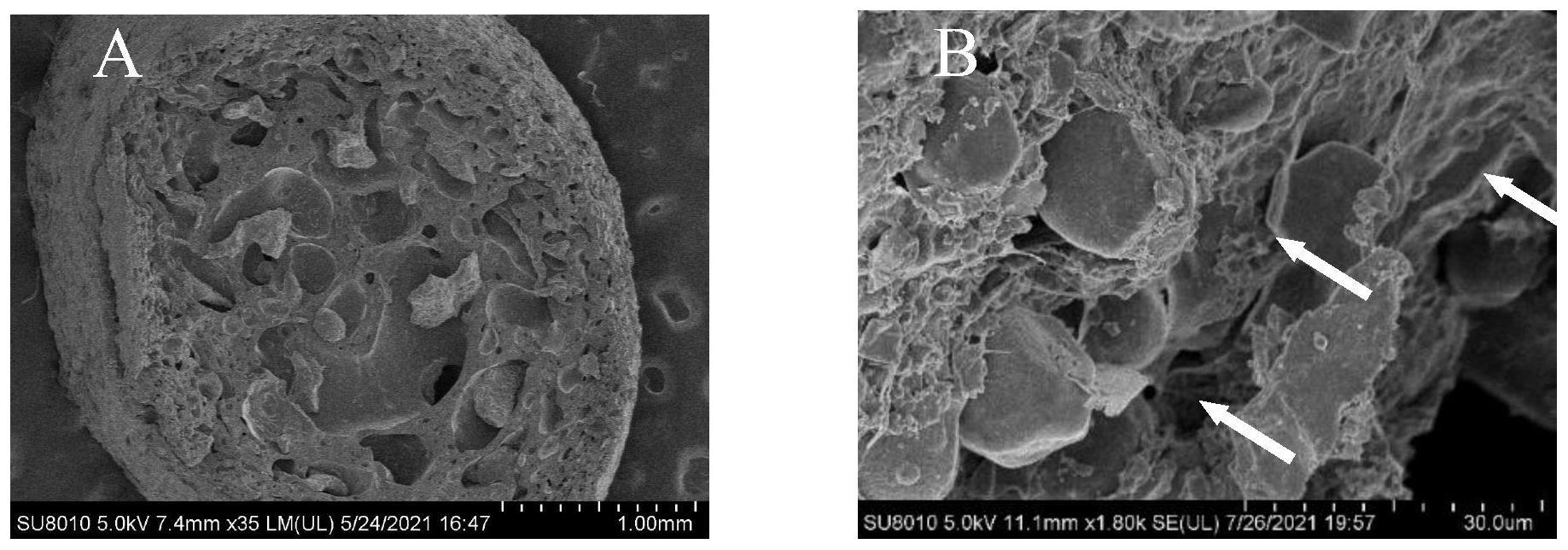
23.图1为caco
3-cs-固定化酶的横切面及内部的扫描电镜图(a:横切面扫描图,b:内部扫描图)
24.图2为固定化酶在水中浸泡后的完整程度(a:实施例1,b:对比例1)
25.图3为固定化酶吸水后平均直径(
①
:实施例1,
②
:对比例1)
26.图4为caco
3-cs-固定化酶中酶的相对活性(
①
:纤维素酶,
②
:果胶酶)
27.图5为caco
3-cs-固定化酶重复利用次数对刺五加苷b得率的影响
28.图6为不同提取方式对刺五加苷b得率影响
具体实施方式
29.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
30.实施例1
31.caco
3-cs-固定化酶的制备
32.(1)取130ml去离子水置于烧杯,加入9g聚乙烯醇、2g海藻酸钠、3.9g碳酸钙、0.65g壳聚糖,混合均匀后,在95℃,以200rpm速度,磁力搅拌10min,待试剂充分溶解均匀后,降温到40℃,得凝胶溶液。
33.(2)取0.78g果胶酶、0.52g纤维素酶,加入到步骤(1)溶液中,保持40℃,200rpm转速,磁力搅拌10min,得复合酶凝胶溶液。取100mlph=6的硼酸缓冲溶液,加入2g无水氯化钙,60w超声30min,制备交联固定液。
34.(3)用去掉针头的5ml注射器吸取3ml复合酶凝胶溶液,以2s每滴的速度滴到交联固定液中固定,边滴加边用玻璃棒搅拌。20℃静置交联2h后取出,用去离子水冲洗两遍,50℃烘干至恒重,即完成固定化酶微球制备。
35.刺五加苷b的提取
36.(1)取刺五加根茎干粉,按料液比1:20(w/v)加入去离子水,混合均匀;按质量分数1%称取caco
3-cs-固定化酶,用单层纱布包裹放入反应体系,保持40℃温度,搅拌转速300rpm,浸提60min。
37.(2)对步骤(1)浸提液进行高压提取,提取条件为:压强5mpa,温度50℃,处理时间45min,将粗提物减压过滤,得到粗提液,回收固定化酶微球。
38.(3)将步骤(2)中得到的粗提液上样ab-8大孔树脂柱,上样浓度5mg/ml,上样量为0.2bv,上样流速0.5bv/h,用7bv浓度70%乙醇进行洗脱,流速1bv/h,收集洗脱液、浓缩、冻
干,得刺五加苷b。
39.经测定刺五加苷b的得率为1.685mg/g。本发明中刺五加苷b得率测定步骤如下:
40.将刺五加苷b标准品配置成不同浓度,分别在265nm下检测其吸光值,用吸光值对刺五加苷b浓度作图,绘制刺五加苷b标准曲线。取刺五加苷b提取液,在265nm下检测吸光值。对照标准曲线求得刺五加苷b浓度,根据以下公式计算刺五加苷b得率。刺五加苷b得率表示为刺五加苷b当量(mg)/刺五加粉重(g)。
[0041][0042]
式中:m为刺五加干粉的质量,g;
[0043]
c为由标准曲线计算所得刺五加提取液刺五加苷b浓度,mg/ml;
[0044]
v为待测溶液体积,ml;
[0045]
实施例2
[0046]
caco
3-cs-固定化酶的制备
[0047]
(1)取100ml去离子水置于烧杯,加入8g聚乙烯醇、2g海藻酸钠、3g碳酸钙、0.5g壳聚糖,混合均匀后,在100℃,以200rpm速度,磁力搅拌10min,待试剂充分溶解均匀后,降温到40℃,得凝胶溶液。
[0048]
(2)取0.6g果胶酶、0.4g纤维素酶,加入到步骤(1)溶液中,保持40℃,200rpm转速,磁力搅拌10min,得复合酶凝胶溶液。取100mlph=6的硼酸缓冲溶液,加入3g无水氯化钙,60w超声30min,制备交联固定液。
[0049]
(3)用去掉针头的5ml注射器吸取3ml复合酶凝胶溶液,以2s每滴的速度滴到交联固定液中固定,边滴边用玻璃棒进行搅拌。20℃静置交联2h后取出,用去离子水冲洗两遍,50℃烘干至恒重,即完成固定化酶微球制备。
[0050]
刺五加苷b的提取
[0051]
(1)取刺五加根茎干粉,按料液比1:30(w/v)加入去离子水,混合均匀;按质量分数2%称取caco
3-cs-固定化酶,用单层纱布包裹放入反应体系,保持40℃温度,搅拌转速300rpm,浸提70min。
[0052]
(2)对步骤(1)浸提液进行高压提取,提取条件为:压强6mpa,温度55℃,处理时间50min,将粗提物减压过滤,得粗提液,回收固定化酶微球。
[0053]
(3)将步骤(2)中得到的粗提液上样ab-8大孔树脂柱,上样浓度5mg/ml,上样量为0.2bv,上样流速1bv/h,用7bv浓度70%乙醇进行洗脱,流速0.5bv/h,收集洗脱液、浓缩、冻干,得刺五加苷b。按照实施例1的方法测定刺五加苷b得率。经测定,刺五加苷b得率为1.703mg/g。
[0054]
对比例1
[0055]
聚乙烯醇-海藻酸钠-固定化酶的制备
[0056]
(1)取130ml去离子水置于烧杯,加入9g聚乙烯醇、2g海藻酸钠,混合均匀后,在95℃,以200rpm速度,磁力搅拌10min,待试剂充分溶解均匀后,降温到40℃,得凝胶溶液。
[0057]
(2)取0.78g果胶酶、0.52g纤维素酶,加入到步骤(1)溶液中,保持40℃,200rpm转速,磁力搅拌10min,使酶均匀分散在溶液中,得复合酶凝胶溶液。取100mlph=6的硼酸缓冲溶液,加入2g无水氯化钙,60w超声30min,制备交联固定液。
[0058]
(3)用去掉针头的5ml注射器吸取3ml复合酶凝胶溶液,以2s每滴的速度滴到交联固定液中固定,边滴加边用玻璃棒搅拌。20℃静置交联2h后取出,用去离子水冲洗两遍,50℃烘干至恒重,即完成固定化酶制备。
[0059]
固定化酶固定效果和性能分析
[0060]
1.固定化酶结构
[0061]
图1为实施例1中制备caco
3-cs-固定化酶微球结构的sem扫描图,从图中可以看出微球具有完整的海绵状空心结构,进一步放大可以看出,样品内壁附着酶颗粒(白色箭头所指),说明本发明制备的固定化酶微球具有良好的酶固定效果。
[0062]
2.机械强度
[0063]
取实施例1和对比例1制备的固定化酶。每组固定化酶取10粒分别在0r/min和300r/min搅拌下的水溶液中放置5天,观察各组固定化酶的完整程度并通过以下公式计算完好率。
[0064][0065]
式中:n1:测试固定化酶总数(粒);
[0066]
n2:未破损固定化酶总数(粒)。
[0067]
由图2可以看出本发明制备固定化酶在水中搅拌5天后均保持完整,完好率可达100%。而对比例1中常规壁材制备的聚乙烯醇-海藻酸钠-固定化酶吸水涨大明显,逐渐变成凝胶状,失去原本球状形态,完好率比本实验发明固定化酶低15%。
[0068]
3.体积膨胀性
[0069]
取实施例1和对比例1制备固定化酶。每组固定化酶取10粒分别在水中连续浸泡5天,每天定时测量各固定化酶微球直径。结果如图3,本发明制备的固定化酶由于添加碳酸钙和壳聚糖,放置5天后体积增加不显著(《20%),吸水膨胀性很小。而对比例1中常规壁材制备的聚乙烯醇-海藻酸钠-固定化酶放置5天后,体积显著增加(》45%),吸水膨胀明显。
[0070]
4.caco
3-cs-固定化酶中酶活检测
[0071]
dns法测定果胶酶活力
[0072]
(1)半乳糖醛酸标准曲线的绘制:将半乳糖醛酸标准溶液配置成不同浓度,分别取0.4ml,加入0.3mldns试剂,沸水浴10min后,冷却至室温,加4.3ml水,在490nm处测吸光值,用吸光值对半乳糖醛酸浓度作图,制得半乳糖醛酸标准曲线。
[0073]
(2)果胶酶活性检测:分别取10ml7.0 mg/ml的果胶标准溶液于两个试管,37℃预热10min后。一个试管加0.6mg游离果胶酶,另一试管中加入实施例1制备的固定化酶1.0g。分别在不同时间从试管中取0.4ml酶解液,加入0.3ml dns试剂。沸水浴10min后,冷却至室温,加入4.3ml去离子水,混匀,在490nm下检测各酶解液的吸光值,对照标准曲线求得转化生成半乳糖醛酸浓度。
[0074]
本发明制备的caco
3-cs-固定化酶中果胶酶活性以酶解果胶转化生成的半乳糖醛酸浓度为指标,将游离酶活性设为100%,用固定化酶活性除以游离酶活性,可得固定化酶的相对活性。由图4可以看出,在60min时本发明制备的caco
3-cs-固定化酶中果胶酶活性达到了游离酶活性的76.6%。
[0075]
dns法测定纤维素酶活力
[0076]
(1)葡萄糖标准曲线绘制:将葡萄糖标准溶液配置成不同浓度,分别取2ml,加入1mldns溶液,沸水浴10min后,冷却至室温,加21.5ml去离子水。在540nm处测吸光值,用吸光值对葡萄糖浓度,制得葡萄糖标准曲线。
[0077]
(2)纤维素酶活性检测:分别取20ml 7.0mg/ml的纤维素标准溶液于两个试管,40℃预热10min后。一个试管中加0.4mg游离纤维素酶,另一试管加实施例1制备的固定化酶2.0g。分别在不同时间从试管中取2.0ml酶解液,加入1.0ml的dns试剂。沸水浴10min后,冷却至室温,加入21.5ml水,混匀,在540nm下检测各酶解液的吸光值,对照标准曲线求得转化生成葡萄糖浓度。
[0078]
本发明制备的caco
3-cs-固定化酶中纤维素酶活性以酶解纤维素转化生成的葡萄糖浓度为指标,将游离酶活性设为100%,用固定化酶活性除以游离酶活性,可得固定化酶的相对活性。由图4可以看出在60min时本发明制备的caco
3-cs-固定化酶中纤维素酶活性达到了游离酶活性的71.3%。
[0079]
5.caco
3-cs-固定化酶循环利用次数
[0080]
取实施例1中回收的caco
3-cs-固定化酶按照实施例1中提取刺五加苷b的步骤,重复操作5次,按照实施例1的方法计算刺五加苷b的得率。实验结果如图5,0次代表单纯高压提取刺五加苷b得率,caco
3-cs-固定化酶在联合高压提取过程中,循环使用5次都可发挥催化活性,刺五加苷b得率均高于单独高压提取得率(1.378mg/g),其中反复使用3次内效果更佳。
[0081]
对比例2
[0082]
刺五加苷b的提取
[0083]
1.固定化酶辅助提取刺五加苷b
[0084]
取刺五加根茎干粉,按料液比1:30(w/v)加入去离子水,混合均匀;按质量分数1%称取实施例1制备的caco
3-cs-固定化酶,用单层纱布包裹放入反应体系,保持40℃温度,搅拌转速300rpm,浸提3h,按照实施例1方法测定刺五加苷b得率。
[0085]
2.高压辅助提取刺五加苷b
[0086]
取刺五加根茎干粉,按料液比1:30(w/v)加入去离子水,混合均匀后进行高压提取,提取条件为:压强6mpa,温度55℃,时间50min,按照实施例1方法测定刺五加苷b得率。
[0087]
3.微波辅助提取刺五加苷b
[0088]
取刺五加根茎干粉,按料液比1:30(w/v)加入去离子水,混合均匀后进行微波辅助提取,提取条件为:功率600w,温度70℃,时间20min,按照实施例1方法测定刺五加苷b得率。
[0089]
4.固定化酶联合微波提取刺五加苷b
[0090]
(1)取刺五加根茎干粉,按料液比1:30(w/v)加入去离子水,混合均匀;按质量分数1%称取实施例1制备的caco
3-cs-固定化酶,用单层纱布包裹放入反应体系,保持40℃温度,搅拌转速300rpm,浸提70min。
[0091]
(2)对步骤(1)浸提液进行微波提取,提取条件为:功率600w,温度70℃,时间20min,按照实施例1方法测定刺五加苷b得率。
[0092]
由图6可以看出固定化酶联合现代提取技术可提高刺五加苷b得率,其中高压联合固定化酶提取效果更佳,相比于微波联合固定化酶方法,高压联合固定化酶提取刺五加苷b得率提高7.8%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1